抗菌肽(antimicrobial peptide)是天然免疫物质的重要组成部分,是免疫增强剂的一种,具有广谱抗菌作用。在机体遭遇病原体入侵和环境应激时,抗菌肽可作为免疫效应分子来启动、调节宿主免疫防御体系,发挥免疫功能,是生物体应对病原物质侵染而产生的免疫应答产物,在生物的防御体制中作用显著。抗菌肽的产生代表了自然界中广泛存在一线宿主天然免疫防御机制[1]。目前,抗菌肽在水产养殖业中的应用研究备受关注,诸如淡水小龙虾(Procambarus clarkii)[2]、红沼泽小龙虾[3]、鳟鱼(trout)[4]、比目鱼(flounder)[5]等养殖过程中,抗菌肽的应用均起到了重要作用。有报道[6-8]称,抗菌肽可以对水生动物的生理功能、消化率、成活率及机体免疫力产生影响。而且,抗菌肽的抗菌机理与抗生素完全不同,不易产生耐药性[9]。作为一种绿色、安全、无残留的生物制剂,抗菌肽应用前景广阔。
虹鳟(Oncorhynchus mykiss)属鲑形目(Salmoniformes)鲑科(Salmonidae)太平洋鲑属(Oncorhynchus),是一种经济价值较高的鱼类,其体内含有的被称为“脑黄金”的DHA、EPA,远远高于其他鱼类,具有很好的药用及食用价值。红色的鱼肉香甜可口,堪称“鱼品之王”,因而在市场上非常畅销。现已成为分布国家最多、地区最广的养殖鱼类之一。为达到供需平衡,虹鳟养殖多采取集约化高密度养殖模式,致使病害频生,严重制约了虹鳟养殖产业的发展。利用抗生素治疗虽能暂时解决问题,但随之而来的抗生素耐受性问题更是对食品安全造成了严重的影响。因此提高虹鳟自身免疫力是亟待解决的问题。目前,关于虹鳟饲料添加剂或免疫增强剂的研究已有报道,如壳聚糖[10]、锌制剂[11]、抗菌肽[12-13]等。研究表明,饲料中添加抗菌肽能够提高凡纳滨对虾(Litopenaeus vannamei)[12]和吉富罗非鱼(Genetically improved farmed tilapia, GIFT)[13]部分免疫指标。为了达到少用甚至不用抗生素的目的,本研究将中国鲎基因工程抗菌肽应用于虹鳟。为了明确抗菌肽不同处理方式对虹鳟免疫指标的影响,分别在虹鳟仔鱼和成鱼两个阶段采用不同方式应用抗菌肽,以期找到最适应用方法,为抗菌肽在虹鳟养殖中的合理应用提供理论依据。
1 材料与方法 1.1 试验材料试验用鱼:虹鳟成鱼[(196.24±5.70) g]购自吉林省延吉市青龙渔业有限公司,养殖在吉林省水产科学研究院生态实验室,养殖缸为圆柱形玻璃钢材质,规格为直径0.8 m,高1.2 m。实验室暂养2周后用于试验。虹鳟仔鱼养殖在吉林省延吉市青龙渔业有限公司,孵化槽规格为0.52 m×0.40 m×0.20 m。
抗菌肽:中国鲎基因工程抗菌肽,购自吉林省瑞金浩业生物科技有限公司,活性210 U/mL。
主要试剂:鱼白细胞介素-1β(IL-1β)试剂盒、鱼肿瘤坏死因子-α(TNF-α)试剂盒、鱼γ干扰素(IFN-γ)试剂盒、鱼超氧化物歧化酶(SOD)试剂盒、鱼过氧化氢酶(CAT)试剂盒、鱼碱性磷酸酶(ALP)试剂盒均购自上海仁捷生物有限公司;荧光PCR相关试剂购自TaKaRa公司。
1.2 抗菌肽浸泡处理仔鱼的试验将抗菌肽应用到虹鳟初孵仔鱼阶段,分试验组(应用抗菌肽浸泡)和对照组(普通养殖用水浸泡),每组3 000尾初孵仔鱼,各设3个平行组。孵化槽规格为0.52 m×0.40 m×0.20 m,流水孵化,水温8 ℃,流速4.0~4.5 L/min。应用84 U/mL抗菌肽浸泡,采用隔天浸泡方式,共浸泡10次。浸泡后第4天抽样,第15天进行第2次抽样,抽取的鱼样经预冷PBS冲洗后,切割称量0.1 g组织加0.9 mL PBS冰上充分研磨,-80 ℃反复冻融5次后匀浆,5 000 r/min离心10 min,取上清分别检测SOD、ALP、CAT、IL-1β、IFN-γ、TNF-α等免疫相关酶水平变化情况,同时应用扫描电镜观察浸泡后第4天仔鱼表面细菌变化情况。
1.3 抗菌肽混合饲料投喂虹鳟的试验将抗菌肽混入基础饲料(山东升索鲑鳟鱼专用饲料P2段)中进行日常饲喂,整个试验分5组进行,每组50尾[(197.35±4.50) g],各设3个平行组。第1组基础颗粒饲料粉碎后不做任何处理,直接重新压制成颗粒饲料;第2组在基础颗粒饲料粉碎后,重新压制成颗粒饲料,再在饲料表面直接喷洒抗菌肽100 mL/kg饲料。第3~5组,分别将基础饲料粉碎后,每千克饲料喷洒抗菌肽25 mL、50 mL、100 mL,混匀后送入制粒机压制成颗粒饲料。各组均按照日投饵量为体质量2%的标准投喂。
开始饲喂后第3~7周及第9周,各组分别采集10尾鱼,经苯氧乙醇麻醉后,用2 mL无菌注射器从尾静脉取血1 mL,置于1.5 mL无菌离心管中,室温静置1 h后转入4 ℃静置3 h,3 500 r/min离心10 min,取上层血清,检测免疫相关酶水平变化情况。开始饲喂后第7、9周分别采集5尾各组鱼头肾组织,按照RNA提取试剂盒(TaKaRa,日本)说明书提取总RNA,经OD260/280分析测定RNA浓度后,使用反转录试剂盒(TaKaRa,日本)将1 μL RNA反转录成cDNA。利用实时定量荧光PCR法检测头肾中IL-1β、IFN-γ、TNF-α 3种细胞因子基因表达情况,以虹鳟β-actin编码的基因作为内参基因,实时定量荧光PCR所用的引物均由北京鼎国生物科技有限公司合成,引物信息详见表 1。

|
表 1 内参基因与目的基因的引物 Tab.1 Primers of reference and target genes |
实时定量荧光PCR采用荧光染料SYBRGreenⅡ法。20 μL反应体系中含有SYBR Premix Ex Taq Ⅱ 10 μL,引物各0.8 μL(10 μmol/L),cDNA 2 μL(100 ng),ddH2O 6.4 μL。使用Illumina ECO实时荧光定量PCR仪进行PCR反应,95 ℃ 30 s,(95 ℃ 5 s, 62 ℃ 34 s)40个循环,95 ℃ 15 s,62 ℃ 1 min,95 ℃ 15 s。采用2-ΔΔCt法对数据进行处理[14]。
1.4 抗菌肽浸泡处理虹鳟的试验试验分3组进行,每组30尾[(196.48±5.76) g],设3个平行组,将抗菌肽分别稀释到42、63和84 U/mL后浸泡试验鱼。每次浸泡5 min,连续浸泡5 d(空白组用普通养殖用水浸泡)。于浸泡后第2天和第4天按照1.3节所述方法采集各组鱼尾静脉血,分离血清。进行免疫相关酶水平检测,确定抗菌肽浸泡最佳浓度。
另对抗菌肽浸泡时间进行确定,试验分3组进行,每组30尾[(195.94±5.16) g],设3个平行组。应用84 U/mL抗菌肽分别浸泡3、5、10 min,连续浸泡5 d。于浸泡后1周和2周按照1.3节所述方法采集各组鱼尾静脉血,分离血清,进行免疫相关酶水平检测,确定抗菌肽浸泡最佳时长。
1.5 数据统计所有数据采用“平均值±标准差”(Mean±SD)表示。采用SPSS 20.0软件对数据进行统计分析,试验数据采用单因素方差分析,进行LSD和Duncan氏多重比较,分析组间差异显著性。P<0.05和P<0.01分别为差异显著和极显著水平。
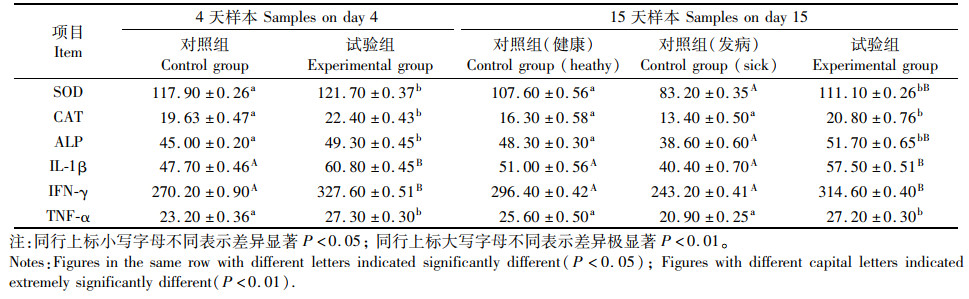
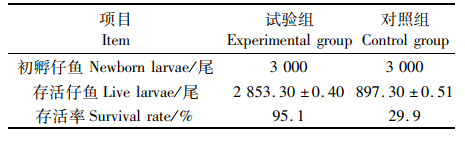
2 结果与分析 2.1 抗菌肽浸泡处理对虹鳟仔鱼免疫指标的影响虹鳟仔鱼期共抽样2次。第2次采样时,对照组有发病死亡现象。共采集样品5组,每组15尾。结果可见,第1批采集样本中,试验组免疫相关酶水平均高于对照组,其中IL-1β、IFN-γ差异极显著(P<0.01),其他差异显著(P<0.05)。第2批采集样本中,试验组免疫相关酶水平仍略高于对照组健康鱼,其中IL-1β、IFN-γ差异极显著(P<0.01),其他差异显著(P<0.05)。对照组发病鱼免疫相关酶水平显著低于试验组,SOD、ALP、IL-1β、IFN-γ均差异极显著(P<0.01),其他差异显著(P<0.05,表 2)。待试验结束后,统计鱼苗存活数量,试验组存活率高达95.1%,对照组存活率仅为29.9%。见表 3。
|
表 2 抗菌肽浸泡对虹鳟仔鱼免疫指标的影响 Tab.2 Effects of soaking treatments of antimicrobial peptides on the immune index of rainbow trout larvae |
|
表 3 抗菌肽浸泡处理对虹鳟仔鱼存活率的影响 Tab.3 Effects of soaking treatments of antimicrobial peptides on survival rate of rainbow trout larvae |
浸泡后第4天,抽样采集试验组和对照组仔鱼样品,用扫描电镜观察仔鱼体表细菌变化情况。结果显示,试验组较对照组体表细菌数量明显减少,见图 1。

|
图 1 虹鳟仔鱼体表扫描电镜观察(细菌数量的差异) Fig. 1 Observation of the rainbow trout larvae surface by scanning electron microscope (differences in the number of bacteria) |
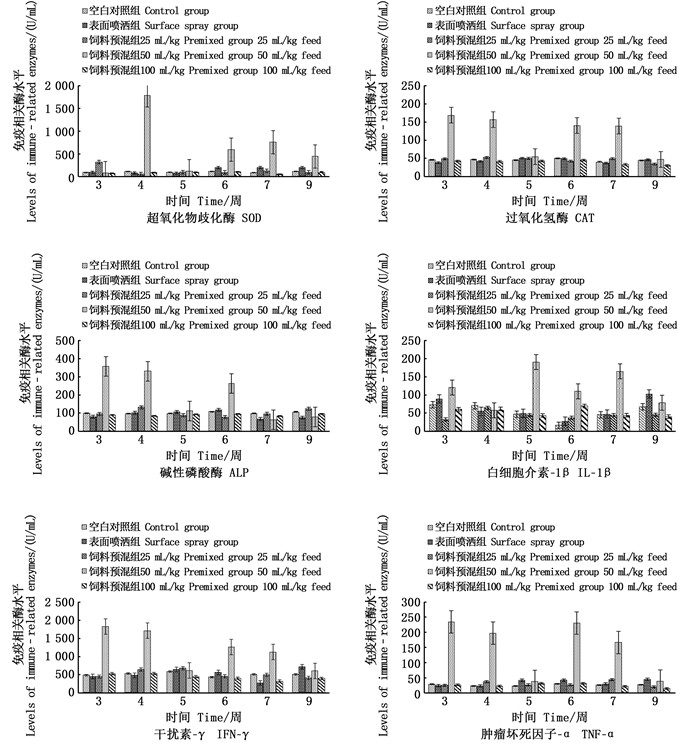
抗菌肽混合饲料饲喂后第3~7周,每周采集10尾各组鱼血清,第9周再采集1次血清,检测免疫相关酶水平变化情况。结果可见,与试验1组相比,试验4组的免疫相关酶水平在不同时间均有不同程度的显著升高情况出现(P<0.01)。其他组与试验1组相比变化不显著。第9周采集样品显示,所有组别的免疫相关酶水平均无明显变化。这表明抗菌肽预混饲料饲喂能持续提高免疫相关酶水平8周左右, 见图 2。
|
图 2 抗菌肽混合饲料饲喂虹鳟免疫相关酶水平的变化 Fig. 2 Change of immune-related enzymes levels in rainbow trout fed with antimicrobial peptides mixed feed |
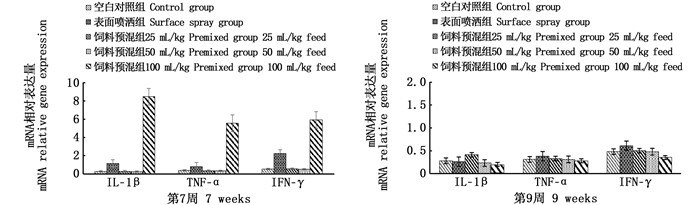
饲喂后第7、9周采集头肾组织提取总RNA并反转录成cDNA后,应用实时定量荧光PCR法(2-ΔΔCt法)检测细胞因子表达量。结果显示,第7周,与对照组相比,试验2组IL-1β、TNF-α、IFN-γ 3种细胞因子表达量分别提高4.4、2.2、4.3倍;试验5组分别提高33.6、15.3、11.5倍。第9周,所有样品均无明显提高,见图 3。
|
图 3 抗菌肽混合饲料饲喂虹鳟细胞因子基因表达量的变化 Fig. 3 Changes of cytokine gene expression in rainbow trout fed with antimicrobial peptides mixed feed |
抗菌肽梯度稀释后浸泡试验鱼,与空白组相比各试验组免疫相关酶水平显著升高(P<0.01)。但试验组组间差异不明显,见表 4。
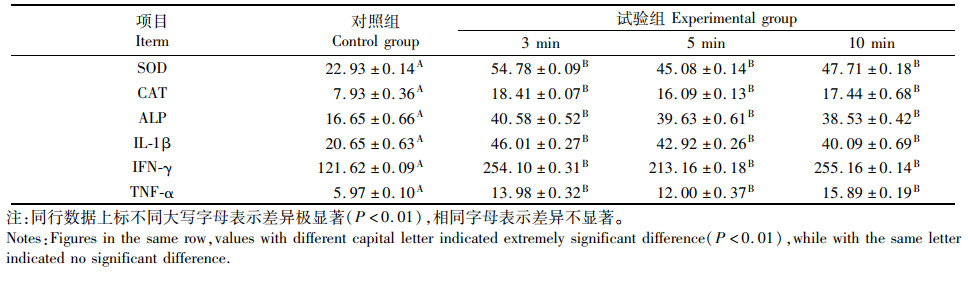
|
表 4 浸泡时长与免疫相关酶关系 Tab.4 Relationship between soaking time and immune-ralated enzymes |
抗菌肽是一种短肽链,存在于微生物、昆虫、植物中,目前已经发现的抗菌肽超过1 500种[15],已有研究[16-18]结果表明, 抗菌肽在体外可直接杀灭病原微生物,具有广谱抗菌活性, 不仅可以抗G+、G-菌和真菌、原虫等多种病原微生物, 还可以抗肿瘤和癌细胞,甚至可以直接杀灭有包膜的流感病毒、疱疹病毒、艾滋病病毒等,是宿主防御外界病原体入侵的重要分子屏障,在机体蛋白酶的作用下,抗菌肽容易降解成氨基酸,是一种环保、无毒、高效的新型抗生素替代制剂,在畜禽和水产上已获得广泛应用[19-21]。本研究所用中国鲎基因工程抗菌肽,是中国鲎血细胞RT-PCR扩增抗菌肽tachyplesins基因,在毕赤酵母GS115中诱导表达,无毒副作用、无有害残留、不易使细菌产生耐药性,具有多种生物活性[22]。本试验尝试将中国鲎基因工程抗菌肽以不同的处理方式应用于虹鳟养殖,用以对抗虹鳟养殖过程中从仔鱼期开始出现的大规模发病死亡现象。检测不同处理方式下抗菌肽对虹鳟免疫指标的影响,为虹鳟养殖过程中抗菌肽的应用提供理论依据。
目前,抗菌肽的主流应用方式是混合饲料法,这也是目前畜牧业及水产业较为广泛的抗菌肽应用方式。宋理平等[6]在饲料中添加抗菌肽显著提高了凡纳滨对虾相对增重率、成活率和对致病菌的免疫保护率(P<0.05),未受外界微生物刺激时,饲料中添加抗菌肽对凡纳滨对虾总抗氧化能力有促进作用(P<0.05),受外界微生物刺激后,饲料中添加抗菌肽喂养凡纳滨对虾可提高对虾超氧化物歧化酶活性(P<0.05)和总抗氧化能力(P<0.01)。姜珊等[13]认为饲料中添加适量重组抗菌肽对吉富罗非鱼幼鱼有一定的促生长作用,并能提高部分免疫指标以及攻毒后的存活率,但过高剂量的抗菌肽对幼鱼的生长与部分酶指标有一定的负面影响。黄沧海等[23]用抗菌肽替代喹乙醇,证明抗菌肽对罗非鱼的生长具有促进作用。本研究在虹鳟成鱼阶段也选择了混合饲料法应用抗菌肽。通过试验鱼血清中超氧化物歧化酶(SOD)、碱性磷酸酶(ALP)、过氧化氢酶(CAT)、白细胞介素(IL-1β)、干扰素(IFN-γ)及肿瘤坏死因子(TNF-α)等免疫相关酶水平及细胞因子表达量的变化情况来衡量抗菌肽对虹鳟机体免疫指标的影响。研究认为,免疫相关酶水平及细胞因子表达量变化趋势基本相同。当抗菌肽添加量为每千克饲料50 mg时,免疫相关酶水平显著上调,明显高于25 mg组、100 mg组及直接喷洒100 mg抗菌肽组,说明50 mg/kg饲料为最适添加比例,过量添加或添加量不足均影响抗菌肽对机体免疫相关酶水平的调节,过高的剂量可能会影响鱼体的消化吸收,这与温刘发等[24]的研究结论一致。高剂量抗菌肽是否对肠道自身菌群产生影响,仍有待于进一步探讨。通过第9周血清检测发现,各试验组与空白对照组免疫相关酶水平均差异不显著。应用荧光定量PCR法检测虹鳟头肾组织IL-1β、IFN-γ及TNF-α3种细胞因子基因表达量,对免疫相关酶水平检测结果进行佐证,两种检测方法结论一致。这表明, 混合饲料法可以维持机体高免疫力情况8周左右。因此,研究认为应用混合饲料法投喂抗菌肽需在常规发病期前8周左右开始效果最佳,且抗菌肽混合比例以50 mg/kg饲料为宜。
我国大多数虹鳟养殖区在虹鳟养殖过程中,幼鱼期会出现大规模死亡,死亡率达70%~90%,严重时可近100%[25-27]。针对这一问题,疫苗的研制在国内外如火如荼地开展。2005年,国际上首个虹鳟IHN核酸疫苗在加拿大批准上市[28]。但由于虹鳟在3个月龄期内其免疫器官尚未完全发育,注射疫苗难以起到相应的免疫保护作用[29],相关部门根据我国虹鳟养殖现状制定了3个月鱼龄内的鱼苗管控措施,亦取得了一定的防控效果[30]。本试验将抗菌肽应用于虹鳟仔鱼期,由于仔鱼尚未开口摄食,无法通过混合饲料摄入抗菌肽。因此,针对虹鳟仔鱼期特殊性,我们采用了抗菌肽浸泡法。此方法未见相关报道。从仔鱼初孵开始浸泡,经过10次浸泡后,第4天,试验组免疫相关酶水平均高于对照组,其中IL-1β、IFN-γ差异极显著(P<0.01),其他差异显著(P<0.05)。浸泡后第15天,试验组免疫相关酶水平仍略高于对照组健康鱼,其中IL-1β、IFN-γ差异极显著(P<0.01),其他差异显著(P<0.05)。对照组发病鱼免疫相关酶水平较试验组显著下降,SOD、ALP、IL-1β、IFN-γ均差异极显著(P<0.01),其他差异显著(P<0.05)。统计仔鱼存活率发现,试验组存活率高达95.1%,对照组存活率仅为29.9%。研究认为,在虹鳟初孵仔鱼阶段应用抗菌肽浸泡可显著改善鱼体抗病能力,其可能与抗菌肽种类、作用方式及养殖虹鳟的疾病暴发特点有关。
本文对抗菌肽不同处理方式对虹鳟免疫指标的影响做了初步研究,发现通过浸泡法和混合饲料法应用抗菌肽均能够提高虹鳟免疫相关酶水平,在虹鳟仔鱼期采用抗菌肽浸泡可以显著提高虹鳟仔鱼的存活率。关于抗菌肽能够提高鱼类抗病力的更深层次的作用机制还需进一步研究。
| [1] |
DESTOUMIEUX D, MUNOZ M, BULET P, et al. Penaeidins, a family of antimicrobial peptides from penaeid shrimp (Crustacea, Decapoda)[J]. Cellular and Molecular Life Sciences CMLS, 2000, 57(8): 1260-1271. DOI:10.1007/PL00000764 |
| [2] |
DU Z Q, LI B, SHEN X L, et al. A new antimicrobial peptide isoform, Pc-crustin 4 involved in antibacterial innate immune response in fresh water crayfish, Procambarus clarkii[J]. Fish & Shellfish Immunology, 2019, 94: 861-870. |
| [3] |
SHI X Z, ZHAO X F, WANG J X. A new type antimicrobial peptide astacidin functions in antibacterial immune response in red swamp crayfish Procambarus clarkii[J]. Developmental & Comparative Immunology, 2014, 43(1): 121-128. |
| [4] |
CHIOU P P, KHOO J, BOLS N C, et al. Effects of linear cationic α-helical antimicrobial peptides on immune-relevant genes in trout macrophages[J]. Developmental & Comparative Immunology, 2006, 30(9): 797-806. |
| [5] |
KWON M G, SEO J S, YOUN H J, et al. Effect of the polychaete antimicrobial peptide as feed additives on olive flounder and black rockfish immune activity[J]. Journal of Fisheries and Marine Sciences Education, 2016, 28(6): 1640-1650. DOI:10.13000/JFMSE.2016.28.6.1640 |
| [6] |
宋理平, 胡斌, 王爱英, 等. 抗菌肽对凡纳滨对虾生长和机体免疫的影响[J]. 广东海洋大学学报, 2010, 30(3): 28-32. SONG L P, HU B, WANG A Y, et al. Effects of antibacterial peptide on growth and immunity of Penaeus vannamei[J]. Journal of Guangdong Ocean University, 2010, 30(3): 28-32. DOI:10.3969/j.issn.1673-9159.2010.03.006 |
| [7] |
柴仙琦, 冷向军, 李小勤, 等. 抗菌肽对凡纳滨对虾生长和血清非特异性免疫指标的影响[J]. 淡水渔业, 2012, 42(4): 59-62. CHAI X Q, LENG X J, LI X Q, et al. Effect of antibacterial peptide on growth and serum non-specific immunity of Litopenaeus vannamei[J]. Freshwater Fisheries, 2012, 42(4): 59-62. DOI:10.3969/j.issn.1000-6907.2012.04.011 |
| [8] |
陈冰, 曹俊明, 陈平洁, 等. 家蝇抗菌肽对凡纳滨对虾生长性能及免疫相关指标的影响[J]. 中国水产科学, 2010, 17(2): 258-266. CHEN B, CAO J M, CHEN P J, et al. Effects of antibacterial peptides of musca domestica on growth performance and immune-related indicators in Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2010, 17(2): 258-266. |
| [9] |
GAZIT E, LEE W J, BREY P T, et al. Mode of action of the antibacterial cecropin B2:a spectrofluorometric study[J]. Biochemistry, 1994, 33(35): 10681-10692. DOI:10.1021/bi00201a016 |
| [10] |
蒋锦坤, 王际英, 张利民, 等. 壳聚糖对虹鳟(Oncorhynchus mykiss)幼鱼生长性能、体组成及非特异性免疫的影响[J]. 海洋与湖沼, 2012, 43(4): 730-734. JIANG J K, WANG J Y, ZHANG L M, et al. Effects of dietary chitosan on growth performance, body composition and non-specific immunity of juvenile Oncorhynchus mykiss[J]. Oceanologia et Limnologia Sinica, 2012, 43(4): 730-734. |
| [11] |
樊英, 李乐, 于晓清, 等. 新型锌制剂对虹鳟生长及免疫功能的影响[J]. 水产科学, 2020, 39(1): 55-62. FAN Y, LI L, YU X Q, et al. Effects of nano-zinc and nano-zinc-polysaccharide on growth and immunity in rainbow trout oncorhynchus mykiss[J]. Fisheries Science, 2020, 39(1): 55-62. |
| [12] |
胡世康, 王博, 秦海鹏, 等. 抗菌肽对凡纳滨对虾抗病性和免疫指标的影响[J]. 热带生物学报, 2018, 9(3): 281-286. HU S K, WANG B, QIN H P, et al. Effect of microbial antimicrobial peptides on disease resistance and immune indices of Litopenaeus vannamei[J]. Journal of Tropical Biology, 2018, 9(3): 281-286. |
| [13] |
姜珊, 王宝杰, 刘梅, 等. 饲料中添加重组抗菌肽对吉富罗非鱼生长性能及免疫力的影响[J]. 中国水产科学, 2011, 18(6): 1308-1314. JIANG S, WANG B J, LIU M, et al. Effects of recombinant antimicrobial peptides on growth and immunity in tilapia (GIFT)[J]. Journal of Fishery Sciences of China, 2011, 18(6): 1308-1314. |
| [14] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [15] |
BULET P, STÖCKLIN R. Insect antimicrobial peptides:structures, properties and gene regulation[J]. Protein and Peptide Letters, 2005, 12(1): 3-11. DOI:10.2174/0929866053406011 |
| [16] |
NESHANI A, ZARE H, MOHAMMAD REZA A E, et al. Epinecidin-1, a highly potent marine antimicrobial peptide with anticancer and immunomodulatory activities[J]. BMC Pharmacology and Toxicology, 2019, 20: 33. DOI:10.1186/s40360-019-0309-7 |
| [17] |
周洪波, 皮灿辉, 彭永鹤, 等. 抗菌肽在调节动物免疫力方面的研究进展[J]. 中国畜牧兽医, 2009(7): 44-48. ZHOU H B, PI C H, PENG Y H, et al. Advance of antimicrobial peptides in the regulation of animal immunity[J]. China Animal Husbandry & Veterinary Medicine, 2009(7): 44-48. |
| [18] |
ZASLOFF M. Antimicrobial peptides of multicellular organisms[J]. Nature, 2002, 415(8670): 389-395. |
| [19] |
WANG G, SONG Q L, HUANG S, et al. Effect of antimicrobial peptide microcin J25 on growth performance, immune regulation, and intestinal microbiota in broiler chickens challenged with Escherichia coli and Salmonella[J]. Animals, 2020, 10(2): 345. DOI:10.3390/ani10020345 |
| [20] |
HE P, JIANG W D, LIU X A, et al. Dietary biotin deficiency decreased growth performance and impaired the immune function of the head kidney, spleen and skin in on-growing grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2020, 97: 216-234. |
| [21] |
LEE S C, PAN C Y, CHEN J Y. The antimicrobial peptide, epinecidin-1, mediates secretion of cytokines in the immune response to bacterial infection in mice[J]. Peptides, 2012, 36(1): 100-108. DOI:10.1016/j.peptides.2012.04.002 |
| [22] |
郑伟, 韩文瑜, 韩俊友, 等. 中国鲎(Tachypleus tridentatus)基因工程抗菌肽的制备及其抗菌活性[J]. 中国兽医学报, 2007, 27(2): 211-213, 217. ZHENG W, HAN W Y, HAN J Y, et al. Preparation of antimicrobial peptide from horseshoe crab (Tachypleus tridentatus) with gene engineering method and its antimicrobial activity[J]. Chinese Journal of Veterinary Science, 2007, 27(2): 211-213, 217. DOI:10.3969/j.issn.1005-4545.2007.02.017 |
| [23] |
黄沧海, 李波, 王冬冬. 抗菌肽与常用抗菌素对罗非鱼生长性能影响的比较研究[J]. 中国畜牧杂志, 2011, 47(17): 52-55. HUNAG C H, LI B, WANG D D. A comparative study on the effects of antimicrobial peptides and antibiotics on the growth performance of tilapia[J]. Chinese Journal of Animal Science, 2011, 47(17): 52-55. |
| [24] |
温刘发, 张常明, 付林, 等. 抗菌肽制剂代替抗生素在断奶仔猪饲粮中的应用效果[J]. 中国饲料, 2001(18): 13-14. WEN L F, ZHANG C M, FU L, et al. Applied effects of antimicrobial peptide in replace of anti-biotic in weanling pigs'retion[J]. China Feed, 2001(18): 13-14. DOI:10.3969/j.issn.1004-3314.2001.18.007 |
| [25] |
徐黎明, 刘红柏, 尹家胜, 等. 传染性造血器官坏死病毒糖蛋白原核表达及免疫原性分析[J]. 病毒学报, 2013, 29(5): 529-534. XU L M, LIU H B, YIN J S, et al. Prokaryotic expression and immunogenicity analysis of glycoprotein from infectious hematopoietic necrosis virus[J]. Chinese Journal of Virology, 2013, 29(5): 529-534. |
| [26] |
WINTON J R. Recent advances in detection and control of infectious hematopoietic necrosis virus in aquaculture[J]. Annual Review of Fish Diseases, 1991, 1: 83-93. DOI:10.1016/0959-8030(91)90024-E |
| [27] |
冯剑, 赵景壮, 刘淼, 等. 我国虹鳟传染性造血器官坏死病防控研究现状[J]. 水产学杂志, 2019, 32(2): 14-18. FENG J, ZHAO J Z, LIU M, et al. A review:current research on prophylactic and therapeutic techniques of Infectious hematopoietic necrosis in rainbow trout (Oncorhynchus mykiss)[J]. Chinese Journal of Fisheries, 2019, 32(2): 14-18. |
| [28] |
LONG A, RICHARD J, HAWLEY L, et al. Transmission potential of infectious hematopoietic necrosis virus in APEX-IHN®-vaccinated Atlantic salmon[J]. Diseases of Aquatic Organisms, 2017, 122(3): 213-221. DOI:10.3354/dao03076 |
| [29] |
徐立蒲, 王小亮, 杨丽文, 等. 传染性造血器官坏死病诊断及防控的研究进展[J]. 中国畜牧兽医, 2013, 40(3): 209-215. XU L P, WANG X L, YANG L W, et al. Researd progress on the diagnosis, prevention and control of infectious hematopoietic necrosis[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(3): 209-215. |
| [30] |
吴斌, 孙铭英, 于畅, 等. 进境鱼传播传染性造血器官坏死病风险分析模型的建立[J]. 水产学杂志, 2014, 27(4): 56-59. WU B, SUN M Y, YU C, et al. Risk analysis model on infectious hematopoietic necrosis from imported fish juveniles[J]. Chinese Journal of Fisheries, 2014, 27(4): 56-59. |
 2021,
Vol. 30
2021,
Vol. 30


