2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
生物絮团技术(biofloc technology,BFT)源自城市污水处理中的活性污泥技术[1],近年来与水产养殖结合后,在世界范围逐渐成为一种热门的养殖模式[2]。生物絮团形成受搅拌强度、溶解氧、有机碳源、温度和pH等多种因素影响[3]。水产养殖中,BFT系统稳定运行时需要提供连续曝气,一方面为养殖对象提供充足的溶解氧,另一方面提供足够的水体混合强度[4]。研究[5]表明,曝气产生的强烈搅拌不但增加了水体剪切力,还对生物絮团形成过程和理化性质带来影响。LARA等[5]使用不同曝气方式养殖南美白对虾,认为鼓风机的使用与否和功率大小可以影响生物絮团形成;EKASARI等[6]研究指出不同粒径絮团的营养成分存在差异;CARVALHO等[7]研究表明絮团中氨氧化细菌和亚硝酸盐氧化细菌分布不同;SOUZA等[8]认为不同粒径的生物絮团不影响硝化反应过程,但会延缓或促进硝化活性。
目前,不同粒径的生物絮团营养成分、细菌分布以及硝化性能方面的研究较多,但在生物絮团培养过程中,不同剪切力与絮团粒径、水质及微生物特性之间关系的研究未见报道。因此,本试验在不同剪切力培养条件下,对生物絮团形成过程中的颗粒形态、粒径变化、水处理效果进行比较,并通过Biolog技术研究生物絮团的微生物群落碳源代谢特征,以期为BFT理论的发展完善及其在水产养殖中的应用提供数据支撑和理论依据。
1 材料与方法 1.1 试验装置及运行方式试验装置如图 1所示,搅拌反应器为有机玻璃制成的锥形容器,内经D为18.5 cm,高度H为30 cm,锥高H′为4 cm,有效容积5 L。设置搅拌强度分别为低转速组300 r/min、中转速组600 r/min、高转速组900 r/min,每组3个重复,24 h不间断搅拌。
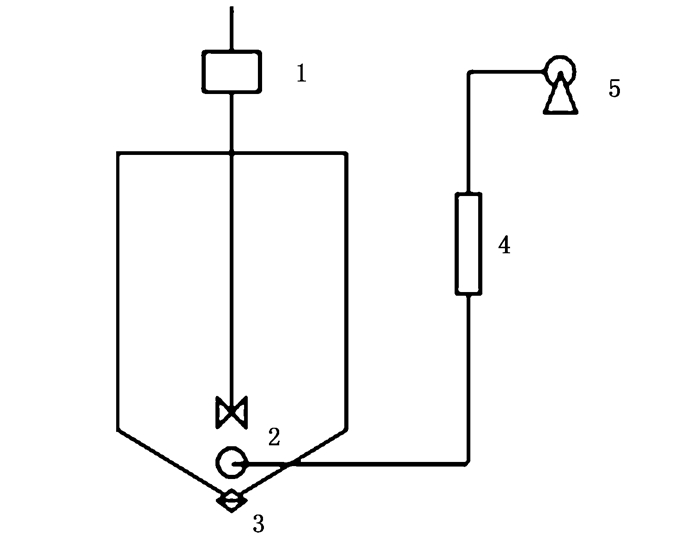
|
1.搅拌机;2.曝气石;3.出水口;4.玻璃转子流量计;5.曝气泵。 1. Blender; 2. Aeration stone; 3. Water outlet; 4.Glass rotor flowmeter; 5. Aeration pump. 图 1 有机玻璃锥形反应器 Fig. 1 Plexiglass conical reactor |
试验开始前5天,接种10 L成熟的自养型生物絮团(来源于上海海洋大学循环水养殖工程研发平台,用鳗鱼粉状饲料培养成熟的自养型生物絮团)于100 L养殖桶中预培养,均匀取5 L絮团到9个反应器中,每天定期加入1 g鳗鱼饲料(统一牌鳗鱼粉状配合饲料,中山统一企业有限公司)。试验周期为21 d,试验期间使用多参数水质测量仪(WTW Multi 3 430 SETF德国)每天测定1次pH、溶氧(DO)、温度(T),每2天测定1次碱度(以CaCO3计),其中碱度调节使用药品为小苏打;每2天测定1次氨氮(TAN)、亚硝氮(NO2--N)、硝氮(NO3--N)、磷酸盐(PO4--P)、总氮(TN)和总悬浮固体颗粒(Total suspended solids,TSS)以及污泥30 min沉降体积(FV30),同时计算污泥沉降指数(FVI=TSS/FV30);每2天取絮团于显微镜下观察其形状并拍照(每组随机取样3次,每次拍摄3张照片);每7天检测1次各反应器内生物絮团粒径分布。待各反应器生物絮团成熟稳定后(形态、粒径分布及水质指标稳定)进行氨氮快速转化试验,于各反应器内添加148.6 mg的氯化铵,10 h内连续测定氨氮和亚硝氮含量变化。另取各组生物絮团,分别接种至Biolog-ECO平板中,于28 ℃恒温培养箱中培养7 d,每12小时采用Biolog Microstation全自动微生物鉴定仪测定每孔在590 nm下的吸光度,测定微生物碳源代谢和利用情况。试验过程中各指标的测定方法[9-11]见表 1。
|
表 1 测定指标与方法 Tab.1 Measurement indexes and methods |
试验过程中,曝气量由玻璃转子流量计控制,曝气量较小且恒定,剪切力大小主要与搅拌器转速相关,各反应器剪切力τ按罗辉荣等[12]方法计算(表 2)。

|
表 2 各组转速与对应剪切力 Tab.2 Rotation speed and corresponding shear stress of each group |
采用96 h的光密度(OD)值计算微生物群落的功能多样性指数,参照TIQUIA等[13]计算方法,用SPSS 22.0进行单因素方差分析(ANOVA)和主成分分析(principal component analysis,PCA),水质数据和粒径分布数据用Origin 2017处理。
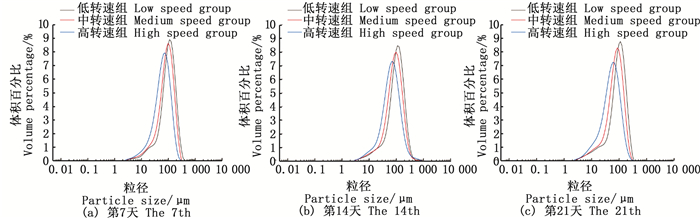
2 结果 2.1 絮团结构和粒径分布观察显微镜照片可知(图版),在培养过程中,生物絮团形态变化在不同处理组存在一定差异。21 d时,低转速组絮团颗粒明显大于中、高转速组,剪切力越大形成的絮团颗粒越小,且中、高转速组的絮团要更为紧实、边缘整齐,低转速组絮团结构松散、边缘模糊。不同培养时间絮团粒径分布为:第7天(图版a)、第14天(图版b)和第21天(图版c)低转速组在粒径为98~111 μm的分布最高,分别为为8.91%、8.46%和8.79%;中转速组在粒径为86~98 μm和76~86 μm的分布最高,分别为7.99%,7.99%和8.32%;高转速组在67~76 μm和52~59 μm的分布最高,分别为7.93%、7.28%和7.25%。絮团粒径的大小随剪切力的大小增大而减小,剪切力越大,相同粒径下的絮团在系统中占比越小。在系统稳定后,各组中生物絮团粒径的大小的体积百分比也维持稳定。

|
不同组别生物絮团不同培养时间形态 Morphology of biofloc at different culture time of 3 groups |
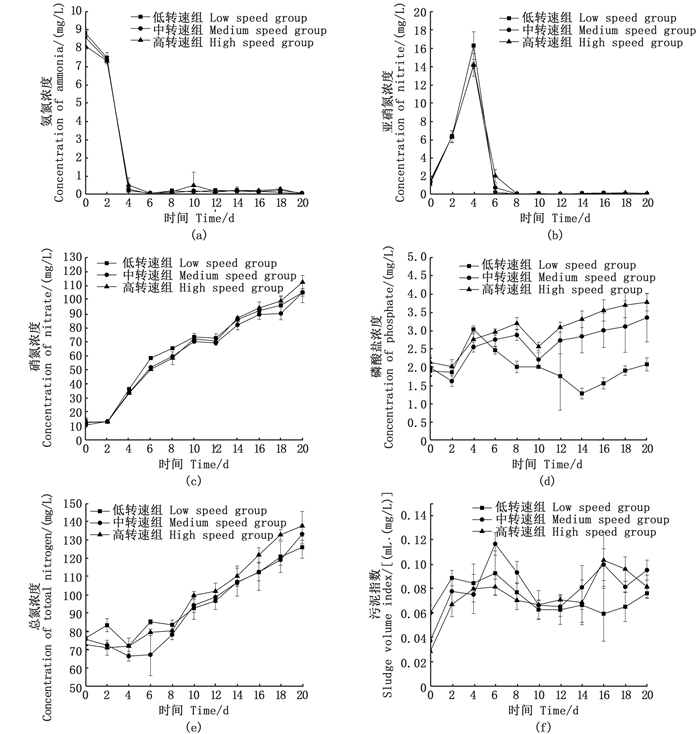
试验期间,pH、DO和T分别稳定在8.35±0.38、(8.85±0.24) mg/L和(21.2±1.21) ℃,碱度维持在150 mg/L以上,各组均无显著性差异。生物絮团培养过程中的水质变化表明(图 3),各组对氨氮和亚硝氮均有较好去除效果,在第4天时3组氨氮从9 mg/L均降至0.5 mg/L以下(图 3a);而亚硝氮浓度均升至峰值14~16 mg/L(图 3b),并在2 d后低转速组和中转速组大幅度下降至0.1 mg/L以下,而高转速组在第8天才下降到0.1 mg/L以下;各组硝氮和总氮含量在整个试验期间一直处于上升趋势;磷酸盐呈现先升高再降低然后再升高的趋势(图 3d),且低转速组较其他两组变化较明显,整个试验期间维持在2 mg/L左右,其他两组略有升高。污泥指数波动较大(图 4f),随时间先上升后下降再上升,各组平均值分别为0.07、0.08和0.07 mL·(mg/L),各组之间无显著性差异。
|
图 2 生物絮团不同培养时间粒径分布 Fig. 2 Particle size distribution of biofloc in different culture time |
|
图 3 不同剪切力条件下生物絮团水质和污泥指数的动态变化 Fig. 3 Dynamic changes of water quality index and sludge index in biofloc under different shear forces |
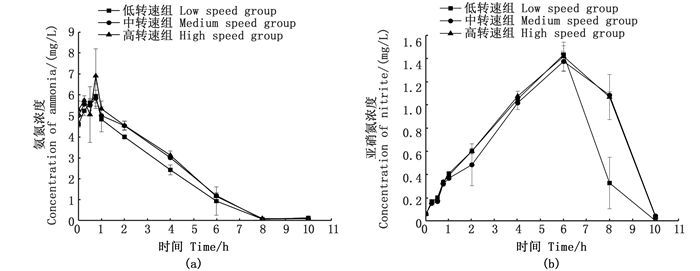
|
图 4 快速转化期间氨氮和亚硝氮动态变化 Fig. 4 Dynamic changes of ammonia nitrogen and nitrite nitrogen during rapid transformation |
成熟絮团氨氮快速转化结果见图 4,各组对氨氮均具有较好的去除效果(图 4a),8 h内将5 mg/L氨氮完全去除率分别达到98.69%、99.00%、98.48%。亚硝氮在前期处于积累状态(图 4b),于6 h到达峰值,之后快速下降,于10 h完全去除,去除速率为0.35 mg/(L·h), 各组之间无显著性差异,但低转速组在6~8 h去除速率优于其他2组。
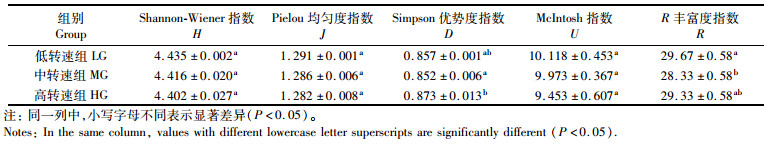
2.3 微生物群落 2.3.1 微生物多样性指数由表 3可知:Shannon-Wiener指数、Pielou均匀度指数和McIntosh指数均随剪切力升高而下降,且各组之间均无显著性差异(P>0.05);Simpson优势度指数在中、高转速组之间差异显著(P<0.05);R丰富度指数在低、中转速组之间差异显著(P<0.05)。结果表明, 在低转速条件下培养的生物絮团中微生物多样性较其他2组更为丰富。
|
表 3 不同处理组的微生物多样性指数 Tab.3 Microbial diversity index of different treatment groups |
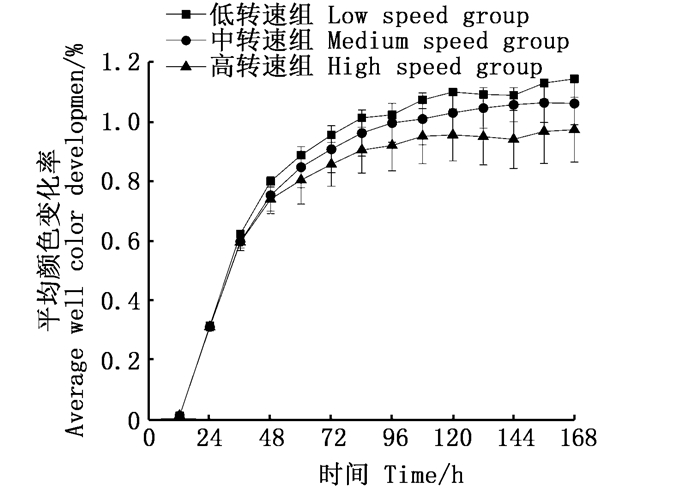
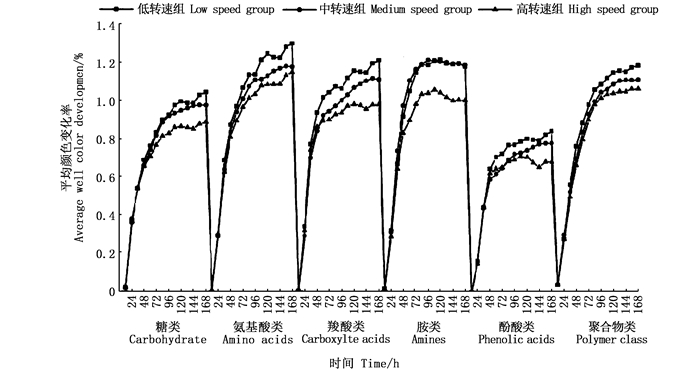
由图 5可知,24 h内各组微生物活性较低,24~96 h微生物活性随培养时间延长呈降速增长,96 h后趋于稳定。稳定期间各组微生物对碳源利用率顺序为:低转速组>中转速组>高转速组。由图 6可知,各组微生物对酚酸类利用率最低,对氨基酸类利用率最高。对糖类、氨基酸类、羧酸类、酚酸类和聚合物类的利用率顺序为:低转速组>中转速组>高转速组;对胺类的利用顺序为:低转速组=中转速组>高转速组。
|
图 5 不同处理组微生物AWCD值随培养时间变化情况 Fig. 5 Changes of AWCD value of microorganisms in different treatment groups with culture time |
|
图 6 不同处理组微生物对6类碳源的利用特征 Fig. 6 Utilization characteristics of six types of carbon sources by microorganisms in different treatment groups |
选择96 h的吸光值进行PCA分析,由图 7各组微生物群落碳源代谢PCA分析可知,第一主成分有19种碳源(相关系数的绝对值﹥0.50)占主要影响,占比67.2%,其中:糖类占36.84%,X8、X11、X6、X7、X16、X15和X14;氨基酸类占15.79%,X26、X27和X28;羧酸类占26.32%,X20、X13、X17、X1和X21;胺类占10.53%,X30和X31;酚酸类占5.26%,X19;聚合物类占5.26%,X3。决定第二主成分变异的碳源(相关系数的绝对值﹥0.50)有13种,占比32.8%,其中;糖类占38.46%,X8、D-木糖X9、X10、X12和X7;氨基酸类占15.38%,X24和X25;羧酸类占23.08%,X20、X21和X23;胺类占7.69%,X30;聚合物类占15.38%,X2和X5。综合第一主成分和第二主成分分析,α-D-乳糖(X7)、β-甲基-D-葡萄糖苷(X8)、γ-羟基丁酸(X20)、衣康酸(X21)和苯乙胺(X30)等碳源能够被不同处理组的微生物优先利用,体现了不同处理组的微生物对碳源的选择性利用。
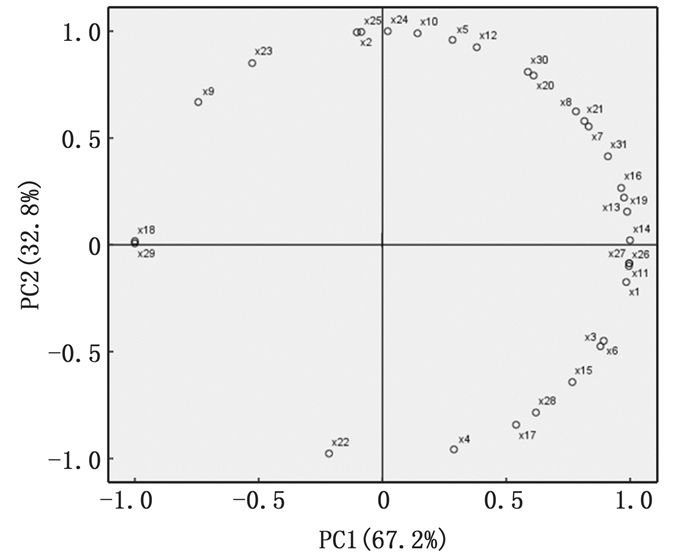
|
图 7 不同处理组微生物群落碳源代谢的PCA分析 Fig. 7 PCA analysis of carbon metabolism of microbial community in different treatment groups |
BFT的絮体结构松散不规则,受培养过程中有机负荷、基质成分、剪切力、沉淀时间和运行周期等因素的影响,水体剪切力更是直接影响絮团粒径和形态结构等理化特性,较高的剪切力有利于分泌更多的胞外聚合物,提高聚集吸附能力[14-18]。
试验结果表明,剪切力能够改变絮团的外观结构。曲新月[19]研究表明水平机械搅拌促进污泥颗粒化过程,使颗粒污泥轮廓清晰、表面光滑、结构密实。TAY等[20]研究不同剪切力对絮体污泥颗粒化的影响,发现较高剪切力下形成的颗粒污泥形状更规则,表面更光滑密实。李冬等[21]通过增加高径比(H/D)来提高水体剪切力,促使污泥分泌含蛋白质的胞外聚合物,从而改变污泥的理化特性,使培养的污泥颗粒粒径较大,外表规则且光滑。这与本试验中,剪切力不仅促进絮团的形成过程,还影响絮团的形态规则的研究结果一致。试验中,絮团粒径随剪切力的增大而减小,剪切力改变絮团粒径也随之改变。张小玲等[22]研究发现当剪切力为0.220 Pa时,颗粒污泥开始解体,颗粒污泥的粒径较小,与本试验高转速组相符。冯骞等[23]研究显示,当剪切力增加到0.149 Pa时, 过大的剪切力使丝状菌几乎无法生存,此时形成的絮体颗粒较小,其结果与本试验结果一致。综上所述,絮团粒径以及颗粒大小分布均受剪切力影响,但过高的剪切力会造成絮团解体,实际应用中如何选择合适的剪切力对反应系统进行优化控制,还有待深入研究。
3.2 不同剪切力对絮团水质处理能力的影响净化水质和饵料补充是生物絮团的两大作用,为养殖对象健康生长提供安全的水环境是首要的作用[24]。试验结果表明,各组培养的生物絮团,均能对水质起到较好的控制效果。CHEN等[25]研究表明,不同粒径絮团对氨氮和亚硝氮的去除速率无显著性差异,与本试验结果一致。本试验中不同处理组硝化反应出现的时间一致,这与SOUZA等[8]认为絮团颗粒大小不影响硝化反应过程,但能改变硝化反应出现时间的结果不同,可能是因为预培养接种的是自养型成熟絮团。SCHRAMM等[26]利用荧光原位杂交技术发现,硝化作用发生在100~150 μm絮凝体表面。本试验粒径分布结果显示,各组絮团主要分布在50~200 μm,各组硝化反应进程无差异,与SCHRAMM等[26]结果一致。低转速组磷酸盐水平显著低于其他2组,李志华等[27]在不同粒径颗粒污泥除磷中发现,颗粒化前期280~450 μm污泥有机磷含量较高,但颗粒化后期不同粒径污泥有机磷含量趋近一致,与本试验的结果相似。有研究[28-29]表明,污泥培养阶段丝状菌大量繁殖时,产生了一种慢速生长的细菌——聚磷菌,具有脱氮除磷的作用。本试验的磷酸盐水平变化结果显示,低转速组磷酸盐水平在前期较低,可能是絮团培养阶段前期,低剪切力下有丝状菌生长,产生聚磷菌,絮团成熟后,搅拌状态下丝状菌无法继续生长,聚磷菌减少,磷酸盐含量也相应升高,而高剪切力组则始终无法生长丝状菌,因此磷酸盐变化出现了差异,具体还需进一步试验研究。
3.3 不同剪切力对微生物群落的影响生物絮团中,微生物对Biolog-ECO板上31种碳源的选择性利用,通过AWCD值反映絮团微生物对不同种类碳源的利用偏好[30]。高晓奇等[31]利用Biolog-ECO技术分析油井周围土壤进行微生物群落多样性分析;李志斐等[32]利用Biolog-ECO技术分析生物絮团养殖水体中的微生物群落,微生物多样性指数能够反映微生物群落的丰富性[33]。本试验结果表明,不同剪切力培养的生物絮团中微生物菌群结构产生差异,且低转速组培养的大颗粒絮团,微生物多样性更丰富。龙腾锐等[34]认为,胶团菌和丝状菌在活性污泥中存在特定的共生关系,是活性污泥生态系统中最主要的微生物群体之一,而高剪切力下抑制丝状菌生长[29],微生物群落也随之改变。冯骞等[23]研究表明,剪切力会影响活性污泥的微生物生态系统,与本试验结果一致。
絮团微生物对Biolog-ECO板上6大类碳源选择利用程度反映了微生物对碳源的代谢偏好[35]。研究结果显示,剪切力大小与AWCD值成反比,各组对酚酸类的利用率最低,对氨基酸类利用最高,在胺类的利用上高转速组明显低于其他2组,这与李志斐等[35]研究结果相似。杨莺莺等[36]在池塘水环境的研究中发现,利用率较高的碳源分别为氨基酸类、羧酸类和糖类,其次为聚合物类、胺类,而其他类碳源的利用率较低;董媛媛等[37]用生物絮团代替饵料的研究表明,水体微生物对脂类和胺类的利用较高,对醇类的利用最低,这与本试验结果一致。生物絮团中微生物对不同种类碳源利用存在差异,可能是絮团培养过程中,常使用葡萄糖和糖蜜等多为单一碳源的有机物[38],因此在絮团成熟后,微生物在碳源的选择利用上出现对某一种或某一类碳源选择利用的情况。
主成分分析反映不同微生物群落的代谢特征[39]。本试验中,碳源的主成分相关系数与碳源的利用率存在正相关的关系,碳源的相关系数越高样本之间的差异比较越重要[32]。3种剪切力下培养的生物絮团,微生物碳源代谢主成分1相关系数0.5以上的碳源有19种,主成分2相关系数0.5以上的碳源有13种。本试验发现,不同处理组的絮团微生物对不同碳源选择性利用,与李志斐等[32]研究结果一致。
| [1] |
BURFORD M A, THOMPSON P J, MCINTOSH R P, et al. The contribution of flocculated material to shrimp(Litopenaeus vannamei) nutrition in a high-intensity, zero-exchange system[J]. Aquaculture, 2004, 232(1/4): 525-537. |
| [2] |
XU W J, MORRIS T C, SAMOCHA T M. Effects of C/N ratio on biofloc development, water quality, and performance of Litopenaeus vannamei juveniles in a biofloc-based, high-density, zero-exchange, outdoor tank system[J]. Aquaculture, 2016, 453: 169-175. DOI:10.1016/j.aquaculture.2015.11.021 |
| [3] |
聂伟, 刘立鹤, 刘军, 等. 生物絮团的研究进展[J]. 江西水产科技, 2014(4): 43-48. NIE W, LIU L H, LIU J, et al. The research progress of biological floc[J]. Jiangxi Fishery Sciences and Technology, 2014(4): 43-48. DOI:10.3969/j.issn.1006-3188.2014.04.015 |
| [4] |
罗国芝, 朱泽闻, 潘云峰, 等. 生物絮凝技术在水产养殖中的应用[J]. 中国水产, 2010(2): 62-63. LUO G Z, ZHU Z W, PAN Y F, et al. Application of biofloc technology in aquaculture[J]. China Fisheries, 2010(2): 62-63. DOI:10.3969/j.issn.1002-6681.2010.02.029 |
| [5] |
LARA G, KRUMMENAUER D, ABREU P C, et al. The use of different aerators on Litopenaeus vannamei biofloc culture system: effects on water quality, shrimp growth and biofloc composition[J]. Aquaculture International, 2017, 25(1): 147-162. DOI:10.1007/s10499-016-0019-8 |
| [6] |
EKASARI J, ANGELA D, WALUYO S H, et al. The size of biofloc determines the nutritional composition and the nitrogen recovery by aquaculture animals[J]. Aquaculture, 2014, 426(426-427): 105-111. |
| [7] |
CARVALHO G, MEYER R L, YUAN Z G, et al. Differential distribution of ammonia-and nitrite-oxidising bacteria in flocs and granules from a nitrifying/denitrifying sequencing batch reactor[J]. Enzyme and Microbial Technology, 2006, 39(7): 1392-1398. DOI:10.1016/j.enzmictec.2006.03.024 |
| [8] |
SOUZA J, CARDOZO A, WASIELESKY JR W, et al. Does the biofloc size matter to the nitrification process in Biofloc Technology (BFT) systems?[J]. Aquaculture, 2019, 500: 443-450. DOI:10.1016/j.aquaculture.2018.10.051 |
| [9] |
魏复盛. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. WEI F S. Water and wastewater monitoring and analysis method[M]. 4th ed. Beijing: China Environmental Science Press, 2002. |
| [10] |
肖静, 高艳娇. 低碳氮比条件对活性污泥粒径分布的影响[J]. 科学技术与工程, 2016, 16(22): 265-268. XIAO J, GAO Y J. Effects of low COD/N ratios on flocs size distribution of activated sludge[J]. Science Technology and Engineering, 2016, 16(22): 265-268. DOI:10.3969/j.issn.1671-1815.2016.22.048 |
| [11] |
李明智, 张宇, 梅荣武, 等. Biolog ECO分析活性污泥微生物功能多样性特征[J]. 环境科学与技术, 2016, 39(6): 55-58. LI M Z, ZHANG Y, MEI R W, et al. Analysis of microbial community functional diversity of activated sludge by Biolog ECO method[J]. Environmental Science &Technology, 2016, 39(6): 55-58. |
| [12] |
罗辉荣. 混凝搅拌实验方法的探讨[J]. 工业水处理, 1984, 4(1): 30-36. LUO H R. Discussion on the test method of coagulation and agitation[J]. Industrial Water Treatment, 1984, 4(1): 30-36. |
| [13] |
TIQUIA S M. Metabolic diversity of the heterotrophic microorganisms and potential link to pollution of the Rouge River[J]. Environmental Pollution, 2010, 158(5): 1435-1443. DOI:10.1016/j.envpol.2009.12.035 |
| [14] |
TAY J H, LIU Q S, LIU Y. Microscopic observation of aerobic granulation in sequential aerobic sludge blanket reactor[J]. Journal of Applied Microbiology, 2001, 91(1): 168-175. DOI:10.1046/j.1365-2672.2001.01374.x |
| [15] |
王建龙, 张子健, 吴伟伟. 好氧颗粒污泥的研究进展[J]. 环境科学学报, 2009, 29(3): 449-473. WANG J L, ZHANG Z J, WU W W. Research advances in aerobic granular sludge[J]. Acta Scientiae Circumstantiae, 2009, 29(3): 449-473. |
| [16] |
罗国芝, 李文清, 陈佳捷, 等. 生物絮凝技术在我国水产养殖中的应用研究现状和发展趋势分析[J]. 中国水产, 2013(11): 64-67. LUO G Z, LI W Q, CHEN J J, et al. Analysis of the application and development trend of biofloc technology in aquaculture in China[J]. China Fisheries, 2013(11): 64-67. DOI:10.3969/j.issn.1002-6681.2013.11.026 |
| [17] |
AWANG N A, SHAABAN M G. Effect of reactor height/diameter ratio and organic loading rate on formation of aerobic granular sludge in sewage treatment[J]. International Biodeterioration &Biodegradation, 2016, 112: 1-11. |
| [18] |
艾石基, 解庆林, 马丽丽, 等. 好氧颗粒污泥颗粒化影响因素及应用现状[J]. 环境科学与管理, 2009, 34(5): 64-68. AI S J, XIEQ L, MA L L, et al. Actors affecting and application of aerobic granular sludge[J]. Environmental Science and Management, 2009, 34(5): 64-68. DOI:10.3969/j.issn.1673-1212.2009.05.018 |
| [19] |
曲新月. 低高径比SBR中好氧颗粒污泥的培养及形成机理[D]. 西安: 西安建筑科技大学, 2018. QU X Y. The formation and mechanism of aerobic granular sludge in SBR with lower ratio of height to diameter[D]. Xi'an: Xi'an University of Architecture and Technology, 2018. |
| [20] |
TAY J H, LIU Q S, LIU Y. The effects of shear force on the formation, structure and metabolism of aerobic granules[J]. Applied Microbiology and Biotechnology, 2001, 57(1/2): 227-233. |
| [21] |
李冬, 王樱桥, 张杰, 等. 高径比对生活污水好氧颗粒污泥系统的影响[J]. 中国环境科学, 2019, 39(1): 141-148. LI D, WANG Y Q, ZHANG J, et al. The impact of height/diameter ratio on aerobic granular sludge(AGS) system in domestic sewage[J]. China Environmental Science, 2019, 39(1): 141-148. DOI:10.3969/j.issn.1000-6923.2019.01.015 |
| [22] |
张小玲, 王芳, 刘珊. 剪切力对好氧颗粒污泥的影响及其脱氮除磷特性研究[J]. 安全与环境学报, 2011, 11(4): 56-60. ZHANG X L, WANG F, LIU S. Effects of shear stress on the activated sludge granular and the features of nitrogen and phosphorus removal[J]. Journal of Safety and Environment, 2011, 11(4): 56-60. DOI:10.3969/j.issn.1009-6094.2011.04.013 |
| [23] |
冯骞, 薛朝霞, 汪翙, 等. 水流剪切力对活性污泥特性影响的试验研究[J]. 河海大学学报(自然科学版), 2006, 34(4): 374-377. FENG Q, XUE Z X, WANG Z, et al. Experimental study on influence of hydrodynamic shear stress on characteristics of activated sludge[J]. Journal of Hohai University (Natural Sciences), 2006, 34(4): 374-377. DOI:10.3321/j.issn:1000-1980.2006.04.005 |
| [24] |
HARGREAVES J A. Photosynthetic suspended-growth systems in aquaculture[J]. Aquacultural Engineering, 2006, 34(3): 344-363. DOI:10.1016/j.aquaeng.2005.08.009 |
| [25] |
CHEN X Q, LUO G Z, MENG H Y, et al. Effect of the particle size on the ammonia removal rate and the bacterial community composition of bioflocs[J]. Aquacultural Engineering, 2019, 86: 102001. DOI:10.1016/j.aquaeng.2019.102001 |
| [26] |
SCHRAMM A, DE BEER, DEN HEUVEL J, et al. Microscale distribution of populations and activities of Nitrosospira and Nitrospira spp[J]. Applied and Environmental Microbiology, 1999, 65(8): 3690-3696. DOI:10.1128/AEM.65.8.3690-3696.1999 |
| [27] |
李志华, 张玉蓉, 杨帆, 等. 除磷颗粒污泥系统中不同粒径颗粒的理化特性分析[J]. 环境科学, 2012, 33(4): 1299-1305. LI Z H, ZHANG Y R, YANG F, et al. Physicochemical characteristics of granules with different size in a granular sludge system for phosphorus removal[J]. Environmental Science, 2012, 33(4): 1299-1305. |
| [28] |
AZIM M E, LITTLE D C, BRON J E. Microbial protein production in activated suspension tanks manipulating C: N ratio in feed and the implications for fish culture[J]. Bioresource Technology, 2008, 99(9): 3590-3599. DOI:10.1016/j.biortech.2007.07.063 |
| [29] |
刘小英, 姜应和, 郭超, 等. SBR中除磷颗粒污泥的培养和A/O及A/A/O颗粒污泥工艺除磷特性研究[J]. 环境科学, 2009, 30(9): 2655-2660. LIU X Y, JIANG Y H, GUO C, et al. Formation of the phosphorus removal granular sludge and phosphorus removal characteristics of the anaerobic/oxic and anaerobic/anoxic/oxic granular sludge process in SBR[J]. Environmental Science, 2009, 30(9): 2655-2660. |
| [30] |
CHOI K H, DOBBS F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203-213. DOI:10.1016/S0167-7012(99)00034-2 |
| [31] |
高晓奇, 肖能文, 叶瑶, 等. 基于Biolog-ECO分析长庆油田土壤微生物群落功能多样性特征[J]. 应用与环境生物学报, 2014, 20(5): 913-918. GAO X Q, XIAO N W, YE Y, et al. Analysis of microbial community functional diversity in the Changqing Oilfield based on Biology-ECO method[J]. Chinese Journal of Applied &Environmental Biology, 2014, 20(5): 913-918. |
| [32] |
李志斐, 王广军, 余德光, 等. 生物絮团对养殖水体水质和微生物群落功能的影响[J]. 上海海洋大学学报, 2015, 24(4): 503-512. LI Z F, WANG G J, YU D G, et al. Effect of bioflocs on water quality and metabolic functions of microbialcommunity in zero-water exchange tanks[J]. Journal of Shanghai Ocean University, 2015, 24(4): 503-512. |
| [33] |
牛翠娟, 娄安如, 孙儒泳, 等. 基础生态学[M]. 2版. 北京: 高等教育出版社, 2002. NIU C J, LOU A R, SUN R Y, et al. Basic ecology[M]. 2nd ed. Beijing: Higher Education Press, 2002. |
| [34] |
龙腾锐, 何强, 林刚. 活性污泥中丝状菌与絮体结构的关系研究[J]. 中国给水排水, 2000, 16(2): 5-8. LONG T R, HE Q, LIN G. Research on the relationships between filamentousorganisms and flocculate structure in activated sludge[J]. China Water &Wastewater, 2000, 16(2): 5-8. DOI:10.3321/j.issn:1000-4602.2000.02.002 |
| [35] |
李志斐, 王广军, 谢骏, 等. 草鱼养殖池塘生物膜固着微生物群落碳代谢Biolog分析[J]. 水产学报, 2014, 38(12): 1985-1995. LI Z F, WANG G J, XIE J, et al. Microbial carbon metabolic characteristics of biofilm communities in the grass carp culture pond based on Biolog-ECO plates[J]. Journal of Fisheries of China, 2014, 38(12): 1985-1995. |
| [36] |
杨莺莺, 李卓佳, 梁晓华, 等. 芽胞杆菌对鱼池微生物群落代谢功能的影响[J]. 微生物学杂志, 2009, 29(3): 11-17. YANG Y Y, LI Z J, LIANG X H, et al. Influences of bacillus on metabolic functions of microbial communities in fishponds[J]. Journal of Microbiology, 2009, 29(3): 11-17. DOI:10.3969/j.issn.1005-7021.2009.03.003 |
| [37] |
董媛媛, 范立民, 胡庚东, 等. 生物絮团的饵料替代能力及水体环境微生物群落多样性分析[J]. 江苏农学学报, 2019, 35(4): 880-886. DONG Y Y, FAN L M, HU G D, et al. The substitute ability of bioflocs and the analysis of microbial community diversity in the ponds environment[J]. Jiangsu Journal of Agricultural Sciences, 2019, 35(4): 880-886. |
| [38] |
罗国芝, 柳泽锋, 谭洪新. 养殖用水重复利用过程中的C/N[J]. 水产科技情报, 2018, 45(1): 34-41. LUO G Z, LIU Z F, TAN H X. C/N in the process of reuse of aquaculture water[J]. Fisheries Science &Technology Information, 2018, 45(1): 34-41. |
| [39] |
张燕燕, 曲来叶, 陈利顶. Biolog EcoPlateTM实验信息提取方法改进[J]. 微生物学通报, 2009, 36(7): 1083-1091. ZHANG Y Y, QU L Y, CHEN L D. An amendment on information extraction of Biolog EcoPlateTM[J]. Microbiology, 2009, 36(7): 1083-1091. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


