2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 浙江省海洋水产养殖研究所, 浙江 温州 325000
鱼类的叉长-体质量关系是鱼类种群动力学的基础研究内容之一,通过它可以把鱼类的体长信息转换成体质量信息,进而将鱼类体长生长方程转化为体质量生长方程,从而广泛应用在渔业资源评估中。同时用于研究鱼类的生长特征:如判断是否为正异速生长、等速生长或负异速生长,求解生长参数等[1-3]。在捕捞压力、水文条件、气候变化等外界因素的作用下,鱼类的叉长-体质量关系也会发生一定的变化[4],进而影响到鱼类的种群动态。因此,对这种异质性的分析是鱼类生活史研究和资源评估及管理的重要内容之一[2, 5]。
线性混合效应模型(linear mixed-effect model, LMEM)是一种在异质性研究上广泛应用的统计效应模型。通过在传统线性模型适用领域基础之上进行扩展,其线性预测不仅包含了个体的固定效应,在分析随机效应方面同样取得了很好的效果[6]。近年来该方法已逐渐应用在渔业个体生物学研究中,如MA等[7]通过将线性混合效应模型应用于我国北部沿海小黄鱼体长-体质量分布关系研究中,分析了不同年份和海域下的随机效应。衷思剑等[8]运用线性混合效应模型对山东近海黄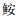
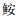
镰鲳(Pampus echinogaster)隶属于鲈形目(Perciformes)鲳科(Stromateidae)鲳属(Pampus),是一种重要的暖水性中上层经济鱼类,广泛分布于中国东海、黄海、南海及印度洋等地[9]。李渊[10]研究表明,分布在东海、黄海、渤海的镰鲳曾被误认为是银鲳。渔业资源调查结果显示,近年来镰鲳资源密度在东海海域逐渐减少[11-12],为了资源可持续利用,需要对其种群动力学过程和资源状态进行深入研究。但作为其资源评估基础的鱼类生物学研究,尤其是时空差异方面的研究并不多见。国内外对镰鲳的研究主要集中在繁殖生物学等方面,如:KANG等[13]研究了韩国西部海岸水域镰鲳的繁殖周期、卵径组成、产卵季节和初次性成熟体长等特征;WU等[14]通过体长-体质量关系研究了我国黄海沿岸水域镰鲳的生长参数;林龙山等[15]研究了镰鲳的生长死亡参数;李建生等[16]研究了镰鲳叉长-体质量关系及相关生长和死亡参数,提出其建议开捕叉长。这些研究主要集中在鲳类的基础生物学方面,缺乏对其生长参数的异质性分析。因此,本文根据2016—2018年冬、春、夏、秋4个季节在浙江南部近海的底拖网调查数据,应用线性混合效应模型,分析镰鲳的叉长-体质量关系及其异质性,为其资源的合理开发和管理提供科学依据。
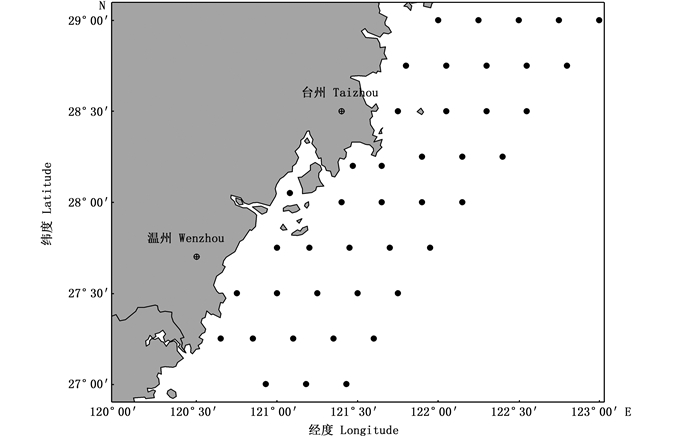
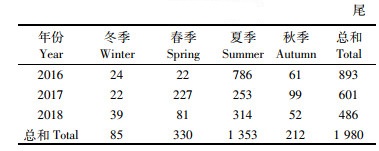
1 材料与方法 1.1 数据来源镰鲳样品取自2016—2018年3月初(冬季)、5月(春季)、8月(夏季)和11月(秋季)在浙江南部近海海域进行的温台地区底拖网渔业资源调查(图 1),调查站点共42个,调查船为“浙洞渔10109号”,主机功率403 kW,作业类型为单船网板底拖,网口平均扩张宽度为40 m,高约7.5 m,囊网网目为20 mm;调查期间每站位平均拖速为3 kn,平均拖网时间为1 h。收集到的镰鲳样品先进行冷冻保存,然后将其带回实验室进行鱼类基础生物学测定。每站点随机选择30尾进行测定,不足30尾的全部测定。本研究共分析1 980尾镰鲳(表 1),其中,冬季85尾,春季330尾,夏季1 353尾,秋季212尾。样品的收集、分析和测定均按照《海洋调查规范第6部分:海洋生物调查》(GB/T 12763.6—2007)[17]进行,叉长和体质量的测量分别精确到1 mm和0.01 g。
|
图 1 浙江南部近海渔业资源调查站点 Fig. 1 Fishery resources survey sites in the southern Zhejiang coastal area |
|
表 1 浙江南部近海镰鲳在不同季节和年份的样本数量 Tab.1 Sample size of Pampus echinogaster in different seasons and years in the offshore waters of southern Zhejiang |
镰鲳的叉长-体质量关系用幂指数方程表示:
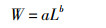 (1)
(1)
式中:W为体质量,g;L为叉长,mm;a为条件因子,b为生长参数。若b=3,表示该鱼类为等速的生长;若b>3,则表示该鱼类增长方式为正异速,即体质量相对叉长增长速度快,鱼体较为肥满;若b < 3,则表示该鱼类为负异速增长,即叉长相对体质量增长速度快,鱼体形态趋于细长[2]。
本研究利用广义线性模型(generalized linear model, GLM)和9个线性混合效应模型(LMEM)对镰鲳叉长-体质量关系进行描述。首先,对体质量数据进行对数化处理(表 2)。其次,在9个LMEM模型中,分别根据季节和年份对生物学参数a,b不同的影响程度,对镰鲳叉长-体质量关系的异质性进行分析。运用赤池信息准则(akaike information criterion, AIC)分别比较10个模型的拟合程度,AIC值越小,则构建的模型拟合程度越高[18]。最后,采用均方根误差(root mean square error, RMSE)判断最优模型,其值越接近0,证明该模型的性能越优[19]。数据整理、模型构建以及结果分析均通过R软件(Version 3.6.1)“lme4”[20]程序包进行。

|
表 2 浙江南部海域镰鲳叉长-体质量关系模型及其拟合效果 Tab.2 Fork length-mass relationship of Pampus echinogaster in the offshore waters of southern Zhejiang and its fitting effect |
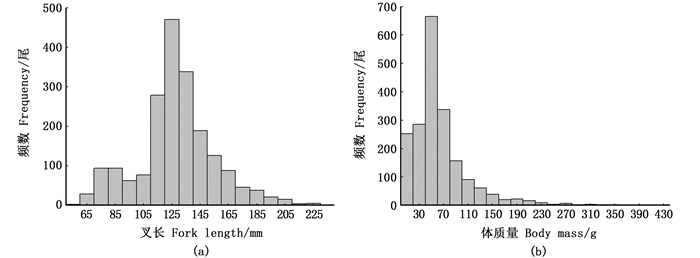
共分析镰鲳样品1 980尾,其体质量范围为3.8~420.5 g,平均体质量63.61 g,优势体质量范围为20~80 g。叉长范围为53~238 mm,平均叉长128.54 mm,优势叉长组范围为110~160 mm。见图 2。
|
图 2 浙江南部近海镰鲳叉长和体质量分布直方图 Fig. 2 Fork length and body mass distribution of Pampus echinogaster in the offshore waters of southern Zhejiang |
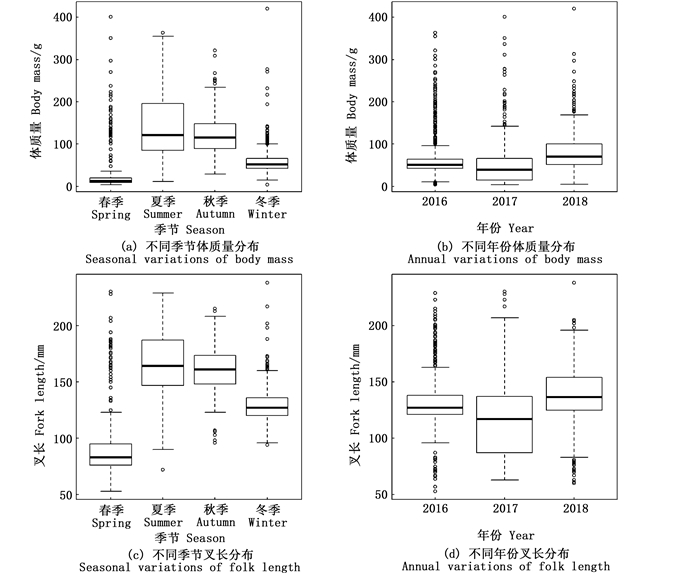
浙江南部近海镰鲳在不同季节和年份的叉长-体质量分布也有一定的差异(图 3)。从季节来看:夏季调查采样的镰鲳样本个体较大,体质量中值约为120 g,叉长中值约为170 mm;秋季和冬季次之,体质量中值分别为115 g和60 g,叉长中值分别为165 mm和125 mm;春季最小,体质量中值约为10 g,叉长中值约为85 mm。从年份来看:以2018年采集的镰鲳样本个体较大,体质量中值在80 g左右,叉长中值约为135 mm;2016年次之,体质量中值约为70 g,叉长中值约为125 mm;2017年最小,体质量中值约为60 g,叉长中值约为115 mm。
|
图 3 浙江南部近海镰鲳不同季节和年份的体质量及叉长分布 Fig. 3 Seasonal and annual variations of Pampus echinogaster body mass and fork length distribution in the offshore waters of southern Zhejiang |
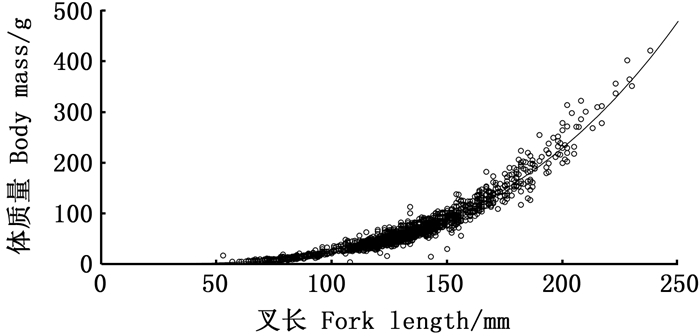
对浙江南部近海采样所得的1 980尾镰鲳样品进行分析,全部镰鲳样品的叉长-体质量的幂函数(图 4)关系式为W=(0.59×10-5)×L3.297(R2=0.953 9,n=1 980)。
|
图 4 浙江南部近海镰鲳叉长-体质量关系 Fig. 4 Fork length-mass relationship of Pampus echinogaster in the offshore waters of southern Zhejiang |
通过对比GLM与9个不同组合的LMEM模型发现,模型AIC值最小的为LMEM(S&Y.I&S),其值为-1 678(表 2),说明在拟合的线性混合效应模型中,同时具有年份和季节对a和b两个参数的随机效应对镰鲳的叉长-体质量关系的拟合效果最优。a的固定效应值为1.75×10-5,估计值范围为5.20×10-6~3.90×10-5;b的固定效应估计值为3.083,估计值范围为2.915~3.317。a值、b值的季节差异范围分别为2.76×10-5和0.294(图 5a);年份差异范围为1.06×10-5和0.273(图 5b)。从不同年份来看:a值在2018年最大,为2.27×10-5,2016年次之,2017年最小,为1.22×10-5;b值在2017年最大,为3.151,2016年次之,2018年最小,为3.042(图 5b)。从不同季节来看:a值在秋季最大,为3.51×10-5,夏季和冬季次之,春季最小,为7.49×10-6;b值在春季最大,为3.249,冬季和夏季次之,秋季最小,为2.955(图 5a)。
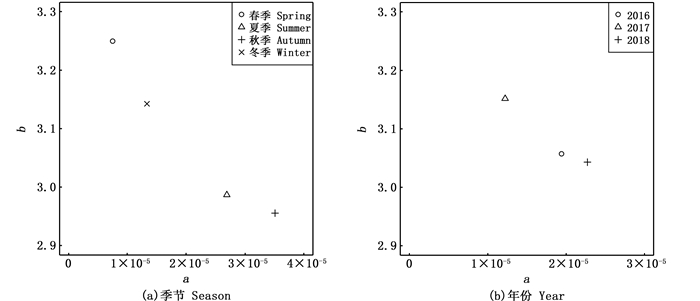
|
图 5 LMEM(S&Y.B&C)中a值和b值的季节和年份变化 Fig. 5 Seasonal and annual variationin a and b values in LMEM (S&Y.I&S) |
镰鲳生长异质性在不同叉长组的表现也不同(图 6)。从不同年份来看:镰鲳叉长为50~200 mm时,各个年份的体质量增长曲线几乎重合(图 6a);叉长大于200 mm后,各年份的体质量增长率大小顺序为2018年>2017年>2016年(图 6b)。从不同季节来看:镰鲳叉长50~200 mm时,体质量增长率的季节性差异较小(图 6c);叉长在大于200 mm后,春季和夏季镰鲳体质量增长率较为明显(图 6d),各季节的体质量增长率大小顺序为春季>夏季>秋季>冬季。
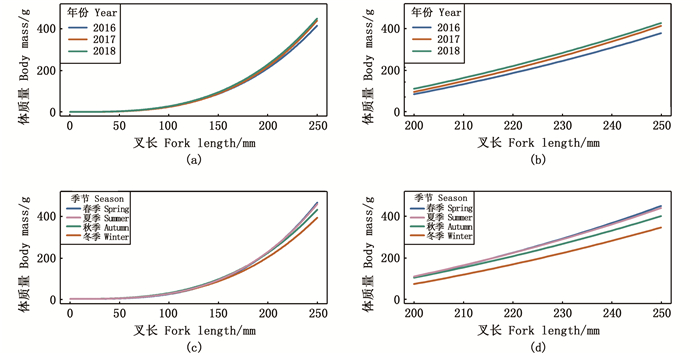
|
图 6 浙江南部近海镰鲳在不同年份(a、b)和季节(c、d)的叉长-体质量关系差异 Fig. 6 Annual (a, b) and seasonal (c, d) variations of Pampus echinogaster fork length-mass relationship in the offshore waters of southern Zhejiang |
叉长-体质量关系的生长参数是了解鱼类生活史和形态特征的基础,是研究鱼类生长情况的重要指标[21]。关系式中的条件因子a反映了其生长环境的适宜性[22],即a值越大说明该水域环境适合鱼类生长,反之,则说明该水域不适合鱼类生长。生长参数中的幂指数b值可以用来分析鱼类是否为等速生长[23],常用来判断鱼类个体的肥满度。鱼类生长参数的时空差异由多种因素造成,包括气候变化、捕捞强度和饵料供应等[16, 24],同时调查样品的样本量、涵盖的体长范围和调查网具的选择性等也会对分析结果产生一定的影响[25-26]。WU等[14]对黄海的镰鲳生物学参数进行了分析,得出其a值为0.011,远高于本研究得出的结果(1.75×10-5),除空间差异的影响外,这可能是由于黄海的研究使用了镰鲳的体长而非叉长,同时其分析的样本较少(69尾)所引起的。同时本研究计算得出的参数a值也低于东海镰鲳的生物学历史研究结果[15-16],这可能是由于捕捞压力等原因,近年来镰鲳的生境恶化所导致。本研究计算得出的生长参数b值大于3,为正异速生长,说明其体质量增长速率略快,身体较为肥满,这与黄海的研究结果(3.101)[14]以及东海[15-16]的历史研究结果相符。本研究镰鲳的叉长最大值为238 mm,WU等[14]与李建生等[16]研究中的镰鲳叉长范围与本研究相似,林龙山等[15]研究中出现了我国近海捕获的镰鲳最大叉长为266 mm,但与Fishbase上记载的镰鲳最大长度(600 mm[27])仍有很大差异,这可能是由于不同海域镰鲳的生长环境导致的,该地区的种群主要以小型个体构成。
许多关于鱼类叉长-体质量关系的时间异质性研究中,均使用特定季节或者特定年份的不同模型来检验鱼类生长参数的时间差异[28],这种方法难以对多重异质性来源进行同时分析。本研究应用线性混合效应模型,同时考虑了季节和年份对生长参数的异质性影响,并且通过季节和年份两个时间因素对参数a和b值产生的随机效应,分别拟合了9个线性混合效应模型,发现任意一个的AIC值都小于简单广义线性模型的AIC值,说明其拟合效果优于广义线性模型。对条件因子a值和生长参数b值来说,包含年份和季节随机效应的混合效应模型的拟合效果最优。最优模型结果表明,不同年份和季节得出的条件因子a值的范围为5.20×10-6~3.90×10-5,显示出不同季节和年间鲳鱼对生长环境的适宜性有一定的波动。春季的镰鲳a值最低,这可能是由于春季补充群体加入导致的结果[29]。镰鲳属于暖水性经济鱼类[8-9],浙江南部近海的地理位置属亚热带季风气候区[30],气候适宜,在此水域,镰鲳于每年4月中旬至5月中旬进行产卵[29],这可能导致了春季调查期(5月下旬)幼鱼比例较高,使得春季镰鲳的a值较小;夏季和秋季处于洄游索饵阶段,比较适宜镰鲳生长,其a值较大。统计检验结果表明,镰鲳的条件因子a值有显著的季节差异,但是没有显著的年际变化。
FROESE[2]研究结果显示大部分鱼类b值通常在2.7~3.4范围之内,Fishbase中镰鲳的b值为3.03(2.84~3.22)[31],本研究镰鲳的b值结果为2.915~3.317。浙江南部近海镰鲳生长参数b的固定值为3.083,为正异速生长,即随着叉长的增加,镰鲳体型较为肥满。本研究中所有年份的春季b值最大,同时每年的b值大小为春季>冬季>夏季>秋季,这可能与镰鲳的产卵、索饵和洄游习性的季节性行为有关。镰鲳在春季处于产卵期[29],其精巢或者卵巢发育较为成熟,体质量上升,所以春季镰鲳体型较为肥满,b值最高。冬季为越冬阶段[16],其体内脂肪储存量较高。夏秋季为洄游索饵阶段,其叉长相对体质量的生长加速度较快,所以b值较小。统计检验结果表明,镰鲳的生长参数b值有显著的季节差异,但并未见有明显的年际变化。其中2017年b值最大,反映出2017年的镰鲳形态较为肥满,说明横向的体型生长要快于纵向体型生长,体质量比叉长增加得快,这可能与采样调查年份中的平均水温有关。温度是影响水生生物生长、发育和分布的主要环境因素[32],2017年平均水温最高,为21.78 ℃。温度升高会引起鱼类新陈代谢加快和饵料生物生长加快[28],同时鲳类最适温度为19~22 ℃[31],在这个温度下,其饵料条件较为丰富,较适合镰鲳生长发育,从而导致了2017年镰鲳的生长参数b值最大。
本研究发现分布于浙江南部海域镰鲳条件因子及生长参数有显著的季节变化,特别春季镰鲳叉长、体质量有逐年增大的趋势。限于本研究的时空尺度等因素,仅仅考虑了年份、季节这两个要素与镰鲳叉长-体质量关系的拟合效果,这种变化也可能受每年各个航次调查时间的差异及取样地点等的影响。在未来的研究中,可进一步考虑性别、空间分布、生长阶段和摄食强度等对镰鲳叉长-体质量关系的影响,为其资源的合理开发和管理提供科学依据。
| [1] |
官文江, 吴佳文. 剩余产量模型形状参数对印度洋黄鳍金枪鱼资源评估的影响[J]. 上海海洋大学学报, 2019, 28(2): 298-304. GUAN W J, WU J W. Impacts of shape parameter of surplus production model on stock assessment of Indian Ocean yellowfin tuna[J]. Journal of Shanghai Ocean University, 2019, 28(2): 298-304. |
| [2] |
FROESE R. Cube law, condition factor and weight-length relationships:history, meta-analysis and recommendations[J]. Journal of Applied Ichthyology, 2006, 22(4): 241-253. DOI:10.1111/j.1439-0426.2006.00805.x |
| [3] |
张畅, 陈新军. 澳洲鲭太平洋群系的资源评估与管理策略[J]. 水产学报, 2020, 44(2): 206-212. ZHANG C, CHEN X J. Management and assessment of spotted mackerel (Scomber australasicus) biomass in the Pacific Ocean[J]. Journal of Fisheries of China, 2020, 44(2): 206-212. |
| [4] |
单秀娟, 李忠炉, 戴芳群, 等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化[J]. 渔业科学进展, 2011, 32(6): 7-16. SHAN X J, LI Z L, DAI F Q, et al. Seasonal and annual variations in biological characteristics of small yellow croaker Larimichthys polyactis in the central and southern Yellow Sea[J]. Progress in Fishery Sciences, 2011, 32(6): 7-16. DOI:10.3969/j.issn.1000-7075.2011.06.002 |
| [5] |
PAULY D. Fishbyte section editorial[J]. Naga:the International Center for Living Aquatic Resources Management Quarterly, 1993, 16(2/3): 26. |
| [6] |
XU H, SUN Y J, WANG X J, et al. Linear mixed-effects models to describe individual tree crown width for China-fir in Fujian Province, southeast China[J]. PLoSONE, 2015, 10(4): e0122257. DOI:10.1371/journal.pone.0122257 |
| [7] |
MA Q Y, JIAO Y, REN Y P. Linear mixed-effects models to describe length-weight relationships for yellow croaker (Larimichthy spolyactis) along the north coast of China[J]. PLoS ONE, 2017, 12(2): e0171811. DOI:10.1371/journal.pone.0171811 |
| [8] |
衷思剑, 麻秋云, 刘淑德, 等. 基于线性混合效应模型的黄鮟鱇体长体重关系的时空差异[J]. 中国水产科学, 2018, 25(6): 1299-1307. ZHONG S J, MA Q Y, LIU S D, et al. Linear mixed-effects models for estimating spatiotemporal variations of length-weight relationships for Lophius litulon[J]. Journal of Fishery Sciences of China, 2018, 25(6): 1299-1307. |
| [9] |
郑元甲, 陈雪忠, 程家骅, 等. 东海大陆架生物资源与环境[M]. 上海: 上海科学技术出版社, 2003: 379-388. ZHENG Y J, CHEN X Z, CHENG J H, et al. The fisheries resources and environment in the East China Sea Shelf[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2003: 379-388. |
| [10] |
李渊.鲳属鱼类形态学和遗传学研究[D].青岛: 中国海洋大学, 2015. LI Y. Studies on morphology and genetics of Pampus species[D]. Qingdao: Ocean University of China, 2015. |
| [11] |
张秋华, 程家骅, 徐汉祥, 等. 东海区渔业资源及其可持续利用[M]. 上海: 复旦大学出版社, 2007: 183-200. ZHANG Q H, CHENG J H, XU H X, et al. The fishery resources and its sustainable utilization in the East China Sea Region[M]. Shanghai: Fudan University Press, 2007: 183-200. |
| [12] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 1999-2019中国渔业统计年鉴[M].北京: 中国农业出版社, 1999-2019. Fishery and Fishery Administration of the Ministry of Agriculture and Rural Areas, National Aquatic Technology Promotion Terminal, Chinese Society of Fisheries.China fishery statistical yearbook, 1999-2019[M].Beijing: China Agriculture Press, 1999-2019. |
| [13] |
KANG H W, KIM S H, CHUNG J S. Histological studies on the reproductive cycle and first sexual maturity of the pomfret, Pampusechinogaster (Perciformes:Stromateidae) on the west coast of Korea[J]. Journal of Fisheries and Marine Sciences Education, 2017, 29(5): 1614-1623. DOI:10.13000/JFMSE.2017.29.5.1614 |
| [14] |
WU Z X, YANG G J, SONG L. Length-weight relationships of three fish species from the coastal waters of Yellow Sea, China[J]. Journal of Applied Ichthyology, 2018, 34(3): 706-707. DOI:10.1111/jai.13552 |
| [15] |
林龙山, 程家骅, 凌建忠, 等. 东海区主要经济鱼类开捕规格的初步研究[J]. 中国水产科学, 2006, 13(2): 250-256. LIN L S, CHENG J H, LING J Z, et al. First capture sizes of major commercial fishes in the East China Sea Region[J]. Journal of Fishery Sciences of China, 2006, 13(2): 250-256. DOI:10.3321/j.issn:1005-8737.2006.02.014 |
| [16] |
李建生, 胡芬, 严利平. 东海区银鲳资源合理利用的研究[J]. 自然资源学报, 2014, 29(8): 1420-1429. LI J S, HU F, YAN L P. Study on the rational utilization of Pampus argenteus resources in the East China Sea Region[J]. Journal of Natural Resources, 2014, 29(8): 1420-1429. |
| [17] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12763.6-2007海洋调查规范第6部分: 海洋生物调查[S].北京: 中国标准出版社, 2008: 56-62. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 12763.6-2007 Specifications for oceanographic survey part 6: marine biological survey[S]. Beijing: Standards Press of China, 2008: 56-62. |
| [18] |
BURNHAM K P, ANDERSON D R. Model selection and multimodel inference:a practical information theoretic approach[M]. 2nd ed. New York: Springer, 2002: 484-488.
|
| [19] |
TANAKA K, CHEN Y. Spatiotemporal variability of suitablehabitat for American lobster (Homarus americanus) in Long Island Sound[J]. Journal of Shellfish Research, 2015, 34(2): 531-543. DOI:10.2983/035.034.0238 |
| [20] |
BATES D, MÄCHLER M, BOLKER B M, et al. Fitting linear mixed-effects models using lme4[J]. Journal of Statistical Software, 2015, 67(1): 1-48. |
| [21] |
TORRES M A, RAMOS F, SOBRINO I. Length-weight relationships of 76 fish species from the Gulf of Cadiz (SW Spain)[J]. Fisheries Research, 2012, 127-128: 171-175. DOI:10.1016/j.fishres.2012.02.001 |
| [22] |
詹秉义. 渔业资源评估[M]. 北京: 中国农业出版社, 1995. ZHAN B Y. Fishery resources evaluation[M]. Beijing: China Agriculture Press, 1995. |
| [23] |
RICKER W E. Computationand interpretation of biological statistics of fish populations[J]. Bulletin of the Fisheries Research Board of Canada, 1975, 191: 1-382. |
| [24] |
ENBERG K, JØRGENSEN C, DUNLOP E S, et al. Fishing-induced evolution of growth:concepts, mechanisms and the empirical evidence[J]. Marine Ecology, 2012, 33(1): 1-25. DOI:10.1111/j.1439-0485.2011.00460.x |
| [25] |
黄洪亮, 王明彦, 徐宝生, 等. 东海区拖网网囊网目选择性研究[J]. 水产学报, 2005, 29(2): 232-237. HUANG H L, WANG M Y, XU B S, et al. Study on selectivity of mesh size of cod-end of trawl in the East China Sea region[J]. Journal of Fisheries of China, 2005, 29(2): 232-237. |
| [26] |
叶婷, 王迎宾, 周丛羽. 鱼类体长频率数据结构对生长参数估算的影响分析[J]. 水产科学, 2014, 33(5): 277-282. YE T, WANG Y B, ZHOU C Y. Analysis of effects of fish length frequency data on estimates of growth parameters[J]. Fisheries Science, 2014, 33(5): 277-282. DOI:10.3969/j.issn.1003-1111.2014.05.003 |
| [27] |
MASUDA H, AMAOKA K, ARAGA C, et al. The fishes of the Japanese archipelago[M]. Tokyo: Tokai University Press, 1984.
|
| [28] |
WANG X, XUE Y, REN Y. Length-weight relationships of 43 fish species from Haizhou Bay, central Yellow Sea[J]. Journal of Applied Ichthyology, 2013, 29(5): 1183-1187. DOI:10.1111/jai.12200 |
| [29] |
胡翠林, 张亚洲, 李德伟, 等. 浙江沿岸产卵场春、夏季鱼类资源密度和群落多样性研究[J]. 水生生物学报, 2018, 42(5): 984-995. HU C L, ZHANG Y Z, LI D W, et al. Study on fish resources and community diversity during spring and summer in the coastal spawning ground of Zhejiang Province, China[J]. Acta Hydrobiologica Sinica, 2018, 42(5): 984-995. |
| [30] |
陈新军. 渔业资源与渔场学[M]. 2版. 北京: 海洋出版社, 2014. CHEN X J. Fisheries resources and fisheries[M]. 2nd ed. Beijing: Ocean Press, 2014. |
| [31] |
FROESE R, THORSON J T, REYES R B JR. A Bayesian approach for estimating length-weight relationships in fishes[J]. Journal of Applied Ichthyology, 2014, 30(1): 78-85. DOI:10.1111/jai.12299 |
| [32] |
KASCHNER K, KESNER-REYES K, GARILAO C, et al. AquaMaps: predicted range maps for aquatic species[J/OL]. World Wide Web Electronic Publication, 2016, https://www.aquamaps.org/.
|
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Zhejiang Mariculture Research Institute, Wenzhou 325000, Zhejiang, China
 2021,
Vol. 30
2021,
Vol. 30


