2. 中国水产科学研究院淡水渔业研究中心, 江苏 无锡 214081;
3. 南京农业大学 无锡渔业学院, 江苏 无锡 214081;
4. 诺亚方舟农业科技有限公司, 江苏 常州 213147
中华绒螯蟹(Eriocheir sinensis)属甲壳纲(Crustacea)十足目(Decapoda)方蟹科(Grapsidae)绒螯蟹属(Eriocheir),是一种降海洄游性甲壳类动物。20世纪80年代以来,随着规模化人工繁育技术的突破,中华绒螯蟹养殖业迅速发展壮大[1]。得益于优质苗种和绿色养殖模式的逐步推广,当前形成了以长江中下游流域为主产区,国内大部分省市均有中华绒螯蟹养殖的局面[2-4]。2018年,全国中华绒螯蟹养殖面积多达6.67×105 hm2,养殖产量达7.57×105 t,占甲壳类经济动物的22%[4],是我国重要的淡水养殖甲壳类动物之一。
中华绒螯蟹属于季节性的水产品,上市时间相对集中且短暂。中华绒螯蟹一般在10月至11月发育成熟,春节前上市。春节过后,气温上升,中华绒螯蟹性腺发育加速,“蟹黄”减少变硬,品质可能下降,所以每年2月后市场上的中华绒螯蟹数量锐减,4—5月基本难以有优质中华绒螯蟹供应。中华绒螯蟹不能均衡上市,限制了消费者享用,由此造成了“六月黄”的热销,然而“六月黄”的营养品质较正常成蟹低[5]。如何在延长中华绒螯蟹上市期的同时,保持较好的肉质品质,成为近年来备受关注的难题。
国内外对中华绒螯蟹的研究主要集中在遗传育种[6-7]、病害防治[8-9]、营养调控[10]、风味品质[11-12]及入侵扩散[13-15]等方面。水产品的暂养技术可以实现错峰上市,克服上市比较集中的劣势。关于中华绒螯蟹暂养的报道较少,仅有个别养殖户尝试通过土池控温暂养或网箱暂养,有效延长了中华绒螯蟹的上市时间[16-17]。关于暂养前后中华绒螯蟹营养品质及风味的研究至今未见报道。为此本试验采用池塘循环水网箱暂养系统对中华绒螯蟹进行越冬暂养,检测分析越冬暂养前后成年雌蟹一般生物学指标、常规生化成分、脂肪酸成分、呈味核苷酸组成、游离氨基酸组成及挥发性风味物质的差异情况,旨在从营养品质及风味层面评判越冬暂养的利弊。
1 材料与方法 1.1 试验材料试验蟹购自江苏诺亚方舟农业科技有限公司,均为生殖蜕壳后的成年雌性中华绒螯蟹,体质量(121.23±9.57)g,背甲长(60.31±1.07) mm,活力强、体态完好、肢体健全。养殖试验在江苏诺亚方舟农业科技有限公司(江苏省常州市)进行。实验用嵌入在2 000 m2循环水养殖池塘中的3个网箱作为暂养系统见图 1,网箱长×宽×高= 2.0 m×1.6 m×1.0 m,网目尺寸0.5 cm,在该系统中,网箱固定在单独的金属框架内,金属框架嵌入在池塘两侧,池塘中央作为出水口通道。池底设置纳米增氧管,池塘中部配备水轮增氧机,以增加溶解氧,加速水流并清除残饵和粪便等废物,保证良好的水环境。
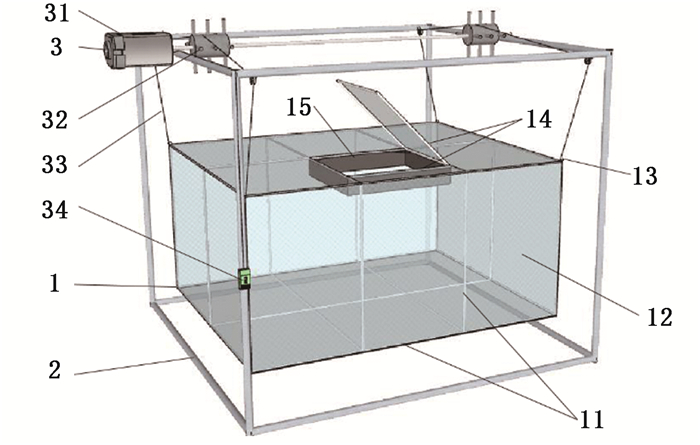
|
1.暂养网箱包括网箱框架(11)、覆盖网片(12)、铁环(13)、网箱门(14)、箱口防逃膜(15)等;2.主体框架;3.升降系统由升降电机(31)、升降绞盘(32)、升降绳(33)和智能开关(34)组成。 1. net cage, containing net cage frame (11), net (12), iron hoop (13), door (14), escape-proof fled membrane (15); 2. main body frame; 3. lifting system consist of lifting motor (31), lifting capstan (32), lifting rope (33) and intelligent switch (34). 图 1 中华绒螯蟹网箱暂养系统轮廓图 Fig. 1 Outline of net cage in Eriocheir sinensis temporary cultivation system |
主要仪器:马弗炉(SX-25-12型,上海洪纪仪器设备有限公司);全自动凯氏定氮仪(JT36-KDY982型,美国海能实验室设备);全自动索氏脂肪测定仪(SOX500型,美国海能实验室设备);高效液相色谱系统(Summit 3型,戴安中国有限公司);6890-5975B气相色谱-质谱联用仪(美国Agilent公司);圆柱形MonoTrap RCC18(2.9 mm×5 mm×1 mm)日本GL Sciences公司;DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);热脱附器、多功能进样器、玻璃衬管、具有PTV的冷却型进样口、气相色谱质谱联用仪GC-MS(德国Gerstel公司)。
1.2 试验设计与养殖管理试验从2018年12月18日至2019年4月2日,暂养密度为每网箱50 kg (15.63 kg/m2)。暂养时间和暂养密度参考文献[18]。
每天17:00投喂冰鲜鱼,每2~3 d搭配投喂植物性饵料(玉米、大豆),与之前成蟹养成期投喂的饵料一致,一般投喂量为总蟹质量的2%~3%,具体投喂量根据残饵情况、溶氧、水温等情况适当调整。每日投喂前检查残饲并捞出,投饲次日9:00左右检查死蟹并捞出。所有试验蟹均在循环水养殖网箱内适应1周后进行。第0天(适应1周后)和第105 d采集样品,在取样前禁食24 h。在试验期间,未观察到疾病暴发或其他疾病现象,成活率为55.46%±13.54%。
越冬暂养期间水温为4.5~20.2 ℃,溶解氧为8.54~13.70 mg/L,氨氮低于0.40 mg/L,亚硝酸盐低于0.15 mg/L,pH维持在7.5~8.5,化学需氧量低于10.0 mg/L,这些水质参数都在正常参考范围内。
1.3 样品采集随机选取18只中华绒螯蟹(每网箱6只),在冰上麻醉后,用电子秤称量其湿体质量(精确到0.01 g),游标卡尺测量其甲壳长、宽及高(精确到0.01g),随后进行解剖,取出全部性腺、肝胰腺,计算出性腺指数(GSI)、肝胰腺指数(HSI),刮出腹部肌肉和附肢肌肉(仅取长节、座节和底节肌肉),称量后将样品储存于-30 ℃以进行下一步生化成分和营养品质测定,计算出出肉率(MY)及总可食率(TEY),记为第0天。
暂养后从3个试验网箱中分别采取6只中华绒螯蟹,操作步骤同暂养前。
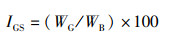 (1)
(1)
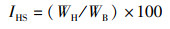 (2)
(2)
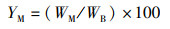 (3)
(3)
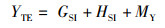 (4)
(4)
式中:IGS为性腺指数,%;IHS为肝胰腺指数,%;YM为出肉率,%;YTE为总可食率,%;WB为体质量,g;WG为性腺质量,g;WH为肝胰腺质量,g;WM为肌肉质量,g。
1.4 试验方法 1.4.1 基本营养成分测定为探究长时间暂养对中华绒螯蟹营养成分潜在的影响,本研究分析了暂养前后卵巢和可食部位混样中常规生化成分及脂肪酸组成。其中可食部位混样为肝胰腺、性腺和肌肉的等量混合。水分含量参照GB 5009.3—2016(105 ℃烘干至恒重)测定;灰分含量参照GB 5009.4—2016(550 ℃灼烧至恒重)测定;粗脂肪参照GB 5009.6—2016(索氏抽提法)测定;粗蛋白参照GB 5009.5—2016(凯氏定氮法)测定。
1.4.2 游离氨基酸测定称取中华绒螯蟹肌肉混匀蟹样湿样1 g左右,精确到0.000 1 g。加入5%三氯乙酸(5 g/100 mL TCA)定容至25 mL并记录体积。涡旋混匀后常温超声20 min,静置2 h及以上。双层滤纸过滤后,取1 mL上清滤液,10 000 r/min离心30 min,取400 μL上清滤液上机测定。
游离氨基酸总含量用T表示,E表示7种必需氨基酸(蛋氨酸、苯丙氨酸、缬氨酸、苏氨酸、亮氨酸、异亮氨酸、赖氨酸),N表示10种非必需氨基酸(天冬氨酸、谷氨酸、甘氨酸、脯氨酸、丙氨酸、精氨酸、组氨酸、丝氨酸、酪氨酸、半胱氨酸)。E/T表示必需氨基酸含量与游离氨基酸总含量的比值,N/T表示非必需氨基酸含量与游离氨基酸总含量的比值,E/N表示必需氨基酸与非必需氨基酸的比值。
1.4.3 脂肪酸测定本研究分析了暂养前后卵巢和可食部位混样的脂肪酸组成。称取可食部位混样或卵巢组织3 g左右(精确到0.000 1 g),采用索氏抽提法(GB 5009.6—2016)提取脂肪。取100 μL脂肪抽提液加入2 mL 0.5 mol/L NaOH-甲醇溶液,65 ℃加热30 min至油珠完全溶解,待冷却后加入25%三氯化硼-甲醇溶液(体积比为1∶3) 2 mL,70 ℃酯化20 min。冷却后加入2 mL正己烷,振摇,加入2 mL饱和NaCl溶液充分振摇,加入无水Na2SO4除水,吸1 mL上清上机测定。
1.4.4 呈味核苷酸测定取中华绒螯蟹可食部位混样(肝胰腺、性腺和肌肉)等量混合,加入高氯酸溶液(5%)30 mL,匀浆后冷冻离心(10 000 r/min, 10 min,4 ℃),取上清液用0.5 mol/L氢氧化钠调节pH至6.5左右,超纯水定容至100 mL,用0.25 μm滤膜过滤后取400 μL滤液于液相瓶中,用Agilent-1206 HPLC仪进行测定。
HPLC仪色谱柱:Diamonsil-C18(5 μm, 4.6×250 mm,柱温30 ℃);流速:1 mL/min;进样量400 μL;紫外检测器检测波长:260 nm;流动相:A为0.05%磷酸,B为95%甲醇。
1.4.5 挥发性风味物质测定称取2 g左右中华绒螯蟹混样(肝胰腺、性腺和肌肉)等量混合于顶空瓶中,插入萃取头后100 ℃水浴40 min,使中华绒螯蟹可食部分完全变熟。萃取结束后,将萃取头迅速转移至气相色谱-质谱联用仪,脱附8 min。
气相色谱质谱联用仪(GC-MS)条件:色谱HP-5MS(柱长30 m,柱径0.25 mm,夜膜厚度0.25 μm的弹性毛细管柱)。温度条件:开始温度为35 ℃,持续3 min;再以3 ℃/min的速度升到65 ℃;继以6 ℃/min的速度把温度升高到185 ℃;最后以10 ℃/min的速度升温至255 ℃,持续10 min。质谱条件:电子电离源;电子能量75 eV;离子源温度为210 ℃。
1.5 数据处理数据用IBM SPSS Statistics 22.0软件进行统计分析,采用平均值±标准差(Mean±SD)来表示。对符合正态分布的数据进行独立样本t检验;对不符合正态分布的数据,进行Mann-Whitney U非参数检验;采用Excel 2010软件做表,Origin 2017软件作图,P < 0.05表示差异显著。
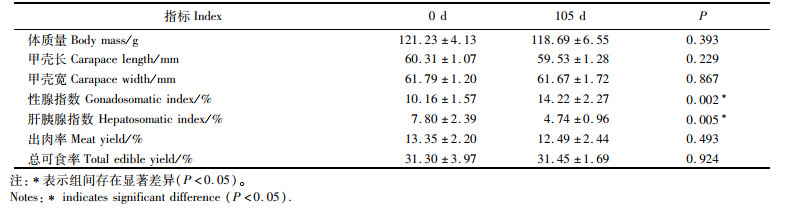
2 结果 2.1 暂养前后中华绒螯蟹一般生物学指数比较分析中华绒螯蟹的肝胰腺指数和性腺指数随着暂养时间的延长而显著变化,在0~105 d时,肝胰腺指数随着暂养时间延长而显著下降,而性腺指数则与之相反(表 1)。另外,越冬暂养期间时间对中华绒螯蟹的其他生长参数无显著影响。结果表明,中华绒螯蟹在越冬暂养期间体质量无明显变化。
|
表 1 暂养前后中华绒螯蟹一般生物学指数比较 Tab.1 Comparative analysis of general biological indices of Eriocheir sinensis before and after overwintering cultivation |
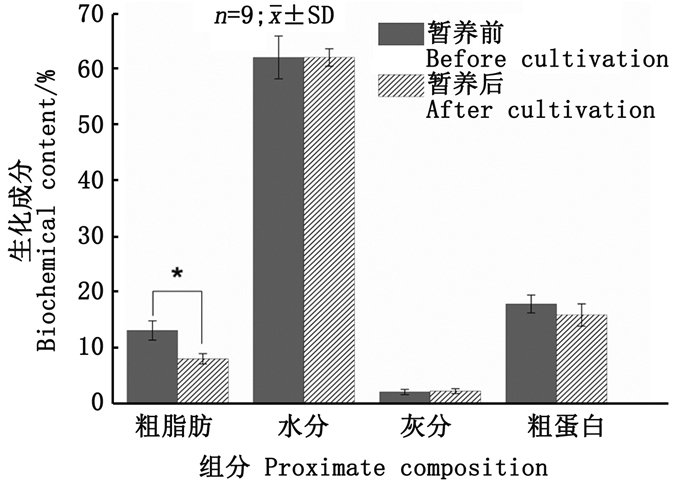
中华绒螯蟹越冬暂养后的总脂含量相比暂养前显著下降(P < 0.05, 图 2),这主要是由于越冬暂养期间,水温相对较低,中华绒螯蟹很少摄食。其他营养成分在越冬暂养前后均无显著变化(P>0.05, 图 2)。
|
*表示差异显著(P < 0.05)。 * indicates significant difference (P < 0.05). 图 2 暂养前后中华绒螯蟹可食组织中一般生化成分的变化 Fig. 2 Changes of proximate composition in edible tissues of Eriocheir sinensis before andafter overwintering cultivation(g/100g wet weight) |
中华绒螯蟹在越冬暂养后,卵巢中脂肪含量下降(P < 0.05, 图 3),其他基本营养成分在暂养前后均无明显差异(P>0.05, 图 3)。

|
*表示差异显著(P < 0.05)。 *indicates significant difference (P < 0.05) 图 3 暂养前后中华绒螯蟹卵巢中一般生化成分的变化 Fig. 3 Changes of proximate composition in ovary of Eriocheir sinensis after overwintering cultivation(g/100 g wet weight) |
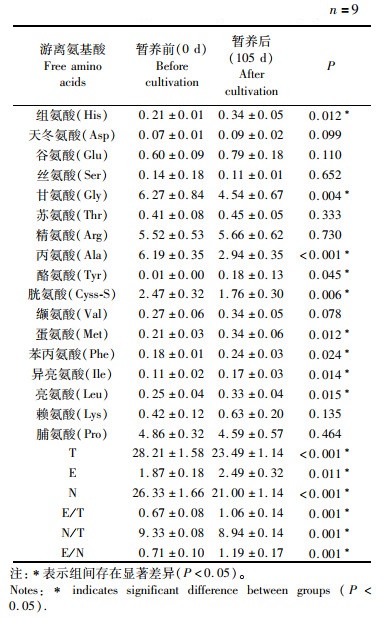
中华绒螯蟹肌肉共检测出17种氨基酸,包括7种必需氨基酸(蛋氨酸、苯丙氨酸、缬氨酸、苏氨酸、亮氨酸、异亮氨酸、赖氨酸)和10种非必需氨基酸(天冬氨酸、谷氨酸、甘氨酸、脯氨酸、丙氨酸、精氨酸、组氨酸、丝氨酸、酪氨酸、半胱氨酸),其中,精氨酸,脯氨酸,甘氨酸,丙氨酸占主要比例。暂养105 d后,甘氨酸和丙氨酸含量显著下降,精氨酸含量最高,但相比暂养前无明显差异。暂养后的中华绒螯蟹获得更高含量的必需氨基酸(蛋氨酸,苯丙氨酸,异亮氨酸,亮氨酸),非必需氨基酸(N)与之相反,在暂养后显著下降。游离氨基酸总含量(T)下降,必需氨基酸与游离氨基酸总含量比值(E/T)显著上升,非必需氨基酸与游离氨基酸总含量比值(N/T)显著下降,必需氨基酸与非必需氨基酸比值(E/N)显著上升。结果表明,暂养105 d后中华绒螯蟹肌肉的风味品质得到了一定程度的改善。见表 2。
|
表 2 暂养后中华绒螯蟹肌肉游离氨基酸含量变化(‰湿重) Tab.2 Change of free amino acid content of muscles in Eriocheir sinensis after overwintering cultivation(‰ wet weight) |
蟹油中共检测出22种脂肪酸,其中饱和脂肪酸8种、单不饱和脂肪酸4种和多不饱和脂肪酸10种(表 3)。在中华绒螯蟹可食组织脂肪酸组成中,C18∶1占主导地位,与暂养时间有显著性差异;其次是C22∶6和C16∶1,与暂养时间无显著性差异。与越冬暂养前相比,暂养后的中华绒螯蟹具有更低的C14∶0(肉豆蔻酸)、C15∶0(十五烷酸)、C20∶1(二十碳五烯酸)、C22∶1(二十二烯酸)和C22∶5(二十二碳五烯酸)含量,而C20∶4(花生四烯酸)和C20∶5(二十碳五烯酸)含量明显上升。越冬暂养105 d后,多不饱和脂肪酸(∑PUFA)和∑PUFA/∑SFA(多不饱和脂肪酸与饱和脂肪酸比值)显著增加。结果表明,暂养105 d后中华绒螯蟹可食组织的营养品质得到了一定程度的改善。
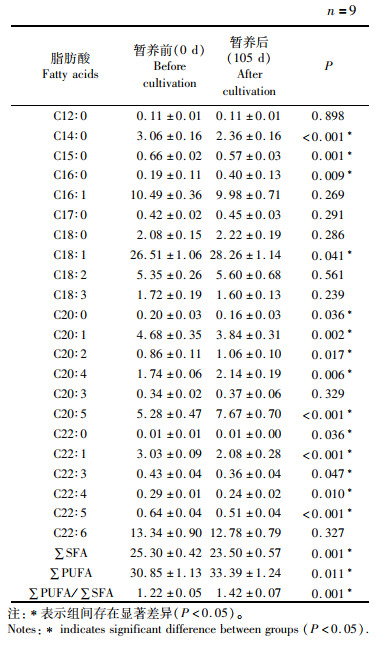
|
表 3 暂养后中华绒螯蟹可食组织脂肪酸组成变化(g/100 g湿重) Tab.3 Change of fatty acid composition in edible tissuesof Eriocheir sinensis after overwintering cultivation(g/100g wet weight) |
卵巢中共检测出23种脂肪酸,饱和脂肪酸8种,多不饱和脂肪酸10种,单不饱和脂肪酸5种。相比暂养前,暂养后C22∶1和C22∶4含量显著下降(P < 0.05, 表 4),其他均无明显变化(P>0.05, 表 4)。结果表明,中华绒螯蟹暂养后营养成分会有一定的流失。

|
表 4 暂养后中华绒螯蟹卵巢中脂肪酸组成变化(g/100 g湿重) Tab.4 Change of fatty acid composition in ovary of Eriocheir sinensis after overwintering cultivation(g/100g wet weight) |
由图 4可知,与暂养前中华绒螯蟹可食组织呈味核苷酸含量相比,暂养后次黄嘌呤(Hx)和肌苷(HxR)显著下降(P < 0.05)。腺苷酸(AMP)和肌苷酸(IMP)显著增加(P < 0.05),肌苷酸(IMP)占最高比例。结果表明,暂养105 d后中华绒螯蟹可食组织风味有所提升。

|
*表示差异显著(P < 0.05)。 * indicates significant difference (P < 0.05). 图 4 暂养前后中华绒螯蟹可食组织呈味核苷酸含量比较(%湿重) Fig. 4 Comparison of flavor nucleotide content of edible tissues in Eriocheir sinensis before and after overwintering cultivation (% wet weight) |
采用暂养前后中华绒螯蟹样品,检测频率均达3次的挥发性化合物进行比较分析。从表 5可知:暂养前检测到6类共16种挥发性物质,其中,烃类3种,醛类1种,醇类3种,酮类5种,芳香类3种,呋喃类1种;暂养后检测到7类共31种挥发性物质,其中,烃类8种,醛类4种,醇类5种,酮类7种,芳香类2种,呋喃类3种,酸类2种;而两者都检测到的挥发性物质有13种,其中,烃类3种,醛类1种,醇类3种,酮类3种,芳香类2种,呋喃类1种。

|
表 5 暂养前后中华绒螯蟹可食组织主要挥发性风味物质成分含量比较(%总挥发性物质) Tab.5 Comparison of main volatile flavor components of edible tissues in Eriocheir sinensis before and after overwintering cultivation(%total volatile flavor) |
暂养后检测到新增4种酮类物质,分别是6-甲基-5-庚烯-2-酮、3, 5-辛二烯-2-酮、2-十一酮和beta-紫罗酮,但2-壬酮和2-辛酮在暂养后均未检出。中华绒螯蟹暂养后检出的烃类物质共8种,其中辛烷和壬烷的相对含量较高,但在暂养前均未检出,而暂养后顺式-3-丁基-4-乙烯基环戊烯含量明显下降。整体而言,醇类化合物在暂养后含量升高,增加的醇类化合物主要是正戊醇和1, 5-辛二烯-3-醇。醛类化合物中壬醛在中华绒螯蟹暂养前后均被检出,2-辛烯醛和十一醛在暂养后被检出,己醛在暂养后相对含量较高。芳香类化合物种类在暂养后减少,甲苯含量明显下降,暂养后的主要芳香类物质是对二甲苯。呋喃类化合物相对含量在暂养后有所提高,2-乙基呋喃和2-戊基呋喃为暂养后的主要风味物质,其中2-戊基呋喃仅在暂养后被检出。暂养前未检测到酸类物质,而暂养后检测到正戊酸和己酸。
3 讨论 3.1 暂养前后中华绒螯蟹一般生物学指数及基本营养成分的变化本研究中暂养前后中华绒螯蟹的TEY没有显著改变,表明越冬暂养后未出现明显的“掉膏”现象。长江流域雌性中华绒螯蟹通常在每年11月份左右进入性腺发育阶段,停滞生长[22],这解释了本研究中中华绒螯蟹暂养期间生长参数的稳定表现;与研究[21-22]结果一致。本研究中暂养后中华绒螯蟹HSI显著降低,GSI显著升高,据此推测暂养过程中中华绒螯蟹体内脂质等营养物质发生了从肝胰腺向卵巢的转移,以满足此阶段性腺发育的需求[19-21]。在营养物质的转移过程中难免发生营养的流失,这就解释了暂养后中华绒螯蟹的卵巢和可食组织混样中粗脂肪含量的下降。综上,越冬暂养后的中华绒螯蟹虽然未出现明显的“掉膏”现象,但是暂养后中华绒螯蟹可食部位有一定的营养流失。
3.2 暂养前后中华绒螯蟹肌肉游离氨基酸含量的变化研究[23]表明中华绒螯蟹的肌肉富含优质蛋白质,游离氨基酸含量较高,而游离氨基酸组成及含量决定了肌肉的滋味品质,其中Asp、Glu和Tyr是主要的鲜味氨基酸,Gly、Ser、Pro、Met和Ala是主要的甘味氨基酸[11, 24]。本研究结果:中华绒螯蟹越冬暂养105 d后,肌肉中鲜味氨基酸Tyr含量显著升高,而Asp和Glu含量无显著变化;甘味氨基酸Met含量显著升高,但Gly和Ala含量显著下降;结果表明暂养后中华绒螯蟹肌肉鲜味有所提升、甜味可能下降。
蛋白质是人类的基本营养元素之一,必需氨基酸的构成是评价蛋白质营养品质重要指标[23]。研究[18]发现中华绒螯蟹越冬暂养前后肌肉中各种水解氨基酸的组成均没有显著差异,表明中华绒螯蟹肌肉氨基酸营养价值在越冬暂养前后无明显差异。本研究中暂养后中华绒螯蟹肌肉中非必需氨基酸与游离氨基酸总含量比值(N/T)明显下降,而必需氨基酸与游离氨基酸总含量比值(E/T)显著增加,表明越冬暂养后中华绒螯蟹肌肉的品质有所改善。此外,研究发现Arg、Gly、Ala和Pro是中华绒螯蟹肌肉中含量最高的4种游离氨基酸,对中华绒螯蟹肌肉的品质有重要的贡献,与研究[25-26]结果一致。
3.3 暂养前后中华绒螯蟹可食组织脂肪酸含量的变化脂肪酸是肉类加热后呈现香味的重要成分[27-28],其含量组成与肉类的风味品质密切相关。PUFA/SFA通常用于评估肉类的营养品质,比值高表示肉类营养品质优[28-29]。相关研究[30]表明鱼类随水流运动会消耗大量的饱和脂肪酸以补充额外的能量需求。本研究中中华绒螯蟹可食组织C14∶0和C15∶0等饱和脂肪酸含量显著下降,可能与该暂养系统中的水流刺激有关。蟹类等水产动物易受水质、水流等外界环境因子的影响,俗话说“好水出好蟹”,优良的养殖水环境能保证蟹类正常的生理状态,合理的能量消耗和均衡的营养构成[31]。暂养105 d后,可食组织及卵巢中C22∶1和C22∶4含量显著下降;C20∶2、C20∶4和C20∶5等多不饱和脂肪酸含量显著升高,同时PUFA/SFA显著上升,结果表明,甲壳动物体内脂肪酸的代谢利用和积累是高度复杂的,后续需要更多的研究来了解它们的机制和调控途径。研究[32-33]表明含有较高花生四烯酸(C20∶4)的肉类味道更好,同时花生四烯酸也是一种人体必需脂肪酸;饮食中的二十碳五烯酸(C20∶5)对预防心脑血管疾病有着重要意义[34-36]。综上,本研究认为,对中华绒螯蟹进行105天的越冬暂养,其营养虽然存在一定的流失,但中华绒螯蟹的整体营养品质有一定程度的改善,同时中华绒螯蟹的食用和保健价值有所提高。
3.4 暂养前后中华绒螯蟹可食组织呈味核苷酸含量变化呈味核苷酸在水产品的呈味和助味成分上有重要作用[23]。主要的呈味核苷酸是AMP和IMP,其中AMP呈甜味,IMP为鲜味增强剂,同时IMP能与游离氨基酸协同呈现鲜味。暂养后中华绒螯蟹的AMP和IMP的含量显著增加,同时具有异味和苦味的Hx和HxR含量显著下降[37-39]。一方面表明暂养后中华绒螯蟹体内嘌呤核苷酸的代谢以合成代谢为主,分解代谢较暂养前下降,推测这与暂养前后的温度变化有关;另一方面在越冬暂养后其鲜味和甜味得到了提升,同时异味和苦味得以抑制,改善了中华绒螯蟹的风味品质。
3.5 暂养前后中华绒螯蟹可食组织挥发性风味物质的变化挥发性风味物质种类繁多,包括烃类、醇类、醛类、酯类、酮类、芳香类、呋喃类等,其中醇、醛、酮、酸对风味的呈现具有重要的作用,与WANG等[11]和GU等[12]的研究结果一致。本研究发现中华绒螯蟹体内的挥发性化合物主要是烃类、酮类、醇类及醛类造就了中华绒螯蟹独特的风味。
本研究中,中华绒螯蟹暂养后未检测到2-辛酮和2-壬酮,但是新增了4种酮类物质,其中:6-甲基-5-庚烯-2-酮具有具有柠檬草和乙酸异丁酯般的香气[40];3, 5-辛二烯-2-酮主要呈现油脂味[41];2-十一酮接近花香和牛奶香[42];beta-紫罗酮具有果香,气味阈值低,常用于香料的生产[43]。这些物质的出现,表明中华绒螯蟹暂养后风味更佳。ZHANG等[44]在甲壳类动物和鱼类的挥发物中检测到烃类化合物,同样地本研究在中华绒螯蟹挥发性物质中检测到烃类化合物的存在, 但由于烷烃类化合物阈值较高,其含量的微量上升对中华绒螯蟹整体风味贡献不大[45]。
中华绒螯蟹暂养后的主要醇类物质是1-辛烯-3-醇,具有蘑菇味、泥土味、鱼腥味和草香味[46-49],因其阈值相对较低[47, 49],所以对中华绒螯蟹风味形成具有重要的贡献。醛类物质是脂肪酸氧化和氨基酸降解的产物[50],因其气味阈值低而对肉制品香气有很大影响[51]。研究[50]表明己醛、壬醛、辛醛和3-甲基丁醛是大河黑猪火腿的主要风味成分,具有青草味、甜味、果香、坚果味、焦糖味等特殊风味;己醛已被发现存在于众多水产品中,具有青草香味,是评价肉制品风味质量的主要物质[52]。本研究发现己醛、壬醛、2-辛烯醛和十一醛为暂养后的主要风味物质,表明中华绒螯蟹暂养后的风味有所改善。
中华绒螯蟹中检测到的芳香族、呋喃类和酸类物质种类较少。其中甲苯、乙苯、二甲苯和呋喃等芳香族化合物来自不饱和脂肪酸的氧化[53],在本研究中,暂养后甲苯、乙苯含量降低,提示中华绒螯蟹体内不饱和脂肪酸的氧化减少。呋喃类物质在蟹肉风味形成过程中起重要作用,其中具有黄油味的2-戊基呋喃气味阈值较低[51],对中华绒螯蟹的风味具有重要贡献。本研究中暂养前未检测到酸类物质,而暂养后中华绒螯蟹体内的酸类物质可能是蟹肉中脂质物质氧化造成的[54]。本研究发现了中华绒螯蟹体内挥发性风味物质在暂养前后的变化特征,这种变化主要与温度、水质等环境因子和中华绒螯蟹生理状态有关[55]。在优良的暂养条件下,中华绒螯蟹在物质的消耗与合成中寻求平衡,造就了较好的风味品质。
| [1] |
胡海彦. 江苏省河蟹产业化发展研究[D]. 南京: 南京农业大学, 2007. HU H Y. Study on crab industrial development in Jiangsu Province[D]. Nanjing: Nanjing Agriculture University, 2007. |
| [2] |
WANG J, XU P, ZHOU G, et al. Genetic improvement and breeding practices for Chinese mitten crab, Eriocheir sinensis[J]. Journal of the World Aquaculture Society, 2018, 49(2): 292-301. DOI:10.1111/jwas.12500 |
| [3] |
ZHANG Z X, CAPINHA C, WETERINGS R, et al. Ensemble forecasting of the global potential distribution of the invasive Chinese mitten crab, Eriocheir sinensis[J]. Hydrobiologia, 2019, 826(1): 367-377. DOI:10.1007/s10750-018-3749-y |
| [4] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2019中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2019: 5. Bureau of Fisheries Fishery Management, Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fisheries statistical yearbook in 2019[M]. Beijing: China Agriculture Press, 2019: 5. |
| [5] |
王帅, 吴旭干, 陶宁萍, 等. 中华绒螯蟹六月黄营养及风味品质研究[J]. 中国食品学报, 2017, 17(4): 219-227. WANG S, WU X G, TAO N P, et al. Nutritional and flavor quality analysis of Liu Yuehuang (Eriocheir sinesis)[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(4): 219-227. |
| [6] |
CUI Z, HUI M, LIU Y, et al. High-density linkage mapping aided by transcriptomics documents ZW sex determination system in the Chinese mitten crab Eriocheir sinensis[J]. Heredity, 2015, 115(3): 206-215. DOI:10.1038/hdy.2015.26 |
| [7] |
QIU G F, XIONG L W, HAN Z K, et al. A second generation SNP and SSR integrated linkage map and QTL mapping for the Chinese mitten crab Eriocheir sinensis[J]. Scientific Reports, 2017, 7: 39826. DOI:10.1038/srep39826 |
| [8] |
JIN X K, LI W W, XU M J, et al. Transcriptome-wide analysis of immune responses in Eriocheir sinensis hemocytes after challenge with different microbial derivatives[J]. Developmental & Comparative Immunology, 2019, 101: 103457. |
| [9] |
CHEN X W, WANG J, YUE W C, et al. Hepatopancreas transcriptome analysis of Chinese mitten crab (Eriocheir sinensis) with white hepatopancreas syndrome[J]. Fish & Shellfish Immunology, 2017, 70: 302-307. |
| [10] |
XU C, WANG X D, HAN F L, et al. α-lipoic acid regulate growth, antioxidant status and lipid metabolism of Chinese mitten crab Eriocheir sinensis: optimum supplement level and metabonomics response[J]. Aquaculture, 2019, 506: 94-103. DOI:10.1016/j.aquaculture.2019.03.029 |
| [11] |
WANG S, HE Y, WANG Y Y, et al. Comparison of flavour qualities of three sourced Eriocheir sinensis[J]. Food Chemistry, 2016, 200: 24-31. DOI:10.1016/j.foodchem.2015.12.093 |
| [12] |
GU S Q, WANG X C, TAO N P, et al. Characterization of volatile compounds in different edible parts of steamed Chinese mitten crab (Eriocheir sinensis)[J]. Food Research International, 2013, 54(1): 81-92. DOI:10.1016/j.foodres.2013.05.018 |
| [13] |
HERBORG L M, RUSHTON S P, CLARE A S, et al. Spread of the Chinese mitten crab (Eriocheir sinensis H. Milne Edwards) in Continental Europe: analysis of a historical data set[M]//JONES M B, INGóLFSSON A, ÓLAFSSON E, et al. Migrations and Dispersal of Marine Organisms. Developments in Hydrobiology. Dordrecht: Springer, 2003: 21-28.
|
| [14] |
HERBORG L M, WEETMAN D, VAN OOSTERHOUT C, et al. Genetic population structure and contemporary dispersal patterns of a recent European invader, the Chinese mitten crab, Eriocheir sinensis[J]. Molecular Ecology, 2007, 16(2): 231-242. |
| [15] |
ZHANG Z X, YOKOTA M, STRÜSSMANN C A. Potential competitive impacts of the invasive Chinese mitten crab Eriocheir sinensis on native Japanese mitten crab Eriocheir japonica[J]. Hydrobiologia, 2019, 826(1): 411-420. DOI:10.1007/s10750-018-3759-9 |
| [16] |
万全, 古界明. 河蟹控温暂养保质新技术研究[J]. 现代农业科技, 2008(24): 231-232. WAN Q, GU J M. Research on new technology of temperature control and quality control of river crab[J]. Modern Agricultural Science and Technology, 2008(24): 231-232. DOI:10.3969/j.issn.1007-5739.2008.24.160 |
| [17] |
WANG Q D, LIU J S, ZHANG S Y, et al. Sustainable farming practices of the Chinese mitten crab (Eriocheir sinensis) around Hongze Lake, lower Yangtze River Basin, China[J]. Ambio, 2016, 45(3): 361-373. DOI:10.1007/s13280-015-0722-0 |
| [18] |
DAI F, SONG L L, GAO J C, et al. Effect of stocking density on mortality rate, physiological status and nutrient contents of Chinese mitten crab Eriocheir sinensis during overwintering cultivation[J]. Aquaculture Reports, 2020, 16: 100241. DOI:10.1016/j.aqrep.2019.100241 |
| [19] |
WU X G, ZHAO L, LONG X W, et al. Effects of dietary supplementation of Haematococcus pluvialis powder on gonadal development, coloration and antioxidant capacity of adult male Chinese mitten crab (Eriocheir sinensis)[J]. Aquaculture Research, 2017, 48(10): 5214-5223. DOI:10.1111/are.13333 |
| [20] |
MA N, LONG X W, LIU J G, et al. Defatted Haematococcus pluvialis meal can enhance the coloration of adult Chinese mitten crab Eriocheir sinensis[J]. Aquaculture, 2019, 510: 371-379. DOI:10.1016/j.aquaculture.2019.05.063 |
| [21] |
于智勇, 吴旭干, 常国亮, 等. 中华绒螯蟹第二次卵巢发育期间卵巢和肝胰腺中主要生化成分的变化[J]. 水生生物学报, 2007, 31(6): 799-806. YU Z Y, WU X G, CHANG G L, et al. Changes in the main biochemical composition in ovaries and hepatopancreas of Chinese mitten crab, Eriocheir sinensis (H. Milne-Edwards) during the second ovarian development[J]. Acta Hydrobiologica Sinica, 2007, 31(6): 799-806. DOI:10.3321/j.issn:1000-3207.2007.06.005 |
| [22] |
李思发, 王成辉, 赵乃刚. 湖泊放养长江水系中华绒螯蟹的性成熟规律研究[J]. 水生生物学报, 2001, 25(4): 350-357. LI S F, WANG C H, ZHAO N G. Studies on gonad developmental rule of lake stocked mitten crab of Yangtze population[J]. Acta Hydrobiologica Sinica, 2001, 25(4): 350-357. DOI:10.3321/j.issn:1000-3207.2001.04.008 |
| [23] |
CHEN D W, ZHANG M, SHRESTHA S. Compositional characteristics and nutritional quality of Chinese mitten crab (Eriocheir sinensis)[J]. Food Chemistry, 2007, 103(4): 1343-1349. DOI:10.1016/j.foodchem.2006.10.047 |
| [24] |
ZHAO C J, SCHIEBER A, GÄNZLEA M G. Formation of taste-active amino acids, amino acid derivatives and peptides in food fermentations-a review[J]. Food Research International, 2016, 89: 39-47. DOI:10.1016/j.foodres.2016.08.042 |
| [25] |
CHEN D W, ZHANG M. Non-volatile taste active compounds in the meat of Chinese mitten crab (Eriocheir sinensis)[J]. Food Chemistry, 2007, 104(3): 1200-1205. DOI:10.1016/j.foodchem.2007.01.042 |
| [26] |
WANG Y R, LI E C, YU N, et al. Characterization and expression of glutamate dehydrogenase in response to acute salinity stress in the Chinese mitten crab, Eriocheir sinensis[J]. PLoS One, 2012, 7(5): e37316. DOI:10.1371/journal.pone.0037316 |
| [27] |
MOTTRAM D S. Flavour formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424. DOI:10.1016/S0308-8146(98)00076-4 |
| [28] |
WOOD J D, RICHARDSON R I, NUTE G R, et al. Effects of fatty acids on meat quality: a review[J]. Meat Science, 2004, 66(1): 21-32. DOI:10.1016/S0309-1740(03)00022-6 |
| [29] |
SCOLLAN N, HOCQUETTE J F, NUERNBERG K, et al. Innovations in beef production systems that enhance the nutritional and health value of beef lipids and their relationship with meat quality[J]. Meat Science, 2006, 74(1): 17-33. DOI:10.1016/j.meatsci.2006.05.002 |
| [30] |
MERINO G E, PIEDRAHITA R H, CONKLIN D E. Effect of water velocity on the growth of California halibut (Paralichthys californicus) juveniles[J]. Aquaculture, 2007, 271(1/4): 206-215. |
| [31] |
邹剑敏, 宋超, 张聪, 等. 主要淡水水产品在养殖模式转换过程中营养品质的形成机制研究进展[J]. 中国农学通报, 2019, 35(18): 142-147. ZOU J M, SONG C, ZHANG C, et al. Formation mechanism of nutritional quality in aquaculture mode conversion for main freshwater aquatic products: research progress[J]. Chinese Agricultural Science Bulletin, 2019, 35(18): 142-147. DOI:10.11924/j.issn.1000-6850.casb18080063 |
| [32] |
YUAN Y H, LI S L, MAI K S, et al. The effect of dietary arachidonic acid (ARA) on growth performance, fatty acid composition and expression of ARA metabolism-related genes in larval half-smooth tongue sole (Cynoglossus semilaevis)[J]. British Journal of Nutrition, 2015, 113(10): 1518-1530. DOI:10.1017/S0007114515000781 |
| [33] |
KIYOHARA R, YAMAGUCHI S, RIKIMARU K, et al. Supplemental arachidonic acid-enriched oil improves the taste of thigh meat of Hinai-jidori chickens[J]. Poultry Science, 2011, 90(8): 1817-1822. DOI:10.3382/ps.2010-01323 |
| [34] |
KRIS-ETHERTON P M, GRIEGER J A, ETHERTON T D. Dietary reference intakes for DHA and EPA[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2009, 81(2/3): 99-104. |
| [35] |
SWANSON D, BLOCK R, MOUSA S A. Omega-3 fatty acids EPA and DHA: health benefits throughout life[J]. Advances in Nutrition, 2012, 3(1): 1-7. DOI:10.3945/an.111.000893 |
| [36] |
STARK K D, VAN ELSWYK M E, HIGGINS M R, et al. Global survey of the omega-3 fatty acids, docosahexaenoic acid and eicosapentaenoic acid in the blood stream of healthy adults[J]. Progress in Lipid Research, 2016, 63: 132-152. DOI:10.1016/j.plipres.2016.05.001 |
| [37] |
KUCHIBA-MANABE M, MATOBA T, HASEGAWA K. Sensory changes in umami taste of inosine 5'-monophosphate solution after heating[J]. Journal of Food Science, 1991, 56(5): 1429-1432. DOI:10.1111/j.1365-2621.1991.tb04790.x |
| [38] |
YU D W, XU Y S, REGENSTEIN J M, et al. The effects of edible chitosan-based coatings on flavor quality of raw grass carp (Ctenopharyngodon idellus) fillets during refrigerated storage[J]. Food Chemistry, 2018, 242: 412-420. DOI:10.1016/j.foodchem.2017.09.037 |
| [39] |
MAGA J A, YAMAGUCHI S. Flavor potentiators[J]. Critical Reviews in Food Science and Nutrition, 1983, 18(3): 231-312. DOI:10.1080/10408398309527364 |
| [40] |
张晶晶, 王锡昌, 施文正. 白姑鱼和小黄鱼肉中挥发性风味物质的鉴定[J]. 食品科学, 2019, 40(14): 206-213. ZHANG J J, WANG X C, SHI W Z. Identification of volatile compounds in white croaker and small yellow croaker[J]. Food Science, 2019, 40(14): 206-213. DOI:10.7506/spkx1002-6630-20180901-001 |
| [41] |
赵凤, 许萍, 曾诗雨, 等. 鲟鱼传统发酵过程中挥发性风味物质的分析评价[J]. 食品科学, 2019, 40(10): 236-242. ZHAO F, XU P, ZENG S Y, et al. Analysis of volatile compounds in fermented sturgeon[J]. Food Science, 2019, 40(10): 236-242. DOI:10.7506/spkx1002-6630-20180514-199 |
| [42] |
DADALI C, ELMACI Y. Characterization of volatile release and sensory properties of model margarines by changing fat and emulsifier content[J]. European Journal of Lipid Science and Technology, 2019, 121(6): 1900003. DOI:10.1002/ejlt.201900003 |
| [43] |
MAHATTANATAWEE K, ROUSEFF R, VALIM M F, et al. Identification and aroma impact of norisoprenoids in orange juice[J]. Journal of Agricultural and Food Chemistry, 2005, 53(2): 393-397. DOI:10.1021/jf049012k |
| [44] |
ZHANG J H, CAO J, PEI Z S, et al. Volatile flavour components and the mechanisms underlying their production in golden pompano (Trachinotus blochii) fillets subjected to different drying methods: a comparative study using an electronic nose, an electronic tongue and SDE-GC-MS[J]. Food Research International, 2019, 123: 217-225. DOI:10.1016/j.foodres.2019.04.069 |
| [45] |
WETTASINGHE M, VASANTHAN T, TEMELLI F, et al. Volatile flavour composition of cooked by-product blends of chicken, beef and pork: a quantitative GC-MS investigation[J]. Food Research International, 2001, 34(2/3): 149-158. |
| [46] |
BRYANT R J, MCCLUNG A M. Volatile profiles of aromatic and non-aromatic rice cultivars using SPME/GC-MS[J]. Food Chemistry, 2011, 124(2): 501-513. DOI:10.1016/j.foodchem.2010.06.061 |
| [47] |
PHAM A J, SCHILLING M W, MIKEL W B, et al. Relationships between sensory descriptors, consumer acceptability and volatile flavor compounds of American dry-cured ham[J]. Meat Science, 2008, 80(3): 728-737. DOI:10.1016/j.meatsci.2008.03.015 |
| [48] |
GARCÍA-GONZÁLEZ D L, TENA N, APARICIO-RUIZ R, et al. Relationship between sensory attributes and volatile compounds qualifying dry-cured hams[J]. Meat Science, 2008, 80(2): 315-325. DOI:10.1016/j.meatsci.2007.12.015 |
| [49] |
FRANK D, POOLE S, KIRCHHOFF S, et al. Investigation of sensory and volatile characteristics of farmed and wild barramundi (Lates calcarifer) using gas chromatography-olfactometry mass spectrometry and descriptive sensory analysis[J]. Journal of Agricultural and Food Chemistry, 2009, 57(21): 10302-10312. DOI:10.1021/jf902030y |
| [50] |
SHI Y N, LI X, HUANG A X. A metabolomics-based approach investigates volatile flavor formation and characteristic compounds of the Dahe black pig dry-cured ham[J]. Meat Science, 2019, 158: 107904. DOI:10.1016/j.meatsci.2019.107904 |
| [51] |
MURIEL E, ANTEQUERA T, PETRÓN M J, et al. Volatile compounds in Iberian dry-cured loin[J]. Meat Science, 2004, 68(3): 391-400. DOI:10.1016/j.meatsci.2004.04.006 |
| [52] |
FRANKEL E N, NEFF W E, SELKE E. Analysis of autoxidized fats by gas chromatography-mass spectrometry: Ⅶ. Volatile thermal decomposition products of pure hydroperoxides from autoxidized and photosensitized oxidized methyl oleate, Linoleate and Linolenate[J]. Lipids, 1981, 16(5): 279-285. DOI:10.1007/BF02534950 |
| [53] |
OOMAH B D, LIANG L S Y, BALASUBRAMANIAN P. Volatile compounds of dry beans (Phaseolus vulgaris L.)[J]. Plant Foods for Human Nutrition, 2007, 62(4): 177-183. DOI:10.1007/s11130-007-0059-3 |
| [54] |
贺林娟. 发酵鳓鱼的制作工艺及挥发性风味成分的研究[D]. 宁波: 宁波大学, 2013. HE L J. Effect of different ages on tenderness of cherry valley ducks breast during postmortem aging[D]. Ningbo: Ningbo University, 2013. |
| [55] |
王丹青. 低盐度海水暂养对中华绒螯蟹品质的影响[D]. 上海: 上海海洋大学, 2018. WANG D Q. Effect of low salinity seawater temporary cultivation on quality changes of Chinese mitten crab[D]. Shanghai: Shanghai Ocean University, 2018. |
2. Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, Jiangsu, China;
3. Wuxi Fishery College, Nanjing Agricultural University, Wuxi 214081, Jiangsu, China;
4. Pipadun Village, Zouqu Town, Changzhou 213147, Jiangsu, China
 2021,
Vol. 30
2021,
Vol. 30


