2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
凡纳滨对虾(Litopenaeus vannamei)是一种重要的水产养殖动物[1]。优质的苗种是对虾养殖业持续发展的重要基础[2],但是在实际育苗生产中,由于育苗投放密度大,前期换水少,水质极易恶化,因此幼体容易感染病原菌,使得育苗成活率偏低[3]。苗种的优劣除了与对虾亲本质量相关外,与水质环境以及水体微生物菌群也有密切关系。此外,饵料的组成也直接影响了苗种的体质[4]。生物絮团技术(biofloc technology,BFT)由于具备净化水质,为对虾提供额外营养物质,提高对虾的非特异性免疫力等特点,在凡纳滨对虾成虾养殖中有广泛的应用[5]。MARCO等[6-7]尝试了从糠虾幼体(M1)阶段开始运用BFT进行育苗,并取得了良好效果。而从无节幼体(N)开始全过程运用BFT进行育苗的报道还比较少。
生物絮团系统从理论上可分为两种,一种是常用于室内养殖以菌类为主的系统,另一种是常用于室外养殖或透光环境的基于藻菌共处的系统[8]。研究表明,藻菌共处型生物絮团系统可以有效去除水体中的含氮含磷污染物质,同时为细菌提供适宜的生长环境[9]。水体中的无机氮可以被微藻固定,从而提高饲料的蛋白利用率[10]。
自然界中光照强度是不断变化的,育苗环境光强一般为2 500~12 000 lx[11]。凡纳滨对虾虾苗具有明显趋光性[12]。游奎等[13]的实验发现:高功率(200 W)白炽灯光照能提高凡纳滨对虾摄食率。胡贤德等[14]的研究也发现激光辐射可以增强凡纳滨对虾幼体对环境的抗逆变能力。同时,欧黄思等[11]的研究发现不同幼体阶段对光照强度适应性不一致,认为在幼体发育至糠虾阶段前,光照强度应控制在5 500 lx以内。
当前,光照强度对于凡纳滨对虾育苗效果影响的研究主要在低固体悬浮物水体中进行[11-14]。本实验旨在探究藻菌共处型生物絮团系统中,光照强度对于水质与虾苗生长性能的影响,以期为藻菌共生型系统在凡纳滨对虾育苗中的应用提供参考。
1 材料与方法 1.1 养殖设施实验在海南卜蜂水产(东方)有限公司进行,采用9个锥形玻璃纤维养殖桶,规格为上口直径100 cm,下口直径80 cm,全高97 cm,支撑腿高36 cm,桶容积500 L,实验工作容积200 L。所有养殖桶均置于室内,养殖桶上方用3层黑色遮阳网进行覆盖。实验组每个桶上方设置1个或2个LED灯(型号:HL-LED,功率:100 W,色温:6 000 K),安装位置距离水面60 cm。在桶周围设置3个曝气石(直径4 cm,高4.5 cm的石英砂聚合气石),通过软管连接在空气泵上(型号:HG-750,浙江森森集团有限公司),每个桶设置1根加热棒(型号AH-200,额定功率:200 W)以保证水体温度。
1.2 实验幼体及饵料凡纳滨对虾无节幼体、饵料微藻:假海莲藻(Thalassiosila pseudonana)及卤虫均由卜蜂水产(东方)有限公司提供。饵料藻采用血球计数板计量浓度进行投喂。卤虫卵营养成分为:粗蛋白质≥45%,粗脂肪≥14%,碳水化合物≥10%,灰分≤10%。后期使用饲料为饶平县永得利饲料虾片,其主要成分为:粗蛋白质≥45%,粗脂肪≥6%,钙≤5%,总磷≥1.2%,赖氨酸≥1.4%,水份≤8%,灰分≤16%,粗纤维≤3%。实验用水是经过超滤消毒后的海水,主要参数为:盐度30.5,pH 8.4,总碱度140 mg/L,温度31.0 ℃,溶解氧5 mg/L。
1.3 实验设计及养殖管理实验9个桶随机分为3组,分别为L200组(设光照200 W)、L100组(设光照100 W)和L0组(不设光照)。光照时间模拟自然光照,用时控开关控制为12L:12D。LED灯开启时,测得水面光照强度分别为L200组:(8 422±195)lx,L100组:(4 400±204)lx,L0组:(3±1)lx。
实验幼体为凡纳滨对虾无节Ⅴ期幼体(N5),每桶投入幼体40 000尾(密度为:200尾/L),同时投入饵料藻使水体藻浓度达到5×104 cfu/mL[6]。之后每天投喂8次(06:00,09:00,12:00,15:00,18:00,21:00,24:00,03:00),每次投喂量及饵料种类如表 1所示。卤虫和虾片采取间隔投喂以保证虾苗充分摄食,实验共养殖14 d。

|
表 1 投喂策略 Tab.1 Feeding method |
实验第2天向所有桶接入驯化成熟的浓缩絮团液20 L,接种絮团(总固体悬浮物2 275 mg/L,pH 8.35,盐度31,总碱度165 mg/L)后水体各项指标如下:总氨氮为0 mg/L,亚硝氮为0 mg/L,硝氮为(5.90±0.39)mg/L,总氮为(7.26±0.13)mg/L,总固体悬浮物为(235.01±33.03)mg/L,DO为(7.50±0.06)mg/L,温度为(31.17±0.35)℃,pH为8.29±0.06,盐度为30.30±0.46。同时向各桶加入小苏打(NaHCO3,上海永华集团)10 g补充水体总碱度。整个养殖期间不换水,不向外移出固体悬浮物,不额外添加碳源,只用淡水补充蒸发的水分以维持水体盐度。
1.4 水质指标测定方法每天早上7:00使用WTW便携式多参数水质分析仪(Multi 3430,德国)测定pH、溶氧DO、水温T,然后取水样,经过0.45 μm混合纤维素针头滤器过滤后待检测。总氨氮(TAN),亚硝氮(NO2--N)每天测定1次;硝氮(NO3--N)、总氮(TN)、叶绿素a(Chl.a)、总碱度(ALK)、总固体悬浮物(TSS)每3天测定1次[15-16]。
1.5 生长性能测定方法与盐度胁迫实验养殖14 d后,第15天早上取仔虾测定各项指标。将所有仔虾捞出放入5 L量杯中,加曝气混合均匀,取出100 mL水体计数虾苗数量,每桶重复3次后计平均数,计算存活率(survival rate,SR)。每桶取20只虾使用游标卡尺测定体长(length,L),以眼柄基部至尾尖的长度视作体长。每桶取200只虾,用纯水洗涤,放入烘箱经过60 ℃烘烤3 h至恒重后称量,计为干质量(dry mass,DM)[7]。
盐度胁迫存活率为衡量早期仔虾质量的重要标准。实验方法:取100只活虾,放入到盐度为1淡水中,30 min后转入到盐度为30的海水中,30 min后统计存活率[7]。水体温度为(30±0.5)℃,pH为8.0~8.5,DO>7 mg/L。
1.6 弧菌总数与总异养菌数测定方法第15天取0.1 g仔虾样本,经过无菌海水冲洗后放入1.5 mL无菌离心管中,添加0.4 mL生理盐水进行研磨。之后取9个养殖桶的水样和仔虾匀浆液,用10倍稀释法进行梯度稀释,选取合适稀释浓度,吸取0.1 mL涂布到TCBS(海博)固定培养基。将涂布好的培养基放入36 ℃培养箱恒温培养24 h后统计菌落数,结果视为水体或幼体体内弧菌总数(total vibrio bacteria,TVB)。吸取0.1 mL水样,涂布到TSA固体培养基上,在30 ℃培养箱恒温培养24 h后统计菌落总数[17],结果视为水体总异养菌数(total heterotrophic bacteria,THA)。
1.7 絮团与仔虾肌肉营养成分分析实验结束后,收集一定量絮团和仔虾样本留存。之后对各絮团进行105 ℃烘干至恒重,采取称重法(GB/T 6435—2006)测定水分;运用凯氏定氮法(GB/T 6432—2006)测定粗蛋白;采用索氏抽提法(GB/T 6438—2007)测定粗脂肪(Lipid)。
实验所涉及数据用Excel软件进行统计,图表绘制通过Origin软件完成。实验数据均表示为平均值±标准差(Mean±SD),采用SPSS 24.0统计软件进行ANOVA单因素方差分析,平均值多重比较方法为最小显著差异法(LSD),P<0.05视为差异显著。
2 结果与分析 2.1 水质的变化如图 1a所示,3个组TAN变化趋势相近。养殖第2天接种絮团后,前4天主要投喂饵料微藻,投喂量不大且微藻本身具有净化水质作用,所以水质变化不明显,之后随着投喂量增高,TAN含量也逐渐升高。第10天后TAN浓度则明显降低。后期由于投喂量增长较快,TAN开始缓慢上升,整个养殖过程,TAN平均浓度组间差异不显著(P>0.05,表 2)。
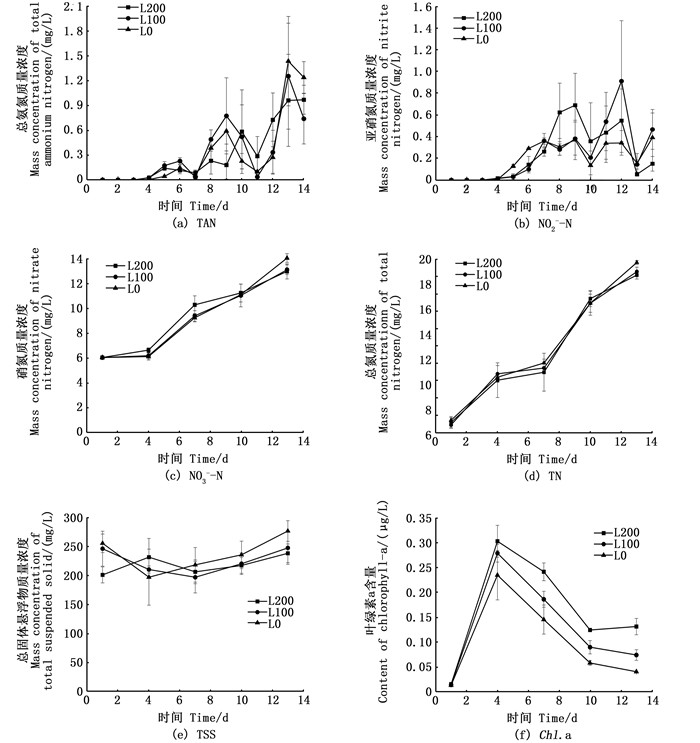
|
图 1 3个处理组中总氨氮、亚硝氮、硝氮、总氮、总固体悬浮物和叶绿素a的动态变化 Fig. 1 Dynamics of TAN, NO2--N, NO3--N, TN, TSS and Chl.a in the different groups |
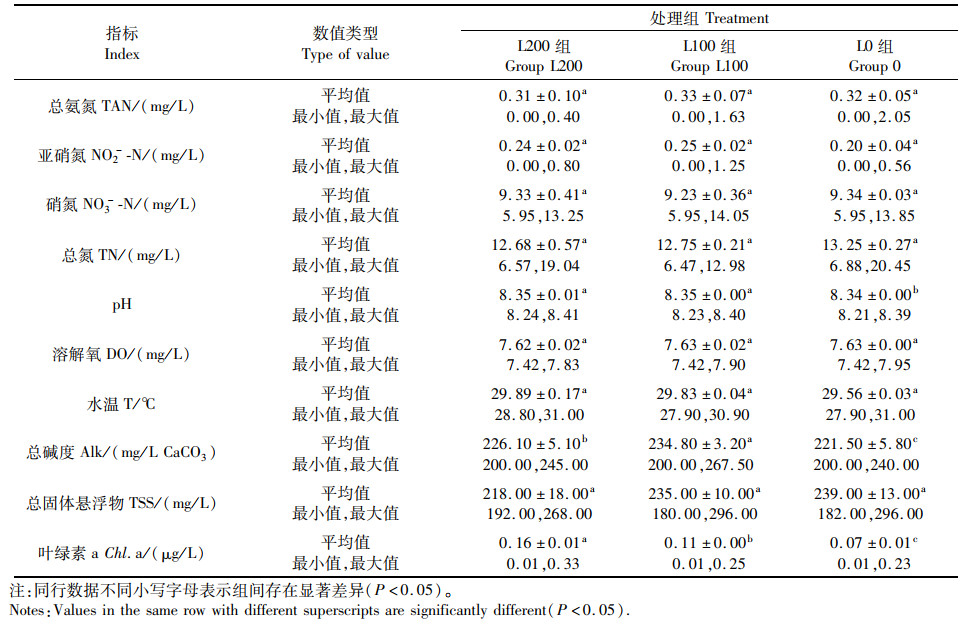
|
表 2 实验期间各处理组中各水质指标的平均值、最小值与最大值 Tab.2 Mean, min. and max. values of the important water quality parameters in each treatment group during the experimental period(n=3, x±SD) |
如图 1b所示,养殖过程中各组NO2--N浓度变化差异较大,第4天开始各组NO2--N上升明显,第8天后处于波动状态,其中L100组峰值最高,12 d后亚硝氮明显下降。养殖过程中3个处理组NO2--N平均浓度组间差异不显著(P>0.05,表 2)。
如图 1c, d所示,接种絮团后,3个处理组NO3--N与TN在养殖期间持续上升,实验结束时,L0组NO3--N与TN浓度最高,但3个处理组平均值差异不显著(P>0.05,表 2)。
如图 1e所示,实验各组TSS变化趋势相近,第2次取样采用200目捞网隔开后,TSS值略微下降,之后均呈缓慢上升,组间差异不显著(P>0.05,表 2)。
各组叶绿素a变化趋势如图 1f所示,养殖前3天由于不断向水体投入饵料微藻,使得3个组水体叶绿素a浓度均明显上升。第4天停止投藻后,3个组叶绿素a浓度开始下降,但由于各组光照强度不同,下降幅度为:L200组<L100组<L0组。整个养殖期间,叶绿素a平均浓度L200组显著大于L100组和L0组(P<0.05),L100组浓度显著大于L0组(P<0.05),光照强度对系统叶绿素a含量有显著影响(表 2)。
3个处理组在pH与碱度变化趋势基本一致,如图 2所示,实验第2天加入10 g小苏打以补充碱度,同时前3天由于投入藻液pH与碱度较高,各组pH与碱度均上升。之后由于幼体和微生物呼吸作用,pH与碱度呈缓慢下降。整个实验期间,pH平均值L200组与L100组显著大于L0组(P<0.05),碱度平均值L100组显著大于L200组与L0组(P<0.05),L200组显著大于L0组(P<0.05)。光照强度对pH与碱度影响显著(表 2)。
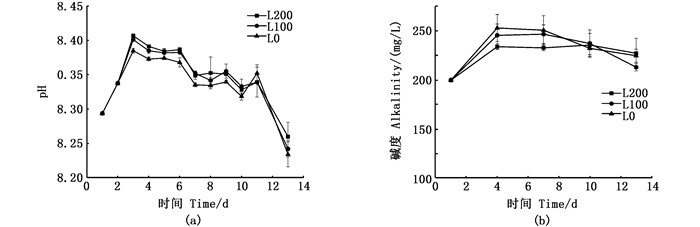
|
图 2 3个处理组中pH与碱度的动态变化 Fig. 2 Dynamics of pH and alkalinity in three different groups |
各处理组的DO和T养殖期间平均值均无显著性差异。
2.2 生长性能如表 3所示,14 d养殖结束后,L200组最终体长显著高于L100组(P<0.05),与L0组差异不显著(P>0.05),L100组体长数值低于L0组,但差异不显著(P>0.05)。最终干质量数值,L200组显著高于L100组与L0组(P<0.05),L100组干质量略低于L0组,但差异不显著(P>0.05)。在存活率上,结果显示L200组>L100组>L0组,但组间差异不显著(P>0.05)。盐度胁迫实验结果显示,存活率为L200组>L0组>L100组,但各组之间差异不显著(P>0.05)。
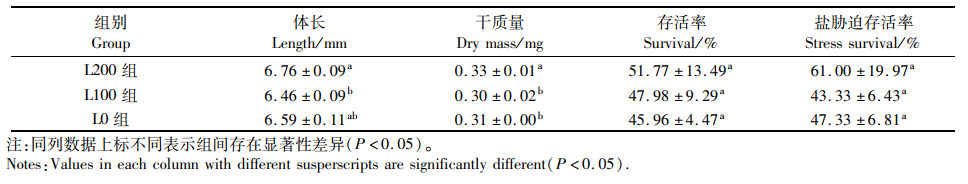
|
表 3 各组仔虾生长性能与存活率 Tab.3 Growth performance and survival of post lavre in each group |
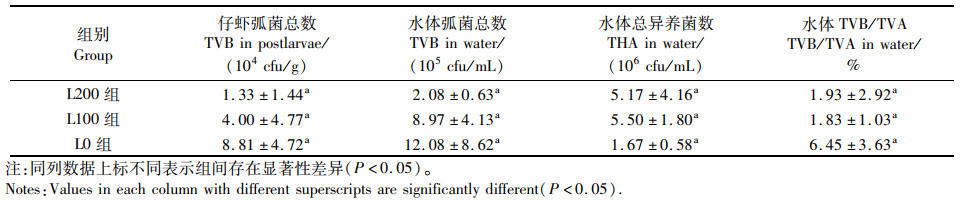
如表 4所示,水体与虾苗体内弧菌总数为L200组<L100组<L0组。这表明,有光照处理时,水体与虾苗体内弧菌数均小于无光照处理组,但组间差异均不显著(P>0.05)。同时,水体中总异养菌数结果显示为L100组>L200组>L0组,但组间差异不显著(P>0.05)。水体中的TVB/TVA数值显示为L100组<L200组<L0组,在有光照的处理组中,弧菌占总异养菌数比例要低于无光照处理的组,但组间差异不显著(P>0.05)。
|
表 4 各组水体与仔虾弧菌总数与异养菌总数 Tab.4 Total Vibrio bacteria and total heterotrophic bacteria in each group |
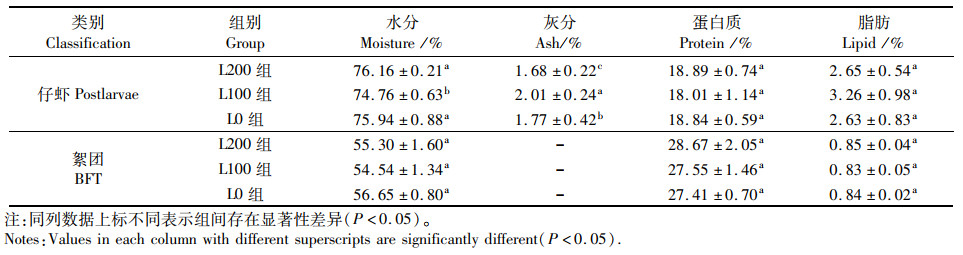
如表 5所示,虾苗肌肉成分中,L100组虾苗水分含量显著低于L200组与L0组(P<0.05),粗灰分含量结果显示L100组>L0组>L200组,差异显著(P<0.05)。粗蛋白含量结果显示,L200组>L0组>L100组,但差异不显著(P>0.05)。同时,L100组虾苗粗脂肪含量显著高于L200组与L0组(P<0.05)。在絮团成分中,水分含量、粗蛋白含量以及粗脂肪含量,组间差异均不显著(P>0.05),说明光照处理对絮团营养组成成分影响不明显。
|
表 5 各组仔虾与絮团的营养成分比例 Tab.5 Nutritional composition ratio of postlarve and BFT in each group |
养殖前期,向各组系统接种了成熟的絮团,在幼体进入Z3时期前投喂了大量饵料藻。初期各组在絮团量、Chl.a含量以及其他水质指标上均无明显差别。研究发现Chl.a受光照影响明显[18],养殖第4天开始,停止投喂饵料藻后,各组Chl.a迅速下降,光照强度越大Chl.a下降幅度越小。随着Chl.a的降低以及投喂量的增大,TAN与NO2--N波动明显。但在整个养殖过程中,TAN平均质量浓度水平均处于安全水平(<0.42 mg/L)[19],NO2--N平均质量浓度也处于安全水平(<6.1 mg/L)[20]。于永霞等[10]发现,在罗非鱼养殖中,藻菌共处生物絮团系统在藻类大量死亡时会显著影响水质。这与本实验结果不同,主要原因可能是育苗周期较短,藻类死亡对水质的影响有限。即光照强度的变化在藻菌共处生物絮团系统中虽会明显影响藻类数量,但系统中的功能性菌群依旧可以控制水体氨氮与亚硝氮浓度。藻菌共处型生物絮团系统在育苗生产中能有效控制水质。
有研究[21]表明,水体中大量的微藻进行光合作用,可以吸收溶解性N元素等营养物质。本实验中,NO3--N和TN均呈不断上升趋势,而在养殖末期,L0组的NO3--N与TN均高于L200组与L100组。这说明微藻能固定水体中的N元素,并且可供幼体摄食,从而提高N元素的利用率。黄翔鹄等[22]发现,在虾苗池中添加角毛藻可以有效降低水体氨氮平均浓度,当角毛藻浓度范围为0.2×105~1.0×105 cells/mL时,氨氮平均质量浓度从3.1 mg/L下降到1.7 mg/L,但显著高于本实验各组氨氮平均质量浓度。这说明,单纯微藻系统只能一定程度控制水体氨氮质量浓度。藻菌生物絮团系统能有效控制水质是微藻与生物絮团共同作用的结果,相对微藻系统更稳定。
水体中的微藻可以利用菌类和幼体产生的CO2进行光合作用,同时水体中的菌类则利用微藻产生的O2降解含C物质[23],当水体细菌占主导时,进入水体的CO2较多,与水分子结合形成HCO3[24],从而对水体的pH和碱度产生影响。本实验中,在停止投喂饵料藻后,各组pH和碱度均明显下降,在养殖末期,L200组pH与碱度均为最高。FLECKENSTEIN等[25]研究表明加强光周期能减缓pH下降速度,这与本实验结果类似。于永霞等[10]研究表明,藻菌共处型生物絮团中微藻处于优势生长时,会对水体产生一定碱度。CHEN等[26]指出在生物絮凝系统需要保持一定的碱度,碱度>200 mg/L时能促进水体的硝化作用。结合本实验结果,即高强度光照条件下,藻菌共处型生物絮团系统能更稳定地维持pH与碱度,这有利于水质的处理与幼体的健康发育。
GAONA等[27]探究了生物絮凝系统中不同TSS质量浓度对凡纳滨对虾生长性能的影响,结果表明较低的TSS质量浓度(100~300 mg/L)对凡纳滨对虾存活率有益。在本实验中观察到,由于系统中饵料藻并未全部被摄食,微藻死亡后会络合絮团形成片状物,在取样测试过程中,为了避免捞到幼体,采用200目捞网隔开的方式取样,这可能会造成误差,造成前期测试TSS质量浓度出现下降。之后随着幼体逐渐发育,取样所用捞网孔径增大,降低了测量误差,TSS整体呈上升趋势。于永霞等[10]研究发现,相对于无光照生物絮团系统,提供光照的藻菌共处型生物絮团系统在养殖过程中TSS质量浓度上升幅度更大。本实验中L0组由于没有光照,系统中的藻类大量死亡,形成较多片状物,末期TSS质量浓度较高,但峰值<300 mg/L。因此在育苗系统中,在初始TSS质量浓度不高的条件下,藻菌系统絮团生成量均不高,不会对幼体产生较大影响。
生物絮团系统可以改变养殖水体中的微生物群落结构,抑制弧菌的生长[28]。本实验3个处理组水体中的TVB与THA值均差异不显著(P>0.05),其中L0组TVB/THA大于L100与L200组。这可能是光照维持了水体中的藻类丰度,促进了系统对弧菌的抑制效果。陈倩伶等[29]研究也发现,投喂牟式角毛藻等饵料藻能促进生物絮团对于弧菌繁殖的抑制。
综上,藻菌共处型生物絮团育苗系统中,养殖过程光照强度对水体TAN和NO2--N等指标平均值影响不明显,不同光强均能有效控制水体N元素。而光照200 W能更稳定控制水体碱度和pH。增大光强能降低水体弧菌占总菌数比例。
3.2 光强对藻菌系统仔虾生长性能与存活率的影响光照强度对于凡纳滨对虾生长性能及存活率的影响已有研究[30]。而在育苗过程中,光照强度对幼体生长性能的影响报道较少。本实验中,L200组在最终体长上高于L100组,最终干质量高于L100与L0组,这表明在藻菌育苗系统中,设立较大光强对仔虾生长性能有促进效果。
L200组最终存活率比L100组高8%,比L0组高13%,但差异不显著(P>0.05)。孙博超等[31]尝试在零换水条件下进行凡纳滨对虾育苗,各组最终平均成活率(50.96%±8.73%)与本实验各组平均成活率(48.57%±2.95%)相近。张哲等[32]研究了添加不同碳源对于凡纳滨对虾育苗的影响,实验最终平均成活率为65.63%±10.02%,高于本实验结果,这可能是投苗密度不同造成的,该实验投苗密度(33尾/L)远小于本实验投苗密度(200尾/L)。俞震颉等[33]研究表明,在水泥池养殖中,有自然光的条件下,凡纳滨对虾养殖成活率得到有效提高,这与本实验结果基本一致。NEAL等[34]研究发现,零交换水系统中,采取低密度有自然光照的条件,能有效增长虾的摄食率,而无论投放密度高低,有自然光的组最终产量都要高于无光照的组。FLECKENSTEIN等[25]在室内养殖系统设立LED灯光照,在84 d的养殖结束后发现,与常规养殖方式相比,有光照系统总产量有显著提高。以上研究均表明,各类系统尤其是生物絮凝系统中,添加光照对于对虾养成有明显促进作用。而在育苗中,欧黄思等[11]研究了不同光照强度对凡纳滨对虾幼体发育时间以及存活率的影响,结果表明在Z3~M1阶段,相比于低强度光照或无光照,12 000 lx的光强显著降低了幼体的成活率,而在M1~PL1阶段相比于其他组,12 000 lx光照强度条件下幼体成活率最高,且在此阶段随着光照强度的升高,幼体发育时间呈缩短趋势。这与本实验结果不完全相同,可能是在藻菌共处型生物絮团系统中,由于固体悬浮物的遮挡以及微生物环境的不同,幼体对光强耐受度更高。
综上,藻菌育苗系统中,在200 W光照条件下,能有效促进幼体发育,对育苗生产有益。
3.3 光强对藻菌系统仔虾质量的影响研究[35-36]表明,在氨氮以及亚硝氮胁迫下,会增加凡纳滨对虾对于副溶血性弧菌的感染性,而生物絮凝技术由于可以稳定控制水质,并且提高凡纳滨对虾的免疫力,从而降低副溶血性弧菌的感染率。同时,孙振等[37]研究发现,在饵料中添加一定的微生物絮团,可以显著提高凡纳滨对虾的非特异性免疫力,从而提高凡纳滨对虾对于各种弧菌的抗感染力。而对于施加光照的藻菌共处型生物絮团系统中,光照强度对凡纳滨对虾免疫力的影响报道较少。在本实验中,随着光照强度加大,仔虾体内弧菌总数呈下降趋势。藻菌共处型生物絮团系统中,光照通过促进微藻生长发育,可降低水体中弧菌占总菌数的比例,进而降低仔虾体内弧菌总数,对育苗生产有益。
同时,通过对絮团的营养成分分析发现,虽然各处理组光强不同,但絮团营养成分差异不大。FLECKENSTEIN等[25]在生物絮凝系统设置了不同的光照周期,分别是24 h全光、12 h光照12 h黑暗以及24 h全黑暗,在3种不同条件下养殖凡纳滨对虾84 d,结果表明光周期24 h全光组的絮团,在粗蛋白以及粗纤维含量上显著高于其他组。而本实验中光强L200组絮团粗蛋白含量也高于其他组,但差异不显著,这可能是育苗周期比较短,造成絮团成分变化不大。在仔虾肌肉营养成分的分析中,除L100组的粗灰分较高,水分较低外,其他均差异不大。
盐度胁迫测试存活率被视为评价仔虾质量的重要标准[38-39]。ÁLVAREZ等[40]研究发现,PL15仔虾盐度胁迫存活率与后期放养存活率呈正相关。本实验3组盐度胁迫存活率平均值不高,这可能是养殖过程没有进行淡化导致的。同时,由于PL5仔虾不完全具备渗透压调节能力,实验发现PL1仔虾与PL20仔虾盐度胁迫存活率没有明显正相关关系[40]。这表明PL5仔虾盐度胁迫存活率只能一定程度反应苗种质量,不能完全预测后期放养效果。本实验中,L200组盐度胁迫成活率比L100组高出40%,比L0组高出29%,但组间差异不显著。这表明较高强度的光照对于PL5仔虾抗应激能力有提升效果,但对于后续养成存活率的影响有待进一步研究。
| [1] |
叶乐, 杨莺莺, 吴开畅, 等. 益生菌在凡纳滨对虾育苗中的应用[J]. 南方水产, 2006, 2(4): 13-18. YE L, YANG Y Y, WU K C, et al. Effect of probiotics on breeding of Litopeuaeus vannamei[J]. South China Fisheries Science, 2006, 2(4): 13-18. DOI:10.3969/j.issn.2095-0780.2006.04.003 |
| [2] |
杨育凯, 林黑着, 杨其彬, 等. 3种虾片在凡纳滨对虾育苗中的效果评价[J]. 四川农业大学学报, 2017, 35(2): 266-272. YANG Y K, LIN H Z, YANG Q B, et al. Effect evaluation of three kinds of shrimp flake in the larval rearing of Litopenaeus vannamei[J]. Journal of Sichuan Agricultural University, 2017, 35(2): 266-272. |
| [3] |
VANDENBERGHE J, VERDONCK L, ROBLES-AROZARENA R, et al. Vibrios associated with Litopenaeus vannamei larvae, postlarvae, broodstock, and hatchery probionts[J]. Applied and Environmental Microbiology, 1999, 65(6): 2592-2597. DOI:10.1128/AEM.65.6.2592-2597.1999 |
| [4] |
薛明, 何瑶瑶, 邱孟德, 等. 高通量测序分析凡纳滨对虾育苗期水体菌群结构特征[J]. 水产学报, 2017, 41(5): 785-794. XUE M, HE Y Y, QIU M D, et al. Characterization of aquatic bacterial community of Litopenaeus vannamei larvae during hatchery period with high-throughput sequencing[J]. Journal of Fisheries of China, 2017, 41(5): 785-794. |
| [5] |
刘文畅, 罗国芝, 谭洪新. 生物絮凝技术在池塘养虾中的应用[J]. 渔业现代化, 2013, 40(3): 14-18. LIU W C, LUO G Z, TAN H X. Application of biofloc technology in shrimp farming ponds[J]. Fishery Modernization, 2013, 40(3): 14-18. DOI:10.3969/j.issn.1007-9580.2013.03.004 |
| [6] |
DE LORENZO M A, CANDIA E W S, SCHLEDER D D, et al. Intensive hatchery performance of pacific white shrimp in the biofloc system under three different fertilization levels[J]. Aquacultural Engineering, 2016, 72/73: 40-44. DOI:10.1016/j.aquaeng.2016.04.001 |
| [7] |
SCHVEITZER R, DE LORENZO M A, DO NASCIMENTO VIEIRA F, et al. Nursery of young Litopenaeus vannamei post-larvae reared in biofloc- and microalgae-based systems[J]. Aquacultural Engineering, 2017, 78: 140-145. DOI:10.1016/j.aquaeng.2017.07.001 |
| [8] |
罗国芝, 朱泽闻, 潘云峰, 等. 生物絮凝技术在水产养殖中的应用[J]. 中国水产, 2010(2): 62-63. LUO G Z, ZHU Z W, PAN Y F, et al. Application of biofloc technology in aquaculture[J]. China Fisheries, 2010(2): 62-63. DOI:10.3969/j.issn.1002-6681.2010.02.029 |
| [9] |
BAI X L, ACHARYA K. Removal of trimethoprim, sulfamethoxazole, and triclosan by the green alga Nannochloris sp[J]. Journal of Hazardous Materials, 2016, 315: 70-75. DOI:10.1016/j.jhazmat.2016.04.067 |
| [10] |
于永霞, 罗国芝, 刘文畅, 等. 罗非鱼藻菌共处型生物絮团养殖系统的初步探究[J]. 淡水渔业, 2019, 49(5): 80-85, 92. YU Y X, LUO G Z, LIU W C, et al. Preliminary study on culturing tilapia (GIFT, Oreochromis niloticus) with algal-bacterial biofloc technology[J]. Freshwater Fisheries, 2019, 49(5): 80-85, 92. |
| [11] |
欧黄思, 梁华芳. 光照对凡纳滨对虾幼体变态发育的影响[J]. 海洋科学, 2017, 41(3): 55-60. OU H S, LIANG H F. Effect of light on the larval metamorphosis of Litopenaeus vannamei[J]. Marine Sciences, 2017, 41(3): 55-60. |
| [12] |
水柏年. 日本对虾虾苗对若干环境因子的适应性研究[J]. 水产学报, 2004, 28(4): 468-472. SHUI B N. Research on the adaptability of young Penaeus japonious to several environmental factors[J]. Journal of Fisheries of China, 2004, 28(4): 468-472. |
| [13] |
游奎, 刘鹰, 杨红生, 等. 不同光源及光照时间对凡纳滨对虾生长的影响[J]. 海洋科学, 2005, 29(5): 1-5. YOU K, LIU Y, YANG H S, et al. Different illumination schemes effect growth of shrimp Litopenaeus vannamei[J]. Marine Sciences, 2005, 29(5): 1-5. DOI:10.3969/j.issn.1000-3096.2005.05.001 |
| [14] |
胡贤德, 王慧, 郭振华, 等. 激光辐照对凡纳滨对虾幼体生长发育的影响[J]. 激光杂志, 2009, 30(3): 69-71. HU X D, WANG H, GUO Z H, et al. Effects of laser irradiation on the larvae of Litopenaeus vannamei[J]. Laser Journal, 2009, 30(3): 69-71. DOI:10.3969/j.issn.0253-2743.2009.03.030 |
| [15] |
国家海洋环境监测中心. 海洋监测规范第4部分:海水分析[M]. 北京: 中国标准出版社, 2004. National Marine Environment Monitoring Center. The specification for marine monitoring part 4:seawater analysis[M]. Beijing: Standards Press of China, 2004. |
| [16] |
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 836. State Environmental Protection Administration of China. Methods of monitoring and analyzing for water and wastewater[M]. 4th ed. Beijing: China Environmental Science Press, 2002: 836. |
| [17] |
黄翔鹄, 李长玲, 郑莲, 等. 固定化微藻对虾池弧菌数量动态的影响[J]. 水生生物学报, 2005, 29(6): 684-688. HUANG X H, LI C L, ZHENG L, et al. Effects of the immobilized microalgae on the quantity dynamics of Vibrio in the shrimp ponds[J]. Acta Hydrobiologica Sinica, 2005, 29(6): 684-688. DOI:10.3321/j.issn:1000-3207.2005.06.014 |
| [18] |
BALOI M, ARANTES R, SCHVEITZER R, et al. Performance of Pacific white shrimp Litopenaeus vannamei raised in biofloc systems with varying levels of light exposure[J]. Aquacultural Engineering, 2013, 52: 39-44. DOI:10.1016/j.aquaeng.2012.07.003 |
| [19] |
DE LOURDES COBO M, SONNENHOLZNER S, WILLE M, et al. Ammonia tolerance of Litopenaeus vannamei (Boone) larvae[J]. Aquaculture Research, 2014, 45(3): 470-475. DOI:10.1111/j.1365-2109.2012.03248.x |
| [20] |
LIN Y C, CHEN J C. Acute toxicity of nitrite on Litopenaeus vannamei (Boone) juveniles at different salinity levels[J]. Aquaculture, 2003, 224(1/4): 193-201. |
| [21] |
UNNITHAN V V, UNC A, SMITH G B. Mini-review:a priori considerations for bacteria-algae interactions in algal biofuel systems receiving municipal wastewaters[J]. Algal Research, 2014, 4: 35-40. DOI:10.1016/j.algal.2013.11.009 |
| [22] |
黄翔鹄, 李活, 李长玲, 等. 牟氏角毛藻对对虾育苗水质及抗逆性的影响[J]. 广东海洋大学学报, 2008, 28(6): 46-50. HUANG X H, LI H, LI C L, et al. Effect of Chaetoceros muelleri on water quality and anti-stress ability of larval prawn[J]. Journal of Guangdong Ocean University, 2008, 28(6): 46-50. DOI:10.3969/j.issn.1673-9159.2008.06.010 |
| [23] |
CHRISTENSON L, SIMS R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts[J]. Biotechnology Advances, 2011, 29(6): 686-702. DOI:10.1016/j.biotechadv.2011.05.015 |
| [24] |
杨威, 孙凌, 袁有才, 等. 碱度水平对铜绿微囊藻和四尾栅藻生长和竞争的影响[J]. 农业环境科学学报, 2007, 26(4): 1264-1268. YANG W, SUN L, YUAN Y C, et al. Effects of alkalinity on growth and competition of Microcystis aeruginosa and Scenedesmus quadricauda[J]. Journal of Agro-Environment Science, 2007, 26(4): 1264-1268. DOI:10.3321/j.issn:1672-2043.2007.04.012 |
| [25] |
FLECKENSTEIN L J, TIERNEY T W, FISK J C, et al. Effects of supplemental LED lighting on water quality and Pacific white shrimp (Litopenaeus vannamei) performance in intensive recirculating systems[J]. Aquaculture, 2019, 504: 219-226. DOI:10.1016/j.aquaculture.2019.01.066 |
| [26] |
CHEN S L, LING J, BLANCHETON J P. Nitrification kinetics of biofilm as affected by water quality factors[J]. Aquacultural Engineering, 2006, 34(3): 179-197. DOI:10.1016/j.aquaeng.2005.09.004 |
| [27] |
GAONA C A P, DE ALMEIDA M S, VIAU V, et al. Effect of different total suspended solids levels on a Litopenaeus vannamei (Boone, 1931) BFT culture system during biofloc formation[J]. Aquaculture Research, 2017, 48(3): 1070-1079. DOI:10.1111/are.12949 |
| [28] |
赵培.生物絮团技术在海水养殖中的研究与应用[D].上海: 上海海洋大学, 2011. ZHAO P. The study and application of bioflocs technology in seawater aquaculture[D]. Shanghai: Shanghai Ocean University, 2011 |
| [29] |
陈倩伶, 赵永贞, 张瑞杰. 不同微藻饵料对生物絮团育苗系统水质和凡纳滨对虾虾苗生长的影响[J]. 水产科技情报, 2018, 45(2): 108-113. CHEN Q L, ZHAO Y Z, ZHANG R J. Effects of different microalgae on the water quality and the growth of Litopenaeus vannamei[J]. Fisheries Science & Technology Information, 2018, 45(2): 108-113. |
| [30] |
NUNES H R, ANDREATTA E R. Effect of light and aeration on the metamorphosis rate from nauplii to protozoea and larval quality of Litopenaeus vannamei[J]. Biotemas, 2010, 23(2): 77-86. |
| [31] |
孙博超, 杨运楷, 王海亮, 等. 零换水条件下益生菌组合在凡纳滨对虾育苗生产中的应用[J]. 上海海洋大学学报, 2019, 28(1): 93-102. SUN B C, YANG Y K, WANG H L, et al. Effects of probiotics combination on breeding of Litopenaeus vannamei under zero-water exchange condition[J]. Journal of Shanghai Ocean University, 2019, 28(1): 93-102. |
| [32] |
张哲, 杨章武, 葛辉, 等. 不同碳源对凡纳滨对虾育苗标粗水体生物絮团的结构、营养成分、细菌群落及其水质的影响[J]. 水产学报, 2019, 43(3): 639-649. ZHANG Z, YANG Z W, GE H, et al. Effects of different carbon sources on the biofloc formation, nutritional ingredients and bacterial community and water quality in Litopenaeus vannamei culture tank[J]. Journal of Fisheries of China, 2019, 43(3): 639-649. |
| [33] |
俞震颉, 张文博, 刘其根. 不同养殖模式及光照对凡纳滨对虾生长和水质的影响[J]. 水产科学, 2016, 35(4): 321-326. YU Z J, ZHANG W B, LIU Q G. Impact of culture pattern and light intensity on growth in Pacific white leg shrimp and on water quality[J]. Fisheries Science, 2016, 35(4): 321-326. |
| [34] |
NEAL R S, COYLE S D, TIDWELL J H, et al. Evaluation of stocking density and light level on the growth and survival of the pacific white shrimp, Litopenaeus vannamei, reared in zero-exchange systems[J]. Journal of the World Aquaculture Society, 2010, 41(4): 533-544. DOI:10.1111/j.1749-7345.2010.00393.x |
| [35] |
邱德全, 周鲜娇, 邱明生. 氨氮胁迫下凡纳滨对虾抗病力和副溶血弧菌噬菌体防病效果研究[J]. 水生生物学报, 2008, 32(4): 455-461. QIU D Q, ZHOU X J, QIU M S. Study on anti-disease ability of Litopenaeus vannamei and the biological control of Vibrio parahaemolyticus bacteriophage under stresses of ammonia nitrogen[J]. Acta Hydrobiologica Sinica, 2008, 32(4): 455-461. |
| [36] |
葛红星.两种主要无机氮胁迫下凡纳滨对虾免疫因子变化及其对副溶血弧菌易感性的研究[D].上海: 上海海洋大学, 2014. GE H X. Effects of two main inorganic nitrogen on the immune response of Litopenaeus vannamei and its susceptibility to Vibrio parahemolyticus[D]. Shanghai: Shanghai Ocean University, 2014. |
| [37] |
孙振, 王秀华, 黄倢. 一种微生物絮团的生化分析及其对凡纳滨对虾免疫力的影响[J]. 水产学报, 2013, 37(3): 473-480. SUN Z, WANG X H, HUANG J. The biochemical analysis of a microbial floc and its effect on the immunity of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2013, 37(3): 473-480. |
| [38] |
SAMOCHA T M, GUAJARDO H, LAWRENCE A L, et al. A simple stress test for Penaeus vannamei postlarvae[J]. Aquaculture, 1998, 165(3/4): 233-242. |
| [39] |
RACOTTA I S, PALACIOS E, HERNÁNDEZ-HERRERA R, et al. Criteria for assessing larval and postlarval quality of Pacific white shrimp (Litopenaeus vannamei, Boone, 1931)[J]. Aquaculture, 2004, 233(1/4): 181-195. |
| [40] |
ÁLVAREZ A L, RACOTTA I S, ARJONA O, et al. Salinity stress test as a predictor of survival during grow out in Pacific white shrimp (Litopenaeus vannamei)[J]. Aquaculture, 2004, 237(1/4): 237-249. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


