抗生素是一类目前在各国各地广泛应用的抗菌药物,由于不合理的使用,抗生素残留已成为水环境永久性污染物,不仅诱导抗性基因的产生,而且影响着水体微生物的生物量和活性,严重威胁着天然水体的水生态系统结构和功能[1]。研究[2-3]表明,抗生素对藻类的生长能力和叶绿素a含量有明显的抑制作用,蓝藻由于其细胞结构与细菌相似,在一定的暴露浓度范围内,比其他藻类对抗生素更敏感。
水体富营养化引起的蓝藻水华越来越普遍,给人类的生活用水和环境旅游业造成巨大危害[4-6]。影响微囊藻暴发性生长的因素有温度、光照、pH、氮磷含量等环境因子[7-8],外源性污染物如内分泌干扰物、壬基酚、重金属等的影响也有报道[9-10]。氟苯尼考是动物专用的氯霉素类抗生素,常被用于家畜、家禽和水产养殖的抗感染治疗[11-12],但不合理的滥用会导致动物的氟苯尼考代谢大量进入环境、土壤和水体中[13],对水生生物的生长和种群结构造成破坏。抗生素对藻类生长和生理活动的影响已有许多研究报道[14-16]。而氟苯尼考对水华蓝藻的影响并未见报道。因此开展不同质量浓度氟苯尼考对铜绿微囊藻的生长和生理活性的影响,对指导抗生素的合理使用有重要意义。
1 材料与方法 1.1 材料铜绿微囊藻(FACHB-524)购自中国科学院水生生物研究所藻种保藏中心。
1.2 方法 1.2.1 铜绿微囊藻的培养藻种在超净工作台转入灭菌的玻璃三角瓶内,放置在智能光照培养箱(PGX-180D型)内培养2~3 d进行活化。在无菌条件取6 mL活化后藻液接种到60 mL BG-11培养基培养。培养温度为(25±1) ℃,光照强度为1 500 lx,光暗周期12 h:12 h,每天定时摇动三角瓶,并以显微计数法统计铜绿微囊藻的生长情况。
1.2.2 不同质量浓度氟苯尼考处理铜绿微囊藻通过药敏试验和预试验可知铜绿微囊藻对氟苯尼考有明显的抗性,预试验中,当氟苯尼考质量浓度达到30 mg/L时铜绿微囊藻全部死亡,25 mg/L时有明显生长抑制。根据预试验结果和环境中氟苯尼考质量浓度(0.1~1.0 mg/L),试验质量浓度梯度设置为0、0.1、1.0、10和25 mg/L。取对数生长期(密度2×106 cell/mL)的微囊藻进行正式试验。每个质量浓度梯度试验组设3个平行。每天定时摇动三角瓶以免藻细胞附壁,试验周期7 d,在1、3、5、7 d取样进行检测。
1.2.3 光合色素(叶绿素a)的测定无菌条件下取10 mL藻液,通过反复冻融-浸提法利用分光光度计测定提取的上清液在波长为630、645、663、750 nm处的吸光度值,根据公式[17]计算并绘制曲线。
1.2.4 藻胆蛋白的测定取5 mL藻液,经离心,加入5 mL的磷酸缓冲液,反复冻融3~4次后,将离心后的上清液用分光光度计测定波长为620、650和656 nm下的吸光度值。根据PADGETT等[18]的公式分别计算藻蓝蛋白、别藻蓝蛋白和藻红蛋白的浓度和相对含量。
1.2.5 胞外多糖的测定参考YANG等[19]的方法,胞外多糖(EPS)可分为固着性胞外多糖(bEPS)和溶解性胞外多糖(sEPS)。将15 mL藻液离心后收集上清液用于测定溶解性胞外多糖(sEPS),下层藻细胞加蒸馏水,调节pH至10,45 ℃水浴4 h,离心收集的上清液经过滤透析冻干浓缩测定固着性胞外多糖(bEPS),采用苯酚硫酸比色法[20]测定各试验组胞外多糖的含量。
1.2.6 铜绿微囊藻总RNA的提取无菌条件下取30 mL的藻液在4 ℃、6 000 r/min下先离心5 min,弃上清再加入1 mL的超纯水,溶解沉淀后转移到15 mL的离心管中,然后在4 ℃、12 000 r/min下离心10 min去上清,沉淀保存于-80 ℃用于提取RNA。铜绿微囊藻RNA提取参考高胜玲等[21]使用PGTX进行。使用核酸分析仪测定RNA浓度和纯度,天根反转录试剂盒(天根生物公司,北京)进行反转录。
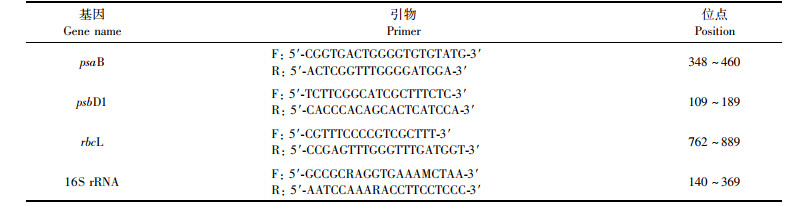
1.2.7 RNA的提取根据文献[22]得到psaB、psbD1和rbcL的定量引物(表 1), 以16S rRNA基因作管家基因进行校正。利用CFX96TM实时PCR检测系统进行qPCR,反应体系:95 ℃预变性10 min、95 ℃变性10 s、55 ℃复性15 s、72 ℃延伸30 s,共39个循环。
|
表 1 本研究所用引物 Tab.1 Sequences of primers used in this study |
基因的相对表达量分析采用2-ΔΔCt法。所有数据的表示方法均使用平均值±标准误进行显著性差异分析。
1.3 数据处理采用SPSS软件和Microsoft Excel进行数据统计分析,以P < 0.05为显著差异(以a, b, c标注),P < 0.01为极显著差异(以A, B, C标注)。使用GraphPad Prism 7软件作图。
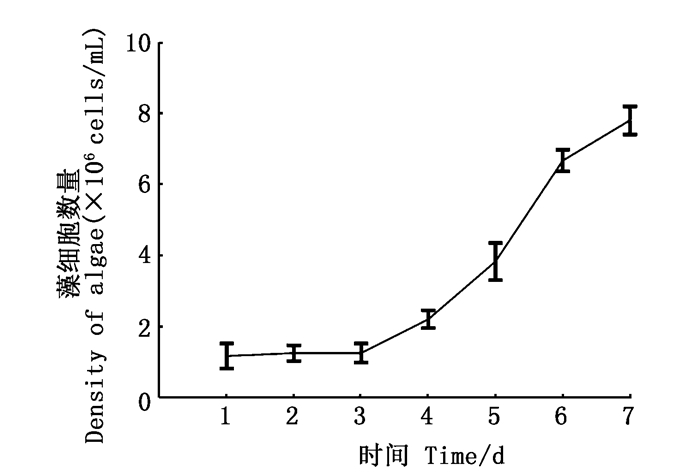
2 结果 2.1 铜绿微囊藻的生长将藻种活化1周后,取10 mL藻液接种到100 mL BG11液体培养液中培养,每天定时取样,用血细胞计数板统计铜绿微囊藻的数量,结果如图 1所示,微囊藻在正常培养条件下第4天左右进入指数生长期。
|
图 1 铜绿微囊藻的生长曲线 Fig. 1 Curve of the growth of M.aeruginosa |
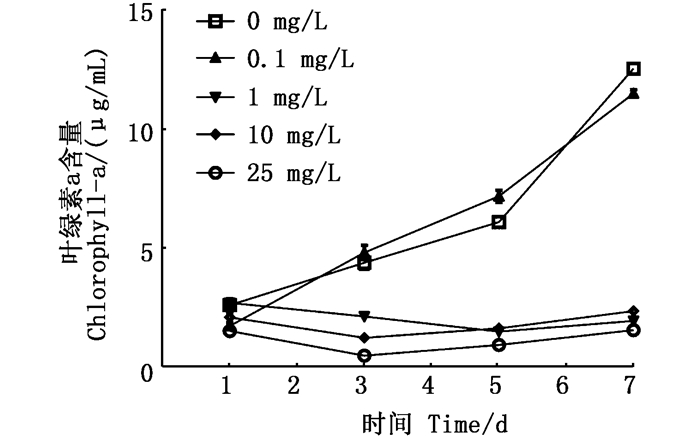
从图 2可见,对照组和0.1 mg/L组的微囊藻叶绿素a含量随时间升高,而氟苯尼考质量浓度1 mg/L组、10 mg/L组和25 mg/L组的铜绿微囊藻叶绿素a含量出现下降。推断氟苯尼考质量浓度低于0.1 mg/L时促进铜绿微囊藻的叶绿素a合成,大于1 mg/L时则抑制其合成。
|
图 2 不同质量浓度氟苯尼考处理下铜绿微囊藻的叶绿素a含量变化 Fig. 2 Changes of Chl.a of M. aeruginosa exposure to different Florfenicol mass concentrations |
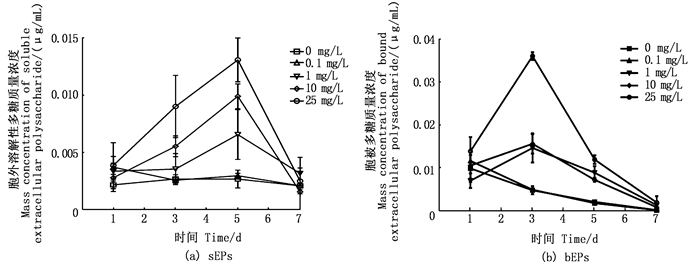
微囊藻的群体直径被认为和胞外多糖含量存在显著的正相关,而固着性胞外多糖和溶解性胞外多糖含量之间也存在显著的正相关关系,可见多糖的合成和分泌与微囊藻形成群体和维持群体形态有着密不可分的联系,而微囊藻群体形成是水华治理的最大限制条件。由图 3a可见,在氟苯尼考质量浓度低于0.1 mg/L时对胞外溶解性多糖分泌无直接影响,在1 mg/L、10 mg/L、25 mg/L 3组中随质量浓度的升高胞外溶解性多糖含量逐渐升高,在第5天左右达到最高值。由图 3b可见,0.1 mg/L组时的胞被多糖分泌和对照组无显著差异,而随着氟苯尼考质量浓度的升高,胞被多糖质量浓度逐渐升高,在第3天达到最高值。总之,氟苯尼考质量浓度低于0.1 mg/L时对多糖分泌无直接影响,质量浓度大于10 mg/L时合成的多糖总量会随抗生素质量浓度的增加而增加,随着氟苯尼考质量浓度的增加,微囊藻胞外多糖的分泌呈现先促进后抑制的趋势,并且在时间上胞被多糖含量的峰值比胞外溶解性多糖滞后2 d。
|
图 3 不同质量浓度氟苯尼考处理下铜绿微囊藻的胞外多糖质量浓度 Fig. 3 EPS mass concentrations of M.aeruginosa exposure to different Florfenicol mass concentrations |
藻胆蛋白主要存在于蓝藻、红藻、隐藻和少数甲藻中,其主要功能是作为光合作用的捕光色素复合体,在一些藻类中藻胆蛋白也可以作为储藏蛋白,供藻类在氮源缺乏的季节作为备用氮源,维持生存。结果表明,3种藻胆蛋白有相同的变化趋势,氟苯尼考质量浓度低于0.1 mg/L时对藻胆蛋白含量无直接影响,质量浓度大于1 mg/L时藻胆蛋白含量均随着处理质量浓度升高有增加趋势,在第3天达到最高值,而后有明显下降趋势(图 4)。
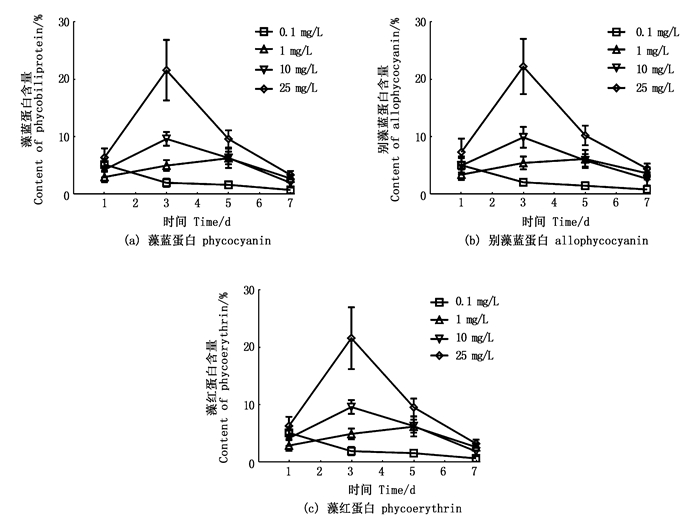
|
图 4 不同质量浓度氟苯尼考处理下铜绿微囊藻的藻胆蛋白含量的变化 Fig. 4 Changes of phycobiliprotein content of M.aeruginosa exposure to different Florfenicol mass concentrations |
通过铜绿微囊藻光合作用相关基因rbcL(1, 5-二磷酸羧化酶/加氧酶)、PSⅠ反应中心蛋白psaB基因和psbD1基因分析不同氟苯尼考质量浓度组对铜绿微囊藻细胞的光合作用系统产生的影响。psaB基因和psbD1基因表现为先下调后随浓度而上调的趋势,rbcL基因表达量在各质量浓度组前3天均下调,而10 mg/L和25 mg/L质量浓度组从第5天开始明显上调,到第7天大于0.1 mg/L的浓度组均明显上调(图 5)。各试验质量浓度组psaB基因表达水平在试验开始第1天相对对照组均下调,第3天氟苯尼考质量浓度在25 mg/L组开始上调表达,第5天在大于10 mg/L组上调表达,第7天大于1.0 mg/L组均有上调表达(图 6)。psbD1基因在0.1 mg/L组的表达水平均下调,而1.0 mg/L组和25 mg/L组表达量在处理5 d后明显上调。可见不同质量浓度的氟苯尼考均会对细胞的光合系统产生一定程度影响(图 7)。
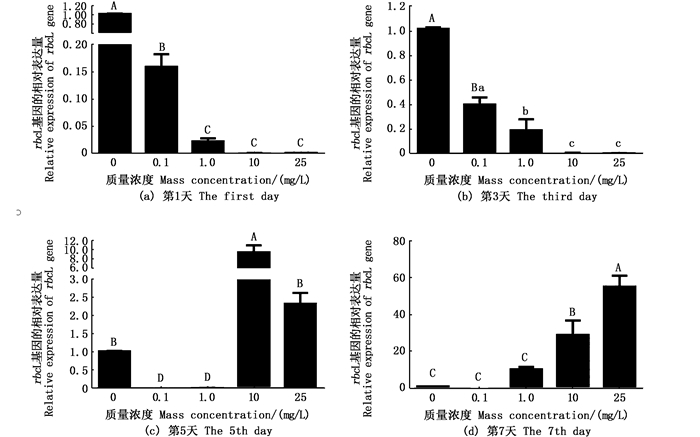
|
不同小写字母表示显著差异(P < 0.05);不同大写字母表示极显著差异(P < 0.01)。 Differernt lowercase letters indicate a significant difference(P < 0.05); Differernt uppercase letters indicates very significant difference(P < 0.01). 图 5 微囊藻rbcL基因在不同质量浓度氟苯尼考处理下的表达 Fig. 5 Expression profile of rbcL gene of M.aeruginosa exposure to different Florfenicol mass concentrations |
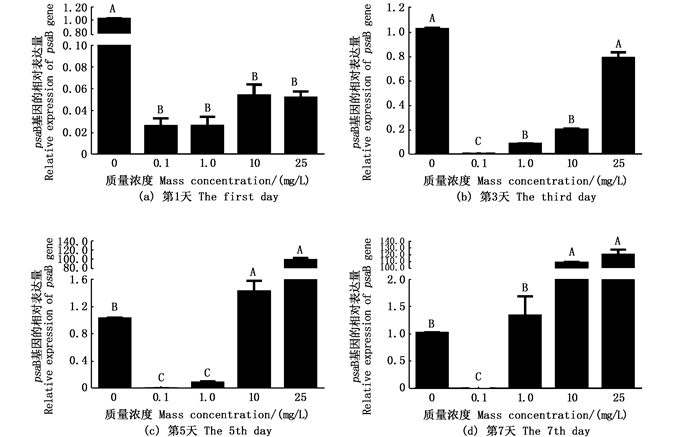
|
不同大写字母表示极显著差异(P < 0.01)。 Differernt uppercase letters indicate very significant difference(P < 0.01). 图 6 微囊藻psaB基因在不同质量浓度氟苯尼考处理下的表达 Fig. 6 Expression profile of psaB gene of M.aeruginosa exposure to different Florfenicol mass concentrations |
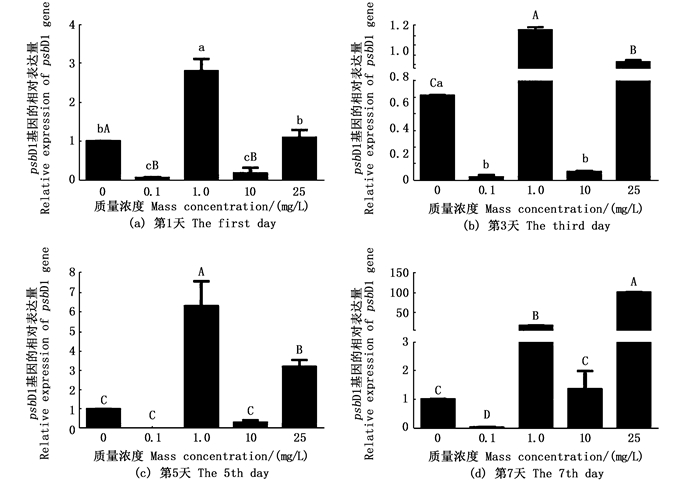
|
不同小写字母表示显著差异(P < 0.05);不同大写字母表示极显著差异(P < 0.01)。 Differernt lowercase letters indicate a significant difference(P < 0.05); Differernt uppercase letters indicates very significant difference(P < 0.01). 图 7 图 7微囊藻psbD1基因在不同质量浓度氟苯尼考处理下的表达 Fig. 7 Expression profile of psbD1 gene of M.aeruginosa exposure to different Florfenicol mass concentrations |
蓝藻的细胞结构简单,无典型细胞核,其细胞壁与细菌细胞壁的化学组成类似,主要为肽聚糖,因此又称蓝细菌。微囊藻作为中国各地常见的水华蓝藻,在水华暴发的机制探讨和治理上越来越引起人们的关注[23-24]。
光合作用是藻类进行自养作用的关键,叶绿体是光合作用的场所,叶绿素在光合作用中起到吸收光能、传递光能的作用,因此叶绿素的含量与藻类的光合速率密切相关。本研究中氟苯尼考质量浓度大于1 mg/L的各试验组铜绿微囊藻的生长受到抑制,叶绿素a含量明显降低,而在0.1 mg/L组叶绿素a含量有明显增高趋势,推断低质量浓度氟苯尼考对铜绿微囊藻生长有促进作用,高质量浓度则抑制其生长。周旭东[22]室内模拟研究发现铜绿微囊藻和小球衣藻在抗生素影响作用下有浓度响应关系,表现出低质量浓度(小于0.5 mg/L)无害甚至促进;而高质量浓度(大于1 mg/L)抑制的特征。四环素类、磺胺类抗生素在较低质量浓度下会促进水体中微囊藻数量的增长,从而加大微囊藻水华暴发的可能性。张晓晗等[24]发现喹诺酮类和磺胺类抗生素均对淡水绿藻的生长表现出“低促高抑”的效果,抗生素质量浓度≤5 mg/L促进藻类的生长,>5 mg/L抑制藻类的生长。
研究[25]表明,当藻类生存状况恶劣时,蓝藻分泌多糖,细胞壁表面的胞外多糖层变厚,溶解性和固着性胞外多糖含量显著增加,某些种类藻就容易聚集成群体。本试验中0.1 mg/L氟苯尼考质量浓度组的胞外多糖的释放总量与对照组相比,无显著变化;大于1.0 mg/L时,各试验组藻类胞被多糖含量明显提高,推断其通过细胞表面多糖层变厚,产生保护机制来降低抗生素对藻类的损伤作用。
藻胆蛋白主要功能是作为光合作用的捕光色素复合体,在一些藻类中藻胆蛋白也可以作为储藏蛋白,试验中氟苯尼考质量浓度大于1 mg/L处理组,藻胆蛋白含量在第3天出现最大值,所以高浓度的氟苯尼考并未对藻细胞产生藻蓝蛋白和别藻蓝蛋白的能力造成更大的损伤,而是促进了藻蛋白的释放,推测其可能是通过增加藻胆蛋白的含量补充光合作用,来抵抗恶劣环境的影响。藻胆蛋白含量有随质量浓度明显增大的趋势。
3.2 不同质量浓度氟苯尼考对铜绿微囊藻光合作用相关基因的影响光合作用是藻类进行自养作用的关键,在藻细胞的光系统受到破坏时,光合作用相关基因rbcL、psaB、psaA/B和psbD1调节光合系统的组装损伤,影响光合反应中的电子传递过程,导致多余电子的积累和细胞的氧化损伤,对植物的光合作用相关细胞器造成影响,目前已发现多种植物可以抑制藻类的光合作用[26-27]。张超[28]发现丹参会导致铜绿微囊藻光合作用相关基因rbcL,psaB和psbD1的表达下调。本研究中铜绿微囊藻对氟苯尼考的响应却随质量浓度而不同。当氟苯尼考质量浓度大于1 mg/L时,光合作用相关基因rbcL出现先下调后上调表达,而光系统Ⅱ反应中心蛋白编码基因psaB和psbD1出现明显上调表达; 当氟苯尼考质量浓度小于1 mg/L时,光合作用相关基因下调,光合作用受到抑制。推断短期低质量浓度抗生素会抑制光合作用基因的表达水平,而高质量浓度抗生素处理会上调光合基因的表达水平,试验中psbD1基因在10 mg/L氟苯尼考质量浓度组却出现明显下调表达,原因需进一步探究。
综合试验的4个指标结果,虽然在使用抗生素处理后高质量浓度组微囊藻的叶绿素a含量下降,但藻细胞会利用提高胞被多糖含量、藻胆蛋白含量、光合作用等其他各种手段来增加其对环境的适应性。所以从环境保护角度,水体中如果出现高于安全质量浓度标准的抗生素,虽然会在一定程度上对微囊藻的数量产生抑制作用,但微囊藻也会通过自身机体的防御机制来抵御这种影响,而且由于大水体中抗生素会随时间被稀释,所以在抗生素质量浓度下降之后产生更加严重的暴发现象,严重者导致水华。因此抗生素的残留对水华蓝藻的影响也需要关注,这可能会成为一个新的水质重要指标,并在未来为水环境治理提供一个新的思路。
| [1] |
王冰, 孙成, 胡冠九. 环境中抗生素残留潜在风险及其研究进展[J]. 环境科学与技术, 2007, 30(3): 108-111. WANG B, SUN C, HU G J. Residue antibiotics in environment:potential risks and relevant studies[J]. Environmental Science & Technology, 2007, 30(3): 108-111. DOI:10.3969/j.issn.1003-6504.2007.03.040 |
| [2] |
CHEN J Q, GUO R X. Access the toxic effect of the antibiotic cefradine and its UV light degradation products on two freshwater algae[J]. Journal of Hazardous Materials, 2012, 209-210: 520-523. DOI:10.1016/j.jhazmat.2012.01.041 |
| [3] |
CRANE M, WATTS C, BOUCARD T. Chronic aquatic environmental risks from exposure to human pharmaceuticals[J]. Science of the Total Environment, 2006, 367(1): 23-41. DOI:10.1016/j.scitotenv.2006.04.010 |
| [4] |
CODD G A, MORRISON L F, METCALF J S. Cyano-bacterial toxins:risk management for health protection[J]. Toxicology and Applied Pharmacology, 2005, 203(3): 264-272. DOI:10.1016/j.taap.2004.02.016 |
| [5] |
SMITH J L, BOYER G L, ZIMBA P V. A review of cyanobacterial odorous and bioactive metabolites:impacts and management alternatives in aquaculture[J]. Aquaculture, 2008, 280(1/4): 5-20. |
| [6] |
WILSON A E, SARNELLE O, NEILAN B A, et al. Genetic variation of the bloom-forming cyanobacterium Microcystis aeruginosa within and among lakes:implications for harmful algal blooms[J]. Applied and Environmental Microbiology, 2005, 71(10): 6126-6133. DOI:10.1128/AEM.71.10.6126-6133.2005 |
| [7] |
陈建中, 刘志礼, 李晓明, 等. 温度、pH和氮、磷含量对铜绿微囊藻(Microcystis aeruginosa)生长的影响[J]. 海洋与湖沼, 2010, 41(5): 714-718. CHEN J Z, LIU Z L, LI X M, et al. Effects of temperature, pH, nitrogen and phosphorus on growth of Microcystis aeruginosa[J]. Oceanologia et Limnologia Sinica, 2010, 41(5): 714-718. |
| [8] |
陈长平, 高亚辉, 林鹏. 盐度和pH对底栖硅藻胞外多聚物的影响[J]. 海洋学报, 2006, 28(5): 123-129. CHEN C P, GAO Y H, LIN P. Production of extracellular polymeric substances (EPS) by benthic diatom:effect of salinity and pH[J]. Acta Oceanologica Sinica, 2006, 28(5): 123-129. DOI:10.3321/j.issn:0253-4193.2006.05.016 |
| [9] |
PERRON M C, JUNEAU P. Effect of endocrine disrupters on photosystem Ⅱ energy fluxes of green algae and cyanobacteria[J]. Environmental Research, 2011, 111(4): 520-529. DOI:10.1016/j.envres.2011.02.013 |
| [10] |
ZENG J, YANG L Y, WANG W X. Acclimation to and recovery from cadmium and zinc exposure by a freshwater cyanobacterium, Microcystis aeruginosa[J]. Aquature Toxicololgy, 2009, 93(1): 1-10. DOI:10.1016/j.aquatox.2009.02.013 |
| [11] |
PAPATSIROS V, TZIKA E, ATHANASIOU L, et al. In vivo effectiveness of injectable antibiotics on the recovery of acute Actinobacillus pleuropneumoniae-infected pigs[J]. Microbial Drug Resistance, 2019, 25(4): 603-610. DOI:10.1089/mdr.2018.0277 |
| [12] |
SHIRY N, SOLTANIAN S, SHOMALI T, et al. Immunomodulatory effects of orally administrated florfenicol in rainbow trout (Oncorhynchus mykiss) following experimental challenge with streptococcosis/lactococcosis[J]. International Immunopharmacology, 2019, 73: 236-245. DOI:10.1016/j.intimp.2019.05.007 |
| [13] |
YÉVENES K, POKRANT E, PÉREZ F, et al. Assessment of three antimicrobial residue concentrations in broiler chicken droppings as a potential risk factor for public health and environment[J]. International Journal of Environmental Research and Public Health, 2019, 16(1): 24. |
| [14] |
DU Y X, WANG J, ZHU F Y, et al. Comprehensive assessment of three typical antibiotics on cyanobacteria (Microcystis aeruginosa):the impact and recovery capability[J]. Ecotoxicology and Environmental Safety, 2018, 160: 84-93. DOI:10.1016/j.ecoenv.2018.05.035 |
| [15] |
张红霞, 宫相忠, 高伟, 等. 四种抗生素对共培养的萱藻丝状体和膨胀色球藻的影响[J]. 水产学报, 2018, 42(12): 1906-1915. ZHANG H X, GONG X Z, GAO W, et al. Inhibitory effect of four antibiotics on Chroococcus turgidus co-cultured to the filaments of Scytosiphon lomentaria[J]. Journal of Fisheries of China, 2018, 42(12): 1906-1915. |
| [16] |
官奕宏, 李红卫, 吕谋, 等. 诺氟沙星和四环素对铜绿微囊藻的毒性研究[J]. 四川环境, 2015, 34(5): 25-30. GUAN Y H, LI H W, LV M, et al. Effects of norfloxacin and tetracycline on Microcystis aeruginosa[J]. Sichuan Environment, 2015, 34(5): 25-30. DOI:10.3969/j.issn.1001-3644.2015.05.005 |
| [17] |
国家环境保护总局. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2006. State Environmental Protection Administration. Water and wastewater monitoring and analysis methods[M]. Beijing: China Environmental Science Press, 2006. |
| [18] |
PADGETT M P, KROGMANN D W. Large scale preparation of pure phycobiliproteins[J]. Photosynthesis Research, 1987, 11(3): 225-235. DOI:10.1007/BF00055062 |
| [19] |
YANG Z, KONG F X, SHI X L, et al. Changes in the morphology and polysaccharide content of Microcystis aeruginosa (cyanobacteria) during flagellate grazing[J]. Journal of Phycology, 2008, 44(3): 716-720. DOI:10.1111/j.1529-8817.2008.00502.x |
| [20] |
杨林莎, 李玉贤, 李明丽, 等. 苯酚-硫酸比色法测定百合多糖的含量[J]. 中国中医药信息杂志, 2004, 11(8): 704-705. YANG L S, LI Y X, LI M L, et al. Determination for the content of polysaccharides in the lilium brownii by phenol-vitriolic colorimetry[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2004, 11(8): 704-705. DOI:10.3969/j.issn.1005-5304.2004.08.022 |
| [21] |
高胜玲, 黄亚新, 卢亚萍, 等. 微囊藻群体总RNA提取方法的比较[J]. 湖泊科学, 2018, 30(2): 441-448. GAO S L, HUANG Y X, LU Y P, et al. Comparison of RNA extraction methods from Microcystis colonies[J]. Journal of Lake Sciences, 2018, 30(2): 441-448. |
| [22] |
周旭东.四环素类、磺胺类抗生素对铜绿微囊藻和小球衣藻的影响研究[D].杨凌: 西北农林科技大学, 2017. ZHOU X D. Effects of tetracyclines and sulfonamides on Microcystis aeruginosa and Chlamydomonas microsphaera[D]. Yangling: Northwest A & F University, 2017. |
| [23] |
辛文克.大萍及其碱类提取物对铜绿微囊藻生长的抑制作用研究[D].哈尔滨: 哈尔滨工业大学, 2013. XIN W K. The study on inhibition effects of Microcystis aeruginosa growth by Pistia stratiotes and its alkali extracts[D]. Harbin: Harbin Institute of Technology, 2013. |
| [24] |
张晓晗, 万甜, 程文, 等. 喹诺酮类和磺胺类抗生素对绿藻生长的影响[J]. 水资源与水工程学报, 2018, 29(4): 115-120. ZHANG X H, WAN T, CHENG W, et al. Effects of quinolones and sulfonamides on the growth of green algae[J]. Journal of Water Resources and Water Engineering, 2018, 29(4): 115-120. |
| [25] |
刘菲菲, 冯慕华, 尚丽霞, 等. 温度对铜绿微囊藻(Microcystis aeruginosa)和鱼腥藻(Anabaena sp.)生长及胞外有机物产生的影响[J]. 湖泊科学, 2014, 26(5): 780-788. LIU F F, FENG M H, SHANG L X, et al. E.ffects of temperature on the growth and generation of extracellular organic matter of Microcystis aeruginosa and Anabaena sp.[J]. Journal of Lake Sciences, 2014, 26(5): 780-788. |
| [26] |
余澍琼.过氧化氢对铜绿微囊藻生长抑制及作用机理研究[D].杭州: 浙江工业大学, 2011. YU S Q. The mechanism and inhibitory effect of hydrogen peroxide on the growth of Microcystis aeruginosa[D]. Hangzhou: Zhejiang University of Technology, 2011. |
| [27] |
ZHANG C, LING F, YI Y L, et al. Algicidal activity and potential mechanisms of ginkgolic acids isolated from Ginkgo biloba exocarp on Microcystis aeruginosa[J]. Journal of Applied Phycology, 2014, 26(1): 323-332. DOI:10.1007/s10811-013-0057-9 |
| [28] |
张超.丹参抑制铜绿微囊藻活性成分及机理研究[D].杨凌: 西北农林科技大学, 2014. ZHANG C. Study on active constitutions and mechanisms of Salvia miltiorrhiza bung against Microcystis aeruginosa[D]. Yangling: Northwest A&F University, 2014. |
 2021,
Vol. 30
2021,
Vol. 30


