2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
暗纹东方鲀(Tetrodontiformes fasciatus)又名气泡鱼,俗称河豚(puffer fish),属硬骨鱼纲(Osteichthyes)辐鳍亚纲(Actinopterygii)鲈形总目(Percomorpha)鲀形目(Tetrodontiformes)中的鲀科[1-2]。2016年9月,河鲀市场初步开放[3],暗纹东方鲀养殖业逐渐得到发展,养殖暗纹东方鲀的毒素微乎其微[4]。暗纹东方鲀鱼皮含有丰富的胶原蛋白,具有抗氧化、抗肿瘤、降血压以及美容美白和促进伤口愈合的能力[5-6]。采用热水法提取胶原蛋白,胶原蛋白经温和而不可逆断裂后的主要产物即为明胶[7-8],明胶具有形成凝胶的能力。因此具有很好的开发潜力,将鱼皮热水熬制后,经过冷藏形成胶冻状食品,俗称“鱼冻”[9-10],同时,消费者反映暗纹东方鲀在食用过程中腹部小鳍刺影响口感,因此,本研究考虑将暗纹东方鲀(T.fasciatus)鱼皮作为原料,开发出含有丰富蛋白质的新一代鱼冻产品。
刘晓宁等[11]和ARNESEN等[12]用热水提取胶原蛋白;ISWARIYA等[13]对暗纹东方鲀鱼皮提取出的胶原蛋白进行了理化性质的研究;易翠平等[14]用鳡(Elopicthys banbusa)副产品制备了鱼冻;顾杨娟[15]用草鱼(Ctenopharyngodon idellus)鳞制备了鱼鳞冻;安然[16]和王雅菲[17]以鲇鱼(Silurus asotus)、鲟鱼(Acipenser sinensis)鱼皮为原料,研发了一种鱼冻,确定了制作鱼冻的工艺,并进行了胶冻调味的研究;还有以鲢(Hypophthalmichthys molitrix)[18]、鳕鱼(Gadus)[19]、罗非鱼(Oreochroms mossambcus)[20]等制备鱼冻类凝胶产品并调味去腥的相关研究。有很多研究学者也报道了从尼罗河鲈鱼(Lates niloticus)[21]、虎头鲨(Pangasius hypophthalmus)[22]、草鱼(Ctenopharyngodon idellus)[23]、大眼鲷鱼(Priacanthus tayenus)[24]以及鲤(Cyprinus carpio)[25]、罗非鱼(Oreochroms mossambcus)[26]等鱼皮中提取的明胶都具有较好凝胶性能。基于鱼皮这一良好性能,本实验在以往研究热水法提取胶原蛋白的基础上,热水法处理暗纹东方鲀鱼皮,收集提取液,经过冷藏凝冻形成初步的鱼冻产品。而暗纹东方鲀鱼皮的明胶熔点比猪、牛低,口感更加细腻,通过研究提取时间、料液比和提取温度对鱼冻的胶原蛋白提取率和凝胶性能的影响,应用响应面法优化暗纹东方鲀鱼皮冻的加工工艺,经过提取、凝冻研发出一种满足消费者口感和营养需求的产品,为暗纹东方鲀的有效利用以及深加工提供技术参考。
1 材料与方法 1.1 材料与试剂暗纹东方鲀鱼皮由江苏中洋集团股份有限公司提供;L-羟脯氨酸标准品、对二甲氨基苯甲醛、柠檬酸、氯仿T、NaOH等购自国药集团化学试剂有限公司,均为分析纯;实验用水均为去离子水。
1.2 仪器与设备L-8800日立氨基酸自动分析仪,日立(中国)有限公司生产;DF-101S型集热式恒温加热磁力搅拌器,巩义市与予华仪器有限责任公司生产;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司生产;TA-XT plus型质构仪,英国Stable Micro System公司生产;超低温冰箱,日本SANYO集团生产;DZF-1B真空干燥箱,上海天恒医疗器械有限公司生产;METTLER TOLEDO pH计,上海雷磁仪器厂生产。
1.3 方法 1.3.1 暗纹东方鲀鱼皮基本成分的测定水分测定:恒温干燥法(GB/T 5009.3—2003);灰分测定:灰化法(GB/T 5009.4—2003);蛋白质的测定:凯氏定氮法(GB/T 5009.5—2003);脂肪测定:索氏提取法(GB/T 5009.6—2003)。
1.3.2 工艺流程鱼皮在室温下流水解冻,清洗表皮杂质,剪至约0.5 cm×0.5 cm,最后自然晾干水分。加入一定比例的去离子水,用锡箔纸封口防止水分挥发,在一定的温度、时间、料液比条件下,水浴加热得到鱼皮胶液,用3层纱布滤掉鱼皮残渣,将胶液放入容器中在4 ℃冷藏柜中凝冻过夜,初步得到鱼冻,即暗纹东方鲀鱼皮冻。
1.3.3 提取参数的选择与初步确定以鱼皮为原料,分别研究提取温度、料液比、提取时间对鱼冻中胶原蛋白提取率和冻力的影响。基本条件:提取时间2 h、提取温度80 ℃、料液比为1: 3(g/mL)。各因素水平:提取时间1、2、3、4、5 h;提取温度60、70、80、90、100 ℃;料液比1: 2、1: 3、1: 4、1: 5、1: 6、1: 7、1: 8(g/mL)。
1.3.4 提取参数的优化(响应面法)在单因素实验基础上,结合Box-Behnken的中心组合实验设计原理,进行3因素3水平的响应面分析法。见表 1。

|
表 1 暗纹东方鲀鱼皮冻制备工艺响应面分析试验因素水平 Tab.1 Test factor level of response surface analysisof fish jelly from the skin of T.fasciatus preparation process |
称取鱼皮或胶液样品于水解管中,加入2 mL的6 mol/mL HCl后放入130 ℃烘箱中,水解3 h。冷却至室温调pH至中性,定容至100 mL。吸1 mL的水解液及3 mL去离子水于试管中,吸2 mL氯胺T,室温氧化30 min,加入对二甲氨基苯甲醛,迅速混匀,并在60 ℃下水浴20 min,染色完成后流水冷却1 min,室温放置5 min后在560 nm处测其吸光度,由标准曲线得出羟脯氨酸浓度。羟脯氨酸是胶原蛋白的特征氨基酸。
L-羟脯氨酸吸光度、标准溶液浓度(μg/mL)分别为纵坐标、横坐标,绘制标准曲线,得曲线方程y=0.196 3x-0.020 4,其中R2=0.980 2,y为560 nm处测定的吸光度值,x为羟脯氨酸含量。计算暗纹东方鲀鱼皮胶原蛋白提取率公式如下:
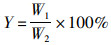 (1)
(1)
式中:Y为胶原蛋白提取率;W1为胶液中胶原蛋白的含量, %;W2为鱼皮中胶原蛋白的含量, %。
1.3.6 冻力测定参考顾杨娟等[28]的方法,略作改动。压缩变形4 mm所需的最大应力为冻力,单位为g。提取液在4 ℃下凝冻36 h,采用TA-XTplus质构仪测定冻力,用P/0.5探头,下压速度1 mm/s,下压高度4 mm。
1.3.7 氨基酸组成的测定参照SU等[29]的方法,略作改动。将样品置于水解管中,加入6 mol/L盐酸2 mL,真空密封,于130 ℃水解3 h。水解液用4 mol/L和0.1 mol/L的NaOH中和pH至2.2,离心取上清液后用0.02 mol/mL HCl定容至50 mL,吸取滤液,过0.22 μm滤膜后用氨基酸自动分析仪测定样品氨基酸含量。
1.4 数据分析使用Excel 2010、SPSS 18.0、Design-Export 10.0.7软件设计响应面试验并分析,数据使用为平均值±标准差。
2 结果与分析 2.1 暗纹东方鲀鱼皮的基本组成成分从表 2可以看出,暗纹东方鲀鱼皮含水量为65.85%,干物质含量为33.48%,在这些干物质中主要为蛋白质,约占干物质总量的90.87%。在鱼皮蛋白质中,胶原蛋白的含量占粗蛋白的73.90%,占有较大比重,因此暗纹东方鲀鱼皮是一种较好的提取胶原蛋白的原料。

|
表 2 暗纹东方鲀鱼皮的基本营养成分
Tab.2 Basic chemical composition of T.fasciatus skin |
以胶原蛋白提取率和冻力为指标,胶原蛋白提取率越大,胶液的胶原蛋白越多,鱼冻更具营养性,而形成的鱼冻不同于热水法提取胶原蛋白,要求具有一定的凝胶特性和适口性。
2.2.1 提取温度对鱼冻品质的影响如图 1所示,在80 ℃时,冻力为163.63 g,提取率为48.04%时达到最大值,也可看出研究的60 ℃以上温度对提取率影响不大。当温度升高时,随着胶液中的α肽链增加,肽链间增加的交联度形成致密的网状结构,冻力随着温度升高增加;当温度继续上升时,肽链次级结构发生降解,形成许多短肽链,不易交联的短肽链难以形成网状结构,导致冻力降低。因此从提取率和冻力确定提取温度为80 ℃。

|
图 1 提取温度对暗纹东方鲀鱼皮冻胶原蛋白提取率和冻力的影响 Fig. 1 Effect of extraction temperature on collagen recovery and gel strength of fish jelly from the skin of T.fasciatus |
如图 2所示,料液比增加,提取率和冻力都在明显的下降,在1: 2料液比时,提取率和冻力都很高,和实际情况相结合,水刚好或者没有淹没鱼皮,应用意义不大,当料液比较高时,胶液浓度低,冻力变小。综上,料液比1: 4时是制作鱼冻最佳的条件。

|
图 2 料液比对暗纹东方鲀鱼皮冻胶原蛋白提取率和冻力的影响 Fig. 2 Effect of material-liquid ratio on collagen recovery and gel strength of fish jelly from the skin of T.fasciatus |
如图 3所示,提取时间超过2 h后,冻力明显降低,由于提取胶原蛋白达到一定时间后,胶原蛋白纤维紧密的网状结构被破坏,次级结构降解不断发生,难以形成交联,引起冻力下降,综合提取率考虑,提取时间2 h时是最佳条件。

|
图 3 提取时间对暗纹东方鲀鱼皮冻胶原蛋白提取率和冻力的影响 Fig. 3 Effect of extraction time on collagen recovery and gel strength of fish jelly from the skin of T.fasciatus |
利用Design-Expert 10.0.7软件中的中心组合试验设计,试验组合与结果见表 3。

|
表 3 暗纹东方鲀鱼皮冻制备工艺响应面试验设计与结果 Tab.3 Experimental design and results for response surface analysis of fish jelly from the skin of T.fasciatus |
根据试验结果,拟合3个自变量和响应值提取率的二次多项式方程Y=46.05+0.29A-7.15B+3.17C-1.82AB-0.70AC-0.15BC-8.06A2-5.66B2-13.92C2, 二次多项式模型R2=0.959 7,校正系数RAdj2=0.907 8,说明回归模型能解释95.97%响应值的变化。
同时对该方程进行回归方差分析,如表 4所示:回归模型F值为18.51,P=0.000 4<0.01,说明该模型极显著;失拟项F值为0.47,P=0.717 6>0.05,说明此模型拟合非常可靠。因此可用上述回归模型分析和预测实验真实点对提取率的影响。料液比一次项B、提取温度二次项A2、提取时间二次项C2均极显著(P<0.01),说明料液比对于提取率有极显著的影响,提取温度和提取时间的二次效应对提取过程中提取率的影响极其显著,提取时间一次项C和料液比二次项B2影响显著(P<0.05),说明提取时间和料液比的二次效应在提取过程中显著影响提取率。A、AB、BC不显著,说明在提取过程中,提取温度、提取温度和料液比的交互作用、料液比和提取时间的交互作用在提取过程中对于提取率基本没有影响。

|
表 4 暗纹东方鲀鱼皮冻的胶原蛋白提取率回归模型方差分析 Tab.4 Variance analysis of collagen recovery regression model of fish jelly from the skin of the skin of T.fasciatus |
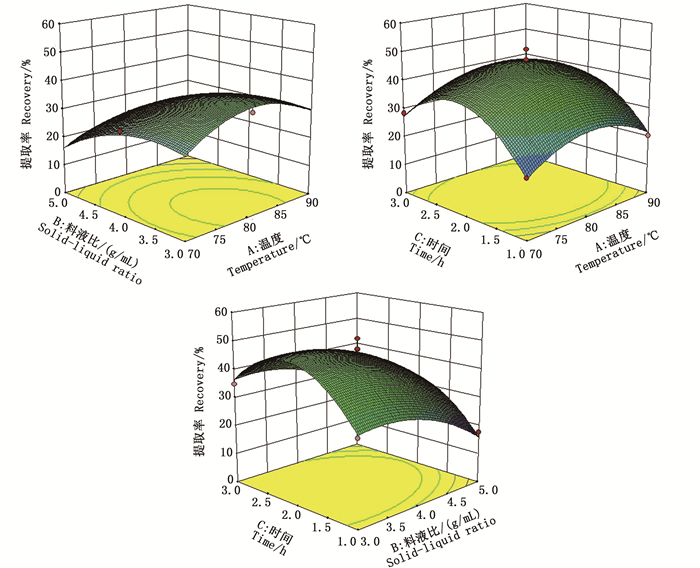
如图 4可知,随着各因素水平的升高,胶原蛋白提取率呈现先上升后下降的趋势,各曲面图均开口朝下,表明实验结果在试验区域内有最大值。
|
图 4 两因素交互作用对暗纹东方鲀鱼皮冻胶原蛋白提取率影响的响应面图 Fig. 4 Response surface showing the influence of interactive effect on collagen recovery of fish jelly from the skin of T.fasciatus |
根据试验结果,拟合独立变量和响应值冻力率的二次多项式方程Y=164.52+9.00A-34.28B-8.82C-21.48AB+7.70AC+13.05BC-70.93A2-34.16B2-44.07C2,二次多项式模型R2=0.886 3,校正系数R2Adj=0.740 1,表示回归模型可以说明88.63%响应值的变化。此模型精密度为6.461,大于4.0,视为合理且拟合程度良好。
对该方程进行回归方差分析,如表 5所示:回归模型F为6.06,P=0.013 4<0.05,说明该模型显著;失拟项F为0.62,P=0.638 7>0.05,说明此模型拟合非常可靠。因此可用上述回归模型分析和预测实验真实点对冻力的影响。冻力回归模型系数显著性结果显示,料液比一次项B和提取温度二次项A2极显著(P<0.01),说明料液比对于冻力有极显著的影响,提取温度二次效应对制备鱼冻过程冻力的影响极其显著,提取温度一次项B和提取时间二次项B2影响显著(P<0.05),说明提取温度和提取时间的二次效应在实验过程中显著影响冻力。A、C、AB、AC、BC、B2不显著,说明在提取过程中,提取温度、提取时间、料液比的二次项和3个因素的的交互作用提取过程中对于冻力基本没有影响。

|
表 5 暗纹东方鲀鱼皮冻冻力的回归模型方差分析 Tab.5 Variance analysis of gel strength regression model of fish jelly from the skin of T.fasciatus |
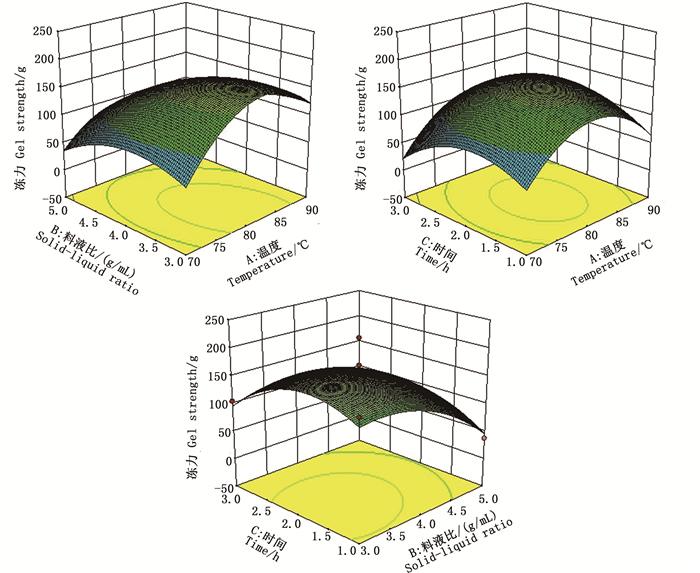
当响应面坡度平缓时,等高线是松散的圆形,表示两个因素交互作用小,反之呈密集椭圆,则交互作用越大。由图 5可知,随着各因素水平的升高,冻力呈现先上升后下降的趋势,各曲面图均开口朝下,实验结果有最大值存在。
|
图 5 两因素交互作用对暗纹东方鲀鱼皮冻冻力影响的响应面分析 Fig. 5 Response surface showing the effect of interactive effect on gel strength of fish jelly from the skin of T.fasciatus |
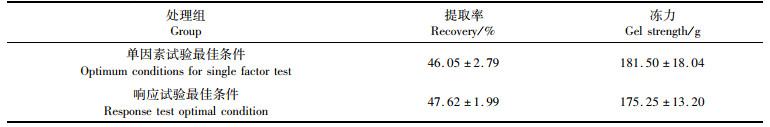
利用软件Design-Expert 10.0.7,在提取温度、料液比和提取时间体系中,设定提取率最大、冻力最大,优化得出最佳试验参数:提取温度81.29 ℃、料液比为1: 3.41、提取时间为2.00 h。根据实际可操作性,将其修正:提取温度为81 ℃,料液比为1: 3.5,提取时间为2 h将响应面法优化得到的组合设为实验组,单因素试验获得的最佳值设为对照组,测定其提取率和冻力。如表 6所示,提取率明显增加,得到的鱼冻胶原蛋白含量高,冻力也维持在较好的范围。因此,响应面优化的最佳试验参数是可靠的。
|
表 6 响应面优化工艺前后胶原蛋白提取率与冻力的比较 Tab.6 Comparison of collagen recovery and gel strength before and after response surface optimization |
鱼冻理论上是胶原蛋白形成的凝胶,具有丰富的营养价值,对未加工的暗纹东方鲀鱼皮和制备的鱼冻进行氨基酸对比分析,保留了鱼皮的氨基酸组成,本实验选用热水处理,不添加化学试剂处理鱼皮,简单有效的利用暗纹东方鲀鱼皮。在优化的工艺处理下,100 g鱼皮最少可制备400 g鱼冻,胶液最大化保留了胶原蛋白,同时具有良好的凝胶性能,400 g暗纹东方鲀鱼皮冻约含10.61 g胶原蛋白,与通常的果冻产品相比,是一种高蛋白低热量富含营养的产品,根据本实验的基本研究参数可开发新型风味暗纹东方鲀鱼皮产品。具体氨基酸含量与组成见表 7,鱼冻相对于鱼皮氨基酸含量减少,推测是在纱布过滤过程中舍弃的鱼皮残渣含有一定氨基酸,同时鱼冻经过一定的料液比加水制备,含水量相对鱼皮增加,导致的氨基酸含量下降。也可看出甘氨酸、脯氨酸、羟脯氨酸、丙氨酸含量丰富,甘氨酸含量最高,这也印证胶原蛋白多肽链片段是由Gly-x-y氨基酸系列重复构成[30-31]。

|
表 7 暗纹东方鲀皮和鱼皮冻的氨基酸含量与组成 Tab.7 Amino acid composition of T.fasciatus skin and fish jelly from the skin of T.fasciatus |
暗纹东方鲀鱼皮胶原蛋白含量高,营养丰富,以暗纹东方鲀鱼皮为原料,采用热水提取制备鱼冻产品,在单因素试验基础上,改变提取时间、提取温度和料液比,以提取率和冻力作为响应值,得到2个二次多项式模型,准确反映各影响因子和响应值之间的关系,决定系数R2分别为0.959 7、0.886 3,失拟项的P大于0.05,显示两个模型均建立有效。优化得到提取温度为81 ℃、料液比为1: 3.5和提取时间为2 h,在此条件下,得到的暗纹东方鲀鱼皮冻胶原蛋白提取率为47.62%,冻力为175.25 g,与拟合效果一致,100 g鱼皮可制备400 g左右产品,含有约10.61 mg胶原蛋白,热水提取不破坏鱼皮基本氨基酸组成,富含甘氨酸和胶原蛋白特征氨基酸,能有效利用鱼皮和保留鱼皮营养成分,初步得到一种富含胶原蛋白和凝胶性能好的暗纹东方鲀鱼皮冻,为暗纹东方鲀鱼皮有效利用提供理论依据,开发暗纹东方鲀鱼皮产品和暗纹东方鲀鱼皮冻的工厂化生产提供参考。
此外暗纹东方鲀鱼皮冻的生产除了提取凝冻的加工工艺外,调味、添加其他功能性产品复合作用、鱼冻保鲜和鱼冻风味形成的图谱均有待进一步研究。
| [1] |
陶宁萍, 龚玺, 刘源, 等. 三种养殖河豚鱼肌肉营养成分分析及评价[J]. 营养学报, 2011, 33(1): 92-94. TAO N P, GONG X, LIU Y, et al. Analysis and evaulation of the nutritional components in muscles of three varieties of bred puffer fish[J]. Acta Nutrimenta Sinica, 2011, 33(1): 92-94. |
| [2] |
黄玉林, 王文利, 刘源, 等. 我国养殖河鲀(业)发展现状及研究进展[J]. 中国食品学报, 2018, 18(1): 217-224. HUANG Y L, WANG W L, LIU Y, et al. The development and progress of cultured puffer fish in China[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(1): 217-224. DOI:10.16429/j.1009-7848.2018.01.028 |
| [3] |
李明爽. 农业部公布第一批养殖河鲀鱼源基地[J]. 中国水产, 2016(10): 18. LI M S. Ministry of agriculture announces first breeding of river herring source base[J]. China Fisheries, 2016(10): 18. |
| [4] |
BANE V, LEHANE M, DIKSHIT M, et al. Tetrodotoxin:chemistry, toxicity, source, distribution and detection[J]. Toxins, 2014, 6(2): 693-755. DOI:10.3390/toxins6020693 |
| [5] |
郭洪辉, 王令充, 洪专. 河豚鱼皮胶原寡肽的护肤美白功效研究[J]. 中国海洋药物, 2015, 34(4): 37-42. GUO H H, WANG L C, HONG Z. Study on skin care and whitening effects of collagen oligopeptides from puffer skin[J]. Chinese Journal of Marine Drugs, 2015, 34(4): 37-42. |
| [6] |
郭芮, 张晓梅, 苏红, 等. 河豚鱼的营养价值及副产物可利用性的研究现状[J]. 食品科技, 2018, 43(3): 113-116. GUO R, ZHANG X M, SU H, et al. The research status of nutrition value and by-products ultilization of puffer fish[J]. Food Science and Technology, 2018, 43(3): 113-116. |
| [7] |
徐萌.斑点叉尾鮰鱼皮胶原蛋白的提取与制膜研究[D].上海: 上海海洋大学, 2016. XU M. Isolation of collagen and prepration of edible film from skin of channel catfish[D]. Shanghai: Shanghai Ocean University, 2016. |
| [8] |
陈丽丽, 赵利, 刘华, 等. 水产品胶原蛋白的研究进展[J]. 食品研究与开发, 2012, 33(1): 205-208. CHEN L L, ZHAO L, LIU H, et al. A review on the advance in aquatic collagen research[J]. Food Research and Development, 2012, 33(1): 205-208. DOI:10.3969/j.issn.1005-6521.2012.01.057 |
| [9] |
蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 256-271. JIANG T D. Collagen and collagen[M]. Beijing: Chemical Industry Press, 2006: 256-271. |
| [10] |
钱国宏. 夏季吃"鱼冻"[J]. 农产品加工, 2012(5): 31. QIAN G H. Eat "fish jelly" in summer[J]. Agricultural Products Processing Journal, 2012(5): 31. |
| [11] |
刘晓宁, 刘安军, 曹东旭, 等. 鱼鳞胶原蛋白的提取鉴定初探[J]. 食品研究与开发, 2007, 28(1): 56-60. LIU X N, LIU A J, CAO D X, et al. A primary research-the extraction and qualitative analysis of fish scale collagen[J]. Food Research and Development, 2007, 28(1): 56-60. DOI:10.3969/j.issn.1005-6521.2007.01.018 |
| [12] |
ARNESEN J A, GILDBERG A. Extraction and characterisation of gelatine from Atlantic salmon (Salmo salar) skin[J]. Bioresource Technology, 2007, 98(1): 53-57. DOI:10.1016/j.biortech.2005.11.021 |
| [13] |
ISWARIYA S, VELSWAMY P, UMA T S, et al. Isolation and characterization of biocompatible collagen from the skin of puffer fish (Lagocephalus inermis)[J]. Journal of Polymers and the Environment, 2018, 26(5): 2086-2095. DOI:10.1007/s10924-017-1107-1 |
| [14] |
易翠平, 祝波, 钟春梅. 鳡鱼副产品制备鱼冻的研究[J]. 食品工业科技, 2014, 35(15): 193-195. YI C P, ZHU B, ZHONG C M. Preparation of fish jelly from Elopichthys bambusa byproduct[J]. Science and Technology of Food Industry, 2014, 35(15): 193-195. |
| [15] |
顾杨娟.草鱼鱼鳞冻的制备及其性质研究[D].上海: 上海海洋大学, 2013. GU Y J. Processing optimization and characterization of jelly from grass carp fish scales[D]. Shanghai: Shanghai Ocean University, 2013. |
| [16] |
安然.即食鱼皮胶冻加工工艺研究[D].福州: 福建农林大学, 2013. AN R. Study on processing technology of ready-to-eat fish-skin jelly[D]. Fuzhou: Fujian Agriculture and Forestry University, 2013. |
| [17] |
王雅菲.鲟鱼鱼皮胶冻加工工艺研究[D].大连: 大连工业大学, 2017. WANG Y F. Study on processing technology of edible gelatin products of sturgeon skin[D]. Dalian: Dalian Polytechnic University, 2017. |
| [18] |
李罗明, 王传花, 郑兵福, 等. 淡水鱼加工副产品中蛋白质提取及鱼冻的配方研究[J]. 食品与机械, 2008, 24(4): 119-123. LI L M, WANG C H, ZHENG B F, et al. Research about progress and formulation of fish gel with byproducts of freshwater fish processing[J]. Food & Machinery, 2008, 24(4): 119-123. |
| [19] |
米顺利, 易湘茜, 李俊豪, 等. 鳕鱼皮胶原蛋白肽即食凝胶的研制[J]. 广西科学, 2018, 25(1): 94-99. MI S L, YI X X, LI J H, et al. The development of cod skin collagen peptide ready-to-eat gel[J]. Guangxi Sciences, 2018, 25(1): 94-99. |
| [20] |
高瑷, 王华杰. 罗非鱼鱼皮制备鱼皮胶冻工艺研究[J]. 食品工业, 2010(4): 41-42. GAO Y, WANG H J. Research on the tilapia oreochromis skin for making gelatin[J]. The Food Industry, 2010(4): 41-42. DOI:10.3969/j.issn.1672-5026.2010.04.012 |
| [21] |
MUYONGA J H, COLE C G B, DUODU K G. Extraction and physico-chemical characterisation of Nile perch (Lates niloticus) skin and bone gelatin[J]. Food Hydrocolloids, 2004, 18(4): 581-592. DOI:10.1016/j.foodhyd.2003.08.009 |
| [22] |
NORMAH I, MUHAMMAD FAHMI I. Physicochemical characteristics of gummy added with sutchi catfish (Pangasius hypophthalmus) gelatin[J]. International Food Research Journal, 2015, 22(3): 1059-1066. |
| [23] |
KASANKALA L M, XUE Y, WEILONG Y, et al. Optimization of gelatine extraction from grass carp (Catenopharyngodon idella) fish skin by response surface methodology[J]. Bioresource Technology, 2007, 98(17): 3338-3343. DOI:10.1016/j.biortech.2006.03.019 |
| [24] |
BENJAKUL S, OUNGBHO K, VISESSANGUAN W, et al. Characteristics of gelatin from the skins of bigeye snapper, Priacanthus tayenus and Priacanthus macracanthus[J]. Food Chemistry, 2009, 116(2): 445-451. DOI:10.1016/j.foodchem.2009.02.063 |
| [25] |
BORAN G, MULVANEY S J, REGENSTEIN J M. Rheological properties of gelatin from silver carp skin compared to commercially available gelatins from different sources[J]. Journal of Food Science, 2010, 75(8): E565-E571. DOI:10.1111/j.1750-3841.2010.01543.x |
| [26] |
姚峰.热水提取鱼皮明胶特性及其成膜性能的研究[D].厦门: 集美大学, 2017. YAO F. Study on properties and film-forming ability of tilapia skin gelatin by hot-water extraction[D]. Xiamen: JiMei University, 2017. |
| [27] |
张笑, 刘杰, 陈翠岚. 比色法测定明胶中的L-羟脯氨酸[J]. 食品安全质量检测学报, 2010, 27(3): 124-127. ZHANG X, LIU J, CHEN C L. Determination of L-hydroxyproline in Gelatin by colorimetry mehod[J]. Journal of Food Safety and Quality, 2010, 27(3): 124-127. |
| [28] |
顾杨娟, 李杰, 李富威, 等. 鱼鳞冻水法制备工艺及性质的研究[J]. 食品工业科技, 2013, 34(8): 312-316. GU Y J, LI J, LI F W, et al. Study on processing and properties of fish scale jelly produced by heating in water[J]. Science and Technology of Food Industry, 2013, 34(8): 312-316. |
| [29] |
SU X R, SUN B, LI Y Y, et al. Characterization of acid-soluble collagen from the coelomic wall of Sipunculida[J]. Food Hydrocolloids, 2009, 23(8): 2190-2194. DOI:10.1016/j.foodhyd.2009.05.013 |
| [30] |
BAE I, OSATOMI K, YOSHIDA A, et al. Biochemical properties of acid-soluble collagens extracted from the skins of underutilised fishes[J]. Food Chemistry, 2008, 108(1): 49-54. DOI:10.1016/j.foodchem.2007.10.039 |
| [31] |
张强, 王倩倩, 陆剑锋, 等. 不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J]. 现代食品科技, 2014, 30(5): 104-110. ZHANG Q, WANG Q Q, LU J F, et al. Comparison of physical and chemical characteristics of collagen from silver carp skin using different extraction methods[J]. Modern Food Science & Technology, 2014, 30(5): 104-110. |
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


