2. 上海海洋大学 农业农村部鱼类营养与环境生态研究中心, 上海 201306;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306
草鱼(Ctenopharyngodon idella)是我国重要的淡水养殖鱼类,2019年产量达到533.3万t[1]。在广东地区,有以投喂蚕豆饲养脆化草鱼的生产方式。研究表明,脆化草鱼的肌肉特性与普通草鱼相比发生极大改变,其中硬度、咀嚼性和弹性等显著增加[2-3],肌纤维直径减小、密度增大[4]。近年来有报道[5]指出,以浸泡豌豆饲喂草鱼,也可以在一定程度上改善草鱼的肌肉品质。摄食蚕豆[6-7]和豌豆[5]均使得草鱼肌肉中的胶原蛋白含量显著提高。
发芽处理能够有效地降低蚕豆中部分抗营养因子的含量,提高蛋白质和淀粉的消化率,增加一些微量营养元素的含量,从而对蚕豆的生物学效价和保健功能有一定的增强作用[8-10]。本实验室前期的实验[11-12]也表明,投喂发芽蚕豆较浸泡蚕豆可以提升草鱼的生长性能,改善肌肉品质。投喂发芽豌豆对草鱼的作用效果如何,发芽豌豆与发芽蚕豆相比,其作用效果又是如何,目前均未见相关报道。
本实验以草鱼为研究对象,分别投喂普通配合饲料、发芽蚕豆和发芽豌豆,探讨发芽蚕豆与发芽豌豆对草鱼生长性能、肌肉品质以及Ⅰ型胶原蛋白基因COL1A1和COL1A2 mRNA表达的影响,为草鱼肌肉品质的改善提供研究基础。
1 材料与方法 1.1 实验设计与实验饲料本实验共设对照组(普通配合饲料)、发芽蚕豆组(germinated broad bean,GBB)和发芽豌豆组(germinated pea,GP)3个处理组。蚕豆产地为湖北省荆州市,豌豆产地为江苏省宿迁市。
发芽蚕豆组:将干蚕豆清洗除杂,放入清水中浸泡12 h,然后在室温、避光的条件下均匀地铺开,定时喷洒少量清水使其保持湿润,直至其发芽。将发芽蚕豆切成小块后直接投喂。
发芽豌豆处理步骤同蚕豆,豌豆发芽后直接投喂。
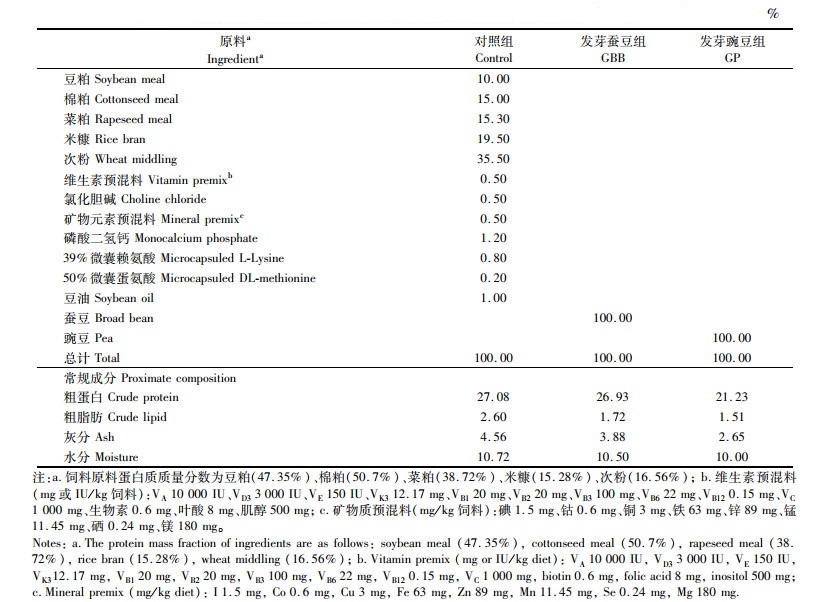
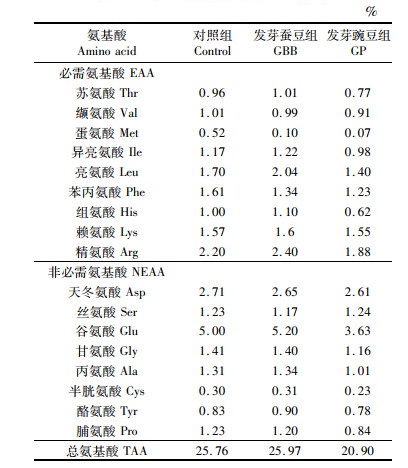
对于基础配合饲料,原料经粉碎、过筛(40目)、称量后,逐级混匀。用环模颗粒饲料机(HKJ-218,无锡市华明机器厂,中国)制成粒径2.5 mm的沉性颗粒饲料(制粒温度70~75 ℃),冷却风干后储存于阴凉干燥处。实验饲料的成分和营养组成见表 1,氨基酸组成见表 2。
|
表 1 实验饲料成分及营养组成(风干质量) Tab.1 Ingredients and proximate composition of experimental diets (air-dry mass) |
|
表 2 实验饲料氨基酸组成(干物质) Tab.2 Amino acid composition of the experimental diets (dry matter) |
实验用鱼取自上海市金山区水产良种场。草鱼运输至实验基地后,使用普通配合饲料暂养、驯化7 d。实验开始前,挑选135尾规格均一、体质健壮的草鱼[体质量(1 056.1±30.3)g]随机平均分配,安置于室内水泥养殖池(5.0 m×3.0 m×1.2 m)的9个网箱(3.0 m×1.0 m×1.2 m)中,每养殖池3个网箱,每网箱15尾鱼。
养殖实验期间每天于08:00、12:00和16:30各投喂1次,每日的投饲率为鱼体质量的1.0%~1.5%,同一处理组的各网箱投饲水平基本控制一致。具体的投喂量会根据每天的天气、水温、实际摄食情况等进行适当调整,保证投喂后20 min网箱底部无残饵。养殖水体持续通气,水深保持1.0 m,每4天更换1/2池水,每7天进行1次吸污,并补足水位。实验期间,水温25~30 ℃,溶氧≥5.0 mg/L,pH 7.5~8.0,氨氮≤0.2 mg/L,亚硝酸盐≤0.1 mg/L。养殖实验在上海海洋大学滨海养殖基地进行,共持续84 d。
1.3 样品采集养殖实验结束前24 h停止投喂,统计每网箱草鱼尾数,利用渔用麻醉剂(MS-222,盛源水产用品有限公司,中国)使其安定,称量总质量(精确至0.1 g)。每个网箱随机取3尾鱼,分别测量体质量、体长;立即解剖并分别称量内脏质量、肝脏质量和肠脂质量(分别精确至0.1 cm与0.01 g)。
从鱼体左侧采集侧线下方的皮肤和腹部肌肉,并置于-80 ℃冰箱保存,用于测定肌肉常规成分、氨基酸以及胶原蛋白含量。取右侧侧线下方的腹肌(3块,约3 g/块)进行系水力的测定,并从同一侧采集肌肉样品(0.5 cm×0.5 cm×2.0 cm)保存在Bouin’s固定液中。
此外,每网箱随机另取3尾鱼(即每处理组共9尾),取其皮肤、肌肉和肝脏分装入RNA free离心管,立即置于液氮中冷冻。经24 h转入-80 ℃冰箱长期保存,用于提取各组织总RNA。
1.4 指标测定方法 1.4.1 生长指标与形体指标生长指标与形体指标包括成活率、增长体质量、饲料系数、脏体指数、肝体指数、肠脂比和肥满度,具体公式如下:
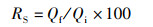 (1)
(1)
式中:RS为成活率,%;Qf为末期存活尾数;Qi为初始尾数。
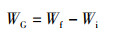 (2)
(2)
式中:WG为增长体质量,g;Wf为末期鱼体质量,g;Wi为初始鱼体质量,g。
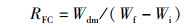 (3)
(3)
式中:RFC为饲料系数;Wdm为摄食饲料干物质质量,g;Wf为末期鱼体质量,g;Wi为初始鱼体质量,g。
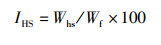 (4)
(4)
式中:IHS为脏体指数,%;Whs为内脏总质量,g;Wf为末期鱼体质量,g。
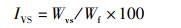 (5)
(5)
式中:IVS为肝体指数,%;Wvs为肝脏质量,g;Wf为末期鱼体质量,g。
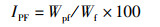 (6)
(6)
式中:IPF为肠脂比,%;Wpf为肠脂质量,g;Wf为末期鱼体质量,g。
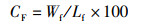 (7)
(7)
式中:CF为肥满度;Wf为末期鱼体质量,g;Lf为末期鱼体体长,cm。
1.4.2 常规成分参考AOAC[13]测定饲料与草鱼肌肉的水分、粗蛋白和灰分含量:水分含量通过105 ℃常压烘干至恒重测定;粗蛋白含量采用凯氏定氮法,使用自动凯氏定氮仪(Kjeltec 2300,FOSS,瑞典)测定;灰分含量在550 ℃马弗炉高温灼烧6 h测得。
粗脂肪含量采用氯仿-甲醇浸提法测定。称取约5 g样品放于具塞三角瓶中,加60 mL氯仿-甲醇混合液[V(氯仿):V(甲醇)=2:1],60 ℃水浴1 h,用布氏漏斗过滤,取滤液放于另一具塞三角瓶,70 ℃水浴,至三角瓶内物料显浓稠态,加入25 mL乙醚,15 g无水硫酸钠,加塞振荡10 min。移入具塞离心管中,以3 000 r/min离心5 min。取澄清的醚层10 mL,蒸发去除乙醚后,置于105 ℃烘箱中1 h。粗脂肪含量计算如下:
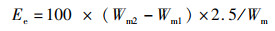 (8)
(8)
式中:Ee为粗脂肪质量分数,%;Wm为样品质量,g;Wm2为称量瓶与粗脂肪总质量,g;Wm1为称量瓶质量,g;2.5为系数(25 mL乙醚中取10 mL进行干燥)。
1.4.3 氨基酸组成饲料的氨基酸(水解)组成使用氨基酸自动分析仪(S-433D,Sykam,德国)测定。样品处理方法:将饲料样品冷冻干燥至质量恒定,称取70 mg干物质,加入10 mL 6 mol/L HCL,在安瓿瓶中真空110 ℃水解24 h。冷却后,取0.5 mL水解液烘干,加5 mL样品稀释液稀释,经0.22 μm滤膜过滤注入进样瓶,上机检测。蛋氨酸(甲硫氨酸,Met)的测定用过甲酸在55 ℃下水解15 min,水解产物注入钠交换柱进行分析测定。
1.4.4 总胶原蛋白含量参照AOAC[13]先测定样品总羟脯氨酸(Hyp)含量,总胶原蛋白含量可用羟脯氨酸含量乘以换算系数8得到。组织中总羟脯氨酸含量的测定,采用碱水解法,按试剂盒(A030-2,南京建成生物工程有限公司)说明操作。
1.4.5 肌肉系水力蒸失水率:取约3 g肌肉鲜样,纱布包裹防止松散,置于沸水锅上蒸5 min,准确计时。取出冷却,用吸水纸轻轻吸干表面水分,称量。
离心失水率:取约3 g肌肉鲜样,放入5 mL离心管,离心管底部预先垫入吸水纸,经3 000 r/min离心10 min。取出后轻轻吸干表面水分,称量。
冷冻失水率:取约3 g肌肉鲜样,分别装入密封袋,-20 ℃冻存24 h。取出肌肉,室温解冻15 min,轻轻吸干表面水分,称量。
据此分别计算肌肉的蒸、离心和冷冻失水率:
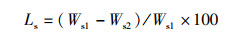 (9)
(9)
式中:Ls为肌肉蒸失水率,%;Ws1为肌肉蒸前质量,g;Ws2为肌肉蒸后质量,g。
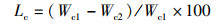 (10)
(10)
式中:Lc为肌肉离心失水率,%;Wc1为肌肉离心前质量,g;Wc2为肌肉离心后质量,g。
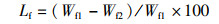 (11)
(11)
式中:Lf为肌肉冷冻失水率,%;Wf1为肌肉冷冻前质量,g;Wf2为肌肉冷冻后质量,g。
1.4.6 肌肉组织学将固定完成的肌肉样品用不同浓度的乙醇、乙醇-二甲苯混合液、二甲苯进行逐级脱水、透明,接着进行浸蜡、包埋、切片(横切,7 μm;RM2245,Leica,德国),并在染色后装片,染色剂选用苏木精-伊红。用装有成像系统的光学显微镜(Eclipse 80i,Nikon,日本)观察并拍照,切片上每个样品在不同区域拍照6张(每处理组样本数目n≥36),结合相片视野面积计算出肌纤维的密度和直径。
1.4.7 肌肉质构使用质构分析仪(Universal TA,上海腾跋仪器科技有限公司)进行肌肉质构(TPA)分析。主要数据包括硬度、咀嚼性、黏聚性、弹性和回复性等。取草鱼侧线下方同一位置肌肉3块(长、宽、高均为1.5 cm左右),立即进行检测(每处理组9尾鱼)。选用25 mm×25 mm柱形探头,接触感应力5 gf,测试速度1 mm/s,目标模式为形变,形变量30%,时间2 s。
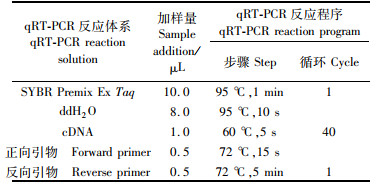
1.4.8 胶原蛋白基因表达使用RNAiso Plus试剂(TaKaRa,日本)提取肌肉、皮肤和肝脏的总RNA。经DNase处理,用PrimeScript RT试剂(TaKaRa,日本)反转录合成cDNA单链。参考相关文献[14-15]合成引物,以草鱼18S rRNA为内参基因(表 3)进行荧光定量。试剂盒选用SYBR Green Premix Ex Taq(TaKaRa,日本),荧光定量仪使用CFX96 Touch real-time PCR(Bio-rad,美国)。qRT-PCR反应体系及扩增程序见表 4。最后需经过95 ℃ 15 s,后60~95 ℃每5 s升温0.5 ℃,进行溶解曲线检测,每个样本重复3次。以对照组草鱼组织的表达量为校准,用CT法(2-ΔΔCt)计算组织中Ⅰ型胶原蛋白基因COL1A1和COL1A2 mRNA的相对表达量。

|
表 3 荧光定量引物 Tab.3 Primers for qRT-PCR |
|
表 4 qRT-PCR反应体系及程序设定 Tab.4 qRT-PCR reaction system and program setting |
实验数据采用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),结果以平均值±标准差(Mean±SD)的形式表示。显著水平P设为0.05,若差异显著(P<0.05),则用Duncan’s法进行多重比较检验。
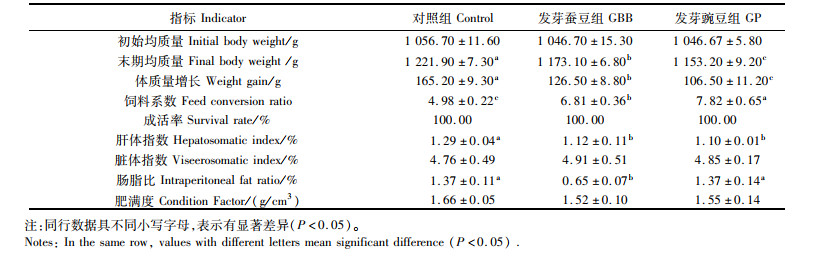
2 结果 2.1 生长性能养殖期间,各组草鱼无死亡发生。与对照组相比,发芽蚕豆、发芽豌豆组草鱼的体质量增长和肝体指数显著降低,饲料系数显著升高(P<0.05)。此外,发芽蚕豆组草鱼的体质量增长高于发芽豌豆组,而饲料系数和肠脂比显著低于发芽豌豆组(P<0.05)。各处理组草鱼脏体指数和肥满度没有显著差异(P>0.05)。见表 5。
|
表 5 发芽蚕豆与发芽豌豆对草鱼生长性能的影响 Tab.5 Effects of germinated broad bean and germinated pea on growth performance of grass carp |
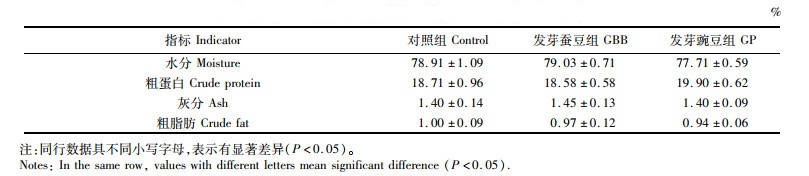
由表 6可知,投喂不同饲料84 d对各组草鱼肌肉常规成分(包括水分、粗蛋白、灰分和粗脂肪)含量没有造成显著影响(P>0.05)。
|
表 6 发芽蚕豆与发芽豌豆对草鱼肌肉组成的影响(湿质量) Tab.6 Effects of germinated broad bean and germinated pea on flesh proximate composition of grass carp (wet mass) |
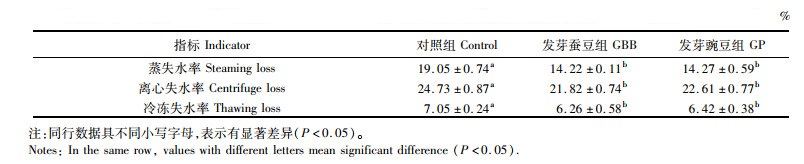
与对照组相比,投喂发芽蚕豆和发芽豌豆均使得草鱼肌肉的蒸、离心和冷冻失水率显著降低(P<0.05), 发芽蚕豆和发芽豌豆组在失水率上无显著差异(P>0.05),见表 7。
|
表 7 发芽蚕豆与发芽豌豆对草鱼肌肉系水力的影响 Tab.7 Effects of germinated broad bean and germinated pea on flesh water holding capacity of grass carp |
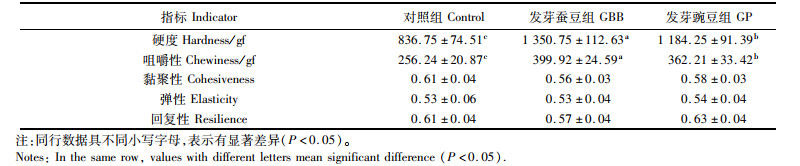
由表 8可知,发芽蚕豆和发芽豌豆组草鱼肌肉的硬度与咀嚼性均较对照组显著提高(P<0.05),而发芽蚕豆组这两项指标显著高于发芽豌豆组(P<0.05), 各处理组草鱼肌肉的粘聚性、弹性和回复性没有显著差异(P>0.05)。
|
表 8 发芽蚕豆与发芽豌豆对草鱼肌肉质构的影响 Tab.8 Effects of germinated broad bean and germinated pea on flesh TPA of grass carp |
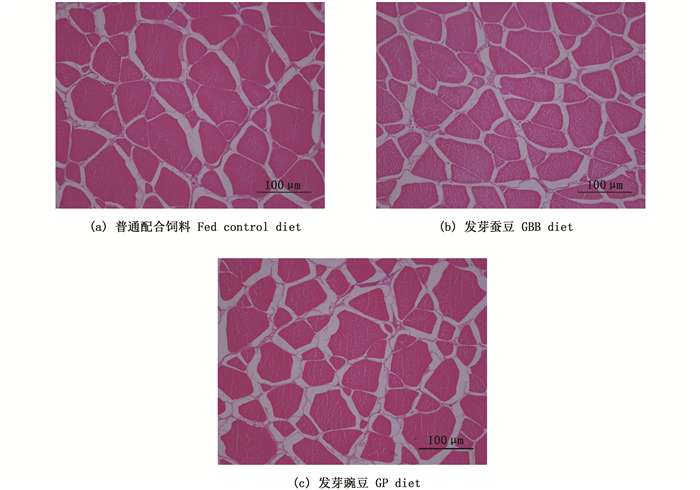
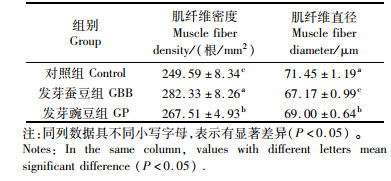
如图 1和表 9所示,投喂发芽蚕豆和发芽豌豆使得草鱼肌纤维的密度较对照组显著提高,直径显著减小(P<0.05)。其中,发芽蚕豆组草鱼肌纤维密度高于发芽豌豆组(P<0.05)。
|
图 1 投喂普通配合饲料,发芽蚕豆及发芽豌豆84 d草鱼肌纤维组织结构 Fig. 1 Muscular microstructure of grass carp fed Control, GBB or GP diet for 84 days |
|
表 9 发芽蚕豆与发芽豌豆对草鱼肌纤维密度和直径的影响 Tab.9 Effects of germinated broad bean and germinated pea on muscle fiber density & diameter of grass carp |
与对照组相比,发芽蚕豆和发芽豌豆组草鱼肌肉中的胶原蛋白含量显著增加(P<0.05),但二者之间没有显著差异,各组草鱼在皮肤和肝脏的胶原蛋白含量上没有表现出显著差异(P>0.05),见表 10。
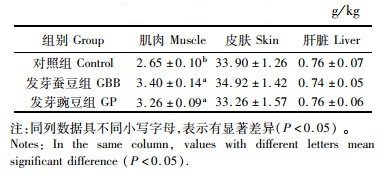
|
表 10 发芽蚕豆与发芽豌豆对草鱼组织胶原蛋白含量的影响(湿质量) Tab.10 Effects of germinated broad bean and germinated pea on collagen content in tissues of grass carp(wet mass) |
由表 11可知,投喂发芽蚕豆和发芽豌豆显著提高了草鱼肌肉和皮肤中Ⅰ型胶原蛋白基因COL1A1和COL1A2 mRNA的相对表达量(P<0.05),且发芽蚕豆组两基因的相对表达量显著高于发芽豌豆组(P<0.05),各组草鱼肝脏中两种基因的表达量没有显著差异(P>0.05)。
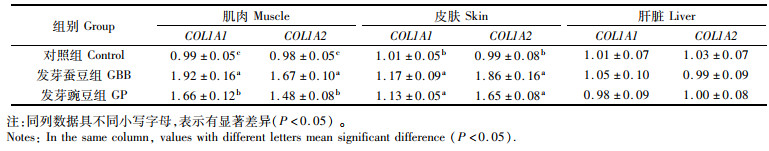
|
表 11 发芽蚕豆与发芽豌豆对草鱼组织COL1A1和COL1A2基因表达的影响 Tab.11 Effects of germinated broad bean and germinated pea on COL1A1 and COL1A2 gene expression in tissues of grass carp |
本实验中,尽管发芽蚕豆和普通配合饲料的常规成分相差不大,但饲喂发芽蚕豆草鱼的生长性能较对照组显著降低,这与前人的报道[6, 11-12]一致。其原因主要是蚕豆的氨基酸平衡较差[7, 16],蛋氨酸的含量很低,碳水化合物含量高,而脂肪含量比较低[17],无法满足草鱼的营养需求;另一方面,蚕豆中含有单宁、植酸、血细胞凝集素和胰蛋白酶抑制剂等抗营养因子[18],它们降低了鱼体内消化酶的活性[6, 11-12],对营养物质的消化和吸收产生负面影响。此外,蚕豆还诱导了草鱼肠道炎症的发生[19]。
与蚕豆一样,豌豆中也存在着这些抗营养因子,从而降低了豌豆的生物利用率[20];此外,发芽豌豆的粗蛋白质量分数为21.23%,脂肪质量分数为1.51%(表 1),蛋氨酸含量低于发芽蚕豆(表 2),从这点来看,发芽豌豆的营养价值不及发芽蚕豆。所以,发芽豌豆组草鱼的生长性能比发芽蚕豆组低。秦志清[5]比较了浸泡蚕豆和浸泡豌豆对草鱼的作用效果,也发现浸泡豌豆组草鱼的体质量增长和饲料利用低于浸泡蚕豆组。
本实验所用的草鱼初始体质量为(1 056.1±30.3)g,各组草鱼的体质量增长较慢,其原因可能是室内水泥池和网箱的空间有限,而大规格草鱼对声音与光线敏感,日常管理中的吸污、换水等工作对其产生了一定的应激。今后应在大水体中开展大规格草鱼的养殖实验,以获得更好的生长效果。
3.2 发芽蚕豆与发芽豌豆对草鱼肌肉品质的影响通常来说,肌肉中较低的粗脂肪含量会使得肌束间存在较大的摩擦力,肌肉的剪切力就会较高,意味着较高的咀嚼性[21]。相比于普通草鱼,投喂浸泡蚕豆与发芽蚕豆都显著降低了草鱼肌肉中的粗脂肪含量[11-12];而肖调义等[22]和伦峰等[23]却发现,脆化草鱼肌肉的粗脂肪含量高于普通草鱼。有研究[24]表明,以蚕豆投喂草鱼,草鱼肌肉中的脂肪含量会先有所降低,之后则随饲喂时间的延长而不断上升,最终高于摄食配合饲料的草鱼。可见,草鱼肌肉中的脂肪含量与投喂的不同阶段相关。本次实验中,各组草鱼之间肌肉常规成分含量没有显著的差异。脂肪含量可能并不是构成脆化草鱼肌肉独特性质的关键因子。
系水力是衡量肌肉品质的主要指标[25],影响着肌肉和肉产品的定量与定性[26],较低的失水率意味着在贮存过程中营养与风味能更好地得到保留。肉制品的组织结构特征主要包括硬度、弹性、黏聚性、咀嚼性和回复性[27],其中对于鱼类肌肉来说最重要的评价指标是硬度[3]。本次实验中,投喂发芽蚕豆和发芽豌豆均显著增加了肌肉的硬度和咀嚼性,这在感官品尝中也得到了证实。
研究[2, 28-29]表明,商品规格脆化草鱼较普通草鱼的肌纤维直径减小、密度增加,排列更加紧密。本实验也发现,发芽蚕豆和发芽豌豆的投喂能够使草鱼的肌纤维变细,密度增大;而肌肉的硬度与咀嚼性与肌纤维密度呈正相关[30],在一定范围内,肌纤维密度越高,肌肉硬度就越大[31]。此外,随着肌纤维直径减小和密度增大,肌纤维排列更为紧密,肌肉的系水能力会相应增强[32]。
肌肉品质与肌肉胶原蛋白含量存在一定的关联[33-34],而胶原蛋白与肌肉组织结构、柔韧性和质地紧密联系[35],在很大程度上能够影响肌肉的持水能力和咀嚼性。研究[36]发现,胶原蛋白含量的增加会使肌肉具有更高的机械强度。同时,胶原蛋白可以在肌纤维之间和肌束的周围形成致密的膜鞘结构,在一定程度上减少了肌肉水分的蒸发和汁液的外渗损失,从而降低肌肉的失水率[23]。
本次实验中,与投喂配合饲料的草鱼相比,投喂发芽蚕豆和发芽豌豆的草鱼具有更高的胶原蛋白含量,肌纤维直径变细、密度增加,肌肉失水率降低,硬度和咀嚼性显著增加,这也表明了各肉质指标之间是密切联系的。
3.3 发芽蚕豆与发芽豌豆对草鱼Ⅰ型胶原蛋白基因表达的影响胶原蛋白家族至少含有19种被正式定义为胶原蛋白的蛋白质[37],存在于鲤(Cyprinus carpio)、日本鳗鲡(Anguilla japonica)、西伯利亚鲟(Acipenser baeri Brandt)和斑点猫鲨(Scyliorhinus canicula)肌肉结缔组织中的主要形式是Ⅰ型(Collagen Ⅰ)[38-39]。Ⅰ型胶原蛋白是脊椎动物机体中含量最为丰富的胶原蛋白和细胞外基质的主要组分,具有调节组织分化和肌原纤维形成的作用[39-40]。它的肽链包含两条α1和1条α2链,分别由COL1A1和COL1A2基因编码[41]。草鱼的COL1A1和COL1A2蛋白含有1个或多个具有三重螺旋构象的结构域[14-15],这种三重螺旋可以聚集形成细胞外基质的结构,从而增强胶原蛋白的机械强度[42-43]。此外,草鱼的COL1A1和COL1A2蛋白具有高度的亲水性[14-15],可以促进与其他物质结合的能力,从而增强组织的功能、弹性以及系水力。LAPI RE[44]对Ⅰ型胶原蛋白的研究也得到了类似结果。
YU等[15]发现,脆化草鱼的Ⅰ型胶原蛋白基因COL1A1和COL1A2 mRNA相对表达量和蛋白表达量均显著高于普通草鱼。本研究中,投喂发芽蚕豆和发芽豌豆均对草鱼肌肉和皮肤中COL1A1和COL1A2 mRNA的相对表达量有显著的促进作用,而这两种基因在肝脏中的表达则没有显著的变化(表 11),有可能蚕豆和豌豆中的活性因子并不作用于肝脏,也有可能养殖的时间不够长,对肝脏的影响效应还没有得到体现。机体中胶原蛋白分子间存在紧密的交联结构,随着生物体不断地生长,这一结构会愈发稳定。组织中胶原蛋白的含量并不一定表现出显著的增加[45]。此外,胶原蛋白的类型繁多,其生成受到多种因素的调控,这两个基因mRNA表达量的上调只能表现分子转录水平的变化情况,不一定能和总胶原蛋白含量的变化联系起来。
| [1] |
农业农村部渔业渔政管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020. Fisheries Administration Bureau of the Ministry of Agriculture and Rural Affairs. China fishery statistical yearbook[M]. Beijing: China Agriculture Press, 2020. |
| [2] |
LIN W L, ZENG Q X, ZHU Z W. Different changes in mastication between crisp grass carp (Ctenopharyngodon idellus C. et V) and grass carp (Ctenopharyngodon idellus) after heating:the relationship between texture and ultrastructure in muscle tissue[J]. Food Research International, 2009, 42(2): 271-278. DOI:10.1016/j.foodres.2008.11.005 |
| [3] |
LIN W L, ZENG Q X, ZHU Z W, et al. Relation between protein characteristics and TPA texture characteristics of crisp grass carp (Ctenopharyngodon idellus C. et V) and grass carp (Ctenopharyngodon idellus)[J]. Journal of Texture Studies, 2012, 43(1): 1-11. DOI:10.1111/j.1745-4603.2011.00311.x |
| [4] |
林婉玲, 关熔, 曾庆孝, 等. 影响脆肉鲩鱼背肌质构特性的因素[J]. 华南理工大学学报(自然科学版), 2009, 37(4): 134-137. LIN W L, GUAN R, ZENG Q X, et al. Factors affecting textural characteristics of dorsal muscle of crisp grass carp[J]. Journal of South China University of Technology (Natural Science Edition), 2009, 37(4): 134-137. DOI:10.3321/j.issn:1000-565X.2009.04.027 |
| [5] |
秦志清. 不同饲料原料对草鱼生长和肌肉品质的影响[J]. 福建水产, 2010(1): 81-85. QIN Z Q. Effects of feeding different raw materials on growth and flesh quality of grass carp Ctenopharyngodon idellus[J]. Journal of Fujian Fisheries, 2010(1): 81-85. DOI:10.3969/j.issn.1006-5601.2010.01.021 |
| [6] |
郑小淼, 李小勤, 魏静, 等. 蚕豆、大巢菜籽及苦瓜籽饲料对草鱼生长、肌肉成分、组织生化指标和消化酶活性的影响[J]. 中国水产科学, 2016, 23(2): 370-381. ZHENG X M, LI X Q, WEI J, et al. Effects of broad bean, common vetch seed and bitter melon seed diets on the growth, flesh composition, tissue indices and digestive enzymes of grass carp[J]. Journal of Fishery Sciences of China, 2016, 23(2): 370-381. |
| [7] |
刘邦辉, 王广军, 郁二蒙, 等. 投喂蚕豆和普通配合饲料草鱼肌肉营养成分比较分析及营养评价[J]. 南方水产科学, 2011, 7(6): 58-65. LIU B H, WANG G J, YU E M, et al. Comparison and evaluation of nutrition composition in muscle of grass carp Ctenopharyngodon idellus fed with broad bean and common compound feed[J]. South China Fisheries Science, 2011, 7(6): 58-65. DOI:10.3969/j.issn.2095-0780.2011.06.010 |
| [8] |
VIDAL-VALVERDE C, FRIAS J, SOTOMAYOR C, et al. Nutrients and antinutritional factors in faba beans as affected by processing[J]. Zeitschrift für Lebensmitteluntersuchung und-Forschung A, 1998, 207(2): 140-145. DOI:10.1007/s002170050308 |
| [9] |
吴海虹, 宋江峰, 李大婧, 等. 发芽处理对蚕豆主要营养成分与抗营养因子的影响[J]. 食品科学, 2012, 33(9): 110-113. WU H H, SONG J F, LI D J, et al. Effect of germination on major nutrients and anti-nutrients in faba bean (Vicia faba L.)[J]. Food Science, 2012, 33(9): 110-113. |
| [10] |
王婷婷, 刘嘉坤, 李岩. 发芽处理对蚕豆主要成分和γ-氨基丁酸的影响[J]. 食品研究与开发, 2017, 38(1): 6-9. WANG T T, LIU J K, LI Y. Effects of germination on major components and GABA in broad bean[J]. Food Research and Development, 2017, 38(1): 6-9. DOI:10.3969/j.issn.1005-6521.2017.01.002 |
| [11] |
李宝山, 冷向军, 李小勤, 等. 投饲蚕豆对草鱼生长和肌肉品质的影响[J]. 中国水产科学, 2008, 15(6): 1042-1049. LI B S, LENG X J, LI X Q, et al. Effects of feeding broad bean on growth and flesh quality of grass carp Ctenopharyngodon idellus[J]. Journal of Fishery Sciences of China, 2008, 15(6): 1042-1049. DOI:10.3321/j.issn:1005-8737.2008.06.019 |
| [12] |
李宝山, 冷向军, 李小勤, 等. 投饲蚕豆对不同规格草鱼生长、肌肉成分和肠道蛋白酶活性的影响[J]. 上海水产大学学报, 2008, 17(3): 310-315. LI B S, LENG X J, LI X Q, et al. Effects of feeding broad bean on growth, muscle composition and intestine protease activity of different sizes of grass carp, Ctenopharyngodon idella[J]. Journal of Shanghai Fisheries University, 2008, 17(3): 310-315. |
| [13] |
Association of Official Analytical Chemists. Official methods of analysis of the Association of official analytical chemists international[M]. 17th ed. Arlington: Association of Official Analytical Chemists, 2000.
|
| [14] |
刘邦辉, 郁二蒙, 王广军, 等. 草鱼Ⅰ型胶原蛋白α1基因cDNA全序列克隆、组织分布及其生物信息学分析[J]. 水产学报, 2012, 36(6): 849-858. LIU B H, YU E M, WANG G J, et al. Cloning, mRNA expression and bioinformatic analysis of full length type I collagen alpha 1 cDNA from grass carp (Ctenopharyngodon idellus)[J]. Journal of Fisheries of China, 2012, 36(6): 849-858. |
| [15] |
YU E M, LIU B H, WANG G J, et al. Molecular cloning of type I collagen cDNA and nutritional regulation of type I collagen mRNA expression in grass carp[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(4): 755-765. DOI:10.1111/jpn.12132 |
| [16] |
甘承露, 郭姗姗, 荣建华, 等. 脆肉鲩肌肉主要营养成分的分析[J]. 营养学报, 2010, 32(5): 513-515. GAN C L, GUO S S, RONG J H, et al. Analysis of the main nutritional components of crisp grass carp[J]. Acta Nutrimenta Sinica, 2010, 32(5): 513-515. |
| [17] |
WU C F, LIN J J, BIAN X C, et al. Nutritional value and application of broad bean nutrition flour as a combination of staple food[J]. Agricultural Science & Technology, 2015, 16(6): 1280-1285. |
| [18] |
FRANCIS G, MAKKAR H P S, BECKER K. Antinutritional factors present in plant-derived alternate fish feed ingredients and their effects in fish[J]. Aquaculture, 2001, 199(3/4): 197-227. |
| [19] |
LI Z F, YU E M, WANG G J, et al. Broad bean (Vicia faba L.) induces intestinal inflammation in grass carp (Ctenopharyngodon idellus C. et V) by increasing relative abundances of intestinal gram-negative and flagellated bacteria[J]. Frontiers in Microbiology, 2018, 9: 1913. DOI:10.3389/fmicb.2018.01913 |
| [20] |
亓美玉, 孙芳, 姚玉昌, 等. 豌豆在畜禽饲料中的应用[J]. 中国饲料, 2014(1): 41-44. QI M Y, SUN F, YAO Y C, et al. The application of pea in livestock feed[J]. China Feed, 2014(1): 41-44. DOI:10.3969/j.issn.1004-3314.2014.01.016 |
| [21] |
GRIGORAKIS K, ALEXIS M N. Effects of fasting on the meat quality and fat deposition of commercial-size farmed gilthead sea bream (Sparus aurata, L.) fed different dietary regimes[J]. Aquaculture Nutrition, 2005, 11(5): 341-344. DOI:10.1111/j.1365-2095.2005.00351.x |
| [22] |
肖调义, 刘建波, 陈清华, 等. 脆肉鲩肌肉营养特性分析[J]. 淡水渔业, 2004, 34(3): 28-30. XIAO T Y, LIU J B, CHEN Q H, et al. Analysis of nutritive composition in muscle of crisped grass carp[J]. Freshwater Fisheries, 2004, 34(3): 28-30. DOI:10.3969/j.issn.1000-6907.2004.03.009 |
| [23] |
伦峰, 冷向军, 李小勤, 等. 投饲蚕豆对草鱼生长和肉质影响的初步研究[J]. 淡水渔业, 2008, 38(3): 73-76. LUN F, LENG X J, LI X Q, et al. Effect of feeding broad bean on growth and flesh quality of grass carp (Ctenopharyngodon idella)[J]. Freshwater Fisheries, 2008, 38(3): 73-76. DOI:10.3969/j.issn.1000-6907.2008.03.014 |
| [24] |
李道友.草鱼脆化养殖过程中的肌肉特性及脆性表征[D].武汉: 华中农业大学, 2011. LI D Y. Muscle prperties of grass carp during crisping cultivation and characterization of crispness[D]. Wuhan: Huazhong Agricultural University, 2011. |
| [25] |
BRINKER A, REITER R. Fish meal replacement by plant protein substitution and guar gum addition in trout feed, Part Ⅰ:effects on feed utilization and fish quality[J]. Aquaculture, 2011, 310(3/4): 350-360. |
| [26] |
KAUFFMAN R G, EIKELENBOOM G, VAN DER WAL P G, et al. The use of filter paper to estimate drip loss of porcine musculature[J]. Meat Science, 1986, 18(3): 191-200. DOI:10.1016/0309-1740(86)90033-1 |
| [27] |
BOURNE M C. Basic principles of food texture measurement[M]//FARIDI H, FAUBION J M. Dough Rheology and Baked Product Texture. Boston: Springer, 1990: 331-341.
|
| [28] |
刘建波, 陈开健, 佘曙明, 等. 脆肉鲩肌肉超微结构分析[J]. 水利渔业, 2005, 25(3): 65-67. LIU J B, CHEN K J, SHE S M, et al. Ultrastructural analysis on muscle of crisp grass carp[J]. Reservoir Fisheries, 2005, 25(3): 65-67. DOI:10.3969/j.issn.1003-1278.2005.03.031 |
| [29] |
李忠铭, 冷向军, 李小勤, 等. 脆化草鱼生长性能、肌肉品质、血清生化指标和消化酶活性分析[J]. 江苏农业科学, 2012, 40(3): 186-189. LI Z M, LENG X J, LI X Q, et al. Analysis on growth performance, flesh quality, serum biochemical indices, and digestive enzyme activities of crisp grass carp[J]. Jiangsu Agricultural Sciences, 2012, 40(3): 186-189. DOI:10.3969/j.issn.1002-1302.2012.03.074 |
| [30] |
JOHNSTON I A, ALDERSON R, SANDHAM C, et al. Patterns of muscle growth in early and late maturing populations of Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2000, 189(3/4): 307-333. |
| [31] |
HURLING R, RODELL J B, HUNT H D. Fiber diameter and fish texture[J]. Journal of Texture Studies, 1996, 27(6): 679-685. DOI:10.1111/j.1745-4603.1996.tb01001.x |
| [32] |
李玉娥. 影响肉品含水量的因素[J]. 肉类工业, 2004(7): 6-8. LI Y E. Factors affecting the moisture content of meat[J]. Meat Industry, 2004(7): 6-8. DOI:10.3969/j.issn.1008-5467.2004.07.002 |
| [33] |
SATO K, YOSHINAKA R, SATO M, et al. Collagen content in the muscle of fishes in association with their swimming movement and meat texture[J]. Nippon Suisan Gakkaishi, 1986, 52(9): 1595-1600. DOI:10.2331/suisan.52.1595 |
| [34] |
卫育良, 徐后国, 梁萌青. 水解鱼蛋白的营养特征及其在水产动物营养饲料中的研究进展[J]. 水产学报, 2019, 43(10): 2060-2073. WEI Y L, XU H G, LIANG M Q. Nutritional characteristics of fish protein hydrolysate and related research progress in aquaculture nutrition[J]. Journal of Fisheries of China, 2019, 43(10): 2060-2073. |
| [35] |
GORDON M K, HAHN R A. Collagens[J]. Cell and Tissue Research, 2010, 339(1): 247-257. DOI:10.1007/s00441-009-0844-4 |
| [36] |
常海军, 王强, 徐幸莲, 等. 肌内胶原蛋白与肉品质关系研究进展[J]. 食品科学, 2011, 32(1): 286-290. CHANG H J, WANG Q, XU X L, et al. Research progress of relationship between intramuscular collagen and meat quality[J]. Food Science, 2011, 32(1): 286-290. |
| [37] |
PROCKOP D J, KIVIRIKKO K I. Collagens:molecular biology, diseases, and potentials for therapy[J]. Annual Review of Biochemistry, 1995, 64: 403-434. DOI:10.1146/annurev.bi.64.070195.002155 |
| [38] |
YATA M, YOSHIDA C, FUJISAWA S, et al. Identification and characterization of molecular species of collagen in fish skin[J]. Journal of Food Science, 2001, 66(2): 247-251. DOI:10.1111/j.1365-2621.2001.tb11325.x |
| [39] |
SATO K, YOSHINAKA R, ITOH Y, et al. Molecular species of collagen in the intramuscular connective tissue of fish[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1989, 92(1): 87-91. DOI:10.1016/0305-0491(89)90317-9 |
| [40] |
KIMURA S, ZHU X P, MATSUI R, et al. Characterization of fish muscle type I collagen[J]. Journal of Food Science, 1988, 53(5): 1315-1318. DOI:10.1111/j.1365-2621.1988.tb09266.x |
| [41] |
GELSE K, PÖSCHL E, AIGNER T. Collagens-structure, function, and biosynthesis[J]. Advanced Drug Delivery Reviews, 2003, 55(12): 1531-1546. DOI:10.1016/j.addr.2003.08.002 |
| [42] |
VAN DER REST M, GARRONE R, HERBAGE D. Collagen:a family of proteins with many facets[J]. Advances in Molecular and Cell Biology, 1993, 6: 1-67. |
| [43] |
GROUNDS M D. Complexity of extracellular matrix and skeletal muscle regeneration[M]//SCHIAFFINO S, PARTRIDGE T. Skeletal Muscle Repair and Regeneration. Dordrecht: Springer, 2008: 269-302.
|
| [44] |
LAPIōRE C M. The ageing dermis:the main cause for the appearance of 'old' skin[J]. British Journal of Dermatology, 1990, 122(s35): 5-11. DOI:10.1111/j.1365-2133.1990.tb16119.x |
| [45] |
CARMICHAEL D J, LAWRIE R A. Bovine collagen. I. Changes in collagen solubility with animal age[J]. International Journal of Food Science & Technology, 1967, 2(4): 299-311. |
2. Centre for Research on Environmental Ecology and Fish Nutrition, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation Centre for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


