浮游植物在营养盐浓度、水温和光照等条件适宜时,短时间内的暴发性增殖现象称为有害藻华或赤潮。中肋骨条藻(Skeletonema costatum)隶属硅藻门(Bacillariophyta),生活在海表,属高光适应种,也是广温广盐种,为我国沿岸广泛分布的近岸性硅藻[1]。据中国海洋灾害公报,中肋骨条藻赤潮(表 1)在我国海域频频发生,成为我国海域赤潮高发藻和常年优势种之一[2]。在经济海藻养殖区,中肋骨条藻赤潮导致海带等经济藻类变色腐烂,还会导致大西洋大马哈鱼的鱼鳃损坏最终使其致死,破坏海洋生态平衡、降低经济效益。
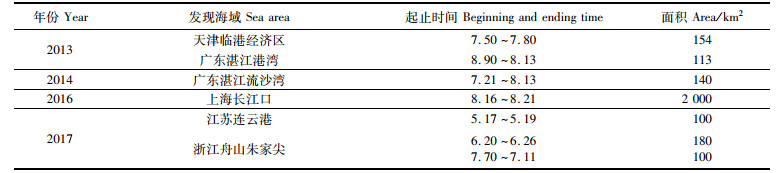
|
表 1 2013—2017年中肋骨条藻赤潮 Tab.1 Red tide of Skeletonema costatum from 2013 to 2017 |
浮游植物通过光合作用合成有机物,光合作用是其最基本、最重要的生理特性,对环境因子变化极其敏感。研究表明温度、光照和营养盐、湍流、盐度等环境因子影响着浮游植物的生长[3]。近年来,由于陆源污染带来的巨量氮营养盐的输入,长江口及其邻近海域的浮游植物生长限制因子由以往的氮限制变为磷限制[4]。常温常压下叶绿素荧光主要来源于光系统Ⅱ(PSⅡ)的叶绿素a,光系统Ⅱ处于整个光合作用过程的最上游,包括光反应和暗反应在内的多数光合过程的变化都会反馈给光系统Ⅱ,几乎所有光合作用过程的变化都可通过叶绿素荧光反映出来。
赤潮的暴发是外界环境条件和藻类自身生理特性耦合相互作用的结果[5]。以往研究讨论了温度、光照[6]、盐度[1, 7-8]或氮[9]、磷、硅营养盐[1]等单一环境因子对中肋骨条藻生长的影响,没有考虑环境因子间的交互作用,以及中肋骨条藻在生长过程中叶绿素荧光活性的变化。某些环境限制作用会引起赤潮生物光合能力的下降,对赤潮终止有重要作用。因此,本文选取中肋骨条藻作为研究对象,从光照、温度和磷酸盐3个环境因子出发,研究3个环境因子及其两两交互作用对中肋骨条藻生长和叶绿素荧光活性的影响,以期为揭示中肋骨条藻赤潮的暴发机制提供依据。
1 材料与方法 1.1 藻种培养藻类培养基采用f/2培养基,除磷酸盐外,硝酸盐、维生素、微量元素均按f/2培养基添加,其中,硝酸盐浓度为882.35 μmol/L,磷酸盐浓度分为0.1、1、10 μmol/L 3个梯度。培养基所用海水为人工配置,盐度为30,海水经过孔径为0.45 μm滤膜过滤后备用。海水和培养基储备液经121 ℃高压蒸汽灭菌20 min,所有藻类储备液、藻类培养等所需三角烧瓶等全部经过高压灭菌后使用。藻类培养光暗比为12 h:12 h,温度、光照和磷酸盐浓度按照实验计划设置不同梯度。所有实验均采用培养至指数生长期的藻类。
1.2 实验方法与数据采集将处于指数生长期的中肋骨条藻用于培养实验,防止生物量过低在接种入新培养环境中死亡,故中肋骨条藻的起始浓度设定为10×104 cells/mL。培养容器为1 000 mL三角烧瓶,含600 mL藻液,每组实验平行样品2个,每天固定时间摇动藻液3次,在培养期间的第0、3、6、9、12天取样测量中肋骨条藻叶绿素a浓度和叶绿素荧光参数,叶绿素荧光参数(表 2)使用叶绿素荧光仪(PHYTO-PAM WALZ)取2 mL藻液测定,经过暗适应后测量最大量子产量Fv/Fm,之后进行快速光曲线测定,拟合光曲线后得到α、rETRmax、IK,快速光曲线拟合方程如下:
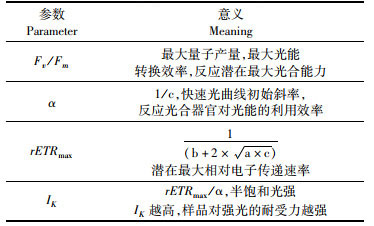
|
表 2 叶绿素荧光参数 Tab.2 Chlorophyll fluorescence parameters |
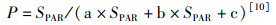 (1)
(1)
式中:P和SPAR分别为相对电子传递速率rETR和有效光合作用光强。
1.3 正交实验设计选取温度、光照和磷酸盐浓度3个环境因子,并考虑其两两间的交互作用,温度和磷酸盐水平设置参考以往东海和长江口水文数据和磷酸盐的浓度,设置较低(17 ℃)、适宜(23 ℃)、较高(29 ℃)3个温度梯度;限定浮游植物生长的最低阈值[11](0.1 μmol/L)、赤潮高发海域[12](1 μmol/L)、营养盐连续输入海域或高富营养化水域[13](10 μmol/L)3个梯度;光照水平的设置由照度计在阴雨、多云、晴朗天气在水下0.2 m实测得出。采用L18(37)正交实验表,正交实验因素和水平如表 3所示。
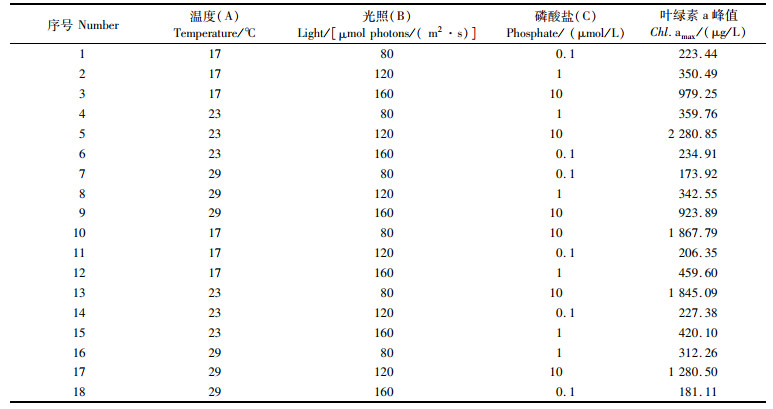
|
表 3 正交实验表 Tab.3 Orthogonal experiment table |
由于培养条件不同,各实验组中肋骨条藻的生长变化差异较大,无法选择培养期间某一天来代表其生长状况,故本文选择叶绿素a在培养期间的最高值作为指标(叶绿素a峰值)。数据为2个平行样品的平均值,对数据进行单因素方差分析(One-Way ANOVA)和多因素方差分析(multivariate analysis of variance)。
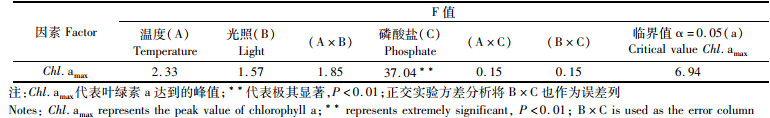
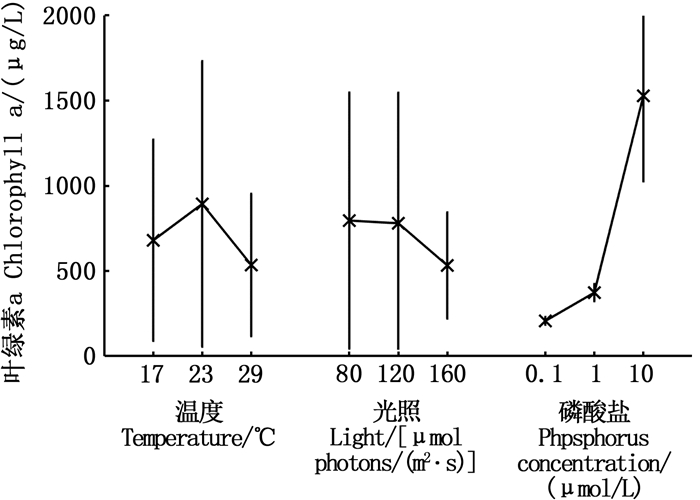
2 结果 2.1 环境因子对叶绿素a峰值的影响研究表明,植物受到胁迫时引起形态和生理上的变化,尤其体现在叶绿素a浓度上[14],叶绿素a浓度是藻类光合作用对环境因子响应的最直观的指标,也是赤潮是否暴发的衡量指标之一。由环境因子的独立作用显著性(表 4)和主效应图(图 1)可知,对叶绿素a峰值产生极其显著影响的为磷酸盐的浓度(P < 0.01),而温度和光照以及因子间的交互作用均未对其产生显著作用。环境因子及其交互作用按影响大小依次为磷酸盐(C) >温度(A) >(A×B) >光照(B)>(B×C) >(A×C)。叶绿素a浓度在23 ℃时最高,在17 ℃和29 ℃下叶绿素a浓度较低,80和120 μmol photons/(m2·s)光强下的叶绿素a峰值高于160 μmol photons/(m2·s)光强下的叶绿素a峰值,叶绿素a峰值随磷酸盐浓度升高而显著增有高。
|
表 4 叶绿素a峰值方差分析表 Tab.4 Peak value of chlorophyll a variance analysis table |
|
图 1 环境因子对叶绿素a峰值影响的主效应图 Fig. 1 Main effect diagram of environmental factors on the peak value of chlorophyll a |
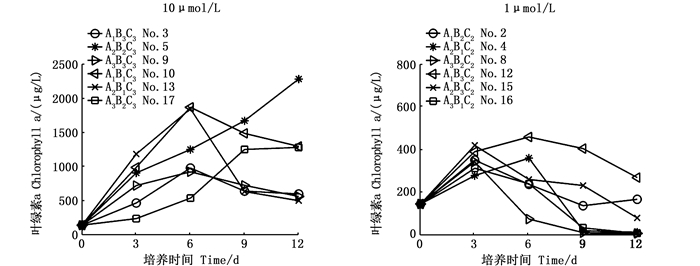
由图 2可知,磷酸盐浓度为10 μmol/L条件下的中肋骨条藻的叶绿素a浓度峰值(923.89~2 280.85 μg/L)显著高于0.1 μmol/L、1 μmol/L磷酸盐浓度下中肋骨条藻的叶绿素a浓度的峰值(P < 0.05)。叶绿素a浓度最高的实验环境因子水平组合为A2B2C3(实验5,2 280.85 μg/L),有明显的指数增长期,其次为A1B1C3(实验10,1 867.79 μg/L)、A2B1C3(实验13,1 845.09μg/L)和A3B2C3(实验17,1 280.5 μg/L),叶绿素a浓度峰值均达到了1 000 μg/L以上。可认为在18组实验中,中肋骨条藻在80~120 μmol photons/(m2·s)、10 μmol/L条件下都能保持快速增殖。但实际海域赤潮发生时磷酸盐浓度约为1 μmol/L左右[15],比较实验中磷酸盐浓度为1 μmol/L的6组实验,发现叶绿素a浓度在培养期间都能达到400 μg/L,细胞密度达到3.45×105 cells/mL,根据赤潮生物数量判断标准[16],可认定为中肋骨条藻赤潮。
|
A、B、C分别表示温度、光照、磷酸盐;下标数字代表水平;No.代表正交实验序号 A, B and C represents temperature, light and phosphate respectively; Subscript numbers represent level; No. represents orthogonal experiment serial number 图 2 10 μmol/L和1 μmol/L磷酸盐浓度下叶绿素a浓度的变化 Fig. 2 Changes of chlorophyll a concentration at 10 μmol/L and 1 μmol/L phosphate concentration |
最大量子产量Fv/Fm在非胁迫条件下变化极小[6],而在胁迫条件下该参数明显下降,因此常以叶绿素荧光参数Fv/Fm的升降作为衡量光合作用变化情况的指标之一。光合速率随光强变化的曲线就是光响应曲线,它不仅可以反映浮游植物现在的光合状态,也可以反映浮游植物在不同环境光强下的潜在光合活性[17]。因此,本文通过叶绿素荧光参数探讨中肋骨条藻在培养期间光合活性的变化。
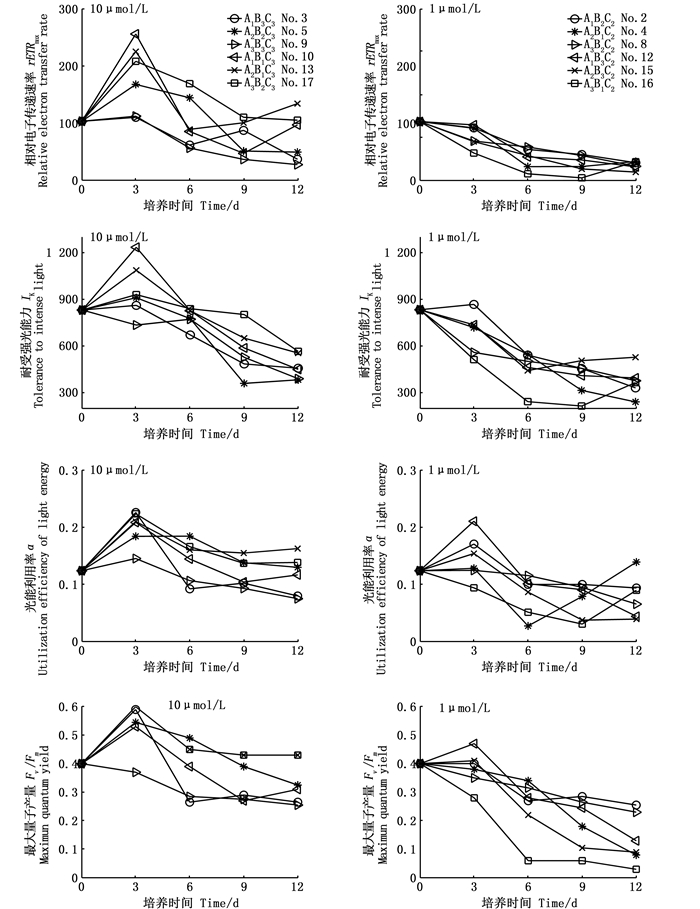
由图 3可知,中肋骨条藻刚接种进入新环境时,藻细胞密度较低,同时需要适应培养环境,处于“静滞期”[18],所以此时光合活性较低,故4个荧光参数值处于较低水平。通过对比10 μmol/L和1 μmol/L磷酸盐组的叶绿素荧光参数变化(图 3)可知,rETRmax和IK在10 μmol/L磷酸盐浓度下培养前3天上升,之后在第3~12天里持续下降;而1 μmol/L磷酸盐浓度下的rETRmax和IK在第0~12天里持续下降,到培养末期已接近为0,通过叶绿素a浓度变化(图 2)可知,此时叶绿素a浓度也趋于0 μg/L,中肋骨条藻大量死亡,在实验期间也可观察到锥形瓶内中肋骨条藻色素消退,出现白色沉淀。10 μmol/L和1 μmol/L磷酸盐浓度下的α前3天上升,之后下降稳定在一定水平,10 μmol/L和1 μmol/L磷酸盐浓度下的α在培养末期相差不大,分别为0.08~0.16和0.04~0.14。10 μmol/L磷酸盐浓度下的Fv/Fm在第3天达到峰值(0.37~0.57),3天后下降,在第6天至培养末期处于较稳定状态(0.28~0.45);1 μmol/L磷酸盐浓度下的Fv/Fm在前3天内略微上升或处于稳定,3天后迅速下降,培养末期处于0.03~0.27。
|
A、B、C分别表示温度、光照、磷酸盐;下标数字代表水平;No.代表正交实验序号 A, B and C represent temperature, light and phosphate respectively; Subscript numbers represent level; No. represents orthogonal experiment serial number 图 3 10 μmol/L和1 μmol/L磷酸盐浓度下叶绿素荧光参数的变化 Fig. 3 Changes of chlorophyll fluorescence parameters at 10 μmol/L and 1 μmol/L phosphate concentration |
通过环境因子对10 μmol/L和1 μmol/L磷酸盐浓度下中肋骨条藻的叶绿素荧光参数进行方差分析,得到光照分别对10 μmol/L(P=0.019)和1 μmol/L(P=0.041)磷酸盐浓度下中肋骨条藻的Fv/Fm产生了显著影响。由主效应图可知,10 μmol/L磷酸盐浓度下,Fv/Fm在160 μmol photons/(m2·s)光强下较低,在80和120 μmol photons/(m2·s)光强下较高;在1 μmol/L磷酸盐浓度下,Fv/Fm在120 μmol photons/(m2·s)光强下最低。
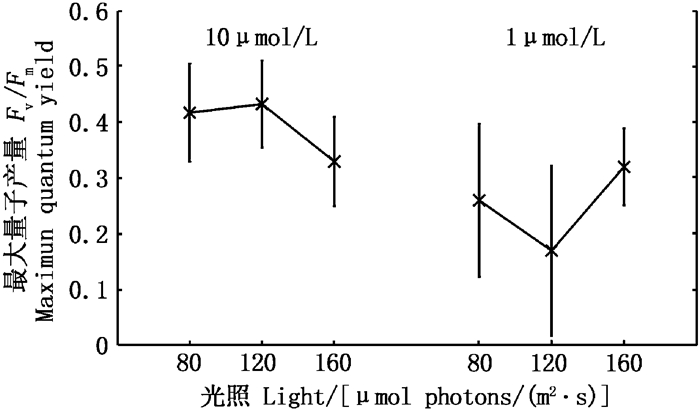
|
图 4 光照对10 μmol/L和1 μmol/L磷酸盐浓度下Fv/Fm影响的主效应图 Fig. 4 Main effect diagram of light on Fv/Fm at 10 μmol/L and 1 μmol/L phosphate concentration |
中肋骨条藻最适增殖温度范围为22~28 ℃[8],在15~25 ℃时具有明显的指数生长期[18]。其叶绿素a浓度在23 ℃适宜温度下最高,在17 ℃和29 ℃下,叶绿素a浓度较低,因为低温阻止了脂膜各相态间的转变[19],减少CO2固定的同时降低水解并导致反应中心蛋白的降解,抑制电子传递[20];温度过高,藻细胞用于呼吸的能量增加,死亡速率升高[21]。中肋骨条藻的叶绿素a峰值在80~160 μmol photons/(m2·s)下未表现出明显差异。因中肋骨条藻适宜增殖温度范围广,且其生活在海表,属高光适应种,受温度和光照影响较小,主要受到磷酸盐影响,故磷酸盐浓度越高,光合作用持续时间越长,叶绿素a峰值越高。
3.2 叶绿素荧光参数通过对10 μmol/L和1 μmol/L两个磷酸盐水平下中肋骨条藻叶绿素荧光参数的变化进行对比发现,10 μmol/L磷酸盐浓度下的α、rETRmax和IK和Fv/Fm均高于1 μmol/L,说明10 μmol/L磷酸盐环境下中肋骨条藻的光能利用效率、最大相对电子传递速率、耐受强光的能力[22]和最大量子产量高。中肋骨条藻不像东海原甲藻等细胞中含有磷库[23],且中肋骨条藻较东海原甲藻利用磷的能力更强,故其生长受磷酸盐浓度的影响极其显著,低磷酸盐对中肋骨条藻造成了抑制作用[24],因此中肋骨条藻在高磷酸盐环境下光合活性较高。在10 μmol/L和1 μmol/L磷酸盐浓度下,光能利用效率α较其他荧光参数的差异小,可能是在1 μmol/L磷酸盐浓度下,中肋骨条藻受到磷酸盐的胁迫作用,α较小;在10 μmol/L磷酸盐浓度下,中肋骨条藻生长速率快,细胞密度过高,由于遮蔽作用降低了光能利用率[25]。在培养后期发现,中肋骨条藻在10 μmol/L和1 μmol/L磷酸盐浓度下,其光合活性都呈现下降趋势,除了进行光合作用导致磷酸盐浓度下降对其造成胁迫外,中肋骨条藻达到饱和浓度迅速衰败的特点也是光合活性下降的原因之一。在10 μmol/L和1 μmol/L磷酸盐浓度下中肋骨条藻的Fv/Fm对光强的响应不同,可能因为中肋骨条藻最适光强在120 μmol photons/(m2·s)左右,在10 μmol/L磷酸盐环境中,适宜光强有利于光合作用,故Fv/Fm高;在1 μmol/L磷酸盐环境中,虽适宜的光强促进了光合作用,但磷酸盐在培养初期就迅速消耗殆尽后受到低磷酸盐的胁迫作用,故中肋骨条藻在120 μmol photons/(m2·s)光强下Fv/Fm最低。
培养初期各组氮盐浓度为882.35 μmol/L,磷酸盐分为0.1、1、10 μmol/L 3个梯度,在接种时中肋骨条藻即处于不同氮磷比环境中,以及随着氮磷营养盐的消耗,氮磷比也处于动态变化中;也未考虑实际海域中,海水混合带来的营养盐补充。这些因素是否对中肋骨条藻的生长特性及叶绿素荧光特性产生了影响还有待更多的实验结果来分析探讨。
4 结论实验结果表明,中肋骨条藻在10 μmol/L磷酸盐浓度下叶绿素a较高,最优环境因子水平组合为23 ℃、120 μmol photons/(m2·s)、10 μmol/L。磷酸盐浓度对中肋骨条藻叶绿素a峰值造成极其显著的影响(P < 0.01),本实验中温度、光照及3个因素两两间的交互作用未对叶绿素a峰值造成显著影响(P>0.05)。
对10 μmol/L和1 μmol/L磷酸盐浓度下中肋骨条藻的叶绿素荧光参数进行分析,发现10 μmol/L磷酸盐浓度下中肋骨条藻的相对电子传递速率rETRmax、耐受强光的能力IK和最大量子产量Fv/Fm更高,但光能利用效率α未表现出明显差异。光照对中肋骨条藻的Fv/Fm造成显著影响(P < 0.05),在10 μmol/L磷酸盐浓度下,Fv/Fm在80和120 μmol photons/(m2·s)光强下较高;在1 μmol/L磷酸盐浓度下,Fv/Fm在120 μmol photons/(m2·s)光强下最低。这是藻类暴发性增殖后磷营养盐限制的结果。因此,控制富营养化对于防治赤潮显得尤为重要。
感谢上海海洋大学沈盎绿老师在实验设计和结果分析、论文撰写过程中提供的指导与帮助。
| [1] |
王志宝, 赵奎峰, 梁黎明, 等. 温度、盐度和硅酸钠浓度对中肋骨条藻生长的影响[J]. 烟台大学学报(自然科学与工程版), 2018, 31(3): 275-282. WANG Z B, ZHAO K F, LIANG L M, et al. Effects of temperature, salinity and silicate density on growth of Skeletonema costatum[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2018, 31(3): 275-282. |
| [2] |
陈炳章, 王宗灵, 朱明远, 等. 温度、盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60-64. CHEN B Z, WANG Z L, ZHU M Y, et al. Effects of temperature and salinity on growth of Prorocentrum dentatum and comparisons between growths of Prorocentrum dentatum and Skeletonema costatum[J]. Advances in Marine Science, 2005, 23(1): 60-64. DOI:10.3969/j.issn.1671-6647.2005.01.008 |
| [3] |
王宗灵, 李瑞香, 朱明远, 等. 半连续培养下东海原甲藻和中肋骨条藻种群生长过程与种间竞争研究[J]. 海洋科学进展, 2006, 24(4): 495-503. WANG Z L, LI R X, ZHU M Y, et al. Study on population growth processes and interspecific competition of Prorocentrum donghaiense and Skeletonema costatum in semi-continuous dilution experiments[J]. Advances in Marine Science, 2006, 24(4): 495-503. DOI:10.3969/j.issn.1671-6647.2006.04.011 |
| [4] |
灯光, 耿亚洪, 胡鸿钧, 等. 几种环境因子对高生物量赤潮甲藻——东海原甲藻光合作用的影响[J]. 海洋科学, 2009, 33(12): 34-39. DENG G, GENG Y H, HU H J, et al. Effects of environmental factors on photosynthesis of a high biomass bloom forming species Prorocentrum donghaiense[J]. Marine Sciences, 2009, 33(12): 34-39. |
| [5] |
SIGNORINI S R, MCCLAIN C R. Environmental factors controlling the Barents Sea spring-summer phytoplankton blooms[J]. Geophysical Research Letters, 2009, 36(10): L10604. DOI:10.1029/2009GL037695 |
| [6] |
FALKOWSKI P G, BARBER R T, SMETACEK V. Biogeochemical controls and feedbacks on ocean primary production[J]. Science, 1998, 281(5374): 200-206. DOI:10.1126/science.281.5374.200 |
| [7] |
殷大聪, 黄薇, 吴兴华, 等. 汉江水华硅藻生物学特性初步研究[J]. 长江科学院院报, 2012, 29(2): 6-10. YIN D C, HUANG W, WU X H, et al. Preliminary study on biological characteristics of spring diatom bloom in the Hanjiang River[J]. Journal of Yangtze River Scientific Research Institute, 2012, 29(2): 6-10. DOI:10.3969/j.issn.1001-5485.2012.02.002 |
| [8] |
孙百晔, 梁生康, 王长友, 等. 光照与东海近海中肋骨条藻(Skeletonema costatum)赤潮发生季节的关系[J]. 环境科学, 2008, 29(7): 1849-1854. SUN B Y, LIANG S K, WANG C Y, et al. Role of irradiance on the seasonality of Skeletonema costatum Cleve blooms in the coastal area in east China Sea[J]. Environmental Science, 2008, 29(7): 1849-1854. DOI:10.3321/j.issn:0250-3301.2008.07.015 |
| [9] |
蔡敬, 王星宇, 曾蓓蓓, 等. 盐度-光照强度-温度对小环藻Cyclotella sp.SHOU-B108生长及ARA和EPA含量的影响[J]. 上海海洋大学学报, 2016, 25(3): 406-414. CAI J, WANG X Y, ZENG B B, et al. Effects of salinity, light intensity and temperature on the growth, ARA and EPA contents in diatom Cyclotella sp.SHOU-B108[J]. Journal of Shanghai Ocean University, 2016, 25(3): 406-414. |
| [10] |
刘莲, 周小玉, 赵良杰, 等. 氮磷比率对两种蓝藻和两种绿藻生长的影响[J]. 上海海洋大学学报, 2014, 23(4): 573-581. LIU L, ZHOU X Y, ZHAO L J, et al. Effect of nitrogen and phosphorus ratios on the growth of cyanobacteria and chlorophyta[J]. Journal of Shanghai Ocean University, 2014, 23(4): 573-581. |
| [11] |
林庆莹, 吴海龙, 刘媛媛, 等. 环境因子对瓦氏马尾藻吸收溶解性无机碳及提升海水pH的影响[J]. 上海海洋大学学报, 2018, 27(2): 221-229. LIN Q Y, WU H L, LIU Y Y, et al. The effects of environmental factors on dissolved inorganic carbon absorption and increasing pH abilities of Sargassum vachellianum[J]. Journal of Shanghai Ocean University, 2018, 27(2): 221-229. |
| [12] |
EILERS P H C, PEETERS J C H. A model for the relationship between light intensity and the rate of photosynthesis in phytoplankton[J]. Ecological Modelling, 1988, 42(3/4): 199-215. |
| [13] |
刘慧, 董双林, 方建光. 全球海域营养盐限制研究进展[J]. 海洋科学, 2002, 26(8): 47-53. LIU H, DONG S L, FANG J G. The progress of nutrient salts control research in global oceans[J]. Marine Sciences, 2002, 26(8): 47-53. DOI:10.3969/j.issn.1000-3096.2002.08.013 |
| [14] |
张传松, 王修林, 石晓勇, 等. 东海赤潮高发区营养盐时空分布特征及其与赤潮的关系[J]. 环境科学, 2007, 28(11): 2416-2424. ZHANG C S, WANG X L, SHI X Y, et al. Seasonal variation and spatial distribution of nutrients and their relationships with harmful algal blooms in coastal area of the East China Sea[J]. Environmental Science, 2007, 28(11): 2416-2424. DOI:10.3321/j.issn:0250-3301.2007.11.002 |
| [15] |
秦伯强, 高光, 朱广伟, 等. 湖泊富营养化及其生态系统响应[J]. 科学通报, 2013, 58(10): 855-864. QIN B Q, GAO G, ZHU G W, et al. Lake eutrophication and its ecosystem response[J]. Chinese Science Bulletin, 2013, 58(9): 961-970. |
| [16] |
吴顺, 张雪芹, 蔡燕. 干旱胁迫对黄瓜幼苗叶绿素含量和光合特性的影响[J]. 中国农学通报, 2014, 30(1): 133-137. WU S, ZHANG X Q, CAI Y. Effects of drought stress on chlorophyll contents and photosynthetic characteristics of cucumber seedlings[J]. Chinese Agricultural Science Bulletin, 2014, 30(1): 133-137. |
| [17] |
黄备, 邵君波, 魏娜, 等. 2014年春季东海大面积甲藻赤潮的生态特征[J]. 生态环境学报, 2014, 23(9): 1457-1462. HUANG B, SHAO J B, WEI N, et al. Ecological studies during occurrence of dinoflagellate blooms in East China Sea spring 2014[J]. Ecology and Environment Sciences, 2014, 23(9): 1457-1462. DOI:10.3969/j.issn.1674-5906.2014.09.008 |
| [18] |
RAE R, VINCENT W F. Phytoplankton production in subarctic lake and river ecosystems:development of a photosynthesis-temperature-irradiance model[J]. Journal of Plankton Research, 1998, 20(7): 1293-1312. DOI:10.1093/plankt/20.7.1293 |
| [19] |
BISHOP D G. Chilling sensitivity in higher plants:the role of phosphatidylglycerol[J]. Plant, Cell & Environment, 1986, 9(8): 613-616. |
| [20] |
KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis:the basics[J]. Annual Review of Plant Physiology, 1991, 42: 313-349. DOI:10.1146/annurev.pp.42.060191.001525 |
| [21] |
郭瑾, 杨维东, 刘洁生, 等. 温度、盐度和光照对球形棕囊藻生长和产毒的影响研究[J]. 环境科学学报, 2007, 27(8): 1341-1346. GUO J, YANG W D, LIU J S, et al. Effects of salinity, temperature and light intensity on the growth and toxin production of Phaeocystis globosa[J]. Acta Scientiae Circumstantiae, 2007, 27(8): 1341-1346. DOI:10.3321/j.issn:0253-2468.2007.08.020 |
| [22] |
RALPH P J, GADEMANN R. Rapid light curves:a powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005, 82(3): 222-237. DOI:10.1016/j.aquabot.2005.02.006 |
| [23] |
周钦.甲藻细胞磷库变化特征及赤潮生消周期内浮游生物群落结构变化研究[D].温州: 温州大学, 2017. ZHOU Q. Studies on cellular phosphoruspool characteristics of dinoflagellates and changes in plankton community during the occurrence and vanishiment process of algal blooms[D]. Wenzhou: Wenzhou University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10351-1017274892.htm |
| [24] |
CAO J, WANG J T. The inhibitory degree between Skeletonema costatum and dinoflagllate Prorocentrum donghaiense at different concentrations of phosphate and nitrate/phosphate ratios[J]. Journal of Ocean University of China, 2012, 11(2): 153-158. DOI:10.1007/s11802-012-1824-y |
| [25] |
王爱军, 王修林, 韩秀荣, 等. 光照对东海赤潮高发区春季赤潮藻种生长和演替的影响[J]. 海洋环境科学, 2008, 27(2): 144-148. WANG A J, WANG X L, HAN X R, et al. Effects of solar radiation on the growth and succession of harmful algae in the East China Sea in spring[J]. Marine Environmental Science, 2008, 27(2): 144-148. DOI:10.3969/j.issn.1007-6336.2008.02.011 |
 2020,
Vol. 29
2020,
Vol. 29


