2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306
几丁质(chitin)是在自然界中储存量排名第二的高度不溶性的天然多糖,仅次于纤维素[1]。它主要存在于昆虫、真菌、酵母和藻类的外骨骼以及其他甲壳类动物的甲壳之中,所以几丁质也被称为甲壳质[2]。几丁质是由β-(1, 4)-糖苷键连接的N-乙酰葡糖胺(GlcNAc)组成的线性聚合物。几丁质酶(E.C 3.2.2.14)是降解几丁质的酶,它属于糖基水解酶[3]。
在海洋中,硅藻是海洋生产者的主要类群,在海洋生态系统的物质循环和能量流动中起着极其重要的作用[4],但是硅藻很容易过度繁殖,形成赤潮,对生态环境造成极大的破坏[5-6]。角毛藻是浮游硅藻的重要类群,普遍分布在世界各海域,也是我国沿海许多港湾的常见优势硅藻[7]。牟氏角毛藻是一种重要的赤潮藻,渤海湾暴发赤潮就属于牟氏角毛藻赤潮,它们繁殖很快,具有很强的代表性,因此选用角毛藻作为几丁质酶的杀灭对象[8]。目前关于赤潮的防治主要分为物理法、化学法和生物法。物理法主要是通过机械搅动、隔离、超声波、微滤机、吸附和气浮等方法去除藻类。化学法分为无机药剂法、有机药剂法和胶体絮凝沉淀法。生物法包括引入赤潮藻类生物天敌、微生物技术和化感技术。采用物理法无二次污染,但费用高、效率低,难以大面积使用;化学法见效快、费用低,但需不断改良;引入生物天敌法费用低、易操作,但易造成生态危害。采用微生物技术和化感技术为治理赤潮提供新思路,具有重要意义和发展前景[9-10]。海洋中微生物资源丰富,取自海洋用于海洋更可避免外来生物入侵,可以实现海洋环境的可持续发展。因此,利用海洋微生物“以菌治藻”进行生物防治具有巨大的潜力与广阔的前景。
关于细菌杀藻的研究大多只限于杀藻细菌种类的筛选和作用方式的区分[11-13]。本研究探究具体的杀藻物质,这对研究菌藻关系和生物防治水华赤潮提供极有价值的帮助。硅藻细胞是由含有几丁质的盒状硅藻壳包裹的,是产几丁质酶细菌的天然靶标,因此将产几丁质酶的细菌应用于水华赤潮的生物防治具有极大潜力。此外,产几丁质酶细菌在真菌的防治上已有初步成效[14],因而对产几丁质酶细菌的研究具有广阔的应用前景。
本研究通过对弧菌科的杀鲑气单胞菌(Aeromonas salmonicida)几丁质酶基因敲除,对比来探究产几丁质酶细菌对牟氏角毛藻杀除的作用,从而探究几丁质酶的功能,为筛选用于防治藻类环境污染的细菌,甚至利用基因编辑技术培养更适合的菌株提供重要理论依据。
1 材料与方法 1.1 材料本研究所使用的菌种源于实验室保存菌株,包括杀鲑气单胞菌(简称“sg”)及杀鲑气单胞菌几丁质酶基因缺失突变株(简称“Δsg”), 所使用硅藻为牟氏角毛藻。杀鲑气单胞菌分离自上海崇明岛的健康野生双斑河鲀(Takifugu bimaculatus)的肝脏[15],是双斑河鲀的共生分离菌。
杀鲑气单胞菌几丁质酶基因缺失突变株(Δsg)构建详细策略见韦芬博士学位论文[16],大致过程如下:①目标基因上下游同源臂的扩增;②上下游同源臂融合;③融合片段连接至自杀质粒pSR-47s;④自杀质粒转化至具有Amp抗性的大肠杆菌cc-118;⑤细胞融合阶段,将野生株杀鲑气单胞菌、cc-118以及辅助菌液cc-118-pHelper混合培养过夜后涂板于Amp、Kan双抗性的LB培养基上;⑥挑取单克隆菌落并验证即获得突变株。
杀鲑气单胞菌以LB培养基,于28 ℃、200 r/min摇床中培养。牟氏角毛藻是海水藻类,培养盐度为25与杀鲑气单胞菌培养盐度相同,以f/2培养基,于室温、每天12 h光照下培养[17]。f/2培养基全称F/2藻类培养基(Guillard F/2 Medium),购买自上海高信化玻公司。LB培养基(Luria-Bertani culture),含有胰蛋白胨,酵母提取物,NaCl固体均购买自上海生工公司。实验所用酶标仪为美国伯腾仪器有限公司生产的synergy2多功能酶标仪。实验所用扫描电镜为HITACHI公司的S-3400N扫描电子显微镜。
1.2 方法 1.2.1 杀鲑气单胞菌降解几丁质能力的检测由于二硝基水杨酸在中性或偏碱性条件下与几丁质水解的还原糖共热后被还原成棕红色的氨基化合物3-氨基-5-硝基水杨酸,在一定范围内,还原糖的量和反应液的颜色呈正比[18]。利用紫外分光光度计对反应液进行检测记录其OD值,由此建立还原糖浓度和OD值的标准曲线,检测几丁质被降解程度,从而反应细菌的几丁质降解能力。
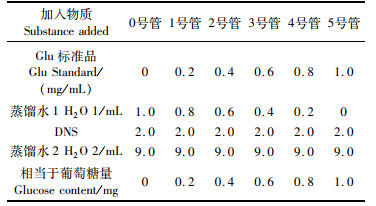
葡萄糖标准曲线的制作:取干净离心管或试管,按表 1组别与配方以0号管进行校对清零,检测540 nm处吸光度,其中加完DNS试剂后需要水浴5 min。以吸光度值为纵坐标,各标准浓度(mg/mL)为横坐标作图得标准曲线。
|
表 1 葡萄糖标准曲线制作时所用浓度及各组份含量 Tab.1 The different concentrations of glucose and content of each component in making glucose standard curve |
吸取20 μL杀鲑气单胞菌菌液至20 mL LB液体培养基中,每管培养基中加入2 mL胶态几丁质[19-20],28 ℃、220 r/min培养,共设12、24和48 h 3个取样时间组,每组设3个平行。将各培养液4 000 r/min均离心10 min,吸取1 mL上清液至干净离心管中,加入2 mL DNS试剂,沸水浴中准确沸煮5 min,取出后用自来水冲洗管壁至冷却到室温,加入9 mL蒸馏水稀释后,紫外分光光度计测量560 nm处吸光度[21]。
1.2.2 杀鲑气单胞菌杀藻活性检测通过验证杀鲑气单胞菌对几丁质的降解能力,验证细菌对硅藻的直接杀死能力。根据藻类的荧光值与其浓度的对应关系,通过检测共培养菌藻的荧光值与对照组藻类荧光值,根据其数值差与对照组荧光值的比值来表示杀鲑气单胞菌对藻类的杀除率。
以杀鲑气单胞菌液、牟氏角毛藻培养基液体积比为0.3%、0.5%、1%、2%、5%共5个不同浓度组,用于测定其杀藻活性并确定后续实验用细菌浓度。每个浓度组设3个平行,菌液是取200 μL、于20 mL LB培养基中28 ℃培养24 h的杀鲑气单胞菌液。以正常生长的藻类为对照组,加入无菌LB培养基以避免培养基的影响。在具有440 nm激发光和680 nm发射光的酶标仪下测量不同处理组和对照组的荧光强度。以如下公式[22]将所测结果作为之后菌液、藻类共培养的浓度比:
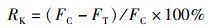 (1)
(1)
式中:RK为杀藻率;FC实验组的藻类培养物的荧光强度; FT为对照组藻类培养物的荧光强度。
1.2.3 杀鲑气单胞菌杀藻模式检测为了更进一步确定细菌中几丁质酶对硅藻的作用,分别将杀鲑气单胞菌敲除株和杀鲑气单胞菌野生株与藻类共培养,并进行对比。
根据上述1.2.2中得到的最佳杀藻浓度,将杀鲑气单胞菌野生株(sg)和敲除株(Δsg)分别加到牟氏角毛藻培养基中,以正常生长的藻类为对照组,培养48 h。在具有440 nm激发光和680 nm发射光的酶标仪下测量野生株组敲除株组和对照组的荧光强度[22]。
1.2.4 杀鲑气单胞菌对牟氏角毛藻作用的扫描电镜观察为了将几丁质酶在杀鲑气单胞菌对牟氏角毛藻的影响中的作用可视化,分别将杀鲑气单胞菌敲除株和杀鲑气单胞菌野生株与藻类共培养并制作扫描电镜标本进行观察。
分别将1 mL杀鲑气单胞野生菌株(sg)和敲除菌株(Δsg)菌液以10 000 r/min离心5 min,并且在用无菌f/2培养基洗涤两次后,将野生株和敲除株的细菌细胞添加到牟氏角毛藻培养物中,以2%比例混匀,培养48 h。收集10 mL混合培养物,3 000 r/min离心5 min收集沉淀,然后在含有2.5%戊二醛的0.1 mol/L PBS缓冲液中固定2小时,再用PBS缓冲液轻轻漂洗2次并在4 000 r/min下离心弃上清。接下来在30%、50%、70%、90%、95%、100%、100%梯度乙醇溶液中脱水,每次脱水15 min后4 000 r/min离心弃上清,沉淀再次脱水,最后将沉淀储存在叔丁醇中于4 ℃过夜,第2天将样品置于无菌超净台中吹风干燥[23-25],用导电胶将干燥后的样品粘在载物台上,放入离子溅射仪中镀金膜,最后在扫描电镜下观察。
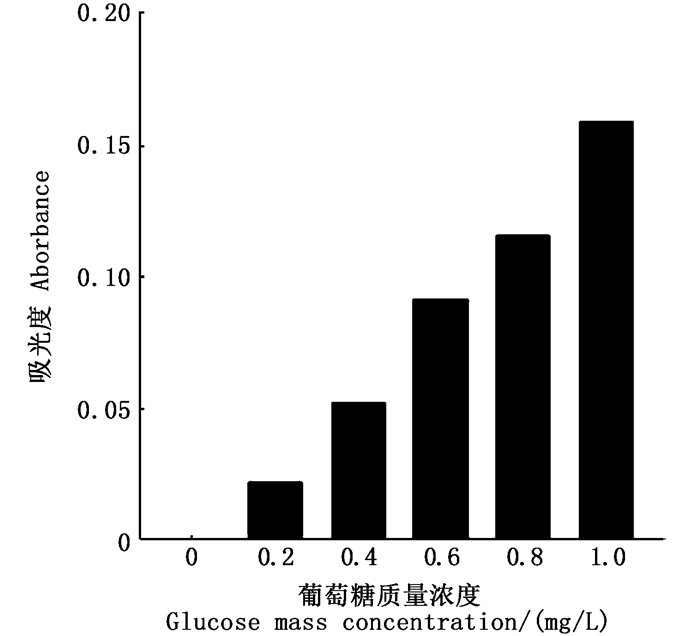
2 结果与分析 2.1 敲除株细菌降解几丁质能力变化DNS法检测的吸光度和葡萄糖含量标准曲线如图 1,关系式为Y=1.517X(R2=0.991 9),Y为吸光度,X为葡萄糖含量(mg/mL),吸光度与葡萄糖质量浓度成正比。
|
纵坐标为样本在560 nm处吸光度 Y-axis is the light absorption value 图 1 葡萄糖质量浓度与吸光度函数关系图 Fig. 1 Functional diagram of glucose mass concentration and absorbance |
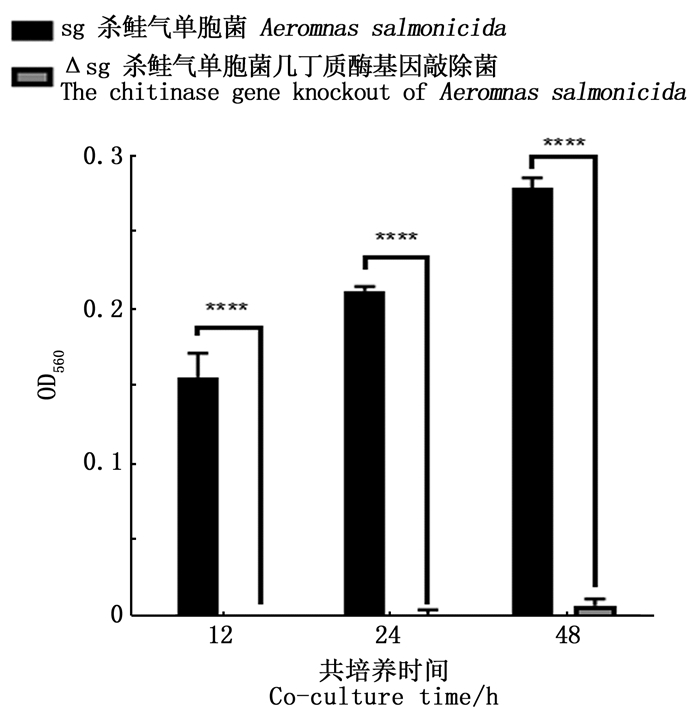
杀鲑气单胞菌野生株与敲除株经过发酵后,以DNS法检测培养基中的还原糖含量来表示几丁质的降解程度(图 2):随着发酵时间的增加,野生株实验组中被还原的几丁质量与时间成正相关,而突变株实验组中几丁质几乎未被降解。因此,杀鲑气单胞菌能够降解几丁质,而敲除株无法降解几丁质。
|
柱状图上方含“****”表示差异性极显著(P < 0.001) The"****"above the histogram means the difference is significant at the 0.001 level 图 2 杀鲑气单胞菌野生株、敲除株降解几丁质酶标检测 Fig. 2 Enzyme-labeled instrument test of Aeromonas salmonicidawild type strain and knockout strain degrading chitin |
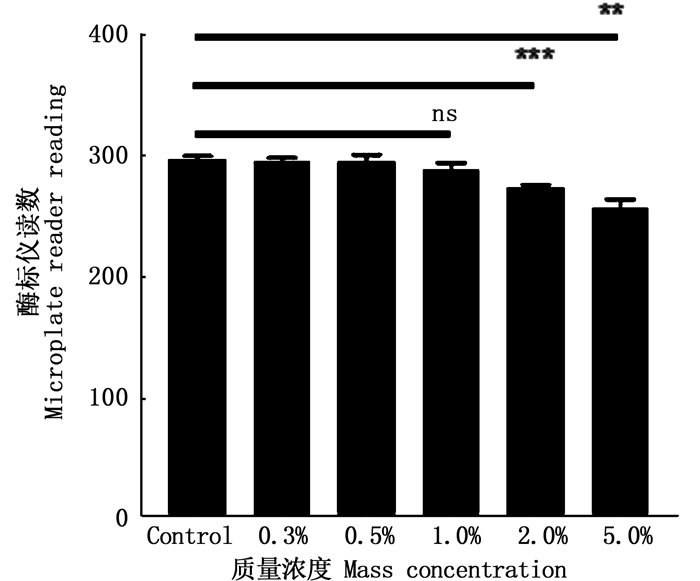
将不同浓度的杀鲑气单胞菌野生株加入牟氏角毛藻共培养48 h,并测定杀藻活性,酶标仪检测结果如图 3。
|
柱状图上方ns表示无显著性差异(P < 0.05),**表示差异性显著,***表示差异性极显著(P < 0.01) The "ns"above the histogram shows no difference. The"**"above the histogram shows significant difference(P < 0.05). The"***"above the histogram means the difference is significant at the 0.01 level 图 3 细菌杀藻活性检测 Fig. 3 Determination of algicidal activity |
与对照组相比,细菌在质量浓度为0.3%和0.5%时没有表现出明显的杀藻活性。当质量浓度超过1.0%时,处理组的荧光强度与对照相比有所下降,并且1.0%、2.0%、5.0%质量浓度下的杀藻率分别为4.74%、11.31%、26.64%,当质量浓度为2.0%时,杀藻活性差异极显著(P < 0.001)。因此,选择质量浓度为2.0%作为探究杀鲑气单胞菌与藻类作用的合适浓度。
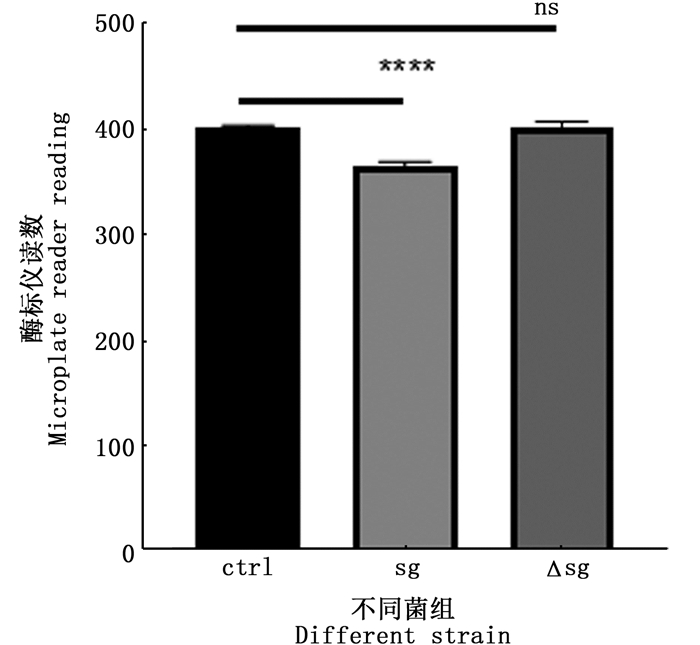
为了研究几丁质酶对于杀鲑气单胞菌杀藻的作用,将野生株和敲除几丁质酶基因的敲除株分别与牟氏角毛藻培养48 h,并与对照组进行对比,结果如图 4。
|
柱状图上方ns表示无显著性差异,****表示差异性极显著(P < 0.001) The "ns" above the histogram shows no difference. The "****" above the histogram means the difference is significant at the 0.001 level 图 4 杀鲑气单胞菌野生株、敲除株杀牟氏角毛藻活性检测 Fig. 4 Determination of algicidal activity of wild type strain and knockout strain |
与对照组相比,杀鲑气单胞菌野生株对于牟氏角毛藻的杀藻率达到了9.18%,而敲除株没有起到明显的杀藻效果。由此,在细菌杀藻的过程中,几丁质酶起到了关键的作用。
2.3 杀鲑气单胞菌对牟氏角毛藻作用的扫描电镜观察杀鲑气单胞菌野生株、敲除株对于硅藻细胞的作用如文后图版所示。图版-1为牟氏角毛藻,其完整且光滑呈圆形或椭圆形的细胞壁以及其角毛。图版-2,3为野生株杀鲑气单胞菌作用下的角毛藻,在扫描电镜下,硅藻外层含有几丁质的细胞壁被细菌附着并裂解,碎成块状图版-4为杀鲑气单胞菌敲除株作用下的角毛藻,细菌虽然依然能够附着于其细胞壁表面,但是由于缺少几丁质酶,因而无法对其细胞壁进行裂解。
3 讨论近年关于几丁质酶的研究成为热点,因而从几丁质酶的角度,许多问题迎来了新的解决方向,其中利用产几丁质酶细菌对藻类的杀灭作用对水华、赤潮进行生物防治引起了关注。
通过DNS法检测细菌降解几丁质能力的实验发现,杀鲑气单胞菌能够通过产生几丁质酶来降解环境中的几丁质,从而对于含有几丁质的生物或物质造成一定影响,甚至具有杀灭作用,这使利用产几丁质酶细菌来降解含几丁质成分的生物成为可能。
在硅藻细胞壁中含有大量几丁质成分,而它的生境也非常广泛,几乎是有水滞留的地方都能见到硅藻的踪迹,小至由雨水积聚成的小水坑,大至占地球表面71%的海洋[26]。在营养丰富的情况下,硅藻在海水中会引起赤潮,在淡水中会引起水华,对生态环境有破坏性影响。大部分种类的硅藻细胞壁高度硅质化,形成上下两个透明的壳,以壳环带套合形成一个硅质细胞壁,且具有孔隙[27]。细菌能够作用于硅藻,与硅藻细胞壁的构成密切相关,因为硅藻细胞壁中含有几丁质。LI等[22]通过将产几丁质酶细菌发酵液分组实验,推测细菌杀藻物质为几丁质酶,在此基础上本研究通过直接敲除细菌几丁质酶,直接确定了杀鲑气单胞菌的杀藻活性来源于几丁质酶,并通过扫描电子显微镜拍摄发现杀鲑气单胞菌能够将藻类裂解从而杀灭藻类。这将会十分有效地抑制藻类引起的环境污染。但目前关于产几丁质酶细菌与藻类相互作用的研究比较少。能够用于实际应用的细菌仍需进一步筛选,有研究[27]表明,在浙江沿海的13种藻类中分离出50株细菌,其中只有6%能够分泌几丁质酶,且酶活性较低。因此,利用产几丁质酶细菌对藻类引起的水华、赤潮进行生物防治仍需进一步研究调查。
杀鲑气单胞菌属气单胞菌属,宿主范围广泛,可感染包括大西洋鲑鱼、比目鱼、虹鳟鱼、金鱼、银鲫、鲤鱼等在内的多种海淡水鱼类[28],而且近期发现其感染宿主包括山羊及人类,是目前很受关注的人-兽-鱼共患性疾病的病原之一[29]。本研究所用杀鲑气单胞菌虽然来源于健康的野生的双斑河鲀的一种共生菌,但对其致病特性未知,可能有潜在的风险。本研究旨在探究细菌杀藻的理论可行性,不会直接投入使用,因此并未对杀鲑气单胞菌做毒性检测。
| [1] |
HAMID R, KHAN M A, AHMAD M, et al. Chitinases:an update[J]. Journal of Pharmacy & Bioallied Sciences, 2013, 5(1): 21-29. |
| [2] |
RATHORE A S, GUPTA R D. Chitinases from bacteria to human:properties, applications, and future perspectives[J]. Enzyme Research, 2015, 2015: 791907. |
| [3] |
BHATTACHARYA D, NAGPURE A, GUPTA R K. Bacterial Chitinases:properties and potential[J]. Critical Reviews in Biotechnology, 2007, 27(1): 21-28. DOI:10.1080/07388550601168223 |
| [4] |
高亚辉, 梁君荣, 陈长平, 等. 海洋硅藻多样性与生态作用研究[J]. 厦门大学学报(自然科学版), 2011, 50(2): 455-464. GAO Y H, LIANG J R, CHEN C P, et al. Studies on biodiversity and ecological importance of marine diatoms[J]. Journal of Xiamen University (Natural Science), 2011, 50(2): 455-464. |
| [5] |
GROUP R T. The current of red tide research[J]. Environmental Health Perspectives, 2002, 110(3): A132-A133. DOI:10.1289/ehp.110-a132 |
| [6] |
NAMIKOSHI M, SIVONEN K, EVANS W R, et al. Isolation and structures of microcystins from a cyanobacterial water bloom (Finland)[J]. Toxicon, 1992, 30(11): 1473-1479. DOI:10.1016/0041-0101(92)90523-8 |
| [7] |
王朝晖, 齐雨藻, 陈菊芳, 等. 大亚湾角毛藻细胞数量波动及其与环境因子关系的多元分析[J]. 生态学报, 2006, 26(4): 1096-1102. WANG Z H, QI Y Z, CHEN J F, et al. Population dynamics of Chaetoceros spp. and multivariate analysis of its relationship with environmental factors in Daya Bay, South China Sea[J]. Acta Ecologica Sinica, 2006, 26(4): 1096-1102. DOI:10.3321/j.issn:1000-0933.2006.04.016 |
| [8] |
叶志娟, 王长海, 刘兆普. 外源氮磷养殖废水对微藻生理生化特征的影响[J]. 哈尔滨工业大学学报, 2009, 41(6): 201-204. YE Z J, WANG C H, LIU Z P. Effects of enriching nitrogen and phosphorus nutrients on growth and biochemical constituents of Chaetoceros mulleri and Dunaliella salina[J]. Journal of Harbin Institute of Technology, 2009, 41(6): 201-204. DOI:10.3321/j.issn:0367-6234.2009.06.045 |
| [9] |
谢宏英, 王金辉. 宁德沿海赤潮灾害风险状况研究[J]. 上海海洋大学学报, 2018, 27(4): 553-563. XIE H Y, WANG J H. Study on the risk of harmful algal blooms hazard along Ningde Coast[J]. Journal of Shanghai Ocean University, 2018, 27(4): 553-563. |
| [10] |
黄姿, 朱白婢, 孙建波, 等. 赤潮的生物防治及其研究进展[J]. 安徽农学通报, 2008, 14(15): 82-84. HUANG Z, ZHU B B, SUN J B, et al. Progresses of research on the biological control method of red tide[J]. Anhui Agricultural Science Bulletin, 2008, 14(15): 82-84. DOI:10.3969/j.issn.1007-7731.2008.15.036 |
| [11] |
蔡亚萍, 苏建强, 谢忠, 等. 南海海域几丁质降解菌的筛选及其特性研究[J]. 厦门大学学报(自然科学版), 2008, 47(s2): 259-263. CAI Y P, SU J Q, XIE Z, et al. Isolation and characterization of Chitin-degrading Bacteria from South China Sea[J]. Journal of Xiamen University (Natural Science), 2008, 47(s2): 259-263. |
| [12] |
李欣毅.三株海洋高效杀藻菌及其杀藻活性物质研究[D].厦门: 厦门大学, 2011. LI X Y. Study on three strains of marine algicidal bacteria and their algicidal substances[D]. Xiamen: Xiamen University, 2011. |
| [13] |
连玉武, 王艳丽, 郑天凌, 等. 赤潮科学中藻菌关系研究的若干进展[J]. 海洋科学, 1999, 23(1): 35-38. LIAN Y W, WANG Y L, ZHENG T L, et al. Advance in the research on interaction between red tide algae and bacteria[J]. Marine Sciences, 1999, 23(1): 35-38. DOI:10.3969/j.issn.1000-3096.1999.01.015 |
| [14] |
檀建新, 陈忠义, 张杰, 等. 产几丁质酶菌的分离鉴定及其抑菌作用的初步研究[J]. 植物保护, 2001, 27(2): 1-3. TAN J X, CHEN Z Y, ZHANG J, et al. Isolation and identification of chitinolytic strains and preliminary study on the antifungal activity of its crude chitinases[J]. Plant Protection, 2001, 27(2): 1-3. DOI:10.3969/j.issn.0529-1542.2001.02.001 |
| [15] |
尹璐.产河鲀毒素细菌的筛选及电阀门钠离子通道基因在鱼类雌雄性腺中的差异表达[D]. 2015. YIN L. Identification of TTX-producing bacteria from pufferfish and different expressions of scn1Laa and scn4aa in fish gonads[D]. 2015. |
| [16] |
韦芬.细菌河鲀毒素合成的前体及相关基因的筛选[D].南宁: 广西大学, 2017. WEI F. Screening of TTX synthetic precursor and related genes in bacteria[D]. Nanning: Guangxi University, 2017. |
| [17] |
曾蓓蓓, 黄旭雄, 危立坤, 等. 3种半咸水硅藻的适宜培养条件及其细胞生化成分[J]. 海洋渔业, 2014, 36(4): 320-328. ZENG B B, HUANG X X, WEI L K, et al. Suitable culture conditions and cellular biochemical composition of three diatoms from brackish water[J]. Marine Fisheries, 2014, 36(4): 320-328. DOI:10.3969/j.issn.1004-2490.2014.04.005 |
| [18] |
俞军, 袁海兰, 欧仁建, 等. 水霉菌生物膜体外模型构建及结构特征[J]. 中国预防兽医学报, 2015, 37(9): 669-673. YU J, YUAN H L, OU R J, et al. Establishment of in vitro model of Saprolegnia biofilm and investigation on its structural characteristics[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(9): 669-673. DOI:10.3969/j.issn.1008-0589.2015.09.05 |
| [19] |
PRIYA M V, SABITHA M, JAYAKUMAR R. Colloidal chitin nanogels:a plethora of applications under one shell[J]. Carbohydrate Polymers, 2016, 136: 609-17. DOI:10.1016/j.carbpol.2015.09.054 |
| [20] |
LIU C L, LAN C Y, FU C C, et al. Production of hexaoligochitin from colloidal chitin using a chitinase from Aeromonas schubertii[J]. International Journal of Biological Macromolecules, 2014, 69: 59-63. DOI:10.1016/j.ijbiomac.2014.05.028 |
| [21] |
王俊丽, 聂国兴, 李素贞, 等. DNS法测定还原糖含量时最适波长的确定[J]. 河南农业科学, 2010, 39(4): 115-118. WANG J L, NIE G X, LI S Z, et al. Optimal wavelength for determining the content of reducing sugar by DNS method[J]. Journal of Henan Agricultural Sciences, 2010, 39(4): 115-118. DOI:10.3969/j.issn.1004-3268.2010.04.032 |
| [22] |
LI Y, LEI X Q, ZHU H, et al. Chitinase producing bacteria with direct algicidal activity on marine diatoms[J]. Scientific Reports, 2016, 6: 21984. DOI:10.1038/srep21984 |
| [23] |
NGUYEN J N T, HARBISON A M. Scanning electron microscopy sample preparation and imaging[M]//ESPINA V. Molecular Profiling. New York, NY: Humana Press, 2017: 71-84.
|
| [24] |
RAD M A, AHMAD M A, NAKAJIMA M, et al. Application of environmental scanning electron microscope-nanomanipulation system on spheroplast yeast cells surface observation[J]. Scanning, 2017, 2017: 8393578. |
| [25] |
YUE X P, LI Q, WANG H W, et al. Scanning electron microscopy of the nail plate in onychomycosis patients with negative fungal culture[J]. Scanning, 2016, 38(2): 172-176. DOI:10.1002/sca.21252 |
| [26] |
马健荣, 刘明, 徐信, 等. 硅藻研究与应用展望[J]. 山东农业科学, 2010(8): 52-56. MA J R, LIU M, XU X, et al. Prospect in research and application of diatoms[J]. Shandong Agricultural Sciences, 2010(8): 52-56. DOI:10.3969/j.issn.1001-4942.2010.08.018 |
| [27] |
苏秀榕, 秦松, 骆其君, 等. 浙江沿海藻类共生细菌的生理生化特性研究[J]. 生态环境学报, 2005, 14(2): 239-241. SU X R, QIN S, LUO Q J, et al. Physiology and biochemistry characteristic of symbiosis bacteria on algae of Zhejiang coast[J]. Ecology and Environment, 2005, 14(2): 239-241. DOI:10.3969/j.issn.1674-5906.2005.02.021 |
| [28] |
刘志刚, 蒋胡艳, 张晓可, 等. 长江江豚杀鲑气单胞菌的分离鉴定及生物学特性分析[J]. 兽类学报, 2018, 38(6): 562-571. LIU Z G, JIANG H Y, ZHANG X K, et al. Identification and characterizations of Aeromonas salmonicida isolated from Yangtze finless porpoise[J]. Acta Theriologica Sinica, 2018, 38(6): 562-571. |
| [29] |
王博, 闫展燕, 孔令聪, 等. 一株山羊源杀鲑气单胞菌的分离、鉴定及药物敏感性检测[J]. 中国兽药杂志, 2018, 52(4): 1-6. WANG B, YAN Z Y, KONG L C, et al. Isolation, Identification and Antimicrobial Susceptibility Test of Aeromonas salmonicida from Goat[J]. Chinese Journal of Veterinary Drug, 2018, 52(4): 1-6. |
2. The Key Laboratory of Exploration and Unilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


