2. 上海水产品加工及贮藏工程技术中心, 上海 201306;
3. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
邻苯二甲醛(OPA)消毒剂由于其具有更强的杀菌能力、更广泛的杀菌范围、使用浓度低灭菌时间短、毒性小及性质稳定等优点成为了新一代医用消毒剂[1-4]。然而,OPA具有强烈挥发性,长时间使用后其浓度会降低。为保证灭菌效果,需对OPA的浓度进行经常性检测。目前报道检测邻苯二甲醛的方法主要有检测纸[5]、滴定法、分光光度法[6]以及色谱法[7]等,这些方法均具有一定的局限性[8],诸如肉眼比色不精确、滴定法繁琐费时、紫外法存在背景干扰、色谱仪器昂贵不经济等。
研究发现,在碱性条件下,OPA和β巯基乙醇(βME)与氨基发生化学反应,衍生出一种蓝色荧光的异吲哚类物质[9-12]。例如朱广华等[13]利用L-组氨酸与OPA进行衍生反应荧光检测OPA。本研究建立一种新型的OPA比率型荧光检测法,基于荧光蛋白R-藻红蛋白(R-PE)与OPA在βME存在的碱性环境下可以发生荧光衍生反应,反应过程中,R-PE在578 nm处的荧光逐渐消退,其衍生产物在430 nm处荧光逐渐增强,一强一弱的荧光信号构成了检测OPA的比率型荧光探针。
1 材料与方法 1.1 材料与仪器 1.1.1 实验材料R-PE晶体购于上海朗雅生物科技有限公司,OPA标准品、βME、十二烷基硫酸钠(SDS)、碳酸钠、碳酸氢钠、盐酸、氢氧化钠均购买于国药集团化学试剂有限公司。OPA消毒剂购买自山东利尔康医疗科技股份有限公司。
1.1.2 仪器与设备紫外-可见分光光度计(UV-3900,Hitachi,日本);荧光光谱仪(FS5,Thermo Scientific,英国);NanoDrop(2000C,Thermo Scientific,英国);超滤离心管(100 ku,生工生物工程股份有限公司,上海); 迷你涡旋混合器(Mixer 4K,生工生物工程股份有限公司,上海);电子分析天平(AE200,Mettler Toledo,上海); pH计(320A/C,Mettler Toledo,上海);小型高速冷冻离心机(5415R,Eppendorf,德国);移液枪(Eppendorf,德国)。
1.2 实验方法 1.2.1 溶液的配置0.5 mol/L碳酸盐缓冲液:准确称取3.70 g碳酸氢钠以及0.60 g碳酸钠,用超纯水定容至100 mL,用盐酸或氢氧化钠调节pH至8~11。不用时应妥善保存,以防环境中CO2溶解于水从而使溶液偏酸或者溶液中释放出CO2使溶液偏碱。
OPA储备液(1 mg/mL):将1 mg OPA加入到1 mL纯水中,45 ℃的水浴加热直至完全溶解,之后冷却至室温,用锡箔纸包好放在4 ℃冰箱中作为储备液。
βME储备液(0.1 mg/mL):准确移取89 μL βME,用超纯水定容至1 mL,包装紧密以防挥发产生刺激性气味。
SDS储备液(20%,质量体积比):用分析天平准确称取SDS 0.4 mg,用超纯水定容至2 mL,室温下保存备用。
R-PE溶液:将R-PE晶体在4 ℃下以3 200 r/min离心15 min,将上清液完全去除后,将沉淀物溶解在50 mmol/L磷酸盐缓冲溶液(PBS, pH =7.5, 50 mmol/L NaCl)中。之后,将获得的R-PE溶液用移液枪加入到100 ku超滤管中,在4 ℃下以3 200 r/min离心15 min,除去少量杂质以及过量的盐。重复洗涤4次,最后收集到100 μL R-PE溶液,并用NanoDrop确定其浓度为50 mg/mL,纯度(A565 nm/A280 nm)为5.6。用锡箔纸包好放在4 ℃冰箱中备用。
1.2.2 OPA的荧光检测在100 μL 50 mmol/L碳酸盐缓冲液(pH=10.5)体系中,包含50 μg/mL R-PE溶液,4% w/v的SDS,1 μg/mL βME,以及系列浓度(0~200 μg/mL)OPA溶液。设定激发波长和发射波长的扫描范围,λex=345 nm,λem=370~700 nm,用FS5型荧光光谱仪(配有Xe灯及100 μL微量石英比色皿)对各个浓度的溶液进行扫描,激发、发射的狭缝宽度均为1 cm。以OPA浓度为横坐标,以两个通道的荧光比率(I430 nm/I578 nm)为纵坐标绘制标准曲线。
1.2.3 实际样品的检测将市售OPA消毒剂稀释100倍,然后再加入不同浓度OPA标准溶液(20、50、100 μg/mL),制备3个实际样品。用建立的荧光方法对上述样品中OPA进行定量检测,每个样品平行测定3次取平均值,计算其加标回收率。
2 结果与讨论 2.1 实验原理如图 1所示,本实验构建一个基于R-PE与OPA衍生法的比率型荧光探针来检测OPA含量。整个探针体系由3部分构成:R-PE、βME和SDS。R-PE含有丰富的氨基酸,使用过量的SDS去折叠后,会将所有的伯胺分子暴露出来,之后在βME存在的碱性环境下,与OPA的醛基发生衍生反应,通过分子重排形成共轭吡咯环,生成取代的异吲哚类物质,这种物质在光谱的蓝色区域发出强烈的荧光[14]。随着OPA的浓度不断增加,R-PE本身位于578 nm处的橙红色荧光强度逐渐减弱,衍生的异吲哚类物质位于430 nm处的蓝色荧光逐渐增强,从而构成比率荧光信号用于OPA的检测。
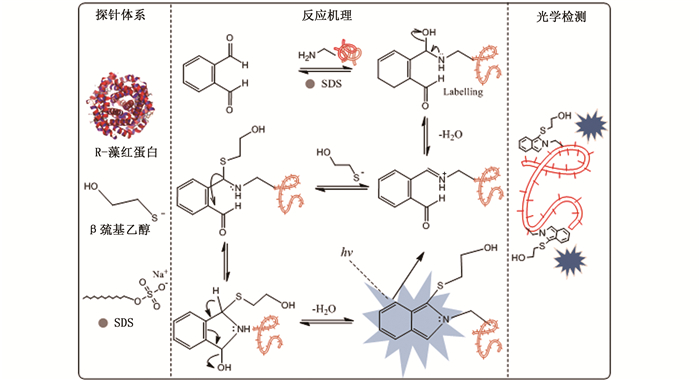
|
图 1 邻苯二甲醛的检测原理示意图 Fig. 1 Schematic diagram of detection principle of the o-phthalaldehyde |
如图 2所示,在280~400 nm紫外可见光谱区域内,单独的SDS、βME与OPA以及三者的混合物在345 nm处均没有吸收峰,而在加入R-PE后,产生了新的345 nm的吸收峰,结果表明,在该体系下,OPA与蛋白的氨基生成了新的荧光衍生产物,这一结果与前人的研究[15]数据基本吻合。如图 3所示,R-PE探针体系与OPA反应后产生的荧光衍生物的激发波长为345 nm,发射波长为430 nm。
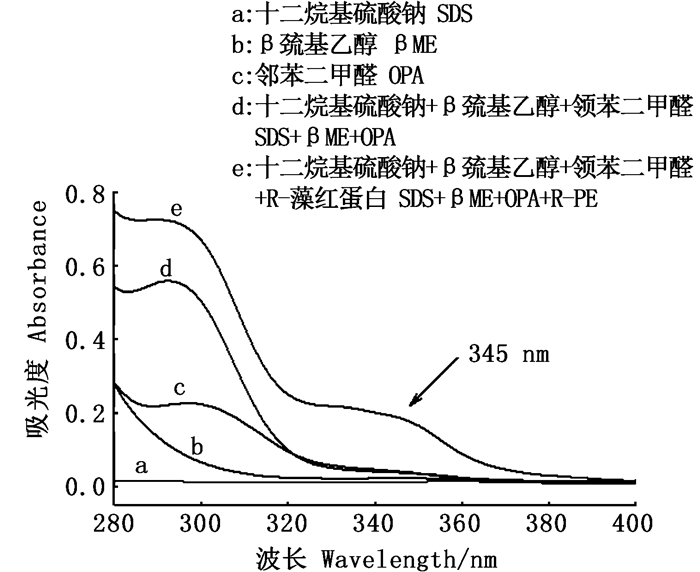
|
图 2 不同条件下的紫外可见吸收光谱 Fig. 2 UV-vis absorption spectra under different conditions |
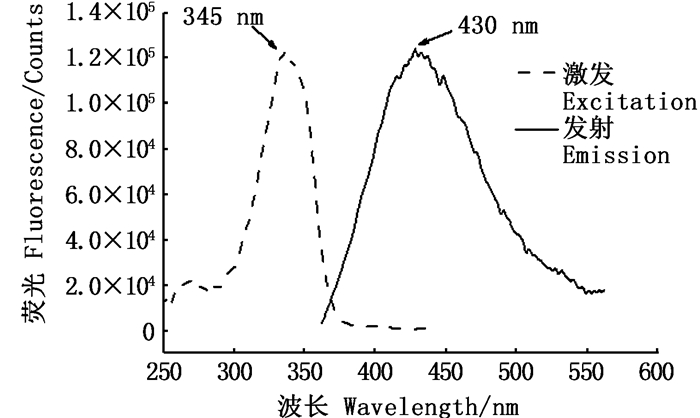
|
图 3 衍生产物的激发和发射光谱 Fig. 3 Excitation and emission spectra of the derivative |
优化了影响OPA检测探针性能的3个因素:SDS浓度、βME浓度和缓冲液pH。SDS是影响探针灵敏度的关键因素,主要作用是使R-PE去折叠,将所有的伯胺基团裸露出来,理论上SDS浓度越高,R-PE暴露的氨基就越多,但考虑到方法成本以及浓度太高时对R-PE本身荧光信号的影响,选择一个最佳浓度。如图 4所示,SDS浓度低于4% w/v时,其对蛋白本身的荧光信号并无明显影响,且在该浓度下蛋白完全可以充分去折叠[14]。当SDS浓度高于4% w/v甚至高达10% w/v时,荧光信号明显下降,因此选择4% w/v的SDS为本实验的最佳浓度。
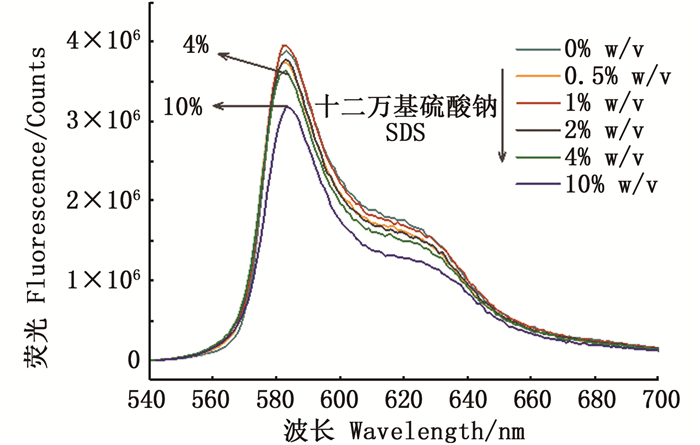
|
图 4 R-藻红蛋白在不同浓度SDS下的荧光发射图,激发波长为535 nm Fig. 4 Emission spectra of R-PE at different concentrations of SDS, λex=535 nm |
βME的浓度直接关系着反应中生成的衍生物的多少,是检测OPA的另一关键因素。图 5(a)显示,βME对R-PE探针本身的荧光强度并无影响,因此只需考察其对衍生产物的荧光强度的影响。由图 5(b)可知,在50 μg/mL R-PE溶液、4% w/v的SDS以及100 μg/mL OPA体系下,在0~1 μg/mL βME浓度范围内,衍生物的荧光强度随βME浓度的增加而增强,达到1 μg/mL后,荧光强度基本不再增加,因此选择1 μg/mL为OPA检测体系中βME的最佳浓度。
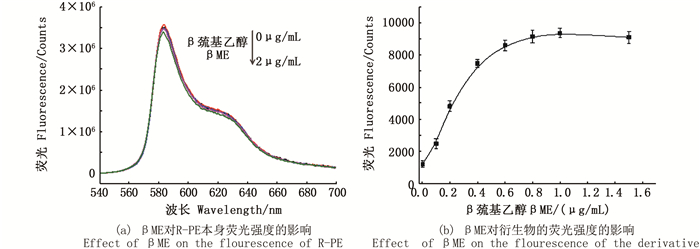
|
图 5 βME对OPA检测体系的影响,激发波长为535 nm Fig. 5 Effect of βME on the detection system of OPA, λex=535 nm |
由于pH被认为是影响上述反应进程的重要因素,本实验在pH 8.0~11.0范围内考察了pH的影响,并以衍生物与R-PE探针的荧光强度的比值变化来评价OPA检测体系的性能。图 6表明:在pH 10.5以下,荧光强度的比值随着pH的逐渐增大而增强; 在pH为10.5时,荧光强度的比值达到最大值,超过10.5以后,荧光强度的比值有所下降。因此, 本实验的最优pH为10.5。
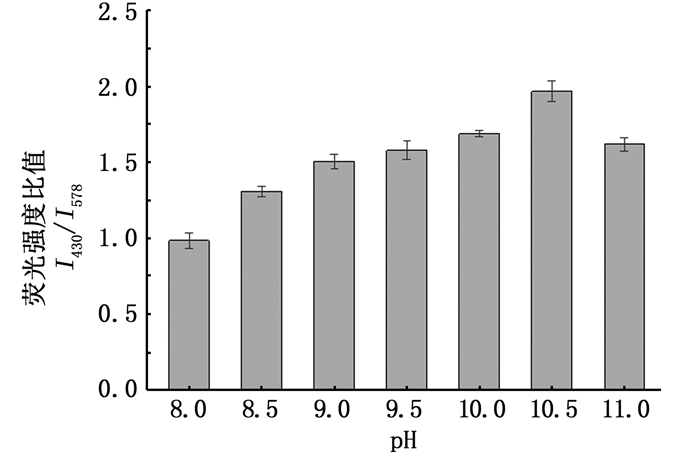
|
图 6 pH对邻苯二甲醛检测体系的影响 Fig. 6 Effect of pH on the detection system of o-phthalaldehyde |
因为比率荧光信号的变化取决于R-PE与OPA发生化学反应的速率,同时反应速率的快慢决定整个检测时间的长短,故本实验考察了检测时间对荧光强度比值变化的影响。由图 7可以看出,R-PE与OPA反应后,荧光强度的比值逐渐增加,3 min后基本达平衡,而6 min后荧光强度比值开始下降。这是因为上述衍生反应具有一定的可逆性[17],生成的荧光衍生物不稳定[18],反应时间过长不利于检测的稳定性,因此最好在反应3~6 min内完成OPA检测。
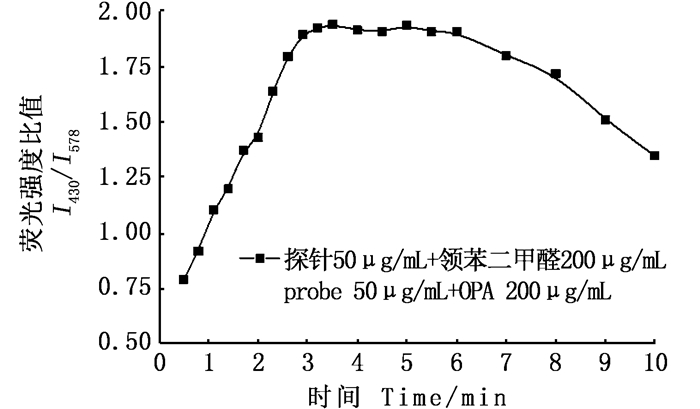
|
图 7 反应时间对邻苯二甲醛检测的影响曲线 Fig. 7 Influence curve of time on o-phthalaldehyde detection |
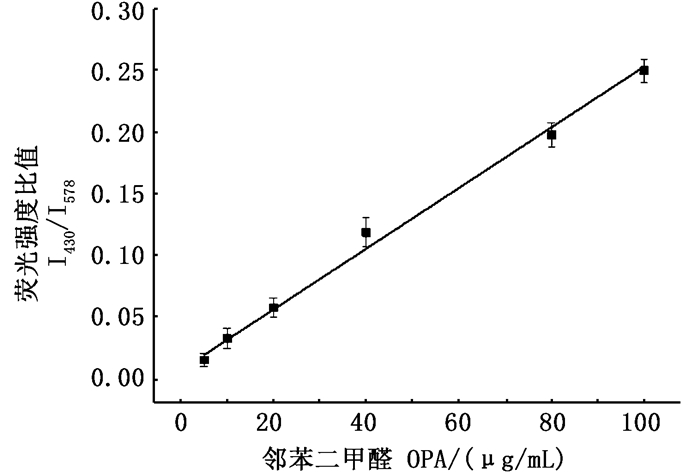
在优化条件下,测定了该探针在50 mmol/L碳酸盐缓冲液(pH=10.5)中与不同浓度OPA (0~200 μg/mL)衍生时的荧光光谱变化,激发波长固定为345 nm,发射波长分别为430 nm(衍生物)以及578 nm(R-PE)。如图 8所示,随着OPA浓度的增加,578 nm处荧光强度逐渐降低,430 nm处荧光强度逐渐增强。当OPA浓度在5~100 μg/mL时,两个波长处荧光强度的比值(I430/I578)和OPA浓度之间具有良好的线性关系(图 9),线性方程:y=0.002 5 x + 0.007 4,R2=0.992,根据3δ/S(δ为11次空白测定的标准偏差,S为标准曲线的斜率)计算其检测限为1.7 μg/mL,与紫外分光光度法及滴定法[8]相比,检测限更低,灵敏度更高。
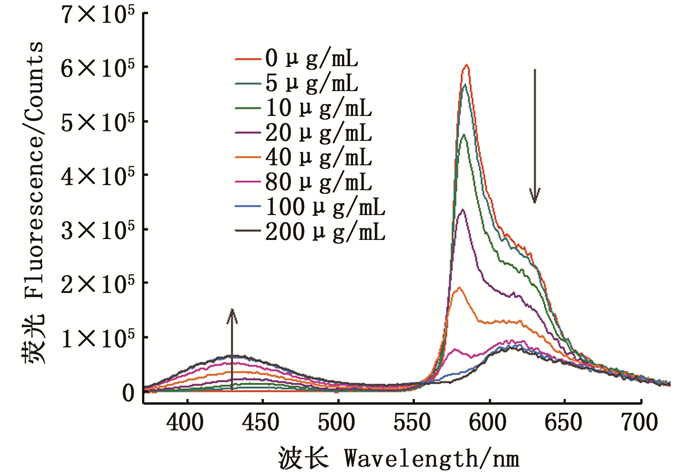
|
图 8 探针与不同浓度的邻苯二甲醛衍生后的荧光光谱,激发波长为345 nm Fig. 8 Fluorescence emission spectra of theprobe at different concentrations of OPA, λex=345 nm |
|
图 9 荧光强度比值与邻苯二甲醛浓度的线性曲线 Fig. 9 Fluorescence intensity ratio plotted against the concentration of OPA |
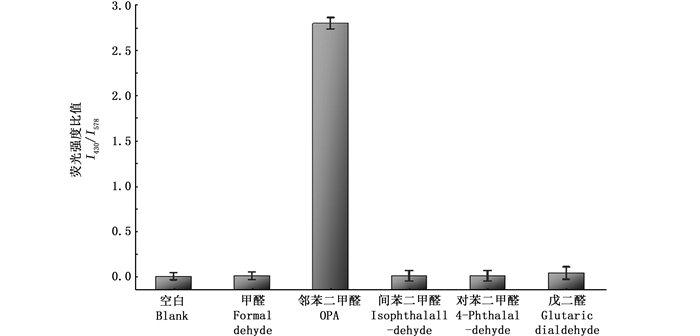
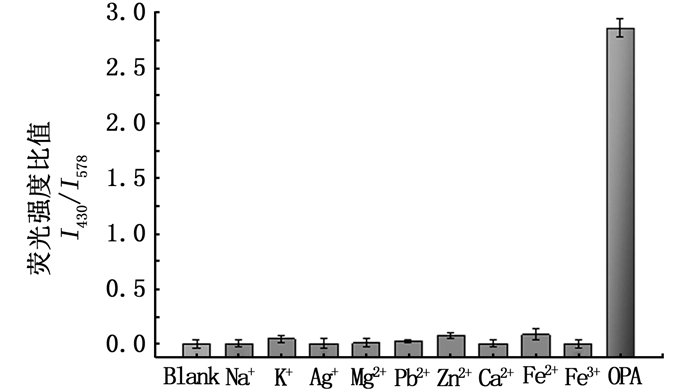
为评价该探针的选择性,测定探针与不同的醛类物质反应后的荧光强度比值。如图 10所示,与空白样品相比,探针与其他醛类物质反应后I430/I578的值变化较小,而只有与OPA衍生后,其荧光强度的比值变化近2.9倍,这表明该探针对OPA的检测具有较高的选择性。本实验同时探讨了消毒剂中存在的一些金属离子对探针检测性能的干扰,如图 11所示,消毒剂样品中可能存在的一些金属离子对于OPA的检测基本没有影响。上述结果表明,该荧光探针可应用于市售消毒液中OPA的检测。
|
图 10 探针在相同浓度条件下对不同醛类物质的选择性 Fig. 10 Response of the probe to different aldehydes at the same concentration |
|
图 11 探针在相同浓度条件下对不同金属离子的响应 Fig. 11 Response of the R-PE probes to different metal ions at the same concentration |
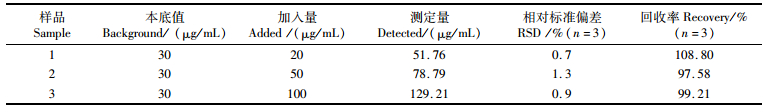
为了验证探针在OPA消毒剂实际样品中的适用性,采用加标回收法,将不同浓度OPA(20、50、100 μg/mL)加入到100倍稀释的消毒液中,制备3个实际样品。根据上述方法测定OPA含量,每个样品测定3次,计算其加标回收率。
回收率实验结果(表 1)显示,经对OPA消毒液含量测定,重复测定3次,其加标回收率为97.58%~108.80%,说明本实验所建立的方法可以准确测定OPA消毒液含量。
|
表 1 消毒液实际样品中OPA的检测 Tab.1 Determination of OPA in disinfectant samples |
目前报道的检测OPA的方法主要包括检测纸、滴定法、紫外分光光度法、高效液相色谱以及气相色谱法等。这些方法都各有其优缺点,其中:检测纸通过颜色比较肉眼观察,结果并不准确;化学滴定法繁琐费时,常因样品中成分的干扰而不能准确测定;利用OPA本身在258 nm处的最大吸收进行紫外分光光度法检测,不能排除其他物质在紫外区域存在吸收而造成干扰;液相与气相色谱法通过一定的条件优化可以消除其他物质的干扰,然而其仪器昂贵,操作复杂,不经济实用。荧光衍生法因其操作方便、灵敏度高、成本低等固有优势而获得了广泛的研究兴趣,朱广华等[13]通过L-组氨酸在pH为8的体系中与OPA反应形成新的复合物,在376 nm最大吸收处用分光光度法进行检测。郑洪等[19]也利用L-组氨酸与OPA在pH为11的介质中反应,形成新的荧光复合物,在440 nm的激发下检测其在540 nm发射处的荧光强度。这些方法都需要进行衍生反应,且还是利用传统的非比率型荧光法进行检测。
本研究基于RPE与OPA的衍生化反应,建立了一种高灵敏、高选择性的比率型荧光探针检测OPA。该检测方法的线性检测范围为5~100 μg/mL,最低检测限可达1.7 μg/mL,与夏菁等[6]、吴兆凤等[7]和宋金武等[8]的研究相比,灵敏度及选择性更好。传统的荧光光度法虽然操作简单且检测灵敏度高,但其检测结果的精确性容易受到外界环境的干扰[18],而比率型荧光利用两个不同发射波长处的荧光强度的比值作为响应信号,不受仪器以及环境的影响,其灵敏度及选择性大大提高。同时,本实验以稀释的市售消毒液为实际样品,利用加标回收方法评价该探针的精密度和可靠性,结果满意。因此,可将该方法用于实际消毒液样品中OPA含量的测定。
| [1] |
AKAMATSU T, MINEMOTO M, UYEDA M. Evaluation of the antimicrobial activity and materials compatibility of orthophthalaldehyde as a high-level disinfectant[J]. Journal of International Medical Research, 2005, 33(2): 178-187. |
| [2] |
肖雪琴, 王芬, 张吉桂, 等. 邻苯二甲醛与戊二醛对软式内镜消毒的经济效益对比研究[J]. 中华医院感染学杂志, 2012, 22(21): 4827-4829. XIAO X Q, WANG F, ZHANG J G, et al. Comparative study on economic benefits of o-phthalaldehyde and glutaraldehyde for disinfection of soft endoscopes[J]. Chinese Journal of Nosocomiology, 2012, 22(21): 4827-4829. |
| [3] |
CATLIN N R, WILLSON C J, STOUT M, et al. Evaluation of the respiratory tract toxicity of ortho-phthalaldehyde, a proposed alternative for the chemical disinfectant glutaraldehyde[J]. Inhalation Toxicology, 2017, 29(9): 414-427. |
| [4] |
徐文体.邻苯二甲醛消毒性能的研究[D].福州: 福建医科大学, 2004. XU W T. Study of disinfectant properties of ortho-phthalaldehyde[D]. Fuzhou: Fujian Medical University, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10392-2004121582.htm |
| [5] |
汪欣, 彭磊, 于萍, 等. 邻苯二甲醛消毒液浓度快速检测试纸研究[J]. 中国消毒学杂志, 2017, 34(11): 1020-1023. WANG X, PENG L, YU P, et al. Study on a rapid test strip of o-phthalaldehyde concentration in disinfectants[J]. Chinese Journal of Disinfection, 2017, 34(11): 1020-1023. |
| [6] |
夏菁, 王悦, 常静, 等. 邻苯二甲醛消毒剂性能与含量测定方法研究[J]. 中华医院感染学杂志, 2016, 26(5): 1165-1167. XIA J, WANG Y, CHANG J, et al. Research on property and measurement of OPA[J]. Chinese Journal of Nosocomiology, 2016, 26(5): 1165-1167. |
| [7] |
吴兆凤, 余裕娟, 廖如燕. 两种色谱法测定邻苯二甲醛含量比较研究[J]. 中国消毒学杂志, 2015, 32(7): 641-643, 646. WU Z F, YU Y J, LIAO R Y. Comparison of two chromatography methods for determination of o-phthalaldehyde content[J]. Chinese Journal of Disinfection, 2015, 32(7): 641-643, 646. |
| [8] |
宋金武, 阙绍辉, 蔡建华, 等. 消毒剂中邻苯二甲醛含量测定方法比较[J]. 中国卫生检验杂志, 2014, 24(5): 630-632. SONG J W, QUE S H, CAI J H, et al. Comparison of different methods for determination of ortho-phthalaldehyde in disinfectants[J]. Chinese Journal of Health Laboratory Technology, 2014, 24(5): 630-632. |
| [9] |
STERNSON L A, STOBAUGH J F, REPTA A J. Rational design and evaluation of improved o-phthalaldehyde-like fluorogenic reagents[J]. Analytical Biochemistry, 1985, 144(1): 233-246. |
| [10] |
JONES B N, GILLIGAN J P. O-phthaldialdehyde precolumn derivatization and reversed-phase high-performance liquid chromatography of polypeptide hydrolysates and physiological fluids[J]. Journal of Chromatography A, 1983, 266: 471-482. |
| [11] |
李铉军, 韩玲, 朱爱花, 等. 邻苯二甲醛荧光衍生化法测定食用海藻中还原型谷胱甘肽[J]. 食品工业科技, 2012, 33(22): 81-83, 91. LI X J, HAN L, ZHU A H, et al. Determination of glutathione in edible marine algae using OPA fluorescence derivatizing method[J]. Science and Technology of Food Industry, 2012, 33(22): 81-83, 91. |
| [12] |
KULLA E, ZUMAN P. Reactions of orthophthalaldehyde with ammonia and 2-aminoethanol[J]. Organic & Biomolecular Chemistry, 2008, 6(20): 3771-3780. |
| [13] |
朱广华, 胡永桢, 郑洪, 等. L-组氨酸分光光度法测定消毒剂中的邻苯二甲醛[J]. 分析科学学报, 2003, 19(5): 478-479. ZHU G H, HU Y Z, ZHENG H, et al. Spectrophotometric determination of o-phthalaldehyde by using L-histidine[J]. Journal of Analytical Science, 2003, 19(5): 478-479. |
| [14] |
YATES E V, MÜLLER T, RAJAH L, et al. Latent analysis of unmodified biomolecules and their complexes in solution with attomole detection sensitivity[J]. Nature Chemistry, 2015, 7(10): 802-809. |
| [15] |
王燚, 龙云飞, 黄承志, 等. 邻苯二甲醛-β-巯基乙醇组合试剂可视化荧光检测多巴胺[J]. 分析化学, 2007, 35(12): 1741-1744. WANG Y, LONG Y F, HUANG C Z, et al. Visual detection of dopamine with o-phthaldialdehyde-β-mercaptoethanol fluorogenic reagent[J]. Chinese Journal of Analytical Chemistry, 2007, 35(12): 1741-1744. |
| [16] |
YOSHIMURA T, KANEUCHI T, MIURA T, et al. Kinetic analysis of the fluorescence reaction of histamine with orthophthalaldehyde[J]. Analytical Biochemistry, 1987, 164(1): 132-137. |
| [17] |
MAY M E, BROWN L L. Instabllity of orthophthalaldehyde reagent for amino acid analysis[J]. Analytical Biochemistry, 1989, 181(1): 135-139. |
| [18] |
LEE M H, KIM J S, SESSLER J L. Small molecule-based ratiometric fluorescence probes for cations, anions, and biomolecules[J]. Chemical Society Reviews, 2015, 44(13): 4185-4191. |
| [19] |
郑洪, 朱广华. 邻苯二甲醛的荧光光度法测定[J]. 光谱实验室, 2003, 20(4): 533-536. ZHENG H, ZHU G H. Fluorimetric determination of o-phthalaldehyde[J]. Chinese Journal of Spectroscopy Laboratory, 2003, 20(4): 533-536. |
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


