2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学 中国科学技术部海洋生物科学国际联合研究中心, 上海 201306;
4. 同济大学附属上海市肺科医院 上海市结核病(肺)重点实验室, 上海 200433;
5. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
副溶血弧菌(Vibrio parahaemolyticus,Vp)是人-兽-鱼共患性细菌,能够引起人或者动物的严重腹泻和败血症,引起的食品安全问题也日趋严重,给国家和人民群众带来巨大的经济损失[1]。但是关于副溶血弧菌对宿主的动态感染过程以及与嗜中性粒细胞之间的相互作用机制目前还不清楚。
斑马鱼(Danio rerio)受精卵体外发育、胚胎透明,可利用荧光示踪的转基因鱼系直接活体观察免疫细胞发挥功能的行为和过程[2],获得了越来越多研究者的青睐[3-4]。此外,斑马鱼胚胎和3周之内的幼鱼只具备天然免疫系统[5],对于研究天然免疫应答的过程和机制具有独特的优势。而且,其显微注射靶部位有多种解剖结构,包括尾静脉、居维管、后脑室、尾肌、耳泡、脊索和卵黄[6],其中耳泡和后脑室感染已被用来研究嗜中性粒细胞和巨噬细胞的招募和趋化作用[7-8]。
嗜中性粒细胞是斑马鱼体内数量最丰富的天然免疫效应细胞,其形态、行为和功能与哺乳动物嗜中性粒细胞相似,被广泛应用于建立人类嗜中性粒细胞疾病的模型[9]。目前,已有研究利用鼠伤寒沙门杆菌(Salmonella typhimurium)耳泡感染斑马鱼幼鱼的局部感染模型,探究嗜中性粒细胞的招募过程以及介导的宿主效应机制[7]。
关于副溶血弧菌的感染途径,以及被嗜中性粒细胞等免疫细胞进行清除的过程和作用机制目前研究较少。本文以受精后48 h(hours post fertilization,hpf)的斑马鱼幼鱼作为研究对象,建立副溶血弧菌耳泡局部感染模型,激活天然免疫应答,并利用荧光显微镜活体观察大肠杆菌和副溶血弧菌感染过程以及与嗜中性粒细胞之间的相互作用动态变化过程,并进一步分析炎症细胞因子的表达量变化,为探究细菌引起宿主的天然免疫应答的作用机制提供实验模型依据。
1 材料与方法 1.1 实验动物及细菌实验所用野生斑马鱼购于中国科学院上海生命科学研究院斑马鱼平台的AB品系。嗜中性粒细胞标记绿色荧光的斑马鱼鱼系Tg(mpx:GFP)由美国加利福尼亚大学洛杉矶分校(University of California,Los Angeles,UCLA)林硕教授惠赠,参照网站(zfin.org)规范养殖斑马鱼。副溶血弧菌Vp57由上海洋大学食品学院赵勇教授惠赠,Vp57RFP为本实验室标记红色荧光蛋白菌株[10];大肠杆菌Ec01由本实验室分离得到。细菌感染实验按照上海海洋大学动物伦理委员会的相关规定进行(SHOU-DW-2016-002)。
1.2 实验试剂实验试剂包括:TRIzolⓇReagent(Invitrogen,15596-9026)、Light CyclerⓇ SYBR Green ⅠMaster(Roche,04887352001)、cDNA synthesis kit(TaKaRa,Japan)、DEPC(Life Science Products & Services,1609-47-8)、PTU(1-Phenyl-2-thiourea,1-苯基-2-硫脲,Sigma,P7629)、氯仿(Life Science Products & Services,865-49-6)、异丙醇(TEDIA,PS2032-002)、MS-222(Sigma,1001013176)、LB培养基(Sangon Biotech,A507002)和氯化钠(Sigma,7647-14-5)。
1.3 实验仪器实验仪器包括:Milli-Q Direct 8超纯水系统(Millipore,Milli-Q Direct 8)、离心机(eppendorf,5810R)、恒温摇床(Innova,40R)、高端立体显微镜(Zeiss,SteREO Discovery.V8)、微量注射泵(Warner Instruments,PLI-100A Plus)、荧光正置显微镜(Zeiss,Axio Imager2)、实时荧光定量PCR系统(Roche,LightCyclerⓇ 480II)、PCR仪(Bio-Rad,c1000 TouchTMThermal Cycler)、电泳仪(Bio-Rad,PowerPac)和全自动组织匀浆仪(MP Bio,FastPrepⓇ-24)。
1.4 实验方法 1.4.1 细菌感染斑马鱼幼鱼耳泡实验选取处于3~6月龄的成年斑马鱼进行产卵,当胚胎发育至24 hpf时,添加PTU抑制色素,28.5℃培养至48 hpf。吸取副溶血弧菌Vp57RFP菌株和大肠杆菌Ec01菌株的冻存液,按1: 10分别加入到LBS(LB培养基中加入3 %的NaCl)和LB的液体培养基中,37 ℃,200 r/min过夜培养,然后分别转接到LBS和LB液体培养基中培养至对数期,细菌培养液4 000 r/min离心5 min,收集的细菌用PBS洗3次,最后稀释菌液到109 CFU/mL(CFU,Colony-Forming Unit)为原始浓度,其他浓度的菌液用PBS梯度稀释获得。根据OLIVEIRA等[7]的注射方法进行斑马鱼幼鱼耳泡感染,略有改动,将稀释好浓度的菌悬液加入显微注射针,滴加一滴矿物油到带有标尺的测微尺上,将菌液打进矿物油内,在显微镜下观察菌液液滴大小,通过调整注射压力使注射体积为1 nL,对发育到48 hpf的斑马鱼幼鱼进行感染,30尾斑马鱼幼鱼为一组。对照组注射1 nL PBS为阴性对照,每组设置3个平行实验。感染后放置于培养皿中,于28.5 ℃恒温培养箱养殖,观察统计12、24、36、48、72以及96 h的累积死亡数,取3个平行实验的平均值,利用Bliss法计算细菌感染斑马鱼幼鱼后96 h的LD50(median lethal dose,LD50)值,并利用GraphPad Prism 7软件绘制存活曲线。
1.4.2 细菌感染斑马鱼幼鱼耳泡后嗜中性粒细胞的动态变化将发育到48 hpf的斑马鱼幼鱼浸泡于终浓度为0.3 mg/mL的MS-222中进行麻醉处理,并利用高端立体显微镜对注射位点进行拍摄。为了分析斑马鱼幼鱼招募到耳泡内嗜中性粒细胞的行为和细菌的感染过程,将Ec01和Vp57RFP分别培养至对数期后进行收集,4 000 r/min离心5 min,PBS洗3次,最后稀释菌液约为108 CFU/mL,即为感染剂量,将稀释好的菌液分别对发育到48 hpf的斑马鱼幼鱼进行感染,并分别在感染6、12、24和48 h时把斑马鱼幼鱼浸泡于终浓度为0.3 mg/mL的MS-222中进行麻醉处理,利用荧光正置显微镜对细菌和嗜中性粒细胞的相互作用过程进行可视化拍摄。图像由Adobe Illustrator C 2018软件进行处理。
1.4.3 RNA提取和荧光定量PCREc01和Vp57RFP分别耳泡显微注射感染斑马鱼幼鱼,同时注射PBS为阴性对照,8尾/组,每组包含3个生物学重复,分别在注射后6、12、24和48 h收集感染组和对照组整胚胎斑马鱼幼鱼到Trizol中,匀浆混匀后提取总RNA,将RNA反转录为cDNA后,保存到-80 ℃。使用Primer 6.0软件设计RT-qPCR引物,并以ef1a为内参,其中ef1a扩增效率为104.06%,il1b的扩增效率为97.20%,il10 的扩增效率为103.90%,引物序列见表 1。RT-qPCR反应体系为LightCyclerⓇ480SYBR GreenⅠMaster 10 μL,上下游引物各为1 μL(浓度为10 μmol/L),cDNA模板1 μL,RNase-free water补充体系至20 μL;RT-qPCR反应程序为95 ℃,10 s;60 ℃,30 s;40个cycles。通过2-ΔΔCt法对数据进行计算,实验结果用平均值±标准误(Mean±SEM)表示,利用GraphPad Prism 7进行作图,SPSS软件进行显著性差异分析,采用T检验和单因素方差分析(one-way analysis of varianc,ANOVA),采用LSD和Bonferroni校正多重比较。

|
表 1 RT-qPCR引物信息 Tab.1 RT-qPCR primer information |
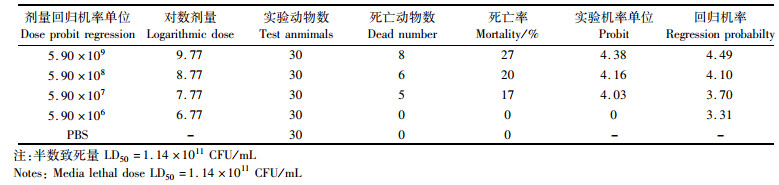
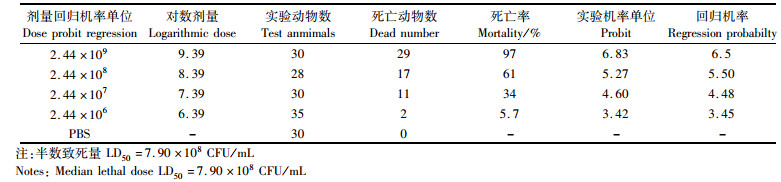
我们分别利用106、107、108和109 CFU/mL的Ec01菌株和Vp57RFP菌株耳泡注射感染48 hpf的斑马鱼幼鱼,并通过Bliss法分别计算Ec01和Vp57RFP感染斑马鱼幼鱼后96 h的LD50。Ec01感染斑马鱼幼鱼的LD50为1.14×1011 CFU/mL(表 2),Vp57RFP感染斑马鱼幼鱼的LD50为7.90×108 CFU/mL(表 3)。通过存活曲线我们发现不同感染剂量的Ec01和Vp57RFP均在感染12 h时斑马鱼幼鱼达到死亡高峰;Ec01最高剂量(109 CFU/mL)感染斑马鱼幼鱼的存活率在70%以上(图 1a),且在12 h后不再死亡;而Vp57RFP感染剂量为107 CFU/mL感染斑马鱼12 h后,斑马鱼幼鱼的存活率低于70%,感染剂量为109 CFU/mL感染斑马鱼96 h后,能够引起斑马鱼幼鱼全部死亡(图 1b)。相比较于大肠杆菌,斑马鱼幼鱼对副溶血弧菌更易感。
|
表 2 用Bliss法计算Ec01感染斑马鱼幼鱼96 h的LD50 Tab.2 Bliss method to calculate LD50 of zebrafish larvae infected with Ec01 at 96 h |
|
表 3 用Bliss法计算Vp57RFP感染斑马鱼幼鱼96 h的LD50 Tab.3 Bliss method to calculate LD50 of zebrafish larvae infected with Vp57RFP at 96 h |
|
(a)Ec01感染斑马鱼幼鱼的存活率测定;(b)Vp57RFP感染斑马鱼幼鱼存活率测定 (a) Statistics of survival rate of zebrafish larvae infected with Ec01; (b) Statistics of survival curvature of zebrafish larvae infected with Vp57RFP 图 1 存活率统计 Fig. 1 Statistics of survival rate |
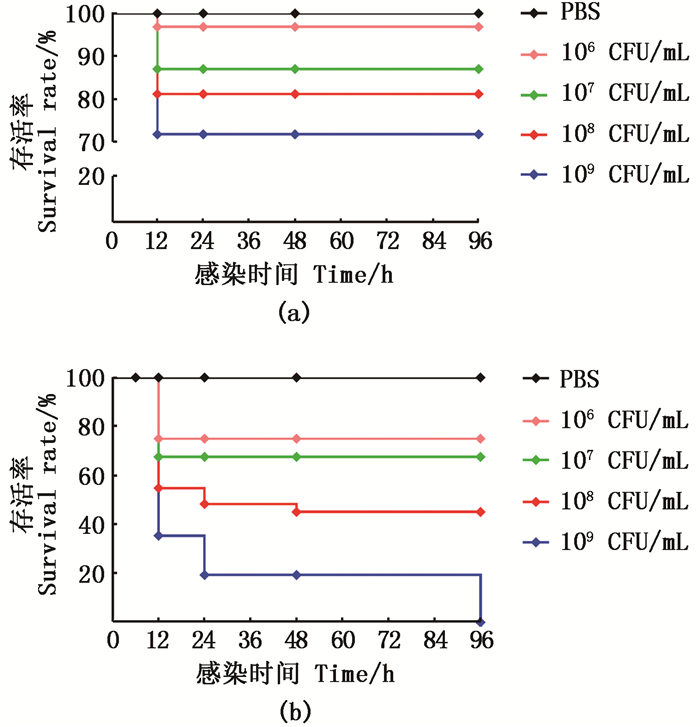
我们利用108CFU/mL的Ec01和Vp57RFP分别感染嗜中性粒细胞标记绿色荧光的Tg(mpx:GFP)斑马鱼幼鱼,在感染0、6、12、24和48 h时分别拍摄嗜中性粒细胞的招募过程。利用高端立体显微镜可清晰观察到斑马鱼耳泡是一个封闭的卵泡腔室,注射入此部位的细菌可对斑马鱼幼鱼造成局部感染(图 2 a)。我们将Ec01和Vp57RFP分别感染48 hpf斑马鱼幼鱼的耳泡,建立局部感染模型。Vp57RFP感染斑马鱼幼鱼后,随着感染时间的延长,Vp57RFP逐渐减少,直到感染后48 h(hours post infection,hpi)几乎被完全清除。与注射PBS对照组相比,Ec01菌株和Vp57RFP菌株分别感染斑马鱼幼鱼后,都能招募大量的嗜中性粒细胞到感染部位。Ec01菌株在24 hpi招募的嗜中性粒细胞的数量达到高峰,而Vp57RFP菌株在6 hpi已达到高峰,且聚集程度更强;随着感染时间的延长,Ec01菌株感染组招募嗜中性粒细胞的数量在达到高峰前一直逐渐增加,而Vp57RFP菌株感染组招募嗜中性粒细胞的数量在达到高峰后逐渐减少,但在12 hpi仍然多于Ec01感染组;直到48 hpi,嗜中性粒细胞不再聚集,机体恢复平衡状态(图 2 b)。
|
(a)高端立体显微镜下拍摄48 hpf斑马鱼幼鱼耳泡注射位置(红框为放大部位,白色虚线表示耳泡);(b)Ec01和Vp57RFP分别感染斑马鱼幼鱼后0~48 hpi招募嗜中性粒细胞的动态过程(n=10) (a) 48 hpfotic vesicle injection site diagram of zebrafish larvae (the red box is the enlarged part, and the white dotted line represents the otic vesicle); (b) The dynamic process of 0-48 hpiinzebrafish larvae infected with Ec01 and Vp57RFP respectively (n=10) 图 2 Ec01和Vp57RFP分别感染斑马鱼幼鱼后嗜中性粒细胞的招募和清除细菌的动态过程 Fig. 2 Dynamic process of neutrophils recruitment and clearance in zebrafish larvae infected with Ec01 and Vp57RFPrespectively |
我们通过RT-qPCR分别检测Ec01菌株和Vp57RFP菌株感染斑马鱼幼鱼6、12、24和48 hpi促炎性细胞因子il1b和抑炎性细胞因子 il10 的表达量变化。促炎性细胞因子il1b的表达量在PBS对照组无显著性变化(6~48 hpi);Ec01感染后,il1b的表达量呈现先显著上升后下降的趋势,在6 hpi时达到峰值(图 3 a);Vp57RFP感染后,il1b的表达量呈现先升高后降低再升高降低的趋势,在6 hpi时达到峰值,与Ec01感染不同的是,Vp57RFP在24 hpi,与PBS组相比il1b的表达量再次显著性升高(图 3 b)。抑炎性细胞因子 il10 的表达量在PBS对照组无显著性变化(6~48 hpi);Ec01感染后,il10 基因呈现出先降低再升高的趋势,但升高趋势差异不显著,在6 hpi时,与PBS对照组相比 il10 的表达量显著性下降,而在12、24和48 hpi时的表达量与PBS对照组无显著性差异(图 3 c);与Ec01不同,Vp57RFP感染后,il10 的表达量呈现先显著性降低再逐渐升高的趋势,Vp57RFP在6 hpi显著性降低后,随着感染时间的延长,il10 的表达量分别在12、24和48 hpi时逐渐递增,且都显著性高于6 hpi时 il10 的表达量(图 3 d)。
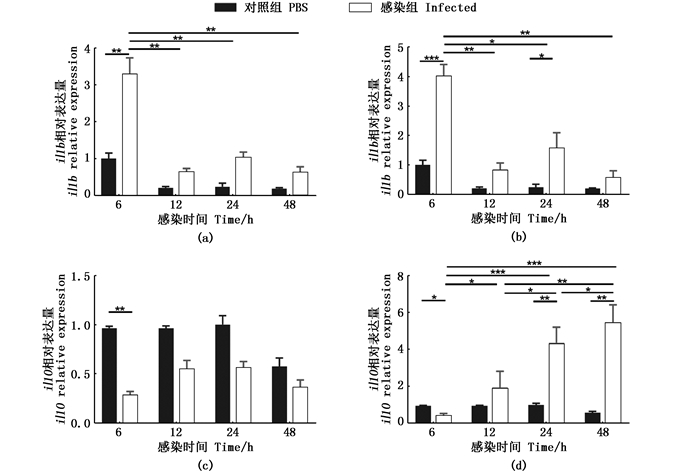
|
(a、c)Ec01感染斑马鱼幼鱼后il1b、il10 分别在各个时间点的表达量变化;(b、d)Vp57RFP感染斑马鱼幼鱼后il1b、il10 分别在各个时间点的表达量变化。*P < 0.05,**P < 0.01,***P < 0.001为有显著统计学差异,无显著性差异未显示 (a.c) Changes in expression of il1b and il10 at various time points after zebra fish larvae infection with Ec01, respectively; (b.d) Changes in expression of il1b and il10 at various time points after zebrafish larvae infection with Vp57RFP, respectively *P < 0.05, **P < 0.01, ***P < 0.001 represents statistical significance, no significant difference is not shown 图 3 Ec01和Vp57RFP分别感染后的炎症相关基因的表达量变化 Fig. 3 Changes in the expression levels of inflammation-related genes after Ec01 and Vp57RFP infection, respectively |
分别利用副溶血弧菌和大肠杆菌以耳泡显微注射的方式感染斑马鱼幼鱼,建立局部感染模型。对比分析副溶血弧菌和大肠杆菌的LD50和存活曲线,发现斑马鱼幼鱼对副溶血弧菌致病菌株Vp57易感,而对大肠杆菌Ec01菌株不易感。大肠杆菌和副溶血弧菌均为重要的人兽共患菌,但致病性的大肠杆菌主要感染家禽等[11],而副溶血弧菌容易感染鱼、虾、蟹等水产品[12],我们的结果也进一步说明了副溶血弧菌是斑马鱼的易感病原,能导致斑马鱼的严重死亡,对于副溶血弧菌感染水产品和人类的防治,有一定的临床用药指导意义。
斑马鱼胚胎具有体外发育、胚胎透明、天然免疫和适应性免疫在时间上分割等独特优势,使得斑马鱼成为研究细菌感染以及活体观察免疫细胞清除病原的动态过程最合适的模式生物[13]。在以往的研究中,尽管已在斑马鱼中建立了一系列细菌感染模型,但大多数研究都集中在全身感染模型上,而对局部感染模型的建立相对较少[14]。耳泡是比较封闭的腔室,病原感染后不会扩散到邻近的组织中,是研究白细胞招募和细菌感染比较理想的感染部位[8, 15]。以耳泡显微注射感染斑马鱼幼鱼的方式,建立副溶血弧菌和大肠杆菌的局部感染模型,副溶血弧菌和大肠杆菌感染斑马鱼耳泡后,只在耳泡内局部感染,直到被完全清除。嗜中性粒细胞被认为是天然免疫系统中短期效应细胞,在抵抗细胞外病原体和急性炎症中发挥主要作用[16]。在局部感染期间,嗜中性粒细胞能快速从骨髓被招募到感染和损伤部位对病原进行吞噬清除,促进炎症的发生[17]。我们通过连续观察细菌感染斑马鱼幼鱼后嗜中性粒细胞的招募过程,结果发现,毒力较强的副溶血弧菌在感染后能够招募大量的嗜中性粒细胞到达感染部位,而毒力较弱的大肠杆菌在感染后招募的嗜中性粒细胞较少,且速度较慢。大肠杆菌和副溶血弧菌感染斑马鱼幼鱼耳泡后,均能够引起免疫应答,但对机体易感且毒性较强的副溶血弧菌能够短时间内招募大量的嗜中性粒细胞,进而快速激活免疫应答过程,促进炎症反应。
炎症细胞因子在细菌介导宿主炎症反应中发挥重要作用。在细菌感染中,机体的炎性小体被激活,诱导产生的促炎细胞因子IL-1β,可以进一步促进嗜中性粒细胞的募集和活性氧(reactive oxygen species, ROS)释放,以杀死病原体[18]。在我们的研究中,大肠杆菌和副溶血弧菌在感染早期能引起il1b的高表达,副溶血弧菌引起的il1b的表达水平更高,鱼类对感染的表征是炎症细胞因子il1b等的表达水平升高[5],由此可见这2种细菌均可以诱导天然免疫炎症反应,但副溶血弧菌能够诱导更加强烈的炎症反应。在炎症反应中,il1b首先在巨噬细胞中表达,随后在中性粒细胞中表达水平较高,而且中性粒细胞的早期和晚期的招募都需要il1b的表达,而巨噬细胞的招募则不需要,并且il1b是募集过程中白细胞自身产生的信号,能够增强中性粒细胞的活化,阻止炎症的消退[19]。KARMAKAR等的研究表明中性粒细胞是il1b对小鼠感染铜绿假单胞菌(Pseudomonas aeruginosa)产生反应的主要来源,强调了激活中性粒细胞在介导炎症中的重要性[20]。在我们的结果中,相比较于感染大肠杆菌,斑马鱼幼鱼在感染副溶血弧菌后il1b的高表达可能是通过嗜中性粒细胞的大量募集造成的,而il1b的高表达也促使嗜中性粒细胞的大量募集。抑炎细胞因子IL-10可以抑制炎症过度反应,研究表明,IL-10可以保护宿主免受金黄色葡萄球菌(Staphylococcus aureus)的全身感染[21],我们的研究发现大肠杆菌感染斑马鱼幼鱼后,il10 变化量不大,而感染副溶血弧菌6~48 h内,il10 的表达量呈现时间依赖性的逐渐升高。IL-10可以平衡炎症过度反应[17],最大限度地减少病原对宿主的损伤,阻断趋化因子受体,起到抑制促炎细胞因子的作用[22],il10 的表达量逐渐上调可以抑制由副溶血弧菌引起的过度炎症反应,从而保护斑马鱼免受副溶血弧菌的过度感染,为副溶血弧菌导致人类产生的“自限性疾病”提供了理论依据[23]。
综上所述,我们建立了一种有效的细菌耳泡感染斑马鱼幼鱼的局部感染模型,在此感染模型的基础上,我们比较分析了斑马鱼幼鱼感染副溶血弧菌和大肠杆菌后的感染过程、嗜中性粒细胞招募的动态变化以及免疫反应,并检测了在感染过程中免疫相关基因的表达水平,这将为我们进一步深入研究副溶血弧菌引起机体天然免疫应答机制奠定理论基础。
| [1] |
BROBERG C A, CALDER T J, ORTH K. Vibrio parahaemolyticus cell biology and pathogenicity determinants[J]. Microbes and Infection, 2011, 13(12/13): 992-1001. |
| [2] |
BARROS-BECKER F, LAM P Y, FISHER R, et al. Live imaging reveals distinct modes of neutrophil and macrophage migration within interstitial tissues[J]. Journal of Cell Science, 2017, 130(22): 3801-3808. |
| [3] |
TOBIN D M, MAY R C, WHEELER R T. Zebrafish:a see-through host and a fluorescent toolbox to probe host-pathogen interaction[J]. PLoS Pathogens, 2012, 8(1): e1002349. |
| [4] |
DÍAZ-PASCUAL F, ORTÍZ-SEVERÍN J, VARAS M A, et al. In vivo host-pathogen interaction as revealed by global proteomic profiling of zebrafish larvae[J]. Frontiers in Cellular and Infection Microbiology, 2017, 7: 334. |
| [5] |
SULLIVAN C, KIM C H. Zebrafish as a model for infectious disease and immune function[J]. Fish&Shellfish Immunology, 2008, 25(4): 341-350. |
| [6] |
TAKAKI K, DAVIS J M, WINGLEE K, et al. Evaluation of the pathogenesis and treatment of Mycobacterium marinum infection in zebrafish[J]. Nature Protocols, 2013, 8(6): 1114-1124. |
| [7] |
OLIVEIRA S D, LOPEZ-MUÑOZ A, MARTíNEZ-NAVARRO FJ, et al. Cxcl8-l1 and Cxcl8-l2 are required in the zebrafish defense against Salmonella typhimurium[J]. Developmental&Comparative Immunology, 2015, 49(1): 44-48. |
| [8] |
MAZON-MOYA M J, WILLIS A R, TORRACA V, et al. Septins restrict inflammation and protect zebrafish larvae from Shigella infection[J]. PLoS Pathogens, 2017, 13(6): e1006467. |
| [9] |
HARVIE E A, HUTTENLOCHER A. Neutrophils in host defense:new insights from zebrafish[J]. Journal of Leukocyte Biology, 2015, 98(4): 523-537. |
| [10] |
ZHANG Q Y, DING A, YUE Q W, et al. Dynamic interaction of neutrophils and RFP-labelled Vibrio parahaemolyticus in zebrafish (Danio rerio)[J]. Aquaculture and Fisheries, 2017, 2(6): 269-277. |
| [11] |
TIVENDALE K A, LOGUE C M, KARIYAWASAM S, et al. Avian-pathogenic Escherichia coli strains are similar to neonatal meningitis E. coli strains and are able to cause meningitis in the rat model of human disease[J]. Infection and Immunity, 2010, 78(8): 3412-3419. |
| [12] |
RASZL S M, FROELICH B A, VIEIRA CR W, et al. Vibrio parahaemolyticus and Vibrio vulnificus in South America:water, seafoodand human infections[J]. Journal of Applied Microbiology, 2016, 121(5): 1201-1222. |
| [13] |
DAVIDSON A J, ZON L I. The 'definitive'(and 'primitive') guide to zebrafish hematopoiesis[J]. Oncogene, 2004, 23(43): 7233-7246. |
| [14] |
PHENNICIE R T, SULLIVAN M J, SINGER J T, et al. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator[J]. Infection&Immunity, 2010, 78(11): 4542-4550. |
| [15] |
DENG Q, SARRIS M, BENNIN D A, et al. Localized bacterial infection induces systemic activation of neutrophils through Cxcr2 signaling in zebrafish[J]. Journal of Leukocyte Biology, 2013, 93(5): 761-769. |
| [16] |
SOEHNLEIN O, LINDBOM L. Phagocyte partnership during the onset and resolution of inflammation[J]. Nature Reviews Immunology, 2010, 10(6): 427-439. |
| [17] |
WANG Z, LIN L Y, CHEN W J, et al. Neutrophil plays critical role during Edwardsiella piscicida immersion infection in zebrafish larvae[J]. Fish&Shellfish Immunology, 2019, 87: 565-572. |
| [18] |
JORGENSEN I, LOPEZ J P, LAUFER S A, et al. IL-1β, IL-18, and eicosanoids promote neutrophil recruitment to pore-induced intracellular traps following pyroptosis[J]. European Journal of Immunology, 2016, 46(12): 2761-2766. |
| [19] |
NGUYEN-CHIM, PHAN Q T, GONZALEZ C, et al. Transient infection of the zebrafish notochord with E. coli induces chronic inflammation[J]. Disease Models&Mechanisms, 2014, 7(7): 871-882. |
| [20] |
KARMAKAR M, SUN Y, HISE AG, et al. Cutting edge:IL-1β processing during Pseudomonas aeruginosa infection is mediated by neutrophil serine proteases and is independent of NLRC4 and caspase-1[J]. Journal of Immunology, 2016, 189(9): 4231-4235. |
| [21] |
LEECH J M, LACEY K A, MULCAHY M E, et al. IL-10 plays opposing roles during Staphylococcus aureus systemic and localized infections[J]. The Journal of Immunology, 2017, 198(6): 2352-2365. |
| [22] |
ZHANG Z H, WU H Z, XIAO J F, et al. Immune responses of zebrafish (Danio rerio) induced by bath-vaccination with a live attenuated Vibrio anguillarum vaccine candidate[J]. Fish&Shellfish Immunology, 2012, 33(1): 36-41. |
| [23] |
ALIPOUR M, ISSAZADEH K, SOLEIMANI J. Isolation and identification of Vibrio parahaemolyticus from seawater and sediment samples in the southern coast of the Caspian Sea[J]. Comparative Clinical Pathology, 2014, 23(1): 129-133. |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Shanghai Ocean University, Shanghai 201306, China;
3. International Research Center for Marine Biosciences, Ministry of Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Key Laboratory of Tuberculosis, Shanghai Pulmonary Hospital, Tongji University School of Medicine, Shanghai 200433, China;
5. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


