2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
金黄色葡萄球菌(Staphylococcus aureus)是皮肤、软组织和血液感染的主要病原菌之一,导致局部或全身性的多种感染[1],其严重程度从皮肤脓肿和伤口感染到深部组织脓肿,如肺炎、中毒性休克综合征[2-3]。
在哺乳动物中,一氧化氮(NO)参与许多生物过程,从血压调节到机体对病原体免疫应答[4]。细菌突破黏膜屏障入侵宿主细胞,宿主吞噬细胞响应病原体感染而产生大量的NO、活性氧和氮物质。一方面,NO可以直接抑制病原菌的有氧呼吸和能量代谢,并抑制细菌的DNA复制[5];另一方面,NO在与自由基中超氧离子反应时,会生成强杀菌复合物过氧硝酸盐,进而起到抗菌作用。然而,金黄色葡萄球菌一氧化氮合酶(S.aureus nitric oxide synthase,saNOS)基因缺失实验表明saNOS为致病菌提供抗氧化杀伤的保护功能。在感染的早期阶段,细菌内源性NO保护细菌来自宿主的杀伤,但宿主也产生NO,作为其自身保护性氧化杀伤的组分[6]。
关于这种宿主-病原体相互作用中NO所起的精确调控成为当下研究的热点。NO在参与宿主和病原信号级联反应中间接影响病原菌的感染,在杀伤和清除入侵的病原菌及在炎症反应方面起着十分重要的作用[7]。然而,细菌内源性NO和哺乳动物产生的NO起着不同的功能和作用,链霉菌(Streptomycetaceae)内源性NO参与植物毒素合成,亚硝化单胞菌(Nitroso monas)NO在调控细菌生长代谢中作为信号分子,金黄色葡萄球菌NO抗生素敏感性实验表明细菌的NOS还可能是抗生素良好的靶标[8-9]。此外,外源性NO影响金黄色葡萄球菌生物被膜的合成,但是关于saNOS是否可以感应外源性NO并进行适应性调控仍需要进一步的证据[10]。
为了进一步探究saNOS的功能,本研究利用质粒构建了nos过表达菌株,并比较野生型菌株、nos缺失突变株和过表达菌株的表型差异。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养基大肠杆菌(Escherichia coli)DH5α购自天根生化科技有限公司,金黄色葡萄球菌RN4220是限制性核酸内切酶缺陷菌株,可以接受并修饰外来的质粒DNA,购自北京派瑞金生物科技有限公司。金黄色葡萄球菌ATCC 29213标准菌株从中国工业微生物菌种保藏管理中心订购,金黄色葡萄球菌29213 nos缺失突变株(nos mutant,Δnos)为本实验室构建。单拷贝整合质粒pLI50购自武汉淼灵生物科技有限公司。培养大肠杆菌和金黄色葡萄球菌所用的Luria-Bertani培养基(LB)和胰酪胨大豆肉汤培养基(Trypticase Soy Broth,TSB)为实验室自制,脑心浸液肉汤(Brain Heart Infusion Broth,BHI)培养基购自青岛海博生物技术有限公司。
1.1.2 试剂蛋白酶K购自德国Merk公司,革兰氏阳性菌质粒大量提取试剂盒购自北京索莱宝科技有限公司,PCR Purification Kit购自QIAGEN。溶菌酶、溶葡球菌酶、蔗糖、氨苄青霉素和氯霉素从生工生物工程(上海)股份有限公司订购。BP clonase Ⅱ酶和EcoRⅠ, BamHⅠ内切酶购自Thermo Fisher Scientific公司。过氧化氢酶购自Sigma-Aldrich公司,RNAprep pure细菌总RNA提取试剂盒,质粒小提中量试剂盒及普通琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司。亚硝基铁氰化钠和结晶紫(Crystal violet)购自上海兰拓生物科技有限公司。
1.2 过表达载体pLI50-nos的构建pLI50质粒是一个金黄色葡萄球菌单拷贝整合载体,在大肠杆菌内具有氨苄抗性,在金黄色葡萄球菌内具有氯霉素抗性。以金黄色葡萄球菌ATCC 29213基因组DNA为模板,通过Primer Premier 6,设计29213 nos基因及上游启动子区域的引物,命名为pLI50-nos-F和pLI50-nos-R(表 1),PCR扩增nos及其启动子序列。PCR反应条件:95 ℃ 3 min,95 ℃ 15 s,52 ℃ 15 s,72 ℃ 1 min 50 s,72 ℃ 8 min,共35个循环。PCR产物纯化后和pLI50质粒分别用BamH Ⅰ和EcoR Ⅰ双酶切(37 ℃,2 h),琼脂糖电泳后用凝胶回收试剂盒割胶回收。使用NANODROP 2000分别测定PCR产物和pLI50质粒回收的浓度,以3: 1(PCR产物:质粒)的摩尔浓度比在T4接酶作用下4 ℃过夜[11]。连接产物转化E.coil DH5α,氨苄(100 μg/mL)LB平板上挑取单菌落,扩增菌株并提取质粒[12]。从pLI50的BamH Ⅰ和EcoR Ⅰ酶切位点上下游设计引物pLI50-ZY-F和pLI50-ZY-R,通过PCR验证插入片段大小,测序验证序列。PCR反应条件:95 ℃ 3 min,95 ℃ 15 s,52 ℃ 15 s,72 ℃ 2 min 15 s,72 ℃ 8 min,4 ℃保持,共35个循环。
|
表 1 实验中所用的PCR引物 Tab.1 PCR primers used in the experiment |
野生型的金黄色葡萄球菌不能接受来自革兰氏阴性菌的质粒,敲除载体需先导入金黄色葡萄球菌RN4220中进行修饰。金黄色葡萄球菌的感受态的制备参考文献[13]中的步骤,10 μL的100~300 ng/μL的质粒加入160 μL的金黄色葡萄球菌RN4220感受态细胞中,轻弹混匀,加入预冷的电击杯中,冰上孵育15 min。参照文献[14]中的电击参数,用电转仪电击感受态细菌,参数为:电压2.5 kV,电阻200 Ohms,电容25 μF。电击后,立即加入1 mL BHI培养基到电击杯中,充分混合之后吸出移入到EP管中,30 ℃震荡培养2 h(120~150 r/min),吸取100 μL涂在10 μg/mL氯霉素的TSA板上,30 ℃培养箱静置培养2 d(30 ℃细菌基因组可以稳定遗传不容易发生变异)。用10 μg/mL氯霉素(chl-10)将细胞铺在TSA上[15],在30 ℃培养箱中孵育平板。30 ℃在3 mL TSB(chl-10)中培养转化的RN4220,溶葡萄球菌酶37 ℃处理1 h溶解细胞壁,提取质粒,并在琼脂糖凝胶上检查质粒。确认质粒完好,将经RN4220修饰的质粒电穿孔到目标菌株Δnos中,操作步骤同上。在30 ℃培养转化的目标菌株,提取纯化质粒,然后在琼脂糖凝胶上检查质粒。
1.4 金黄色葡萄球菌nos基因过表达菌株鉴定 1.4.1 PCR鉴定为了筛选nos过表达菌株,分别以6个待筛选的菌株的质粒DNA为模板,采用pLI50-ZY-F和pLI50-ZY-R为引物进行PCR扩增,筛选出的nos过表达菌株命名为Δnos-pLI50-nos。
1.4.2 荧光定量检测nos转录水平反转录样品适当稀释为模板,每个样品3个平行,采用默认的PCR程序,进行定量PCR检测,分析nos基因的相对表达量(以野生型菌株WT转录水平为1,测定Δnos和Δnos-pLI50-nos的转录水平)。内参基因选择16S rDNA,计算并取平均Ct值,以ATCC 29213中的nos基因扩增的Ct值为基准值[10],计算Δnos-pLI50-nos中nos的相对表达量。
1.5 内源性NO对生长速率的影响将保种的菌液在新制的TSA板上划线。37 ℃培养箱培养12~16 h,分别挑取WT和Δnos各3个单菌落,接种到TSB液体培养基中,37 ℃摇床中震荡培养(200~300 r/min)。将过夜生长的菌液转接到含有50 mL TSB的250 mL锥形瓶,初始OD值均为0.05,WT和Δnos菌株各接种3瓶(37℃,200 r/min)[16]。测定每小时各瓶菌液OD600值,并结合活菌平板菌落计数法测定培养中细菌浓度[17],直至稳定期吸光度不再变化。采用GraphPad.Prism.v 5.0软件,以培养时间t为横坐标,各实验组3个平行的活菌数的对数的均值为纵坐标绘制WT和Δnos,nos-pLI50-nos的生长曲线。根据文献中对比生长速率μ(每小时单位质量的菌体所增加的菌体量)的描述[18],以培养时间t为横坐标,ln2除以菌体倍增时间的均值为纵坐标,绘制比生长速率曲线。两组曲线的数据均使用T检验测定显著性差异。
1.6 Triton X-100诱导的自溶分析使WT和Δnos在TSB中于37 ℃振荡至OD600为1.2至1.3[19-20],然后将细菌培养物以1: 100进行传代稀释。新鲜TSB含有1 mol/L NaCl,并在37 ℃下孵育至OD600为0.6~0.8。通过5 000 mol/L离心5 min收获细菌细胞,用预冷的无菌去离子洗细胞,重复操作两次[21]。并重悬于相同体积的缓冲液中含有50 mmol/L Tris-HCl(pH 7.5)和0.1%Triton X-100。然后将细菌细胞在30 ℃下振荡温育,并测量OD600的变化。结果在零时刻(OD0)标准化为OD600,即每个阶段裂解的百分比=[(OD0-ODt)/OD0]×100[20],过30 min测量1次OD600的值,所有实验组设置3个平行。
1.7 过氧化氢杀灭试验在H2O2处理之前,将WT和Δnos菌株在阳离子调节的Mueller-Hinton肉汤(CAMHB)中培养过夜(37 ℃,200 r/min)。并在新鲜的CAMHB中以2%稀释进行传代培养[9]。使菌株生长至对数中期(OD600≈0.6),通过离心沉淀,在PBS中重悬两次,并在CAMHB中稀释至预定浓度,密度接近2×107cfu/mL。将25 μL(约5×105 cfu)的菌液加入以200 μL等体积的CAMHB和含30 mmol/L H2O2的CAMHB。在37 ℃,低速(120 r/min)孵育20 min,40 min。样品将其在PBS中稀释并涂布在TSB琼脂板上进行计数,稀释液中含有2 500 U/mL过氧化氢酶以进行猝灭残留的H2O2,孵育平板过夜,通过计数计算培养物cfu/mL菌落并乘以稀释因子[22]。所有条件为一式3份取样,显示的值为平均值±标准差(SD)。统计分析在(IBM SPSS Statistics 22)中使用Student t检验进行。NO抑制剂L-NNA对H2O2杀伤的影响:H2O2处理前准备步骤H2O2杀灭实验相同。25 μL菌液分别加入等体积的CAMHB,含10 mmol/L L-NNA的CAMHB,10 mM H2O2的CAMHB,10 mmol/L H2O2和L-NNA的CAMHB中。涂板、计数及分析方法同上所述。
1.8 结晶紫染色法检测静态生物被膜取TSB平板上单克隆接入TSB中,摇床中37 ℃过夜培养(200 r/min)[23]。用TSB稀释菌液(1%体积),测定OD590的数值。用TSB稀释菌液,使OD590到0.01。96微孔板中每孔加入100 μL稀释菌液,避免液体残留在臂边缘,用湿布沿孔板边缘包裹,37 ℃培养24 h。用150 μL PBS无菌溶液处理3次(用25%甲醛固定10 min,吸出液体自然风干),200 μL 1%结晶紫染色10 min[24]。吸出结晶紫染液后,用无菌生理盐水缓慢冲洗残余的染料,至溶液无色,吸出残液,超净台下吹干。干燥彻底后,每个样孔加入100 μL 33%冰醋酸液体,20 min以溶解结晶紫[25];590 nm测定吸光度,用酶标仪测量样品孔中液体的OD数值;每种菌株设4个平行组。
1.8.1 外源性NO对金黄色葡萄球菌生物被膜形成的影响为了研究NO对金黄色葡萄球菌生物被膜的影响,培养基中加入不同浓度的NO供体SNP,检测外源NO其对被膜生成的作用。按照之前所述的生物被膜检测方法, 在稀释后的菌液中加入1 mol/L的SNP浓溶液至终浓度为250 μmol/L、500 μmol/L,检测生物被膜的变化。
1.8.2 内源性NO对金黄色葡萄球菌生物被膜形成的影响按照所述的方法, 检测WT、Δnos和Δnos-pLI50-nos静置培养后生物被膜的变化,统计分析方法同上。
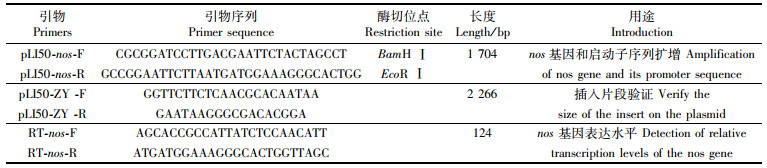
2 结果与分析 2.1 过表达菌株的鉴定以过表达质粒为模板,通过位于质粒酶切位点BamHⅠ和EcoRⅠ两端的引物进行PCR,成功插入nos基因起启动子区域的质粒PCR片段大小为2 266 bp(1 704 bp加质粒上的562 bp)。6株待筛选菌株有两株成功转入了过表达质粒,如图 1a所示。荧光定量结果如图 1b所示,Δnos-pLI50-nos中nos基因成功表达,表达量接近野生菌株WT的18倍,证明在Δnos菌株过表达成功,可以作为过表达菌株用于进一步检测内源性NO对金黄色葡萄球菌的作用。
|
(a)nos基因PCR检测,1~5泳道为Δnos-pLI50-nos菌株,6泳道是以WT基因组DNA为模板的阳性对照; (b)荧光定量测定3种菌株nos的表达量 (a) nos gene PCR detection, lanes 1 to 5 were Δnos-pLI50-nos strain, and lane 6 was a positive control using WT genomic DNA as a template; (b) Fluorescence quantitative determination of the expression level of nos gene of three strains 图 1 nos过表达菌株Δnos-pLI50-nos的PCR和Real-Time PCR检测 Fig. 1 PCR and Real-Time PCR detection of nos in over-expression strain Δnos-pLI50-nos |
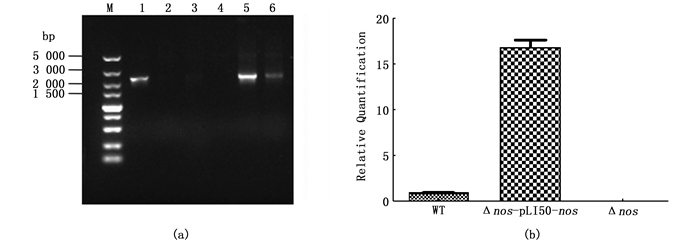
由图 2可知,同等的接种量,WT与Δnos菌株相比,WT在1~3 h细菌浓度均高于Δnos菌株(P<0.05),在3 h时浓度差值达到最大(P<0.001)。WT与过表达菌株相比Δnos-pLI50-nos,仅在3 h时WT菌株明显高于过表达菌株(P<0.001)。3种菌株都在培养6 h左右细菌浓度接近最大值,进入稳定期。
|
图 2 WT,Δnos,Δnos-pLI50-nos生长曲线 Fig. 2 WT, Δnos, Δnos-pLI50-nos growth curve |
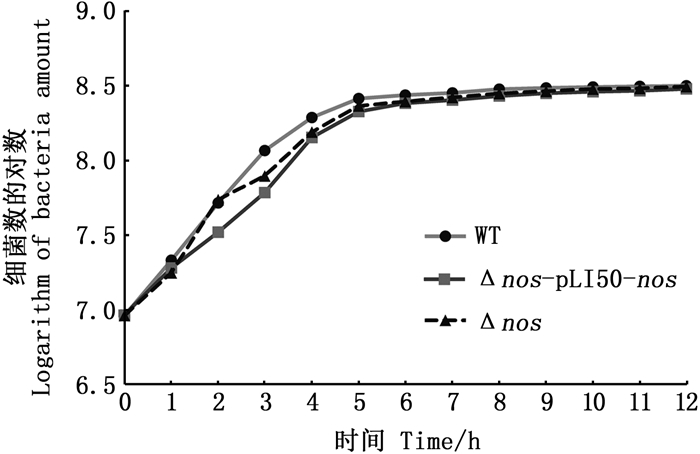
为了进一步了解3株细菌各时间段生长速率的差异,排除接种量的细微差异对实验结果造成的干扰,本实验检测野生菌WT、nos缺失菌Δnos和过表达菌株Δnos-pLI50-nos的比生长速率(图 3)。结果显示,WT在1 h时比生长速率接近最大值,1~3 h维持在0.95左右,随后比生长速率开始下降,6 h比生长速率接近0。Δnos菌株在0~3 h比生长速率均低于WT,3~4 h比生长速率再次提高并在4 h时达到最大值,接近WT的最大比生长速率,随后开始降低。过表达菌株0~2 h比生长速率持续增加,并在2 h是达到最大值(明显高于WT),2~3 h比生长速率急剧下降,3 h的比生长速率比2 h下降了3.83倍,3~4 h比生长速率回升,之后持续降低。
|
图 3 WT,Δnos,Δnos-pLI50-nos比生长速率 Fig. 3 WT, Δnos, Δnos-pLI50-nos specific growth rate |
总而言之,内源性NO缺失和过表达均导致金黄色葡萄球菌在迟缓期和对数期比生长速率(倍增时间)剧烈地上下波动,过表达造成的影响更大。
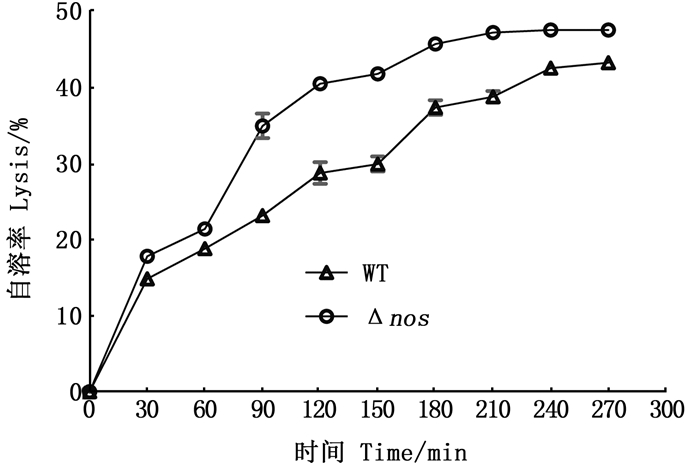
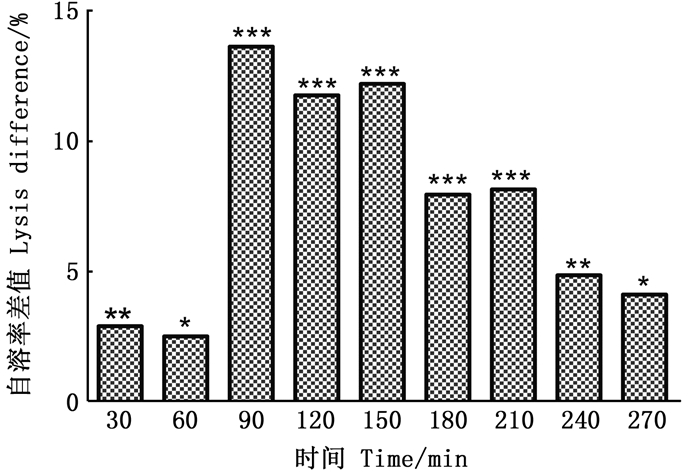
2.3 内源性NO对自溶的影响如图 4所示,Δnos菌株自溶率在各个时间段均高于野生菌株WT。WT在8 h左右时自溶速率基本不再发生变化,Δnos比WT要推迟1 h。从图 4,图 5可以看出,0~60 min自溶率差值在3%以内,90~150 min差值一直维持在11%左右,180~270 min,随着Δnos自溶率接近最大值,而WT自溶率趋于稳定,自溶率差值趋于减小,最终的自溶率差值为4.143%。
|
图 4 Triton X-100诱导条件下的野生菌株(WT)和nos缺失菌株(Δnos)的自溶率 Fig. 4 Autolysis of wild and nos-deficient strains under Triton X-100 induction conditions |
|
自溶率差值为nos缺失菌株减野生型,数值为3个平行组的菌株±标准差,t检验表明nos缺失菌株和野生菌株自溶率的显著性差异,*.P<0.05; **.P<0.01; ***.P<0.001 The difference of autolysis rate was nos-missing strain minus wild type, and the value was the strain of three parallel groups ± standard deviation. The T test showed significant difference in autolysis rate of nos-deleted strain and wild strain, *.P < 0.05; **.P < 0.01; ***.P < 0.001 图 5 时间段nos缺失菌株和野生菌株自溶率的差值 Fig. 5 Differences in autolysis rate between nos-deleted strains and wild strains in each time period |
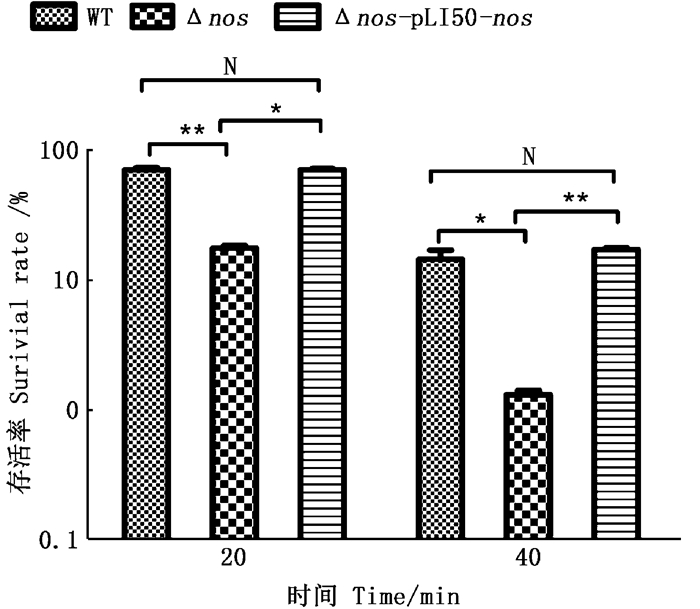
如图 6所示,与野生菌株WT相比较,H2O2处理20 min后Δnos存活率为WT的24.98%,处理40 min后存活率为WT的9.11%。,过表达菌株Δnos-pLI50-nos两个时间段的存活率与WT接近。随着H2O2杀伤时间的持续,saNOS介导的NO保护作用越发的明显。
|
将对数期细菌暴露于30 mmol/L H2O2,并通过连续稀释平板每20 min监测存活。误差线代表 3次重复的平均值±标准差,T检验表明显著性差异 Log phase bacteria were exposed to 30 mmol/L H2O2, and survival was monitored every 20 min by serial dilution plating.Error bars represent the mean ±SD deviation of three replicates, and the T test shows significant differences 图 6 不同NOS表达水平细菌的氧化应激的存活率 Fig. 6 Survival rate of bacteria with different NOS expression levels under oxidative stress |
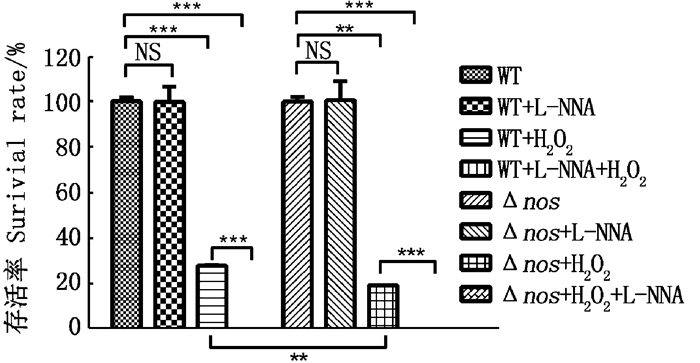
从图 7可以看出单独用二氧化氮合酶抑制剂L-NNA处理金黄色葡萄球菌时,无论是野生型WT或是Δnos均未表现出细胞毒性,但和H2O2一起处理时,可以显著增强H2O2的氧化杀伤作用。L-NNA增强H2O2杀伤金黄色葡萄球菌在WT和Δnos中都存在显著效果。
|
用10 mmol/L H2O2,10 mmol/L L-NNA,10 mmol/L H2O2+ L-NNA处理20 min计算存活率。误差线代表 3次重复的平均值±标准差,T检验表明显著性差异 Survival was calculated by treatment with 10 mmol/L H2O2, 10 mM L-NNA, 10 mmol/L H2O2+L-NNA for 20 min.Error bars represent the mean ±SD deviation of three replicates, and the T test shows significant differences 图 7 NOS抑制剂L-NNA和H2O2对不同NOS表达水平的细菌存活率的影响 Fig. 7 The effect of NOS inhibitors L-NNA and H2O2 on the survival rate of bacteria with different NOS expression levels |
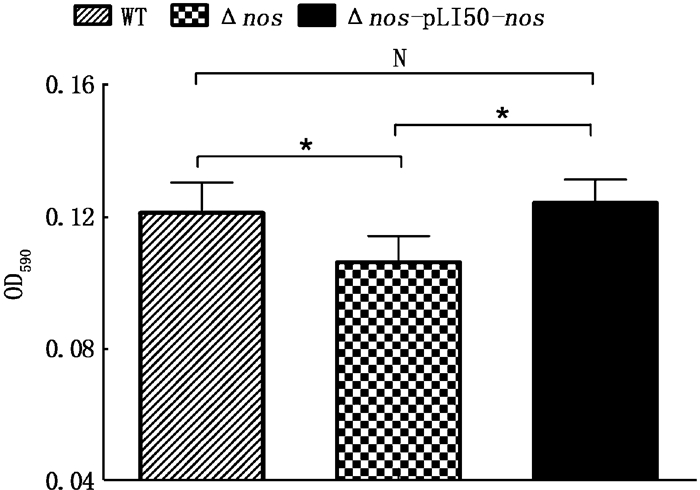
如图 8所示,Δnos和野生菌株WT所相比,生物被膜生成能力减弱。用质粒对nos基因进行过表达之后,被膜形成能力得到回复,说明内源性NO对金黄色球菌生物被膜有加强作用。与内源性NO影响生长速率不同,nos过表达并不会影响生物被膜的形成,而且过表达菌株的成膜能力还有轻微的提升。
|
图 8 WT、Δnos、Δnos-pLI50-nos菌株生物被膜形成能力比较 Fig. 8 Comparison of WT, Δnos and Δnos replenishment biofilm formation ability |
目前大多数关于细胞NOS功能的报道都集中在NO的直接生物学作用上,如氧化应激介导的Fenton反应上。为了验证saNOS是否影响外源NO介导的作用,向培养基中添加SNP,检测nos缺失是否影响外源性NO对生物被膜的增进效果。
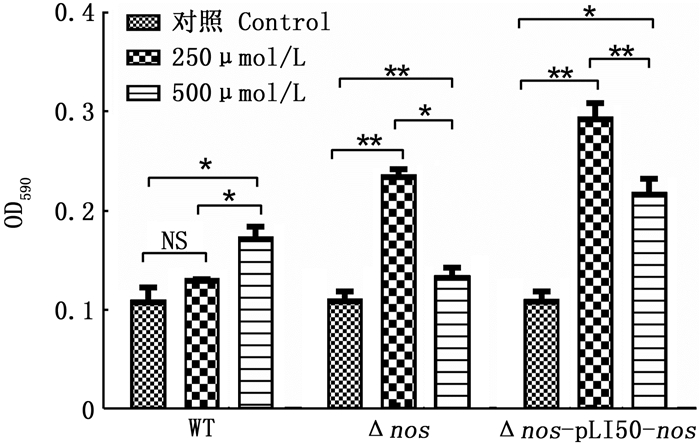
如图 9所示,对野生菌株WT,在250~500 μmol/L SNP添加范围内,生物被膜的量随着SNP的提高而增加,表现出明显的NO抗性(NO对细菌也是有细胞毒性的)。对于Δnos和过表达菌株,添加250 μmol/L的SNP后生物被膜有明显增加,生物被膜的量明显高于野生菌株。但是当SNP浓度升高到500 μmol/L时,生物被膜的量又明显下降,其中Δnos成膜能力降到低于WT的水平。Δnos过表达菌株可能是因为nos基因在质粒上表达,内源性表达相对稳定,和WT基因组上nos的调控方式不同。
|
图 9 不同浓度SNP对3种菌株生物被膜的影响 Fig. 9 Effect of different concentrations of SNP on biofilm of three strains |
金黄色葡萄球菌属于为数不多的拥有和iNOS同源物的革兰氏阳性菌[26]。此外,金黄色葡萄球菌通过对毒力的转录适应从而对亚硝化应激,即外源NO具有相对抗性[27-28]。目前的研究对内源NO一氧化氮的调控作用了解得很少,saNOS的功能和作用也仅限于NO的直接生物学作用[8],即充当细菌应激反应保护剂。本研究结果表明金黄色葡萄球菌29213内源性NO缺失和过表达并没有直接影响指数期的金黄色葡萄球菌的总体生长速率,但是细菌的比生长速率剧烈的上下波动,表明正常的生长周期被打乱,内源性NO不仅参与了细菌的生长周期的调控,还可以影响细菌从一个生长阶段向下一个阶段的转变[29],推测金黄色葡萄球菌NOS(saNOS)和哺乳动物NOS(mNOS)一样是个严格调控表达的蛋白。自溶率实验结果表明内源性NO对金黄色葡萄球菌自溶的主要作用是抑制。WT和Δnos出现的自溶率差值短暂的降低,可能是非NO依赖性的自溶素基因调控系统短暂抑制了细菌的自溶。
先前已有实验室证明内源性NO保护MRSA减少H2O2引起的损伤,同样我们证明内源NO对甲氧西林敏感型菌株同样起保护作用。在本文中,nos缺失的菌株对氧化应激的应激的敏感性明显增加,通过质粒过表达nos基因菌株存活率恢复到WT,但是nos过表达并不能提高细菌的抗氧化杀伤能力。
越来越多的研究表明内源性NO可以为病原菌提供抗氧化应激的保护机制,细菌bNOS也就成为了潜在药物靶标之一。本实验中,使用L-NNA作为saNOS抑制剂,结果表明L-NNA和H2O2的协同杀菌作用并不完全依赖抑制NOS的活性,推测L-NNA作为L-Arg类似物可能还可以抑制其它和抗氧化杀伤相关的酶,如过氧化氢酶或者SOD。从另一个方面也表明NO并不是过氧化氢酶和SOD唯一的激活途径。nos的缺失和过表达对细菌生物被膜的影响并不大,这与saNOS的催化能力较mNOS比较低的有关[30]。有意思的是,nos的缺失和过表达还显著影响外源性NO对生物被膜的作用,这些结果表明金黄色葡萄球菌可以共同选择宿主来源的NO来补充bNOS衍生的NO在与活化的吞噬细胞相遇时减轻活性氧应激带来的损伤[31],更重要的是外源性NO对生物被膜的作用受到saNOS的调控,说明金黄色葡萄球菌通过感应外界环境的NO增加生物被膜的生成,从而逃避宿主的免疫攻击[32],这对金黄色葡萄球菌是否能在宿主体类存活有重要作用。nos的缺失和过表达对金黄色葡萄球菌生长周期调控、自溶速率、抗应激反应和生物被膜生成能力造成一系列影响,引起的表型变化类似于真核生物中NO调控引起的级联反应,表明金黄色葡萄球菌可以通过产生内源性NO和感应外源NO调整自身生长代谢,提高抗应激反应杀伤的能力,说明NO不仅作为金黄色葡萄球菌的一种保护剂,更是一种重要的信号分子。
| [1] |
张明. 抗体-抗生素缀合物消灭金黄色葡萄球菌[J]. 中华预防医学杂志, 2016, 50(1): 90. ZHANG M. Novel antibody-antibiotic conjugate eliminates intracellular Staphylococcus aureus[J]. Chinese Journal of Preventive Medicine, 2016, 50(1): 90. DOI:10.3760/cma.j.issn.0253-9624.2016.01.057 |
| [2] |
HORN J, STELZNER K, RUDEL T, et al. Inside job:Staphylococcus aureus host-pathogen interactions[J]. International Journal of Medical Microbiology, 2018, 308(6): 607-624. DOI:10.1016/j.ijmm.2017.11.009 |
| [3] |
张洪涛, 邵彬, 麻宏亮, 等. 降钙素原在恶性血液病发热中的诊断价值[J]. 临床肿瘤学杂志, 2008, 13(12): 1099-1104. ZHANG H T, SHAO B, MA H L, et al. Procalcitonin in the differential diagnosis of the fever in hematological malignancies[J]. Chinese Clinical Oncology, 2008, 13(12): 1099-1104. DOI:10.3969/j.issn.1009-0460.2008.12.010 |
| [4] |
SUDHAMSU J, CRANE B R. Bacterial nitric oxide synthases:what are they good for?[J]. Trends in Microbiology, 2009, 17(5): 212-218. DOI:10.1016/j.tim.2009.02.003 |
| [5] |
姜鹏, 路新枝, 侯方杰, 等. 金黄色葡萄球菌hmp基因缺失突变株的构建及抗一氧化氮能力分析[J]. 微生物学报, 2011, 51(2): 196-202. JIANG P, LU X Z, HOU F J, et al. Construction of Staphylococcus aureus RN6390hmp genemutant and analysis of NO sensitivity[J]. Acta Microbiologica Sinica, 2011, 51(2): 196-202. |
| [6] |
HOLDENJK. Structural, biochemical, and biological studies on bacterial nitricoxide synthase[D].Irvine: University of California, Irvine, 2015.
|
| [7] |
UEHARA E U, De STEFANOSHIDA B, DE BRITO C A. Role of nitric oxide in immune responses against viruses:beyond microbicidal activity[J]. Inflammation Research, 2015, 64(11): 845-852. DOI:10.1007/s00011-015-0857-2 |
| [8] |
GUSAROV I, NUDLER E. NO-mediated cytoprotection:instant adaptation to oxidative stress in bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(39): 13855-13860. DOI:10.1073/pnas.0504307102 |
| [9] |
HOLDEN J K, LEWIS M C, CINELLI M A, et al. Targeting bacterial nitric oxide synthase with aminoquinoline-based inhibitors[J]. Biochemistry, 2016, 55(39): 5587-5594. DOI:10.1021/acs.biochem.6b00786 |
| [10] |
侯方杰.一氧化氮调节金黄色葡萄球菌生物被膜形成的作用机制探讨[D].青岛: 中国海洋大学, 2010. HOU F J. Experimental study on the mechanism of nitric oxide in the regulation of Staphylococcus aureus biofilm formation[D]. Qingdao: Ocean University of China, 2010. |
| [11] |
SPIROS. Regulators of bacterial responses to nitric oxide[J]. FEMS Microbiology Reviews, 2007, 31(2): 193-211. DOI:10.1111/j.1574-6976.2006.00061.x |
| [12] |
VAN SORGE N M, BEASLEY F C, GUSAROV I, et al. Methicillin-resistant Staphylococcus aureus bacterial nitric-oxide synthase affects antibiotic sensitivity and skin abscess development[J]. Journal of Biological Chemistry, 2013, 288(9): 6417-6426. DOI:10.1074/jbc.M112.448738 |
| [13] |
SHANG F, XUE T, SUN H P, et al. The Staphylococcus aureus GGDEF domain-containing protein, GdpS, influences protein a gene expression in a cyclic diguanylic acid-independent manner[J]. InfectionandImmunity, 2009, 77(7): 2849-2856. |
| [14] |
张晓静, 冯世源, 杜崇涛, 等. 金黄色葡萄球菌OatA基因敲除菌株及其回补菌株的构建[J]. 现代生物医学进展, 2015, 15(15): 2815-2819. ZHANG X J, FENG S Y, DU C T, et al. Construction of OatA deletion mutant and complementation of Staphylococcus aureus[J]. Progress in Modern Biomedicine, 2015, 15(15): 2815-2819. |
| [15] |
BAE T, SCHNEEWIND O. Allelic replacement in Staphylococcus aureus with inducible counter-selection[J]. Plasmid, 2006, 55(1): 58-63. |
| [16] |
关玮琨.基于假基因内插入的嵌合肠毒素重组减毒大肠杆菌口服疫苗候选菌株的研究[D].哈尔滨: 东北农业大学, 2016. GUAN W K. Researchof the recombinant attenuated Escherichiacoli oral vaccine candidate strain based on the insertion of chimeric enterotoxin gene in the pseudogene[D]. Harbin: Northeast Agricultural University, 2016. |
| [17] |
王蒙蒙, 张莉, 李慧, 等. 粪肠球菌生长曲线的测定及其对小鼠脑组织的影响[J]. 中国畜牧兽医, 2018, 45(4): 1041-1049. WANG M M, ZHANG L, LI H, et al. Study on growth curve of Enterococcus faecalis and its effect on brain tissue of mice[J]. ChinaAnimal Husbandry& Veterinary Medicine, 2018, 45(4): 1041-1049. |
| [18] |
宋健, 林建群, 金燕, 等. 以比生长速率时间曲线为基础的生物群体生长数学模型[J]. 微生物学通报, 2007, 34(5): 836-838. SONG J, LIN J Q, JIN Y, et al. A new population growth model based on the time dependent changes of the specific growth rate[J]. Microbiology, 2007, 34(5): 836-838. DOI:10.3969/j.issn.0253-2654.2007.05.002 |
| [19] |
FOURNIER B, HOOPER D C. A new two-component regulatory system involved in adhesion, autolysis, and extracellular proteolytic activity of Staphylococcus aureus[J]. Journal of Bacteriology, 2000, 182(14): 3955-3964. DOI:10.1128/JB.182.14.3955-3964.2000 |
| [20] |
ZHENG L, YU C X, BAYLES K, et al. Conditional mutation of an essential putative glycoprotease eliminates autolysis in Staphylococcus aureus[J]. Journal of Bacteriology, 2007, 189(7): 2734-2742. DOI:10.1128/JB.01806-06 |
| [21] |
方希修, 王冬梅, 唐现文, 等. 携带EGFPC3质粒的重组减毒鼠伤寒沙门氏菌在小鼠体内的表达[J]. 免疫学杂志, 2007, 23(2): 180-183. FANG X X, WANG D M, TANG X W, et al. Expression of recombinant attenuated Salmonella typhimurium carrying enhancement green fluorescence protein in mice[J]. Immunological Journal, 2007, 23(2): 180-183. |
| [22] |
李子尧, 刘雷, 孟蔚, 等.口腔诊疗用水微生物污染检测方法初探[C]//中华预防医学会消毒分会2014年学术年会.合肥: 中华预防医学会消毒分会, 2014: 198-203. LI Z Y, LIU L, MENG W, et al. Microbiological examination methods for water of dental unit waterlines[C]//Proceedings of the Chinese Society of Preventive Medicine Disinfection Branch Academic Annual Meeting. Hefei, 2014: 198-203. |
| [23] |
田曙光, 靳小潘, 陈建魁, 等. 以菌蜕作为DNA载体构建双重靶向乳腺癌基因疫苗[J]. 国际检验医学杂志, 2012, 33(20): 2478-2481. TIAN S G, JIN X P, CHEN J K, et al. Construction of a dual-targeted breast cancer gene vaccine using bacillus as a DNA vector[J]. International Journal of Laboratory Medicine, 2012, 33(20): 2478-2481. DOI:10.3969/j.issn.1673-4130.2012.20.019 |
| [24] |
刘芳. DADS上调miR-7靶向XIAP抑制人胃癌细胞增殖和侵袭[D].衡阳: 南华大学, 2015. LIU F. Up-regulation of miR-7 targeting for XIAP inhibit proliferation and invasion inhuman gastric cancer cells induced by diallyl disufide[D]. Hengyang: Nanhua University, 2015. |
| [25] |
林镯. Benzonase酶对金黄色葡萄球菌和表皮葡萄球菌生物膜的影响[D].温州: 温州医科大学, 2014. LINZ. Effect of Benzonase on forming biofilms by Staphylococcus aureus and Staphylococcus epidermidis[D]. Wenzhou: Wenzhou Medical University, 2014. |
| [26] |
GUSAROV I, STARODUBTSEVA M, WANG Z Q, et al. Bacterial nitric-oxide synthases operate without a dedicated redox partner[J]. Journal of Biological Chemistry, 2008, 283(19): 13140-13147. DOI:10.1074/jbc.M710178200 |
| [27] |
RICHARDSON A R, DUNMAN P M, FANG F C. The nitrosative stress response of Staphylococcus aureus is required for resistance to innate immunity[J]. Molecular Microbiology, 2006, 61(4): 927-939. DOI:10.1111/j.1365-2958.2006.05290.x |
| [28] |
RICHARDSON A R, LIBBY S J, FANG F C. A nitric oxide-inducible lactate dehydrogenase enables Staphylococcus aureus to resist innate immunity[J]. Science, 2008, 319(5870): 1672-1676. DOI:10.1126/science.1155207 |
| [29] |
SAPP A M, MOGEN A B, ALMAND E A, et al. Contribution of the nos-pdt operon to virulence phenotypes in methicillin-sensitive Staphylococcus aureus[J]. PLoS One, 2014, 9(10): e108868. DOI:10.1371/journal.pone.0108868 |
| [30] |
BIRD L E, REN J S, ZHANG J C, et al. Crystal structure of SANOS, a bacterial nitric oxide synthase oxygenase protein from Staphylococcus aureus[J]. Structure, 2002, 10(12): 1687-1696. DOI:10.1016/S0969-2126(02)00911-5 |
| [31] |
MCCOLLISTER B D, HOFFMAN M, HUSAIN M, et al. Nitric oxide protects bacteria from aminoglycosides by blocking the energy-dependent phases of drug uptake[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(5): 2189-2196. DOI:10.1128/AAC.01203-10 |
| [32] |
ELSON G, DUNN-SIEGRIST I, DAUBEUF B, et al. Contribution of Toll-like receptors to the innate immune response to Gram-negative and Gram-positive bacteria[J]. Blood, 2007, 109(4): 1574-1583. DOI:10.1182/blood-2006-06-032961 |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean Universitry, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


