我国针对渔业资源衰退和海域生态荒漠化日趋严重的情况大力开展水生生物资源增殖放流的活动,坚持质量和数量并重,并进一步扩大规模[1],取得了良好的效果。在不考虑捕捞等人为干扰的情况下,增殖放流对象的群体数量受初期存活率的影响很大[2-3]。增殖放流种类幼体初期存活率主要受运输过程和放流海域环境因素两方面的影响[4],其中鱼类在运输中幼鱼的密度、水体温度、溶氧以及运输设备产生的摇晃和噪声等是影响幼体初期存活率的主要胁迫因子[5-8],应激反应存在于捕获、运载和装卸等环节,过强的应激反应会对幼体放流进入海洋后的生长产生不可逆的影响[9]。
鱼类的皮质醇、乳酸以及糖元含量等生化指标广泛用于研究鱼类机体应激反应程度,在运输过程中幼鱼的这些生化指标随水温和摇晃等胁迫因子发生规律性变化[10-15]。目前有关鱼类幼体运输胁迫的研究主要有实际运输和模拟运输,对运输前、运输过程中和运输后的幼体各应激指标及水质指标的变化分析[16-20],且多集中于商品鱼的运输,而针对增殖放流种类幼体运输适宜条件的研究甚少[13]。
黑鲷(Acanthopagrus schlegelii)隶属于辐鳍鱼纲(Optimum)鲈形目(Perciformes)鲷科(Sparidae)鲷属(Sparus),是在我国东南沿海及日本地区广泛分布的重要经济鱼类。黑鲷为浅海底层鱼类,喜栖息在沙泥底或多岩礁的海区,一般不作远距离洄游[21-22],具有生长速度快、抗病力较强以及对不良环境具有很好的耐受性等特点,是我国沿海开展增殖放流的主要放流种。
目前针对黑鲷的研究集中在行为学、生物学等方面[23-26],尚无关于幼体运输过程中应激反应的研究。本研究以黑鲷幼体增殖放流环节中的运输过程中水体温度和摇晃为胁迫因子,分析在不同水温和摇晃频率下黑鲷幼鱼肌肉乳酸、糖元和水体氨氮含量变化,量化黑鲷幼体对环境变化所产生的应激反应程度,为提高黑鲷幼体运输过程中的存活率等提供基础数据和理论依据。
1 材料与方法 1.1 实验材料实验黑鲷幼鱼取自舟山市施晓峰种苗养殖场,选取体质健壮且规格相近的个体,黑鲷幼鱼平均体长为(5.63±0.64)cm,平均体质量为(2.9±0.3) g,经1 h充气运输到达舟山市渔业检验检测中心后暂养15 d。
用透明塑料罐(外径10 cm×高20 cm)和透明整理箱(长35 cm×宽26 cm×高22.5 cm)作为实验养殖水箱,养殖水体中溶氧含量使用SB-988氧气泵进行控制,水温使用YEE牌加热棒(温度范围20~34 ℃,可以精确到1 ℃)和奥凌牌冷水机(设定范围10~40 ℃,可以精确到1 ℃)进行控制,使用HY- 4A数显调速多用振荡器(振幅20 mm,振荡频率为0~320 r/min,可以精确到1 r/min)来模拟不同的振动条件,使用YSI多参数水质分析仪测量水体的水温、盐度和溶氧等,使用南京建成生物工程研究所的试剂盒测定乳酸和糖元,使用哈希试剂盒测定水体的氨氮浓度。用呼吸频率来评估黑鲷幼鱼的活性,当呼吸次数小于15次/min时,判定为死亡[27]。
1.2 实验设计及方法采用控制变量的方法,实际幼鱼运输过程一般不超过24 h,本研究中摇晃组的实验时间设置为24 h。
温度组:根据往年东海区黑鲷放流海区水温及室内养殖水温,共设7个水温组(21、23、25、27、29、31和33 ℃),每个水温组设3个平行组,其中25 ℃为室内养殖水温,作为对照组水温。根据黑鲷幼鱼暂养期间最适水文条件,实验过程中水体溶解氧含量保持在6.00~8.00 mg/L。水温用加热棒和冷水机调至相应的温度,海水盐度均为21,实验用水为经2次过滤的海水,水质符合《海水水质标准》(GB 3097—1997)中Ⅰ类海水的标准。每个透明整理箱装18 L海水,放20尾黑鲷幼鱼。黑鲷幼鱼野外放流后对环境水温有一个缓慢的适应过程,因此温度组的实验时间设置为72 h,运输过程中水体氨氮仍会随时间的增加而变化,因此实验过程中测定24 h内的水体氨氮浓度变化。
摇晃组:根据东海近岸海浪起伏波动周期和车载运输对应的晃动频率,本实验共设7个摇晃组,其中6个实验组摇晃频率分别为210、175、140、105、70和35 r/min,1个对照组为静止状态,每个摇晃组设3个平行组。实验过程中各组水温均为23 ℃,海水条件同温度组。每个透明塑料罐内装800 mL水,放6尾黑鲷幼鱼。
1.3 样品采集与分析黑鲷幼鱼驯养1周,每天定时7:00和19:00投喂配合饲料,饲喂后换水。
温度组:用于实验的黑鲷幼体在实验前停食1天,实验期间每天早、中、晚观察并记录各组黑鲷幼体存活情况,每24 h换水1次,换水前半小时喂食1次,并将残饵及时捞出,每天喂食前从各组随机取3尾黑鲷幼鱼,经丁香酚快速麻醉后,测量体长和体质量,随后置于冰上快速取其背部肌肉样品,保存于-80 ℃中待测。实验水体氨氮浓度每隔3小时测1次。
摇晃组:用于实验的黑鲷幼体在实验前停食1天,实验过程中观察到黑鲷幼鱼呼吸频率小于15次/min时取出,记录对应时间,每组实验在该组全部样品死亡后结束,若该组样品未全部死亡则在实验进行24 h后终止实验。黑鲷幼鱼经丁香酚快速麻醉后,测量体长和体质量,随后置于冰上快速取其背部肌肉样品,保存于-80 ℃中待测。分别在实验阶段的第0、2、5、7、9、12、16、18、21和24 h时测定水体氨氮,黑鲷幼鱼死亡时同步测定水体氨氮浓度。
乳酸、糖元测定:首先对所取得的黑鲷幼鱼背部肌肉组织按质量(g):体积(mL)=1:9的比例加入9倍体积的生理盐水,冰水浴条件机械匀浆,2 500 r/min,离心10 min,取上清液用生理盐水按1:9稀释成1%组织匀浆后测定蛋白质量浓度(g/L),取组织称量水解后测定各自吸光度值,计算乳酸和糖元含量。
1.4 数据处理实验结果以平均值±标准差表示,所得数据利用Microsoft Office Excel和SPSS 11.5进行相关的统计分析及作图,采用Duncan氏检验进行多重比较,P<0.05即认为有显著性差异。
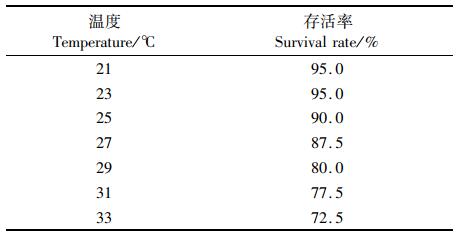
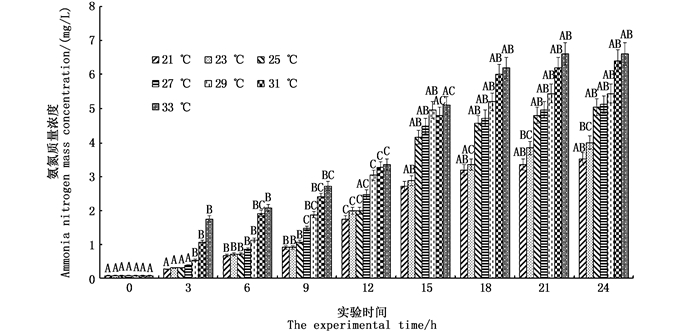
2 结果 2.1 在不同水温条件下黑鲷幼鱼存活率和水体氨氮质量浓度的变化黑鲷幼鱼存活率随水温的上升而下降(P<0.05,表 1):以21与23 ℃两个水温条件下的存活率最高,均为95.0%;33 ℃时黑鲷幼鱼存活率最低,为72.5%。水体氨氮质量浓度在21~33 ℃范围内随水温和时间上升(图 1)。
|
表 1 温度组黑鲷幼鱼存活情况 Tab.1 Survival of juvenile black seabream in temperature groups |
|
同一温度不同时间组上方不同的大写字母表示有显著性差异(P<0.05) Different uppercase letters above the same temperature group showed significant differences (P<0.05) 图 1 温度组水体氨氮含量的变化 Fig. 1 The change in the content of ammonia nitrogen in the different temperature groups |
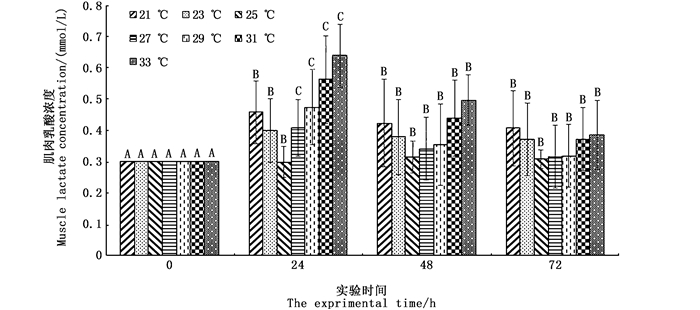
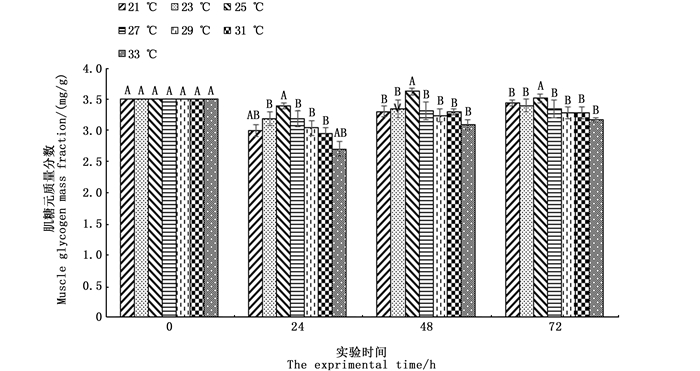
在不同水温条件下肌肉乳酸浓度的变化趋势(图 2)均为先上升后下降(P<0.05),在实验时间内,25 ℃时肌肉乳酸浓度最低,33 ℃时肌肉乳酸浓度最高。不同水温条件下肌肉糖元浓度的变化趋势(图 3)均为先下降后上升(P<0.05),在实验时间内,25 ℃时肌肉糖元浓度最高,33 ℃时肌肉糖元浓度最低。
|
同一温度不同时间组上方不同的大写字母表示有显著性差异(P< 0.05) Different uppercase letters above the same temperature group showed significant differences (P< 0.05) 图 2 温度组肌肉乳酸的变化 Fig. 2 Changes in muscle lactate in the temperature groups |
|
同一温度不同时间组上方不同的大写字母表示有显著性差异(P<0.05) Different uppercase letters above the same temperature group showed significant differences (P<0.05) 图 3 温度组肌肉糖元的变化 Fig. 3 Changes in muscle glycogen in temperature groups |
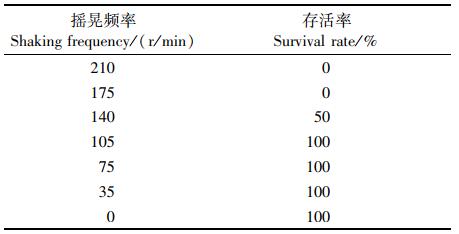
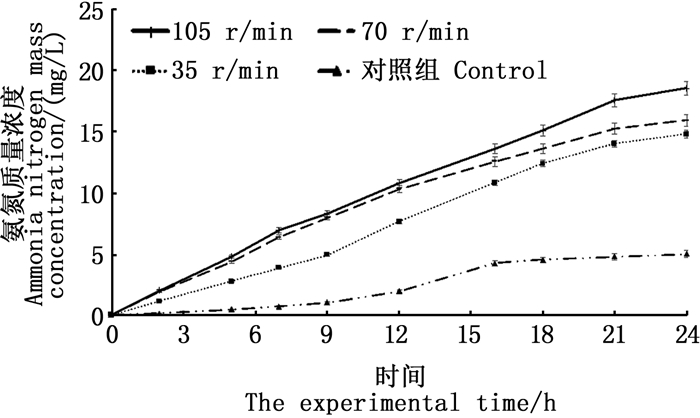
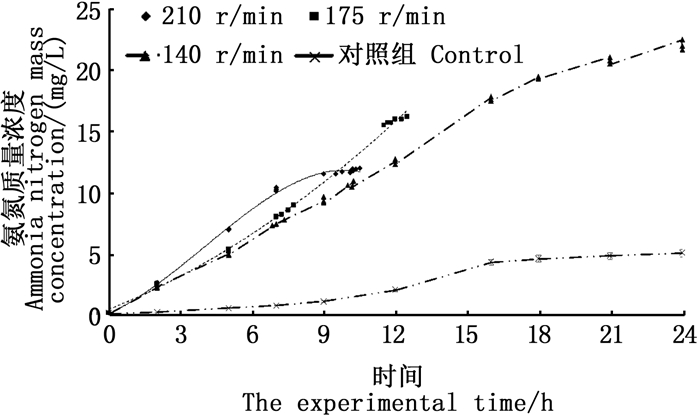
在实验进行的24 h内,黑鲷幼鱼存活率随摇晃频率的上升而下降(表 2):105、75、35和0 r/min的存活率最高,均为100%;140 r/min的存活率为50%;210 r/min与175 r/min的存活率最低,均为0。在实验时间内,在不同摇晃频率下,水体氨氮含量均随时间的增加而上升,变化速率先快后变缓,而在140 r/min以上时出现幼鱼死亡(图 4、5)。
|
表 2 摇晃组黑鲷幼鱼存活情况 Tab.2 The survival of juvenile black seabream in the shaking groups |
|
图 4 无鱼死亡的摇晃组水体氨氮质量浓度的变化 Fig. 4 Changes in the content of ammonia nitrogen in the shaking groups without fish death |
|
图 5 有鱼死亡的摇晃组水体氨氮质量浓度的变化 Fig. 5 Changes in the content of ammonia nitrogen in the shaking groups with the death of fish |
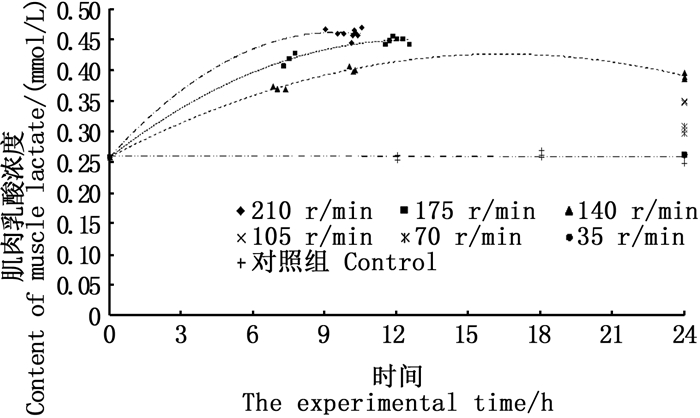
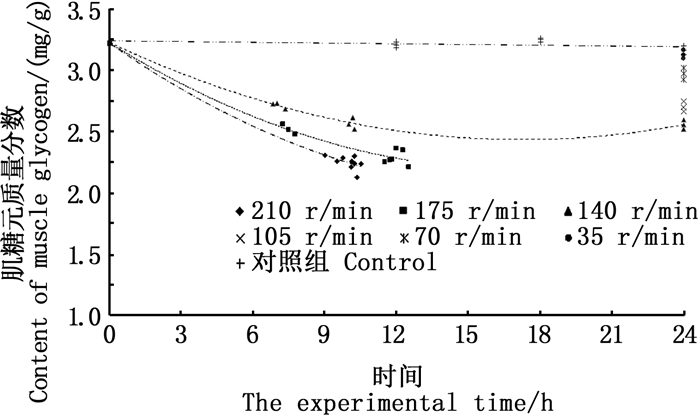
相同实验时间内,随摇晃频率的增加,黑鲷幼鱼肌肉乳酸浓度和糖元质量分数分别呈增加和降低的趋势,见图 6、7。在35 r/min的频率条件下,黑鲷幼鱼的肌肉乳酸浓度和肌肉糖元质量分数随时间均无明显变化,其他摇晃频率下,肌肉乳酸浓度随实验时间增加而升高,而肌肉糖元质量分数随实验时间增加而降低(图 6、7)。
|
图 6 摇晃组肌肉乳酸的变化 Fig. 6 Changes in muscle lactate in the shaking groups |
|
图 7 摇晃组肌肉糖元的变化 Fig. 7 Changes in the muscle glycogen of the shaking groups |
本实验明确了目前放流规格下的黑鲷幼体在水温变化和不同摇晃频率下的应激反应情况,并通过机体乳酸浓度、糖元质量分数和水体氨氮质量浓度等指标对应激反应的程度进行了量化。
3.1 水温对黑鲷幼体存活率的影响水温是影响鱼类新陈代谢速率的重要环境因子之一,在鱼类适宜水温范围内,随着水温的升高,鱼类代谢的速率、排泄速率和耗氧率加快,导致水体氨氮质量浓度升高,鱼类存活率降低[28-34]。根据东海区历年黑鲷幼鱼放流期海域环境状况,本实验选定控制水温为21~33 ℃。实验表明,黑鲷幼鱼实验水体氨氮质量浓度随水温和时间的增加而上升,黑鲷幼鱼存活率随水温的上升而下降,21 ℃与23 ℃存活率最高为95.0%,而33 ℃的黑鲷幼鱼存活率最低为72.5%,这可能是水体氨氮质量浓度过高导致鱼类血液中氨氮质量浓度迅速升高,进而对黑鲷幼体产生毒害,加大了其死亡速率。因此,从代谢的角度考虑,在适宜水温范围内,较低的水温有利于提高黑鲷幼鱼运输过程中的存活率。根据本实验结果,结合实际黑鲷幼体运输过程和水温控制可操作性,在24 h范围内,21~23 ℃是黑鲷幼体运输过程中最为适宜的水温。
3.2 水温对黑鲷幼鱼野外放流初期的影响幼鱼野外放流初期水环境中氨氮质量浓度不再是影响鱼类存活率的限制性因子,初始条件与野外放流环境的水温差成为影响鱼类存活率的主要限制性因子,鱼类会对生存环境中的水温变化起应激反应,在一定范围内乳酸积累量随着水温降低而升高[35-36]。本研究分析了为期3 d不同水温条件下黑鲷幼鱼肌肉乳酸浓度和糖元质量分数的变化,结果表明:黑鲷幼体会因水温的变化产生应激,水温差越小,应激反应就越小,随着水温的升高,黑鲷幼鱼肌肉乳酸浓度先上升后下降,肌肉糖元质量分数先下降后上升,说明黑鲷幼鱼机体存在应激后恢复的过程;高温组黑鲷幼鱼肌肉乳酸浓度下降不明显,这可能是较高水温条件下乳酸脱氢酶活性较高导致的,但高活性的乳酸脱氢酶使乳酸分解速率加快,导致乳酸堆积会影响幼鱼的存活率,因此黑鲷幼鱼野外放流前后的水温差异不宜过大,应控制在4 ℃范围内。
3.3 水体摇晃对幼鱼增殖放流运输的影响相关研究表明[17],黑鲷幼鱼在其机体耐受范围内对于外界环境有一个逐渐适应的过程。本实验中,黑鲷幼鱼存活率随摇晃频率增加而下降:105 r/min以下时无死亡;摇晃频率为140 r/min时,存活率为50%;摇晃频率为175 r/min和210 r/min时,存活率为0。增殖放流幼鱼运输主要包括水路活水船和陆路两种运输方式,其中水路活水船运输过程中,摇晃频率主要受对应海区的海浪影响,近岸海浪起伏波动周期一般为0.5~25 s,对应的摇晃频率为0.04~2 Hz[37],由此可以推断,从晃动频率的角度来考虑,在该海况条件下用活水船来运输黑鲷幼鱼是较为合适的。在陆路运输条件下,105 r/min的摇晃频率相当于40 km/h的车速的摇晃状况[6],该车速下的长途运输也能保证较高的存活率。由此推断,105 r/min及以下的摇晃频率,比较有利于黑鲷幼鱼的运输。
3.4 不足与改进黑鲷幼鱼平均体长(5.63±0.64)cm,平均体质量(2.9±0.3)g,因幼鱼较小获取鱼体血液指标时存在困难,无法通过更灵敏的血液指标对黑鲷幼鱼生理活性进行指示。此外水体氨氮质量浓度在运输过程中较难控制,无法用控制变量法来研究氨氮质量浓度对幼鱼运输的影响。本文主要分析了温度和摇晃频率对于幼鱼生存活性的影响,考虑到实际运输是多因子交互影响的过程,后续会研究多因子交互作用对幼鱼生存活性的影响。
4 结论实验分析了在现有放流条件下,规格为5 cm左右的黑鲷幼鱼对水温和摇晃的应激反应,较高或较低的水温和较大的摇晃频率都会导致黑鲷应激反应程度的增加。很多研究表明,鱼类在应激方面有一个适应的过程,在运输前进行拉网锻炼和筛选活性强的个体,有利于增加机体对不良环境的耐受性[38]。在鱼类受到胁迫而产生应激的过程中,鱼类产生应激的强度与胁迫因子变化的速率成正相关[39],因此,降低环境条件变化的频率和幅度都有助于减小鱼类受到的胁迫。综上所述,为提高增殖放流黑鲷幼鱼运输过程中的成活率,建议在运输前对黑鲷幼鱼进行拉网锻炼,以及进行水温和摇晃等胁迫因子耐受性训练,规格为5 cm左右的黑鲷幼鱼运输时水温不宜超过其室内培育条件下的水温,以21~25 ℃为宜,可以低于其室内培育条件下的水温,但温差不宜超过4 ℃,同时运输时的摇晃频率不宜超过105 r/min。
| [1] |
鲁泉. 《全国渔业发展第十三个五年规划(2016-2020年)》正式发布实施[J]. 中国水产, 2017(2): 2. LU Q. The 13th Five-Year Plan (2016-2020) of the national fisheries development officially released and implemented[J]. China Fisheries, 2017(2): 2. |
| [2] |
CUSHING D H. Plankton production and year-class strength in fish populations:an update of the match/mismatch hypothesis[J]. Advances in Marine Biology, 1990, 26: 249-293. |
| [3] |
李曰嵩, 潘灵芝, 陈新军. 产卵深度变动对东海日本鲭鱼卵仔幼鱼运输和存活率的影响[J]. 海洋渔业, 2013, 35(2): 176-182. LI Y S, PAN L Z, CHEN X J. Effects of spawning water depth on transport and survival of chub mackerel (Scomber japonicus) eggs and larvae in the East China Sea[J]. Marine Fisheries, 2013, 35(2): 176-182. |
| [4] |
APRAHAMIAN M W, SMITH K M, MCGINNITY P, et al. Restocking of salmonids-opportunities and limitations[J]. Fisheries Research, 2003, 62(2): 211-227. |
| [5] |
BERKA R. The transport of live fish:a review[M]. Rome: Food and Agriculture Organization of the United Nations, 1986.
|
| [6] |
王利娟.大口黑鲈保活运输的研究[D].上海: 上海海洋大学, 2015. WANG L J. Transportation of largemouth bass (Micropterus salmoides)[D]. Shanghai: Shanghai Ocean University, 2015. |
| [7] |
龙华. 温度对鱼类生存的影响[J]. 渔业现代化, 2005(2): 20-22. LONG H. The effect of temperature on fish survival[J]. Fishery Modernization, 2005(2): 20-22. |
| [8] |
SPECKER J L, SCHRECK C B. Stress responses to transportation and fitness for marine survival in Coho salmon (Oncorhynchus kisutch) smolts[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(5): 765-769. |
| [9] |
刘小玲. 鱼类应激反应的研究[J]. 水利渔业, 2007, 27(3): 1-3. LIU X L. Studies on the emergency responses of fishes[J]. Reservoir Fisheries, 2007, 27(3): 1-3. |
| [10] |
徐钢春, 聂志娟, 薄其康, 等. 水温对刀鲚幼鱼耗氧率、窒息点、血糖及肌肝糖元指标的影响[J]. 生态学杂志, 2012, 31(12): 3116-3120. XU G C, NIE Z J, BO Q K, et al. Effects of water temperature on oxygen consumption rate, asphyxiant point, blood glucose content, and muscle and liver glycogen content of juvenile Coilia nasus[J]. Chinese Journal of Ecology, 2012, 31(12): 3116-3120. |
| [11] |
刘波, 王美垚, 谢骏, 等. 低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响[J]. 生态学报, 2011, 31(17): 4866-4873. LIU B, WANG M Y, XIE J, et al. Effects of acute cold stress onserum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia (Oreochromis niloticus)[J]. Acta Ecologica Sinica, 2011, 31(17): 4866-4873. |
| [12] |
陈超, 施兆鸿, 薛宝贵, 等. 低温胁迫对七带石斑鱼幼鱼血清生化指标的影响[J]. 水产学报, 2012, 36(8): 1249-1255. CHEN C, SHI Z H, XUE B G, et al. Influence of low-temperature stress on serum biochemical parameters in juvenile Epinephelus septemfasciatus[J]. Journal of Fisheries of China, 2012, 36(8): 1249-1255. |
| [13] |
李丹丹, 陈丕茂, 朱爱意, 等. 黑鲷幼鱼力竭运动后代谢酶活性的恢复水平[J]. 南方水产科学, 2018, 14(6): 59-65. LI D D, CHEN P M, ZHU A Y, et al. Recovery level of metabolic enzymes in juvenile black sea bream (Sparus macrocephlus) after exhaustive exercise[J]. South China Fisheries Science, 2018, 14(6): 59-65. |
| [14] |
虞顺年, 魏小岚, 韦芳三, 等. 不同运动强度对黑鲷生长、血清和肝脏抗氧化指标的影响[J]. 水生生物学报, 2018, 42(2): 255-263. YU S N, WEI X L, WEI F S, et al. Effects of different exercise intensity on growth and serum and liver antioxidant indices of Sparus macrocephalus[J]. Acta Hydrobiologica Sinica, 2018, 42(2): 255-263. |
| [15] |
邓正华, 陈明强, 李有宁, 等. 不同运输条件对合浦珠母贝稚贝存活比较[J]. 上海海洋大学学报, 2020, 29(1): 36-44. DENG Z H, CHEN M Q, LI Y N, et al. Comparison of survival rates of different transport conditions for Pinctada fucata juveniles[J]. Journal of Shanghai Ocean University, 2020, 29(1): 36-44. |
| [16] |
洪磊, 张秀梅. 环境胁迫对鱼类生理机能的影响[J]. 海洋科学进展, 2004, 22(1): 114-121. HONG L, ZHANG X M. Effects of environmental stress on physiological function of fish[J]. Advances in Marine Science, 2004, 22(1): 114-121. |
| [17] |
姜丹莉, 林雅云, 吴玉波, 等. 草鱼、银鲫和青鱼捕捞后的应激反应[J]. 水产学报, 2016, 40(9): 1479-1485. JIANG D L, LIN Y Y, WU Y B, et al. Stress response of grass carp (Ctenopharyngodon idella), Prussian carp (Carassius auratus gibelio) and black carp (Mylopharyngodon piceus) to handling[J]. Journal of Fisheries of China, 2016, 40(9): 1479-1485. |
| [18] |
彭士明, 施兆鸿, 李杰, 等. 运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J]. 水产学报, 2011, 35(6): 831-837. PENG S M, SHI Z H, LI J, et al. Effect of transportation stress on serum cortisol, glucose, tissue glycogen and lactate of juvenile silver pomfret (Pampus argenteus)[J]. Journal of Fisheries of China, 2011, 35(6): 831-837. |
| [19] |
张伟, 王有基, 李伟明, 等. 运输密度和盐度对大黄鱼幼鱼皮质醇、糖元及乳酸含量的影响[J]. 水产学报, 2014, 38(7): 973-980. ZHANG W, WANG Y J, LI W M, et al. Effects of transportation density and salinity on cortisol, glycogen and lactate of large yellow croaker (Larimichthys crocea) juveniles[J]. Journal of Fisheries of China, 2014, 38(7): 973-980. |
| [20] |
张勇, 马旭洲, 王昂. 施肥对幼蟹池塘养殖水质影响的初步探究[J]. 上海海洋大学学报, 2018, 27(6): 884-893. ZHANG Y, MA X Z, WANG A. Preliminary study on the effect of fertilization on the water quality of crab culture pond[J]. Journal of Shanghai Ocean University, 2018, 27(6): 884-893. |
| [21] |
成庆泰, 周才武. 山东鱼类志[J]. 济南:山东科学技术出版社, 1997, 182-183. CHENG Q T, ZHOU C W. The fishes of Shandong province[J]. Ji'nan:Shandong Science and Technology Press, 1997, 182-183. |
| [22] |
NIP T H M, HO W Y, WONG C K. Feeding ecology of larval and juvenile black seabream (Acanthopagrus schlegeli) and Japanese sea perch (Lateolabrax japonicus) in Tolo Harbour, Hong Kong[J]. Environmental Biology of Fishes, 2003, 66(2): 197-209. |
| [23] |
龙章强.黑鲷(Acanthopagrus schlegeli)幼鱼对氨氮胁迫的生理响应及其维生素C的营养需求研究[D].上海: 华东师范大学, 2008. LONG Z Q. The physiological responses to ammonia stress and vitamin C requirement of juvenile black seabream (Acanthopagrus schlegeli)[D]. Shanghai: East China Normal University, 2008. |
| [24] |
刘岩, 杨长平, 单斌斌, 等. 大亚湾黑鲷标志放流及回捕率调查[J]. 中国水产科学, 2019, 26(1): 63-70. LIU Y, YANG C P, SHAN B B, et al. Investigation of a mark-recapture method of black porgy, Acanthopagrus schlegelii, in Daya Bay using plastic oval tags[J]. Journal of Fishery Sciences of China, 2019, 26(1): 63-70. |
| [25] |
梁君, 陈德慧, 王伟定, 等. 正弦波交替音对黑鲷音响驯化的实验研究[J]. 海洋学研究, 2014, 32(2): 59-66. LIANG J, CHEN D H, WANG W D, et al. Acoustic taming on Sparus macrocephalus by sine wave alternate sounds[J]. Journal of Marine Sciences, 2014, 32(2): 59-66. |
| [26] |
马细兰, 张勇, 刘云, 等. 不同饥饿时段对黑鲷(Acanthopagrus schlegeli) ghrelin基因表达的影响[J]. 海洋与湖沼, 2009, 40(3): 313-318. MA X L, ZHANG Y, LIU Y, et al. Effect of different fasting stages on ghrelin expression in black seabream Acanthopagrus schlegeli[J]. Oceanologia et Limnologia Sinica, 2009, 40(3): 313-318. |
| [27] |
田标, 陈申如, 杨远帆, 等. 黑鲷无水保活技术的初步研究[J]. 集美大学学报(自然科学版), 2004, 9(3): 221-225. TIAN B, CHEN S R, YANG Y F, et al. A primary study on the keeping-alive technique of Sparus macrocephalus by waterless method[J]. Journal of Jimei University (Natural Science), 2004, 9(3): 221-225. |
| [28] |
郭丰红.鳜鱼保活运输的研究[D].上海: 上海海洋大学, 2010. GUO F H. The study on keep-alive transportation of Siniperca chuatsi[D]. Shanghai: Shanghai Ocean University, 2010. |
| [29] |
HARMON T S. Methods for reducing stressors and maintaining water quality associated with live fish transport in tanks:a review of the basics[J]. Reviews in Aquaculture, 2009, 1(1): 58-66. |
| [30] |
DÍAZ F, RE A D, GONZÁLEZ R A, et al. Temperature preference and oxygen consumption of the largemouth bass Micropterus salmoides (Lacépède) acclimated to different temperatures[J]. Aquaculture Research, 2007, 38(13): 1387-1394. |
| [31] |
陈锦云, 曹振东, 谢小军. 温度对瓦氏黄颡鱼幼鱼静止代谢的影响[J]. 西南师范大学学报(自然科学版), 2003, 28(4): 618-621. CHEN J Y, CAO Z D, XIE X J. Effect of temperature on resting metabolic rate of Pelteobagrus vachelli (Richardson)[J]. Journal of Southwest China Normal University (Natural Science), 2003, 28(4): 618-621. |
| [32] |
殷名称, BATTY R S, FRANKLIN C E, 等. 温度和活动对仔鲱氧代谢的影响[J]. 海洋与湖沼, 1995, 26(3): 285-294. YIN M C, BATTY R S, FRANKLIN C E, et al. The influence of temperature and activity on oxygen consumption of larval herring (Clupea harencus L.)[J]. Oceanologia et Limnologia Sinica, 1995, 26(3): 285-294. |
| [33] |
范镇明, 赵新红, 钱龙. 河鲈鱼苗耗氧率和窒息点的测定[J]. 水生态学杂志, 2009, 30(4): 129-132. FAN Z M, ZHAO X H, QIAN L. Determination of oxygen consumption rate and asphyxia point of Perca fluviatilus fry[J]. Journal of Hydroecology, 2009, 30(4): 129-132. |
| [34] |
日本水產學會. 水産学シリース:No. 39活魚輸送[M]. 東京: 恒星社厚生閣, 1982: 9-91. Japan Water Industry Society. Fisheries science series:No. 39 Live fish transport[M]. Tokyo: Stellar Star Company, Koseikaku, 1982: 9-91. |
| [35] |
程守坤.鳜鱼活体运输技术基础研究[D].上海: 上海海洋大学, 2015. CHENG S K. The basic study on live transportation of mandarin fish[D]. Shanghai: Shanghai Ocean University, 2015. |
| [36] |
何伟, 曹振东, 付世建. 温度和低氧对白鲢乳酸与糖水平的影响[J]. 重庆师范大学学报(自然科学版), 2013, 30(5): 27-31. HE W, CAO Z D, FU S J. Effects of temperature and hypoxia on lactate and carbohydrate level in silver carp (Hypophthalmichthys molitrix)[J]. Journal of Chongqing Normal University (Natural Science Edition), 2013, 30(5): 27-31. |
| [37] |
侍茂崇, 高郭平, 鲍献文. 海洋调查方法导论[M]. 青岛: 中国海洋大学出版社, 2008. SHI M C, GAO G P, BAO X W. Introduction to ocean survey methods[M]. Qingdao: Ocean University of China Press, 2008. |
| [38] |
李黎, 曹振东, 付世建. 力竭性运动后鲇鱼幼鱼乳酸、糖原和葡萄糖水平的变动[J]. 水生生物学报, 2007, 31(6): 880-885. LI L, CAO Z D, FU S J. Lactate, glycogen and glucose levels of juvenile catfish (Silurus asotus Linnaeus) in response to exhaustive exercise[J]. Acta Hydrobiologica Sinica, 2007, 31(6): 880-885. |
| [39] |
夏继刚, 蔡瑞钰, 吕潇, 等. 升温/降温速率和驯化模式对斑马鱼及孔雀鱼热耐受性测定的影响[J]. 生态学杂志, 2016, 35(8): 2170-2174. XIA J G, CAI R Y, LYU X, et al. The effects of heating/cooling rate and acclimation mode on the determination of thermal tolerance of zebrafish (Danio rerio) and guppy (Poecilia reticulata)[J]. Chinese Journal of Ecology, 2016, 35(8): 2170-2174. |
 2020,
Vol. 29
2020,
Vol. 29


