2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
红色作为动物中常见的体色之一,在动物的择偶、交流、免疫和抗氧化等方面发挥着重要作用[1-3]。鸟类、家蚕和部分爬行类的研究认为,动物体表的红色(包括黄色、橙色等渐变色)主要由类胡萝卜素、蝶啶色素单独或者联合控制。鸟类的羽毛颜色变化与类胡萝卜素密切相关,如金丝雀(Serinus canaria)的羽毛从黄色变至白色是由于类胡萝卜素缺失引起[4];羽毛由红色变至黄色与酮类类胡萝卜素的含量相关[5]。雌性条纹高原蜥蜴(Sceloporus virgatus)的黄色或橙色斑块是由蝶啶色素决定,而与类胡萝卜素无关[6]。颈鳞蜥蜴(Chlamydosaurus kingii)的皱褶中色素包含类胡萝卜素和蝶啶色素,其含量随地理环境变化而变化,蝶啶色素主要以红色和橙色颜色存在[7]。棕色蜥蜴(Norops sagrei)和地表蜥蜴(N. humilis)的喉部垂肉中,后部红色区域色素主要为蝶啶色素,而中部的黄色区域色素主要为类胡萝卜素[8]。
鱼类拥有丰富的体色,红色是鲤(Cyprinus carpio)的一种重要体色突变色,例如我国的兴国红鲤、玻璃红鲤、荷包红鲤和瓯江彩鲤等[9]。我国对红鲤的遗传多样性研究[10-11]较为深入,但对于色素成分的研究较少。目前鱼类色素分析方法主要包括:分光光度法、薄层色谱法和高效液相色谱法等。王安利等[12]应用薄层色谱法分析了锦鲤的色素组分,发现其主要色素组分为杏黄色或橙色;刘金海等[13]应用分光光度法和薄层色谱法分析了不同颜色金鱼皮肤的主要色素成分,认为金鱼红色皮肤的主要成分为虾青素。还有研究[14]应用高效液相色谱法测得大黄鱼皮肤中的主要色素为黄体素,并含有少量的角黄素、虾青素和部分未知的色素;红小丑鱼皮肤中的主要色素为虾青素和黄体素,鳍条中不含有黄体素[15]。同时,类胡萝卜素在动物体内存在的形式也不同,例如:红小丑鱼[15]和鲑鱼[16]的类胡萝卜素以游离态形式存在;金鱼[17]和巴沙鱼[18]中的类胡萝卜素主要以酯化形式存在,需要皂化水解后才能鉴定出来。
瓯江彩鲤(Cyprinus carpio var. color)是我国瓯江彩流域的一种地方性养殖对象,拥有“全红”(全身均为红色)、“粉玉”(全身均为白色)、“大花”(红色体表镶嵌大块黑色斑块)、“粉花”(白色体表镶嵌大块黑色斑块)等多种体色[19],是进行鱼类体色研究的良好材料。本实验室对瓯江彩鲤的体色表型遗传规律与分子遗传机制进行了初步研究,发现红色对于白色为显性,两者符合孟德尔遗传规律[20]。然而,目前尚未对其色素组成及其含量进行研究与分析。本文以瓯江彩鲤“全红”和“粉玉”体色这一孟德尔性状为对象,应用分光光度法和高效液相色谱法,对瓯江彩鲤红、白体色皮肤和组织中色素组成进行鉴定与分析,以期为瓯江彩鲤的体色遗传变异研究以及后续选育提供相关依据。
1 材料与方法 1.1 实验材料本实验所用的“全红”和“粉玉”两种体色样本来源于2015年经“全红”和“粉玉”杂交家系所产生的F2分离群体,实验鱼饲养于浙江龙泉省级瓯江彩鲤良种场,规格为5月龄,每种体色各取3尾用于色素差异分析。
1.2 分光光度法测定皮肤中类胡萝卜素和蝶啶色素总量参照条纹高原蜥蜴[6]、棕色蜥蜴和地表蜥蜴中色素提取方法[8],以丙酮和甲基叔丁基醚(MTBE)分别对皮肤中总类胡萝卜素和叶黄素进行提取,以pH=2.0的30%酸化乙醇和1%的NH4OH溶液分别对蝶啶色素(主要为Drosopterins)进行提取。
在紫外分光光度计(UV2000,上海优尼科,中国)中进行吸光值的测定。总类胡萝卜素的测定波长为447 nm,空白对照组为正己烷溶液,消光系数为2 500[6]。pH=2.0的30%酸化乙醇提取的蝶啶色素测定波长为490 nm,空白对照组为pH=2.0的30%酸化乙醇溶液,消光系数为25 100[6]。叶黄素测定时以MTBE为空白对照,测定波长447 nm,消光系数为2 550[8]。1%的NH4OH溶液提取的蝶啶色素测定时,以1%的NH4OH溶液为空白对照,测定波长490 nm消光系数为10 000[8]。
提取的相关色素含量计算公式为
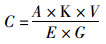 (1)
(1)
式中:C为类胡萝卜素或蝶啶色素含量, mg/kg;A为吸光值;K为常数, 104;V为提取液体积, mL;E为摩尔消光系数;G为样品质量, g。
1.3 高效液相色谱技术(HPLC)测定不同组织中类胡萝卜素种类和含量 1.3.1 虾青素和叶黄素标准溶液的配制虾青素标准品购于Cayman chemical公司,纯度大于98%,型号CAT NO.472-61-7;黄体素标准品购于CFW Ⓡ Labs公司,纯度大于90%,型号CAT NO.L04460CN。为减少实验误差,直接将1 mL甲醇溶液(HPLC级别)加至购买的标准品中,超声波辅助溶解充分后,将标准溶液稀释至工作液浓度,随后加入0.1 g BHT,充入氮气密封后,-40 ℃避光保存。虾青素标准品工作液浓度的梯度依次为2.5、25、100、250、500 ng/mL。黄体素标准品工作液浓度的梯度依次为10、50、250、500、1 000 ng/mL。
1.3.2 HPLC分析条件及标准品线性方程液相色谱机器型号为ACQUITY ULPCⓇ BEH C18 1.7 μm column (2.1×50 mm),进样体积为2 μL。样品通过紫外可见光二极管阵在475 nm处检测虾青素,黄体素的检测波长为445 nm,洗脱条件为等度洗脱,流动相为甲醇和水的混合溶液(V: V=90: 10),流速为0.5 mL/min,柱温为40 ℃。
以虾青素和黄体素标准品峰面积为纵坐标,以对应的浓度(ng/mL)为横坐标,分别绘制虾青素和黄体素的标准曲线。
1.3.3 类胡萝卜素的提取、皂化与测定取眼睛、皮肤和鳍条组织,参照鲑鱼中色素提取方法对其类胡萝卜素进行提取[16],皂化处理方法根据鸟类视网膜中类胡萝卜素皂化方法[21]。高效液相色谱分析时,将干燥后的样本重新溶解于2 mL甲醇(HPLC级别)中,充分溶解后,通过0.22 μm的注射器式有机过滤膜过滤,随后上机测定类胡萝卜素种类及含量。
1.4 数据处理实验结果用平均值±标准差(Mean ± SD)表示。应用SPSS 17.0进行数据分析,统计学显著性(P < 0.05)通过单因素方差分析(ANOVA)和邓肯多重检验(Duncan’s tests)进行分析,皮尔逊相关系数(Pearson correlation coefficient)通过双变量相关性(Bivariate correlate algorithm)进行分析。
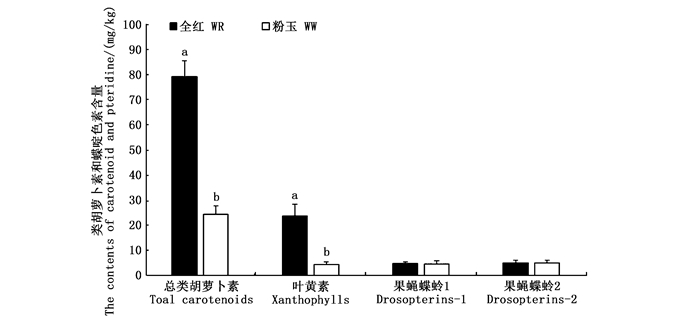
2 结果 2.1 分光光度法测定两种体色皮肤中类胡萝卜素和蝶啶色素含量分光光度法测定的“全红”皮肤中总类胡萝卜素[(79.03 ± 2.44)mg/kg]和叶黄素[(23.83± 4.50) mg/kg]的含量均显著的高于“粉玉”皮肤中的总类胡萝卜素[(24.37 ± 3.41) mg/kg]和叶黄素[(4.49 ± 1.07) mg/kg]的含量(P < 0.05)。用1% NH4OH溶液提取的蝶啶色素(果蝇蝶蛉1)在“全红”和“粉玉”皮肤中的含量分别为(4.93 ± 0.73) mg/kg和(4.75 ± 1.38) mg/kg;用pH=2.0的30%酸化乙醇提取的蝶啶色素(果蝇蝶蛉2)在“全红”和“粉玉”皮肤中的含量分别为(5.29 ± 1.03) mg/kg和(5.21 ± 1.07) mg/kg,这两种方法提取的蝶啶色素在两种体色间均没有显著差异(P>0.05)。见图 1。
|
Drosopterins-1表示由1% NH4OH溶液提取的果蝇蝶蛉,Drosopterins-2表示由pH=2.0 30%酸化乙醇溶液提取的果蝇蝶蛉。不同的字母表示具有显著性差异(P < 0.05) Drosopterins-1 means pteridines extracted by 1% NH4OH, and Drosopterins-2 means pteridines extracted by acidified pH=2.0 30% ethanol. Different lowercase letters on the column stand for a significant difference (P < 0.05) 图 1 “全红”和“粉玉”皮肤总类胡萝卜素、叶黄素和蝶啶色素的含量比较 Fig. 1 Content of total carotenoids, xanthophylls and drosopterins in WR (black bars) and WW (white bars) skin of Oujiang color common carp |
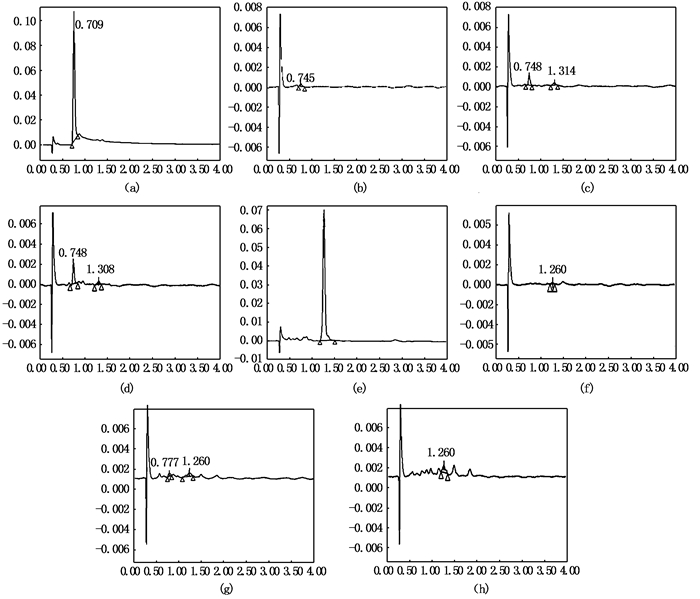
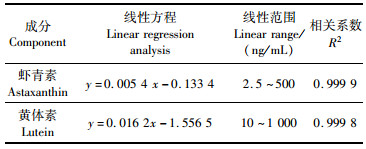
高效液相色谱结果显示,虾青素和黄体素标准品的出峰时间分别为0.748 min和1.262 min(图 2a、2e)。以虾青素和黄体素标准品峰面积为纵坐标,以对应的浓度(ng/mL)为横坐标,分别绘制虾青素和黄体素的标准曲线,其线性方程、线性范围和相关系数如表 1所示。
|
(a)虾青素标准品的色谱图;(b)、(c)和(d)分别为眼睛、皮肤和鳍条中虾青素的色谱图;(e)为黄体素标准品的色谱图;(f)、(g)和(h)分别为眼睛、皮肤和鳍条中黄体素的色谱图 (a)HPLC chromatogram of astaxanthin standards; (b), (c) and (d) represent HPLC chromatogram of astaxanthin in skin and fin tissues, respectively; (e)HPLC chromatogram of lutein standards; (f), (g) and (h) represent HPLC chromatogram of lutein in skins and fin tissues 图 2 虾青素和黄体素的标准品与“全红”眼睛、鳍条和皮肤中虾青素和黄体素的色谱图 Fig. 2 HPLC chromatogram of astaxanthin and lutein in standard condition and the eye, fin and skin tissues |
|
表 1 虾青素和黄体素的线性方程和线性范围 Tab.1 Linear regression equation and linear range of astaxanthin and lutein |
高效液相色谱分析发现,未经皂化的提取物中检测不到虾青素和黄体素,皂化后可以成功检测到虾青素和黄体素,说明瓯江彩鲤的虾青素和黄体素主要以酯化形式存在。经0.2 mol/L NaOH/甲醇溶液成功鉴定出了“全红”眼睛、皮肤和鳍条中的虾青素(图 2b~d),经0.02 mol/L NaOH/甲醇溶液成功鉴定出了“全红”眼睛、皮肤和鳍条中的黄体素(图 2f~h)。分析还发现鳍条中可能含有更多的未知的类胡萝卜素(图 2g、2h)。
在“全红”的眼睛、皮肤和鳍条组织中均检测到了虾青素和黄体素;在“粉玉”的眼睛、皮肤和鳍条中未能检测到虾青素和黄体素。“全红”鳍条中虾青素含量为(28.00±3.61) mg/kg,显著的高于皮肤[(11.57±2.27)mg/kg]和眼睛[(1.57±2.27)mg/kg]中虾青素的含量(P < 0.05)。“全红”皮肤和眼睛中黄体素含量分别为(62.34±4.93) mg/kg和(56.00±6.74) mg/kg,二者之间并无显著性差异(P> 0.05),但均显著的高于“全红”鳍条中黄体素的含量[(46.49±7.26) mg/kg,P < 0.05]。见图 3。
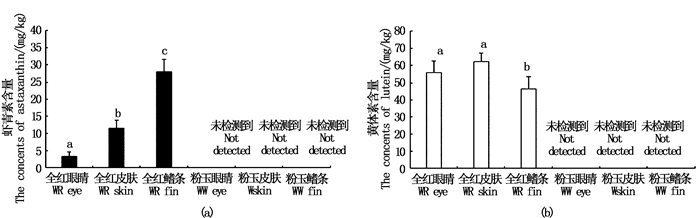
|
不同的字母表示具有显著性差异(P < 0.05) Different lowercase on the column stand for a significant difference (P < 0.05) 图 3 “全红”和“粉玉”的眼睛、皮肤和鳍条中虾青素和黄体素的含量 Fig. 3 Concents of astaxanthin and lutein in the eyes, skins and fins in WR and WW Oujiang color common carp |
动物红色组织中沉积的主要色素为类胡萝卜素和/或蝶啶色素,二者具有相似的光谱特性,均可产生红色、橙色和黄色等一系列颜色。蝶啶色素可由动物自身合成[22],如果蝇红色眼睛中色素为蝶啶色素,主要成分为红色的果蝇蝶蛉[23]。雌性高原蜥蜴(Sceloporus virgatus)独有的颈部红色斑块的主要色素成分为果蝇蝶蛉,增加饮食中的类胡萝卜素并不能影响其橙色斑块的颜色[6]。在孔雀鱼中,橙色斑块与其择偶等密切相关,当类胡萝卜素不足时,通过蝶啶色素合成量上升来增加其橙色斑块的颜色[24]。与蝶啶色素不同,动物自身不能合成类胡萝卜素,只能从外界食物中获得。当类胡萝卜素吸收过程受阻时皮肤会呈现白色[4];类胡萝卜素分解受到抑制时,动物体表及部分组织中就会出现类胡萝卜素的沉积,例如鸡皮肤的黄色[25],人类视网膜中的黄斑色素[26],羊脂肪组织的黄色[27]。类胡萝卜素的选择性吸收过程也会影响动物的颜色,例如在家蚕的突变体中,Scrb15突变体选择性的吸收β-胡萝卜素,而Camoe2突变体主要吸收黄体素[28]。目前在鲤的颜色变种中,皮肤色素的鉴定多为分光光度法或薄层层析法鉴定类胡萝卜素的含量[29-30],蝶啶色素含量的鉴定未见相关报道。本实验通过分光光度法分别对“全红”和“粉玉”不同颜色皮肤中的蝶啶色素和类胡萝卜素进行了鉴定,结果发现,“全红”和“粉玉”皮肤中差异色素以类胡萝卜素为主,蝶啶色素在“全红”和“粉玉”皮肤中并没有差异,说明类胡萝卜素可能是造成瓯江彩鲤红、白体色分化的关键色素,但哪些类胡萝卜素参与瓯江彩鲤红色的形成过程仍未知。
HPLC可以鉴定鱼类皮肤中类胡萝卜素的种类和含量,如HPLC鉴定红小丑鱼中的虾青素和黄体素[15],鲑鱼中的虾青素、黄体素和玉米黄质等[16],巴沙鱼中的黄体素和玉米黄质等[18]。但在鲤的颜色变种中,还未见HPLC对类胡萝卜素种类和含量鉴定的相关报道。类胡萝卜素在海水鱼类体内主要以游离态形式存在,如红小丑鱼[15]和鲑鱼[16],而在淡水鱼类体内主要以酯化形成存在[31],如金鱼[17]和巴沙鱼[18]。本实验以0.2 mol/L NaOH/甲醇溶液和0.02 mol/L NaOH/甲醇溶液分别对瓯江彩鲤红色组织中的类胡萝卜素进行了皂化过程,成功对虾青素和黄体素等类胡萝卜素进行了测定,结果说明瓯江彩鲤红色组织中类胡萝卜素主要以酯化形式存在。综上所述,“全红”和“粉玉”瓯江彩鲤体表的差异色素以虾青素和黄体素等类胡萝卜素为主,在体内以酯化形式存在,为下一步瓯江彩鲤的红、白体色研究提供基础。
| [1] |
SONG G J, KIM S M, PARK K H, et al. SR-BI mediates high density lipoprotein (HDL)-induced anti-inflammatory effect in macrophages[J]. Biochemical and Biophysical Research Communications, 2015, 457(1): 112-118. DOI:10.1016/j.bbrc.2014.12.028 |
| [2] |
TOEWS D P L, HOFMEISTER N R, TAYLOR S A. The evolution and genetics of carotenoid processing in animals[J]. Trends in Genetics, 2017, 33(3): 171-182. DOI:10.1016/j.tig.2017.01.002 |
| [3] |
HAN T, LI X Y, WANG J T, et al. Effects of dietary astaxanthin (AX) supplementation on pigmentation, antioxidant capacity and nutritional value of swimming crab, Portunus trituberculatus[J]. Aquaculture, 2018, 490: 169-177. DOI:10.1016/j.aquaculture.2018.02.030 |
| [4] |
TOOMEY M B, LOPES R J, ARAU'JO P M, et al. High-density lipoprotein receptor Scarb1 is required for carotenoid coloration in birds[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(20): 5219-5224. DOI:10.1073/pnas.1700751114 |
| [5] |
LOPES R J, JOHNSON J D, TOOMEY M B, et al. Genetic basis for red coloration in birds[J]. Current Biology, 2016, 26(11): 1427-1434. DOI:10.1016/j.cub.2016.03.076 |
| [6] |
GRETHER G F, HUDON J, ENDLER J A. Carotenoid scarcity, synthetic pteridine pigments and the evolution of sexual coloration in guppies (Poecilia reticulata)[J]. Proceedings of the Royal Society B-Biological Sciences, 2001, 268(1473): 1245-1253. DOI:10.1098/rspb.2001.1624 |
| [7] |
MERKLING T, HAMILTON D G, CSER B, et al. Proximate mechanisms of colour variation in the frillneck lizard:geographical differences in pigment contents of an ornament[J]. Biological Journal of the Linnean Society, 2016, 117(3): 503-515. DOI:10.1111/bij.12672 |
| [8] |
STEFFEN J E, MCGRAW K J. Contributions of pterin and carotenoid pigments to dewlap coloration in two anole species[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2007, 146(1): 42-46. DOI:10.1016/j.cbpb.2006.08.017 |
| [9] |
WANG C H, WANG J, XIANG S P, et al. Parental genetic effects evaluation of growth-related traits of red common carp in China[J]. Fisheries Science, 2009, 75(5): 1301-1305. DOI:10.1007/s12562-009-0155-4 |
| [10] |
王成辉.中国红鲤遗传多样性研究[D]. 上海: 上海水产大学, 2002. WANG C H. Study on genetic diversity of red common carps in China[D]. Shanghai: Shanghai Fisheries University, 2002. http://cdmd.cnki.com.cn/article/cdmd-10264-2006030017.htm |
| [11] |
陈晓雯, 王军, 岳武成, 等. 两种拼接方法在瓯江彩鲤转录组研究中的适用性比较[J]. 上海海洋大学, 2017, 26(5): 666-673. CHEN X W, WANG J, YUE W C, et al. Comparison of two transcriptome assembly strategies on Oujiang color common carp(Cyprinus carpio Var. color)[J]. Journal of Shanghai Ocean University, 2017, 26(5): 666-673. |
| [12] |
王安利, 刘金海, 王维娜. 锦鲤总色素及色素组分的比较研究[J]. 水生生物学报, 2005, 29(6): 694-698. WANG A L, LIU J H, WANG W N. Comparative studies on the total pigment and pigment components of color carp[J]. Acta Hydrobiologica Sinica, 2005, 29(6): 694-698. DOI:10.3321/j.issn:1000-3207.2005.06.016 |
| [13] |
刘金海, 王安利, 王维娜. 金鱼总色素及色素组分的比较研究[J]. 水生生物学报, 2007, 31(1): 73-77. LIU J H, WANG A L, WANG W N. Comparative studies on the total pigment and pigment components of Goldfish[J]. Acta Hydrobiologica Sinica, 2007, 31(1): 73-77. DOI:10.3321/j.issn:1000-3207.2007.01.011 |
| [14] |
李欢, 段青源, 桑卫国. 固相萃取-反相高效液相色谱法测定大黄鱼皮肤主要色素[J]. 食品工业科技, 2015, 36(4): 57-60, 66. LI H, DUAN Q Y, SANG W G. Determination of main pigment in the skin of large yellow croake (Peseudosciaena crocea R.) by reversed phase high performance liquid chromatography with solid phase extraction[J]. Science and Technology of Food Industry, 2015, 36(4): 57-60, 66. |
| [15] |
张芬, 杜虹, 汤水粉, 等. 高效液相色谱法测定红小丑鱼中虾青素和叶黄素含量[J]. 食品工业科技, 2018, 39(4): 210-214. ZHANG F, DU H, TANG S F, et al. Determination of lutein and astaxanthin in Amphiprion frenatus by reversed-phase high performance liquid chromatography[J]. Science and Technology of Food Industry, 2018, 39(4): 210-214. |
| [16] |
LI H X, TYNDALE S T, HEATH D D, et al. Determination of carotenoids and all-trans-retinol in fish eggs by liquid chromatography-electrospray ionization-tandem mass spectrometry[J]. Journal of Chromatography B, 2005, 816(1/2): 49-56. |
| [17] |
陈晓明, 徐学明, 金征宇. 富含虾青素的法夫酵母对金鱼体色的影响[J]. 中国水产科学, 2004, 11(1): 70-73. CHEN X M, XU X M, JIN Z Y. Pigmentation of Carassius auratus with astaxanthin-riched Phaffia raodozyma[J]. Journal of Fishery Sciences of China, 2004, 11(1): 70-73. DOI:10.3321/j.issn:1005-8737.2004.01.013 |
| [18] |
赵艳杨, 杨发树, 张凤枰, 等. 反相高效液相色谱法测定巴沙鱼中的黄体素和玉米黄质[J]. 食品科学, 2012, 33(16): 225-228. ZHAO Y Y, YANG F S, ZHANG F P, et al. Determination of lutein and zeaxanthin in Pangasius bocouti by reversed-phase high performance liquid chromatography[J]. Food Science, 2012, 33(16): 225-228. |
| [19] |
LI S F, WANG C H. Genetic diversity and selective breeding of red common carps in China[J]. Naga, The World Fish Center, 2001, 24(3/4): 56-61. |
| [20] |
王成辉, 项松平, 吕耀平, 等. 瓯江彩鲤红、白两种体色遗传关系的初步研究[J]. 上海水产大学学报, 2018, 17(4): 402-405. WANG C H, XIANG S P, LYU Y P, et al. Preliminary study on inheritance of red and white color phenotypes in Oujiang color carp, C. carpio var. color[J]. Journal of Shanghai Fisheries University, 2018, 17(4): 402-405. |
| [21] |
TOOMEY M B, MCGRAW K J. Modified saponification and HPLC methods for analyzing carotenoids from the retina of quail:implications for its use as a nonprimate model species[J]. Investigative Ophthalmology & Visual Science, 2007, 48(9): 3976-3982. |
| [22] |
BRAASCH I, SCHARTL M, VOLFF J N. Evolution of pigment synthesis pathways by gene and genome duplication in fish[J]. BMC Evolutionary Biology, 2007, 7: 74. DOI:10.1186/1471-2148-7-74 |
| [23] |
KIM H, KIM K, YIM J. Biosynthesis of drosopterins, the red eye pigments of Drosophila melanogaster[J]. IUBMB Life, 2013, 65(4): 334-340. DOI:10.1002/iub.1145 |
| [24] |
GRETHER G F, HUDON J, ENDLER J A. Carotenoid scarcity, synthetic pteridine pigments and the evolution of sexual coloration in guppies (Poecilia reticulata)[J]. Proceedings of the Royal Society B-Biological Sciences, 2001, 268(1473): 1245-1253. DOI:10.1098/rspb.2001.1624 |
| [25] |
ERIKSSON J, LARSON G, GUNNARSSON U, et al. Identification of the Yellow skin gene reveals a hybrid origin of the domestic chicken[J]. PLoS Genetics, 2008, 4(2): e1000010. DOI:10.1371/journal.pgen.1000010 |
| [26] |
LI B X, VACHALI P P, GORUSUPUDI A, et al. Inactivity of human β, β-carotene-9', 10'-dioxygenase (BCO2) underlies retinal accumulation of the human macular carotenoid pigment[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(28): 10173-10178. DOI:10.1073/pnas.1402526111 |
| [27] |
VÅGA D I, BOMAN I A. A nonsense mutation in the beta-carotene oxygenase 2(Bco2) gene is tightly associated with accumulation of carotenoids in adipose tissue in sheep (Ovis aries)[J]. BMC Genetics, 2010, 11: 10. |
| [28] |
SAKUDOH T, KUWAZAKI S, IIZUKA T, et al. CD36 homolog divergence is responsible for the selectivity of carotenoid species migration to the silk gland of the silkworm Bombyx mori[J]. Journal of Lipid Research, 2013, 54(2): 482-495. DOI:10.1194/jlr.M032771 |
| [29] |
白东清, 阎姗姗, 吴旋, 等. β-胡萝卜素对红白锦鲤生长、体色及代谢的初步研究[J]. 天津农学院学报, 2010, 17(1): 1-5. BAI D Q, YAN S S, WU X, et al. Primary study of β-carotene on growth, colouring and deposition of red-white koi carp (Cyprinus carpio L.)[J]. Journal of Tianjin Agricultural College, 2010, 17(1): 1-5. DOI:10.3969/j.issn.1008-5394.2010.01.001 |
| [30] |
邹旭龙, 崔昊, 狄大可, 等. 光照对锦鲤类胡萝卜素含量分布影响的初步研究[J]. 山西农业大学学报(自然科学版), 2016, 36(6): 428-432. ZOU X L, CUI H, DI D K, et al. Study on distribution of carotenoid in Cryprinus Carpin Koi under different illumination condition[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2016, 36(6): 428-432. DOI:10.3969/j.issn.1671-8151.2016.06.010 |
| [31] |
冷向军, 李小勤. 水产动物着色的研究进展[J]. 水产学报, 2006, 30(1): 138-143. LENG X J, LI X Q. The recent advance of aquatic animal pigmentation[J]. Journal of Fisheries of China, 2006, 30(1): 138-143. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


