美洲鲥(Alosa sapidissima)属于鲱形总目(Clupeomorpha)鲱形目(Clupeiformes)鲱科(Clupeidae)西鲱属(Alosa),原产于北美洲大西洋西岸,属于洄游性鱼类。因其肉鲜味美,经济价值较高,且适合人工驯养,被世界各国广泛引种[1-2],中国于1998年开始从美国引进美洲鲥受精卵进行人工驯养。在国内,因与中国鲥的外形相似、肉质相媲美,美洲鲥深受市民的喜爱,市场价格也非常高,达150~200元/kg [3]。目前,国内美洲鲥养殖主要采用工厂化养殖、网箱养殖、池塘养殖等3种模式,以工厂化养殖模式居多,因美洲鲥对水温的特殊要求,养殖户往往采用抽取深井水的方式来维持工厂化养殖的水温[4]。随着国内美洲鲥养殖面积日益扩大[1-2, 5],苗种的需求量大增,2017年美洲鲥苗种价格为5~12元/尾,苗种的规模化生产就需要实现美洲鲥的全人工繁殖。
国内外有关美洲鲥繁殖的基础研究主要包括性腺发育[6-8]、精子冷冻保存[9-10]、早期发育[2, 11-12]及人工繁殖等[1-2, 13-14],有关美洲鲥交配产卵规律的研究还未见报道。本文采用池塘培育美洲鲥亲本,通过室内调控方法促产交配,实现了全程不使用深井水条件下的美洲鲥全人工繁殖,弄清了美洲鲥亲本交配产卵的规律和趋势。
1 材料与方法 1.1 亲本强化适应培育选取2冬龄体表无外伤、健康的美洲鲥作为亲本,该亲本由地处杭州湾北部沿岸的上海市水产研究所奉贤科研基地人工繁育, 又经过约2年的遮阴池塘养殖、土池大棚越冬及升降盐处理的仿洄游培育而成,亲本池塘及越冬培育方法见施永海等[15],采用大棚结构式池塘,在池塘上方,夏季采用遮阴膜遮阴降温,冬季采用塑料薄膜保温。放养密度为0.48~1.56尾/m2,按常规投喂海水鱼膨化饲料(浙江明辉饲料有限公司)。春秋两季,每2周换水1次,换水量为1/3;盛夏季节,减少换水量,选择阴凉天气、少量多次的换水方式,每次换水量为1/5;冬季,每2周换水1次,换水量为1/5~1/3[15]。
一般到3月中旬~4月中旬,将越冬培育的美洲鲥亲本从土池大棚移入简易大棚水泥池进行春季强化适应培育,培育用池面积为220 m2、深1.2~1.8 m、池壁光滑的方形水泥池,水泥池上方架构拱形顶,顶部覆盖塑料薄膜和遮阴率90%的遮阴膜,以互相补充调光调温[3],保证白天的光照强度范围为300~500 Lx,保持水温范围在16~18 ℃。池内放置气头,密度为0.2~0.3尾/m2,连续充气。放养前,清池消毒后,晾干3~4 d再使用,亲本放养密度为0.7~1.0尾/m2(表 1)。其间,按常规投喂粗蛋白含量为40%的海水鱼膨化饲料3#料(浙江明辉饲料有限公司),每天投喂2次(9:00和15:00),以1~2 h摄食完为准[3];用水为当地河水(淡水),经过沉淀和自然预升降温,筛绢网过滤(60目),每5~6 d换水1次,每次2/3,每2周倒池1次,换水温差小于2 ℃,倒池水温差小于1 ℃[3]。
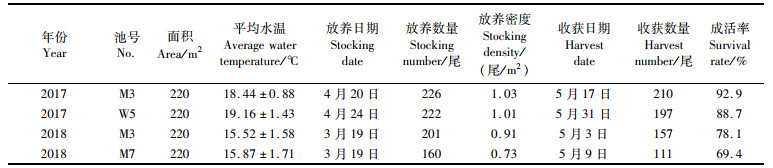
|
表 1 美洲鲥亲本强化适应培育情况 Tab.1 Basic informations of A. sapidissima broodstock intensive adaptive cultivation |
促产循环系统的构建:产卵池的上半部分为近正方形水泥池(图 1),长11.0 m×宽10.0 m×高1.2~1.3 m,水深1.05~1.15 m,下半部分呈锥型,池中心设有排水口,排水口和池壁底部的落差为20~30 cm,排水口上设有排水罩,排水口连接4寸排水管,沿产卵池四周底部铺设纳米充气管,形成闭合充气环;产卵池旁边设有一个集卵池,集卵池为狭长形水泥池,长11.0 m×宽1.0 m×高1.6~1.7 m,水深1.4~1.5 m,集卵池的一端设有20根1英寸气提循环管,通过充气的方式把集卵池的水提升到产卵池内,同时设有2个0.75 kW的潜水泵,通过软管把集卵池的水回流到产卵池;集卵池中心位置设有集卵网箱,规格为长1.0 m×宽0.6 m×高0.4 m,网片为20~30目的聚乙烯网,集卵网箱底部中心向下圆形开口做成袖管,同时将4英寸排水管接入,促产池的水利用水位压力差通过中心排水口以及排水管顺水流方向进入集卵网箱,鱼卵随水流从底部进入集卵网箱,鱼卵滞留于网箱,水流经过网箱网片进入集卵池,再由气提管以及潜水泵进入产卵池,完成整个水循环;在促产循环系统的上方设置拱形环顶,顶部覆盖2~3层遮阴膜,保证白天的光照强度范围为300~500 Lx,同时配备20 kW的空气能制冷机组维持水温。
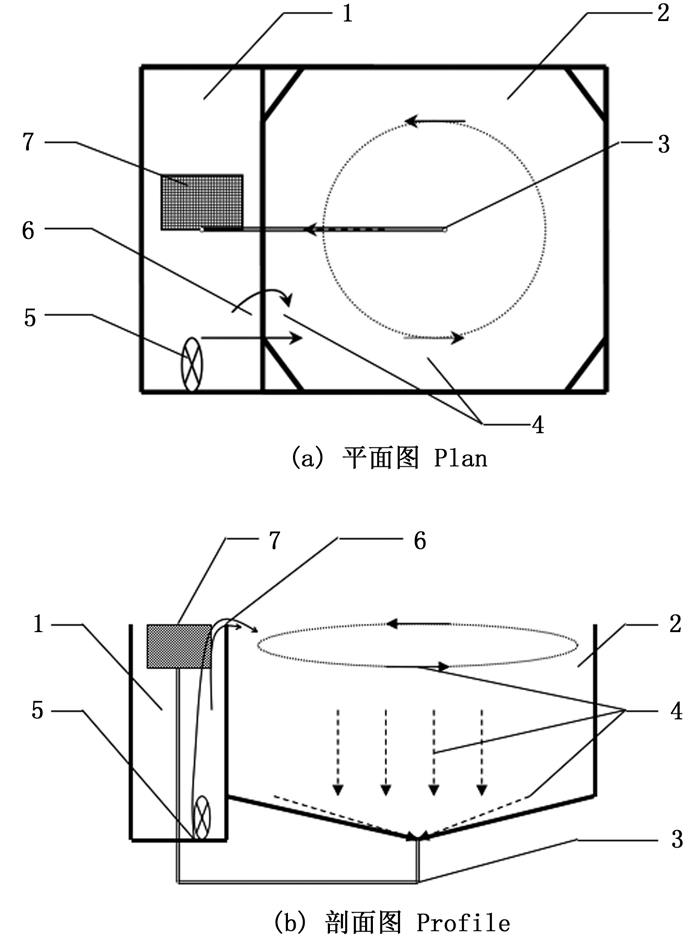
|
1.集卵池;2.产卵池;3.排水口;4.水流方向;5.潜水泵;6.气提管;7.集卵网箱 1.pool for collecting eggs; 2.spawning pond; 3.outfall; 4.water flow direction; 5.submersible pump; 6.stripping tube; 7.the net cage for collecting eggs 图 1 美洲鲥产卵循环系统的示意图 Fig. 1 Schematic of the spawning circulation system of A. sapidissima |
促产亲本挑选及放养:5月初,在亲本强化培育池内挑选促产用亲本。促产亲本放养前,对整个促产循环系统进行清洗、消毒,晾干3~4 d后进水,用水经过二级沉淀和80目筛绢网过滤,用空气能机组调温,维持水温18~19 ℃。挑选促产亲本的要求:雌鱼后腹部膨大而柔软,泄殖孔微红,有些轻压腹部不流卵;雄鱼,轻压泄殖孔有少量精液流出,且遇水不散。整个挑选和运输过程中操作轻柔不离水;促产亲本放养密度为1.0~1.5尾/m2。
亲本促产交配受精:亲本进入产卵池后,24 h连续不间断开启纳米充气和气提循环,晚上20:00~次日上午10:00期间开启循环潜水泵,增强循环压力,使产卵池和集卵池水位差达到20~30 cm,使得产卵池的卵通过4英寸排水管到集卵池。促产期间,上午投喂饲料1次,投饲量为鱼体质量的0.3%~0.5%,每隔2~3天换水1次,每次约20%~30%,用水经过水泥池沉淀曝气及预降温至17~18 ℃,并用80目筛绢网过滤进水,利用制冷机组保持促产水温为17.0~20.0 ℃;及时清除死亡个体,以防止死亡个体堵住中心排水口。
鱼卵收集及计数:亲本交配产卵时间一般在早上5: 00~8: 00,收集鱼卵时间设定在9: 00~10: 00,用24目软筛绢抄网抄取,经清洗和分离,用烧杯量鱼卵体积计数后移入孵化池,孵化池水温保持在18.5~19.5 ℃,第2天上午肉眼观察受精卵胚体,并计数计算受精率。
1.3 取样与数据分析方法由于美洲鲥雌鱼产卵是分批产卵类型,随机选取未产过卵、且有成熟卵子的雌鱼进行测量和解剖,取成熟卵子,进行计数,以测算雌鱼第1次产卵的数量。
所有数据用Mean±SD表示,采用Excel和SPSS 19.0处理数据及图表。用Oneway ANOVA对各旬的日产卵量、日受精卵量及日均受精率的差异进行方差分析,用Duncan氏法作多重比较,以P < 0.05为差异显著[3];以P < 0.01建立回归曲线[3]。数据分析所用公式:
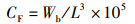 (1)
(1)
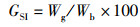 (2)
(2)
式中:CF为肥满度;GSI为性腺指数;L为体长,mm;Wg为性腺质量,g;Wb为鱼体质量,g。
2 结果与分析 2.1 美洲鲥亲本强化适应培育情况池塘培育美洲鲥亲本经约1个月的简易大棚水泥池强化适应培育,培育成活率2017年较高(88.7%~92.9%)、2018年较低(69.4%~78.1%),见表 1。强化适应培育后,美洲鲥发育良好,雌鱼后腹部明显膨大,雄鱼腹部性腺轮廓明显(图 2)。对2017年强化适应培育的美洲鲥产前雌鱼亲本(Ⅴ期)进行测量解剖:体长(34.62±2.90)cm、体质量(844.11±134.78)g、卵巢重(232.22±73.42)g、肥满度2.07%±0.42%、卵巢性腺指数27.59%±6.47%(17.39%~35.20%),卵巢腔内游离卵的数量和质量分别为(3.226±2.734)万粒和(114.83±73.42)g,每克游离卵的数量为(271.68±127.47)粒,n=9。

|
图 2 美洲鲥亲本外形(上♀、下♂) Fig. 2 Shape of A. sapidissima broodstock(above ♀, below♂) |
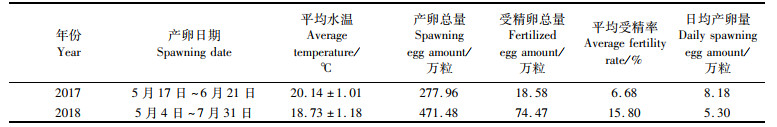
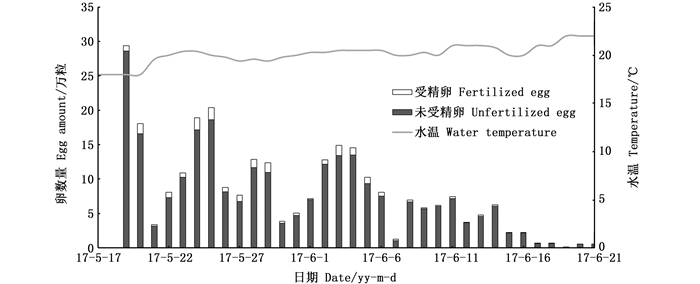
2017年人工繁殖期间,每7~10 d对产卵池亲本进行清理,剔除无用亲本,补充挑选亲本。产卵持续时间为35 d(5月17日—6月21日),产卵总量为277.96万粒,受精卵总量为18.58万粒,平均受精率为6.68%(表 2);日均产卵量为8.18万粒,日产卵量最高是29.4万粒,时间是5月19日(图 3);受精率最高是17.69%,时间是6月7日(图 4)。
|
表 2 2017年和2018年美洲鲥产卵受精情况 Tab.2 Situation of A. sapidissima spawning and fertilization in 2017 and 2018 |
|
图 3 美洲鲥2017年产卵受精情况 Fig. 3 Situation of A. sapidissima spawning and fertilization in 2017 |
|
图 4 美洲鲥2017年的受精率 Fig. 4 Fertility rate of A. sapidissima in 2017 |
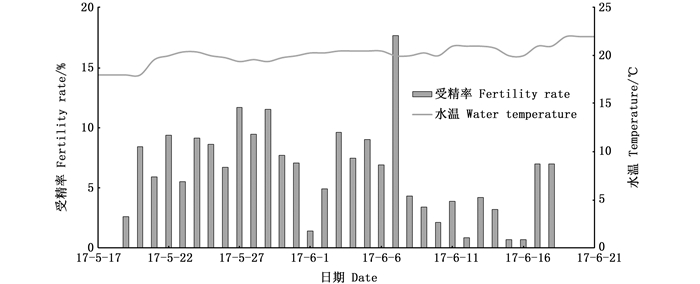
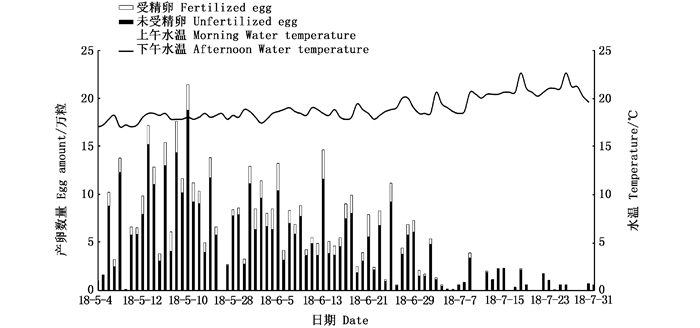
2018年人工繁殖开始,挑选75组亲本放入产卵池,期间不再清理亲本。产卵持续时间为89 d(5月4日—7月31日),产卵总量为471.48万粒,每尾雌鱼平均产卵总量为6.23万粒,受精卵总量为74.47万粒,平均受精率为15.80%(表 2);日均产卵量为5.30万粒,日产卵量最多是21.4万粒,时间是5月20日(图 5);日受精卵量最多的是3.24万粒,时间是5月18日(图 5);受精率最高是33.28%,时间是5月17日(图 6)。
|
图 5 美洲鲥2018年产卵受精情况 Fig. 5 Situation of A. sapidissima spawning and fertilization in 2018 |
|
图 6 美洲鲥2018年日产卵量、日受精卵量及受精率与产卵持续天数的关系 Fig. 6 Relationships between spawning duration and the daily egg number, the daily fertilized egg amount, and the fertility rate of A. sapidissima in 2018 |
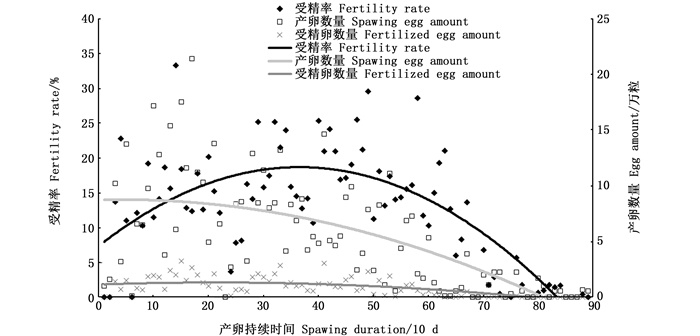
对2018年的日产卵量、日受精卵量及受精率分别与产卵持续时间作回归分析(图 6):均呈现有顶点、开口向下的二次函数抛物线,方程式分别为y=-0.001 479x2 + 0.011632 x+ 8.744 312(n = 89,R2=0.422 654,P < 0.01),y=-0.000 45x2+0.017 289x+1.145 264(n=89,R2=0.405 294,P < 0.01)和y =-0.008 486x2+0.619 741x + 7.370 594(n=80,R2=0.492 676,P < 0.01);依据二次函数方程预测到理论最高的日产卵量、受精卵量和受精率预期分别产生于产卵第4天(5月7日)、第21天(5月24日)和第37天(6月9日)。
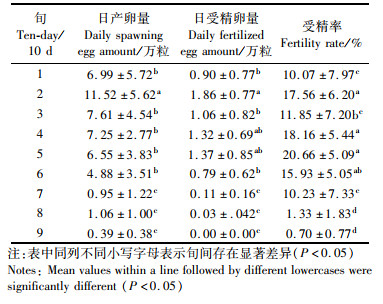
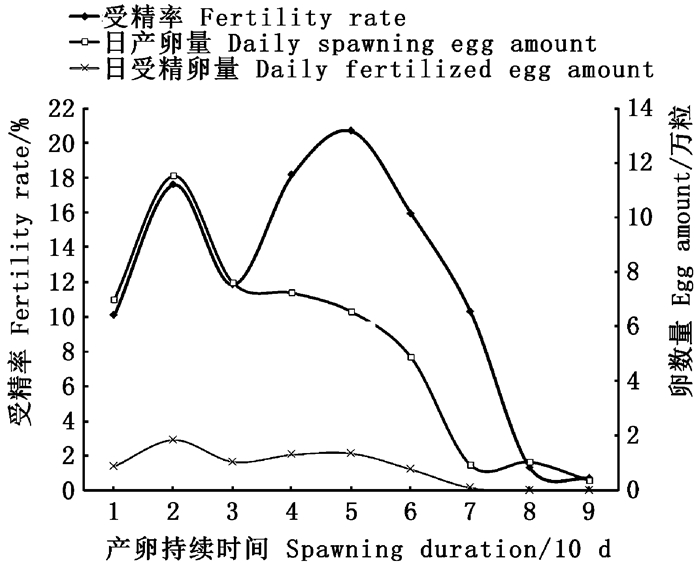
依据二次函数预测产生最高的日产卵量、受精卵量和受精率的理论日期(5月7日、5月24日和6月9日)与实际时间(5月20日、5月18日和5月17日)的差异比较大(特别是受精率最高的时间),为了进一步弄清美洲鲥产卵结果趋势,对2018年日产卵量、日受精卵量及受精率分别进行的旬(10天)均值比较(表 3,图 7):日均产卵量随产卵持续时间(旬)呈现单峰的抛物线(图 7),峰值位于第2旬,即日均产卵量最高(11.52万粒,P < 0.05),第1、3、4、5和6旬日均产卵量(4.88~7.61万粒)明显高(P < 0.05)于第7、8和9旬(0.39~1.06万粒),在第1、3、4、5和6旬的日均产卵量相对比较稳定,无显著性差异(P>0.05,表 3)。由此说明美洲鲥产卵可分为产卵稳定期(第1、3、4、5和6旬)、产卵高峰期(第2旬)和产卵停滞期(第7~9旬)3个时期。
|
表 3 美洲鲥2018年日产卵量、日受精卵量及受精率的旬均值 Tab.3 Ten-day averages of the daily spawning egg amount, the daily fertilized egg amount, and the fertility rate of A. sapidissima in 2018 |
|
图 7 美洲鲥2018年日产卵量、日受精卵量及受精率的旬均值趋势 Fig. 7 Trends of ten-day averages of the daily spawning egg amount, the daily fertilized egg amount, and the fertility rate of A. sapidissima in 2018 |
日均受精卵量随产卵持续时间(旬)呈现微弱的双峰波动,双峰分别位于第2旬和第4~5旬(图 7),第2旬的日受精卵量(1.86万粒)显著高于(P < 0.05)1、3、6、7、8、9旬,而第7、8、9旬的日均受精卵量(0.00~0.11万粒)显著低于(P < 0.05)前面第1~7旬(0.79~1.86万粒)。见表 3。
受精率旬均值随产卵持续时间(旬)呈现显著的双峰波动,双峰分别位于第2和第5旬(图 7),在第5旬的受精率均值最高(20.66%),且显著高于(P < 0.05)第1、3、7、8和9旬(分别为10.07%、11.85%、10.23%、1.33%和0.70%),第8和9旬的受精率均值最低(分别为1.33%和0.70%),且显著低于(P < 0.05)前面第1~7旬的受精率均值(10.07%~20.66%)。见表 3。
3 讨论 3.1 亲本强化适应培育美洲鲥性情急躁,本研究中池塘培育美洲鲥亲本长期在池塘大环境下生长,对水泥池小环境会产生一定应激反应,因此,亲本需要经过一个水泥池适应性的强化培育过程才能进行促产交配。本研究中,2017年的强化适应培育成活率(88.7%~92.9%)明显高于2018年(69.4%~78.1%),可能原因是在2017年池塘培育及池塘大棚越冬培育期间,每月对美洲鲥拉网进行生长及发育监测,这每月的拉网操作相当于对美洲鲥人为操作应激的一个锻炼,使美洲鲥性情趋于温和、适应人为拉网操作,这可能是2017年池塘拉网运输进入水泥池后的美洲鲥强化培育成活率高的主要因素。然而,频繁的监测拉网操作会干扰亲本性腺发育,进而可能影响亲本交配产卵的受精率,这可能是造成本研究中美洲鲥受精率2017年较低(6.68%)、2018年较高(15.80%)的主要因素之一。这也是在2018年美洲鲥亲本培育期间不再做性腺发育监测的主要原因。
3.2 池养美洲鲥性成熟和卵巢性腺指数池塘培育美洲鲥雌雄鱼2龄达到初次性成熟,繁殖期为5—7月份,本研究中,养殖美洲鲥最小性成熟年龄为2龄,这与徐钢春等[2]的研究结果相一致。然而,早在1967年,WALHURG和NICHOLS对分布在美国的7条河流中的美洲鲥成熟雌鱼生物学进行了调查研究,发现最小性成熟(即初次性成熟)年龄为3龄[13]。造成人工养殖美洲鲥性成熟年龄提早的原因可能是人工养殖环境下,饵料充足,饲料营养价值高,美洲鲥营养积累较好,导致了性早熟。另外,本研究池塘培育美洲鲥亲本在促产交配期间依然保持低水平的摄食,摄食量为鱼体质量的0.3%~0.5%,这与美洲鲥雌鱼卵巢分批成熟、分批产卵的习性有关,在实际的人工繁殖过程中,促产交配期间投喂高营养价值的饲料是非常有必要的[16]。这种现象也出现在中国鲥鱼(Tenualosa reevesii)[17]:天然鲥鱼溯入江河后,绝大部分停止摄食, 性腺发育所需营养依赖于冬季储存的脂肪,养殖中国鲥在性腺发育过程中一直保持摄食状态[17]。
卵巢性腺指数是卵巢成熟度的系数,反映了鱼类亲本卵巢的发育程度[8]。本研究池塘培育美洲鲥Ⅴ期雌鱼亲本卵巢性腺指数为27.59%±6.47%(17.39%~35.20%),明显高于工厂化培育的亲本(4.58%[8]、18.47%[7]),也略好于自然野生亲本(均值为20.5%,范围为5.8%~35.4%)[6]。由此可见,美洲鲥亲本春夏秋遮阴池塘培育、冬季土池大棚越冬、遮阴水泥池强化培育及升降盐处理的仿洄游培育方式在其性腺发育的激发和调控方面[8]优于工厂化培育模式,更接近自然生境。
3.3 产卵量的趋势及规律美洲鲥属于分批成熟、分批产卵的产卵类型,美洲鲥产卵可分为产卵稳定期(第1、3、4、5和6旬)、产卵高峰期(第2旬)和产卵停滞期(第7~9旬)3个时期,日产卵量总体呈现先上升后下降趋势:2018年全人工繁殖试验中,在没有补充新的亲本的情况下,日产卵量理论和实际的最高值分别产生于5月20日和5月7日,即产卵第17天和第4天,产卵高峰时间出现比较早,日产卵量正态分布的峰值出现时间较早(图 7),这可能是本研究美洲鲥亲本促产时间有些晚,亲本产卵可能有滞后。美洲鲥亲本产卵高峰过后,日产卵量下降过程中,在产卵第30~60天有1个稳定期,日产卵量比较稳定,呈现出持续稳定产卵(图 7),这与美洲鲥雌鱼亲本卵巢卵细胞分批成熟、分批产卵的习性有关[6]。
另外,虽然美洲鲥亲本产卵量总体呈现大的单峰抛物线趋势,但其间还存在小的多峰波动:在促产交配试验中,每隔3 d换水1次,换水后第2天凌晨产卵很少甚至不产卵,第3天凌晨产卵量最高,即换水间隔的中间日凌晨产卵较高,并连续波动,可能是换水操作对美洲鲥亲本有应激作用,惊扰亲本正常的交配产卵活动,应激作用消除后,新水的换入对亲本又有一个刺激产卵的作用[18]。
3.4 受精率和受精卵数量的趋势及规律美洲鲥人工促产自然交配的受精率总体相对较低,本研究中2017和2018年平均受精率分别为6.68%和15.80%(极端最高值为33.28%),这与其他研究对美洲鲥亲本人工促产、自然交配的研究结果相一致:如徐钢春等[2](平均为10%)和曹祥德等[14](6.3%~20.5%);但明显低于同样是分批产卵的其他鱼类自然交配的受精率,如斜带石斑鱼(Epinephelus coioides,64.93%)[19]、半滑舌鳎(Cynoglossus semilaevis,57.9%~68.6%)[20]和四指马鲅(Eleutheronema tetradactylum,72%~95%)[21]等。可能原因是美洲鲥从美洲引进和驯养后,人工养殖及亲本培育还不一定符合其生理生态需求,特别是饲料,目前还没有开发专用饲料,大多采用海水鱼膨化饲料来代替,海水鱼膨化饲料不一定符合作为洄游性鱼类的美洲鲥生殖生理需求,有关美洲鲥亲本营养积累的问题在以往的研究[1-2]也有提及。因此,有关美洲鲥营养需求和商品饲料开发是美洲鲥人工繁殖及养殖的技术关键。
当然,造成美洲鲥受精率2017年较低(6.68%)、2018年较高(15.80%)的主要因素,除了前面所述亲本性腺发育受到频繁拉网操作的影响之外,另外一个重要的因素是美洲鲥亲本促产的水温,美洲鲥交配产卵的适宜水温可能在20 ℃以下,2017年美洲鲥亲本促产平均水温相对过高(20.14 ℃),而2018年是18.73 ℃,可能更加符合美洲鲥交配产卵的要求;另外,在2017和2018年前中期促产水温控制在16~20 ℃,受精率较高,而产卵后期,水温长时间超过20 ℃后,受精率均大幅下降,这点再次证实了美洲鲥交配产卵适宜水温在20 ℃以下。这也与徐钢春等[2]所述的“在14~19 ℃控制产卵效果更好”和曹祥德等[14]所述的“最佳产卵温度为16~19 ℃”相一致。
虽然美洲鲥的受精率总体较低,但其受精率均值随产卵持续时间呈现显著的双峰波动,2018年的双峰分别位于第2和第5旬(图 7):受精率极端最高值(33.28%)在5月17日,即产卵第14天,即处于第1个波峰;而受精率旬均值最高(20.66%)产生于第5旬,处于第2波峰。通常来说,分批产卵类型鱼类随着产卵时间的持续鱼卵质量会逐渐下降,造成美洲鲥卵受精率趋势呈现双峰波动的原因,可能主要与美洲鲥亲本应激性强有关[13, 22],美洲鲥刚进入产卵池,对产卵池的环境有一定的应激,雌雄鱼交配受到一定的影响,随着时间的推移,美洲鲥亲本逐渐适应了产卵池的环境,这有利于雌雄鱼追逐交配。卵受精率趋势呈双峰波动的现象也出现在条石鲷(Oplegnathus fasciatus)[23]。
美洲鲥日均受精卵量随产卵持续时间呈现微弱的双峰波动,双峰分别位于第2旬和第4~5旬(图 7),第2旬的日均受精卵量(1.86万粒)最多(P < 0.05),日受精卵量理论和实际的最高值分别产生于5月24日和5月18日,即产卵第21天和第15天,均处于第1波峰附近(图 7)。第1波峰主要受日产卵量较多影响,而第2波峰主要受日产卵量较稳定、受精率较高共同影响。另外产卵第60天后,即第7、8、9旬的日均受精卵量在0.00~0.11万粒,受精卵量非常少,基本上无生产性培育的价值。因此,为了避免不必要的浪费,建议在美洲鲥产卵持续60 d后及时结束促产调控。
| [1] |
张根玉, 朱雅珠, 张海明, 等. 美国鲥鱼人工繁殖技术研究[J]. 水产科技情报, 2008, 35(5): 221-223. ZHANG G Y, ZHU Y Z, ZHANG H M, et al. Artificial breeding techniques for American Shad Alosa sapidissima[J]. Fisheries Science & Technology Information, 2008, 35(5): 221-223. |
| [2] |
徐钢春, 张呈祥, 郑金良, 等. 美洲鲥的人工繁殖及胚胎发育的研究[J]. 海洋科学, 2012, 36(7): 89-96. XU G C, ZHANG C X, ZHENG J L, et al. Artificial propagation and embryonic development of American shad, Alosa sapidissima[J]. Marine Sciences, 2012, 36(7): 89-96. |
| [3] |
施永海, 徐嘉波, 陆根海, 等. 养殖美洲鲥的生长特性[J]. 动物学杂志, 2017, 52(4): 638-645. SHI Y H, XU J B, LU G H, et al. Growth characteristics of cultured American Shad Alosa sapidissima[J]. Chinese Journal of Zoology, 2017, 52(4): 638-645. |
| [4] |
施永海, 徐嘉波, 刘永士, 等. 敞口池塘和遮荫池塘养殖美洲鲥当年鱼种的生长规律和差异[J]. 上海海洋大学学报, 2019, 28(2): 161-170. SHI Y H, XU J B, LIU Y S, et al. Growth regularity and difference of young fish American Shad Alosa sapidissima cultured in outdoor and shaded ponds[J]. Journal of Shanghai Ocean University, 2019, 28(2): 161-170. |
| [5] |
徐嘉波, 税春, 施永海, 等. 池养美洲鲥1+龄鱼种生长特性的研究[J]. 上海海洋大学学报, 2018, 27(1): 55-63. XU J B, SHUI C, SHI Y H, et al. Study of growth characteristics of pond-reared one-year-old Alosa sapidissima[J]. Journal of Shanghai Ocean University, 2018, 27(1): 55-63. |
| [6] |
OLNEY J E, DENNY S C, HOENIG J M. Criteria for determining maturity stage in female American shad, Alosa sapidissima, and a proposed reproductive cycle[J]. Bulletin Francais de la Pêche et de la Pisciculture, 2001, 362-363: 881-901. |
| [7] |
洪磊, 李兆新, 陈超, 等. 美洲鲥鱼卵巢发育规律和性类固醇激素变化研究[J]. 中国工程科学, 2014, 16(9): 86-92. HONG L, LI Z X, CHEN C, et al. The study of ovary development and steroid hormone changes in Alosa sapidissima[J]. Engineering Science, 2014, 16(9): 86-92. |
| [8] |
洪孝友, 朱新平, 陈昆慈, 等. 池养美洲鲥卵巢周年发育和血清激素变化研究[J]. 基因组学与应用生物学, 2016, 35(10): 2696-2701. HONG X Y, ZHU X P, CHEN K C, et al. The study of ovary development and hormone changes in American shad Alosa sapidissima[J]. Genomics and Applied Biology, 2016, 35(10): 2696-2701. |
| [9] |
吴栩灵, 洪孝友, 李凯彬, 等. 美洲鲥雄性生殖细胞冷冻保存及移植[J]. 水生生物学报, 2018, 42(3): 599-605. WU X L, HONG X Y, LI K B, et al. Studies on cryopreservation and transplantation of the male germ cell in American shad (Alosa sapidissima)[J]. Acta Hydrobiologica Sinica, 2018, 42(3): 599-605. |
| [10] |
王明华, 陈友明, 丁淑燕, 等. 美洲鲥鱼精子超低温冷冻保存技术初探[J]. 江苏农业科学, 2015, 43(7): 250-251. WANG M H, CHEN Y M, DING S Y, et al. Preliminary study on cryopreservation of sperm from American shad (Alosa sapidissima)[J]. Jiangsu Agricultural Sciences, 2015, 43(7): 250-251. |
| [11] |
洪孝友, 朱新平, 陈昆慈, 等. 美洲鲥胚胎及仔稚鱼的发育[J]. 水生生物学报, 2011, 35(1): 153-162. HONG X Y, ZHU X P, CHEN K C, et al. Study on the development of the embryo and larva of American shad, Alosa sapidissima[J]. Acta Hydrobiologica Sinica, 2011, 35(1): 153-162. |
| [12] |
高小强, 刘志峰, 黄滨, 等. 美洲鲥(Alosa sapidissima)胚胎发育形态学及组织切片观察[J]. 渔业科学进展, 2017, 38(5): 9-18. GAO X Q, LIU Z F, HUANG B, et al. Morphological and histological observation of the embryo of American shad (Alosa sapidissima)[J]. Progress in Fishery Sciences, 2017, 38(5): 9-18. |
| [13] |
杜浩.美洲鲥(Alosa sapidissima)人工孵化、养殖及转运关键技术的研究[D].武汉: 华中农业大学, 2005: 15-22. DU H. Studies on key techniques in incubation, culture and transportation of American shad Alosa sapidissima[D]. Wuhan: Huazhong Agricultural University, 2005: 15-22. http://cdmd.cnki.com.cn/article/cdmd-10504-2005153508.htm |
| [14] |
曹祥德, 乔燕平, 李雪松. 美国鲥鱼亲鱼培育及促熟产卵技术研究[J]. 科学养鱼, 2016(4): 6-7. CAO X D, QIAO Y P, LI X S. Breeding and spawning techniques of American shad Alosa sapidissima broodstock[J]. Scientific Fish Farming, 2016(4): 6-7. |
| [15] |
施永海, 徐嘉波, 谢永德, 等. 池塘培育美洲鲥初次性成熟亲本的生长特性[J]. 广东海洋大学学报, 2019, 39(2): 45-52. SHI Y H, XU J B, XIE Y D, et al. Growth characteristics of the first sexual maturation broodstock of Alosa sapidissima cultured in greenhouse structured pond[J]. Journal of Guangdong Ocean University, 2019, 39(2): 45-52. |
| [16] |
彭士明, 李云莉, 施兆鸿, 等. 海水鱼类亲体必需脂肪酸营养的研究进展[J]. 海洋渔业, 2016, 38(1): 98-106. PENG S M, LI Y L, SHI Z H, et al. Research progress of essential fatty acids nutrition in marine fish broodstock[J]. Marine Fisheries, 2016, 38(1): 98-106. |
| [17] |
王汉平, 钟鸣远, 陈大庆, 等. 鲥鱼的驯养与生物学研究Ⅱ.池养鲥鱼的生长特性及其与温度的关系[J]. 应用生态学报, 1995, 6(3): 291-297. WANG H P, ZHONG M Y, CHEN D Q, et al. Domestication of Tenualosa reevesii and its biology Ⅱ. Growth characteristics of pondreared reeves shad and its relation to temperature[J]. Chinese Journal of Applied Ecology, 1995, 6(3): 291-297. |
| [18] |
徐钢春, 聂志娟, 杜富宽, 等. 长江刀鲚亲鱼强化培育及自然产卵规律研究[J]. 水生生物学报, 2016, 40(6): 1194-1200. XU G C, NIE Z J, DU F K, et al. Intensive culture and natural spawning of broodstock Coilia nasus under artificial feeding conditions[J]. Acta Hydrobiologica Sinica, 2016, 40(6): 1194-1200. |
| [19] |
刘付永忠, 王云新, 黄国光, 等. 斜带石斑鱼亲鱼强化培育及自然产卵研究[J]. 中山大学学报(自然科学版), 2000, 39(6): 81-85. LIU F Y Z, WANG Y X, HUANG G G, et al. Enrichment culture and natural spawning of broodstock Epinephelus coioides[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2000, 39(6): 81-85. |
| [20] |
柳学周, 孙中之, 马爱军, 等. 半滑舌鳎亲鱼培育及采卵技术研究[J]. 海洋水产研究, 2006, 27(2): 25-32. LIU X Z, SUN Z Z, MA A J, et al. Study on the technology of spawner culture and eggs collection of Cynoglossus semilaevis Günther[J]. Marine Fisheries Research, 2006, 27(2): 25-32. |
| [21] |
区又君, 谢木娇, 李加儿, 等. 广东池塘培育四指马鲅亲鱼初次性成熟和苗种规模化繁育技术研究[J]. 南方水产科学, 2017, 13(4): 97-104. OU Y J, XIE M J, LI J E, et al. First maturation and mass seedling propagation of cultured Eleutheronema tetradactylum in Guangdong Province[J]. South China Fisheries Science, 2017, 13(4): 97-104. |
| [22] |
刘青华, 郑玉红, 孟涵, 等. 美洲鲥鱼的养殖风险和对策[J]. 科学养鱼, 2017(11): 1-3. LIU Q H, ZHENG Y H, MENG H, et al. Breeding risks and countermeasures for American shad Alosa sapidissima[J]. Scientific Fish Farming, 2017(11): 1-3. |
| [23] |
区又君, 李加儿, 林锋. 南海区驯养条石鲷亲鱼的初次性成熟和产卵[J]. 南方水产科学, 2014, 10(5): 82-86. OU Y J, LI J E, LIN F. First maturation and spawning of cultured Oplegnathus fasciatus broodstock in the South China Sea[J]. South China Fisheries Science, 2014, 10(5): 82-86. |
 2020,
Vol. 29
2020,
Vol. 29

