2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
紫菜(Pyropia)[1]是一种营养丰富、味道鲜美的高经济价值海藻,其藻体富含人体所需的蛋白质、脂肪、糖、无机盐和多种维生素等营养物质[2]。我国主要的紫菜栽培物种包括条斑紫菜(Pyropia yezoensis)和坛紫菜(Pyropia haitanensis),其年产量分别约占全国总年产量的25%和75%[3]。目前,紫菜栽培中存在育苗周期长、采苗时间受季节限制、培养环境不稳定等问题,导致了紫菜养殖业的发展受到限制[4]。与传统育苗法相比,酶法育苗具有稳定性高、周期短、大量节约人力物力等优点[5]。早在20世纪80年代初,国内的学者就利用酶法分离技术获得了条斑紫菜的离体细胞,并成功培育成苗[6-7]。之后,戴继勋等[8]和王素娟等[9]利用酶法育苗进行了条斑紫菜海区试验,并取得了一定的成效。
但是在离体单细胞的后续培养过程中,仍存在许多问题有待解决。环境因素是影响紫菜育苗效率的关键因素,优化体细胞生长发育的适宜条件是提高育苗成功率的关键。国内的一些学者对此做了相关研究。严兴洪等[10]研究表明坛紫菜叶状体体细胞发育的的最适温度为25 ℃,最适光强为40~60 μmol photons/(m2·s),最适盐度为33.3。徐建荣等[11]通过研究不同植物激素对坛紫菜离体单细胞生长发育的影响,发现低浓度的IBA有利于正常叶状体的形成。腾亚娟等[12]研究发现条斑紫菜离体单细胞的最适生长温度为20 ℃,营养盐浓度为50 mg/L。
圆紫菜(Pyropia suborbiculata)属暖温带海藻,主要分布在青岛以南的黄海、东海和南海海域[13]。MONOTILLA等[14]对采自不同地区的圆紫菜进行研究时发现,中国南方产的圆紫菜其温度耐受范围为15~30 ℃。赵爽等[15]对坛紫菜和圆紫菜的叶状体耐高温性进行了研究,证实圆紫菜具有更好的高温耐受性,这表明圆紫菜具有在南方高水温海域进行栽培的潜力。目前,关于外界条件对圆紫菜叶状体体细胞生长发育的影响并没有系统的报道。本文以日龄60 d的圆紫菜野生型品系(PS-WT)和突变型品系(PS-L)的叶状体为实验材料,分别酶解,获得它们的离体单细胞,观察后者在液体培养基中的发育形态,并探究温度和光照对离体单细胞发育分化的影响。
1 材料与方法 1.1 实验材料实验所用材料是圆紫菜野生型品系(PS-WT)和突变型品系(PS-L)。PS-WT品系是由采自广东省阳江市海区的叶状体释放的果孢子萌发后长成;PS-L品系是PS-WT的叶状体经紫外线诱变分离而来[15]。2个品系均以自由丝状体的形式被保存于实验室内,保存方法同严兴洪等[16]。壳孢子采苗与叶状体的培养方法同文献[17]。实验所使用的培养液为添加MES培养基的灭菌海水[18]。
1.2 叶状体体细胞的分离和再生培养圆紫菜野生型(PS-WT)和突变型(PS-L)的壳孢子经培养长成一定大小的叶状体后,选择健康的叶状体作为分离单个细胞的种藻。分离细胞所用的工具酶是海螺酶[6],细胞分离方法:用新鲜海水和毛笔清洗种藻3遍,然后用1 mol/L葡萄糖溶液洗去藻体表面盐分;用刀片将种藻切碎后,投入预先配好的酶液中酶解。酶液由2 mol/L葡萄糖溶液加入0.5 %~1.0 %酶配成。酶解温度为28 ℃,酶解时间为0.5~1 h。细胞和酶的混合液经200目的筛绢网过滤,过滤液经离心(1 200×g, 5 min)除去上清酶液,保留细胞沉淀,并加入比重为1.040的海水,再次离心(1 200×g, 5 min)洗涤细胞。用相同的办法连续离心和洗涤细胞3次后弃上清液,收集细胞沉淀并加入MES培养液(比重=1.030)调成细胞悬浮液。取一定数目的细胞培养在直径为9 cm的培养皿中,加入25 mL左右的培养液在弱光[2 μmol photons/(m2·s)]下进行培养。3天后,补加比重较低的MES培养(比重=1.026)。离体单细胞的培养条件:温度18 ℃,光强20 μmol photons/(m2·s),光周期为10 L: 14 D,培养液每周更换1次。
1.3 光强对圆紫菜离体单细胞发育分化的影响选取日龄60 d的PS-WT和PS-L品系的叶状体,利用酶解方法分别获得它们的离体单细胞。将含有一定数目单细胞的培养液分别倒入15个培养皿中(∅=9 cm),3个为1组,每组分别放置在光强为10、20、40、60和80 μmol photons/(m2·s)的条件下进行培养,其他培养条件:温度18 ℃,光照周期10 L: 14 D。
1.4 温度对圆紫菜离体单细胞发育分化的影响选取日龄60 d的PS-WT和PS-L品系的叶状体,利用酶解方法分别获得它们的离体单细胞。将含有一定数目单细胞的培养液分别倒入15个培养皿中(∅=9 cm),3个为1组,每组分别放置在温度为18、21、24、27和30 ℃下进行培养,其他培养条件:光强20 μmol photons/(m2·s),光照周期10 L: 14 D。
1.5 数据处理和分析运用Excel 2010软件进行常规数据统计,SPSS 18.0软件进行单因素方差分析。统计值用平均值±标准差表示,P < 0.05表示差异显著。
2 结果 2.1 圆紫菜叶状体离体单细胞的发育分化类型根据离体单细胞再生植株的叶片形态、有无假根、细胞颜色、细胞大小和排列方式以及最终发育趋势等,圆紫菜叶状体离体单细胞的发育分化类型大致可分为6类。
第1类发育成正常叶状体(图版-1,9)。在离体条件下,细胞经第1次分裂形成2个极性细胞,其中一个色素体较小而液泡略大,成为原始假根细胞,其一端逐渐伸长形成假根;另一个细胞经数次分裂发育成由多列细胞组成的叶片。叶片多呈披针状,边缘光滑,细胞排列紧密,假根呈透明小柄状,较粗大,附着牢固。其发生和发育方式与壳孢子极为相似。
第2类发育成具有类假根的畸形叶状体(图版-2,10)。在离体培养条件下,其发生和发育方式与壳孢子极为相似。再生叶状体的叶片形态与壳孢子发育成的叶状体很相似,但其假根细长,长度是正常假根的数倍,多为单根,附着不牢固。另外,少量个体易放散单孢子(图版-4)
第3类发育成不具假根的畸形叶状体(图版-3,11)。在离体培养条件下,细胞发育成畸形叶状体,叶片呈多种形态,多数为不规则状,细胞排列紧密,无规则,易放散单孢子(图版-12)。
第4类发育成细胞团(图版-5,13)。细胞团的体积比平常细胞的体积略大,细胞中液泡较大,色素体也呈星状,但细胞排列不规则。培养3~4周后,细胞团解体。
第5类发育成精子囊(图版-6)。它们由营养细胞分化而来。培养至3~7 d,形成精子囊,释放精子。
第6类发育成果孢子囊(图版-7)。细胞发育成圆形细胞团,细胞体积较小,可观察到明显的细胞分隔界限,颜色暗红,排列不规则。培养一段时间后,细胞放散,萌发形成丝状体(图版-8, 14)。
2.2 光强对圆紫菜野生型品系(PS-WT)体细胞发育分化的影响在相同的培养时间内,低光照下的离体单细胞再生体个体偏小,随着光强的增加,其个体增大(表 1)。再生体中正常苗的百分率20和40 μmol photons/(m2·s)组最高,分别达到54.43 %和53.33 %,10和60 μmol photons/(m2·s)组次之,80 μmol photons/(m2·s)组最低,但各组间没有显著性差异。在10、20、40、60和80 μmol photons/(m2·s)组中,再生体中畸形苗、细胞团和丝状体的百分率也均无显著性差异。光强高于40 μmol photons/(m2·s)时,再生体中可放散单孢子的个体(放散单孢子个体)百分率显著增高。
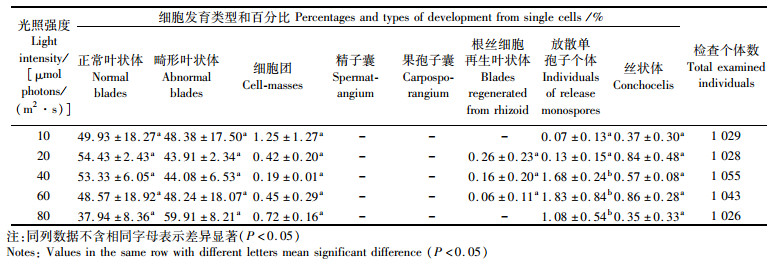
|
表 1 光强对圆紫菜野生型品系(PS-WT)体细胞发育分化的影响 Tab.1 The effect of light intensity on the development and differentiation of the single cells isolated from the blade of wild-type strain (PS-WT) in Pyropia suborbiculata |
在不同光强条件下,PS-L品系叶状体的离体单细胞再生体的生长与PS-WT品系相似,即个体的生长速度随光强的增强而加快(表 2)。再生体中不同类型的百分率变动规律基本与PS-WT品系相似,在10、20、40、60和80 μmol photons/(m2·s)组中,再生体中正常苗、细胞团和丝状体的百分率均无显著性差异。40 μmol photons/(m2·s)光强下,放散单孢子个体数的百分率最高,其次是60 μmol photons/(m2·s)。
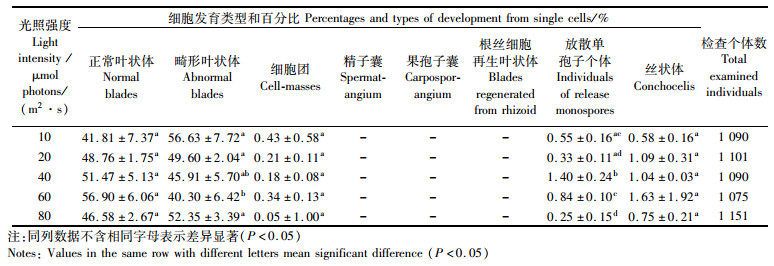
|
表 2 光强对圆紫菜突变型品系(PS-L)体细胞发育分化的影响 Tab.2 The effect of light intensity on the development and differentiation of the single cells isolated from the blade of mutant strain (PS-L) in Pyropia suborbiculata |
在18、21和24 ℃温度组中,PS-WT品系的正常苗百分率无显著性差异,且均高于33 %,但当温度高于27 ℃时,正常苗的百分率显著下降,至30 ℃时,仅有0.05 %(表 3)。温度为27 ℃能促进精子囊和根丝细胞再生体的形成,30 ℃会抑制精子囊、根丝细胞再生体和丝状体的形成。另外,27和30 ℃组中放散单孢子个体数的百分率明显增高。
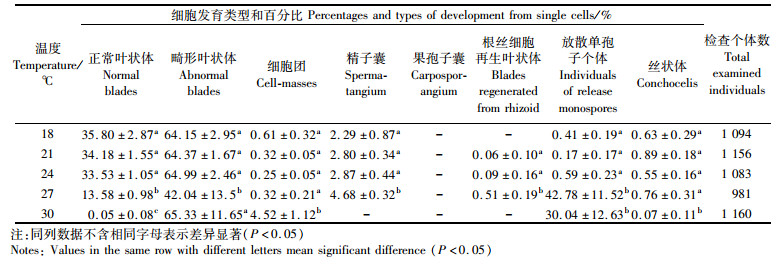
|
表 3 温度对圆紫菜野生型品系(PS-WT)叶状体体细胞发育分化的影响 Tab.3 The effect of temperature on the development and differentiation of the single cells isolated from the blade of wild-type strain (PS-WT) in Pyropia suborbiculata |
温度对PS-L品系体细胞发育分化的影响与PS-WT品系的总体趋势大体相同,所存差异为:在30 ℃下,再生体中畸形苗的百分率达到95.39 %,远高于其他温度组;30 ℃组中放散个体的百分率较低,仅有4.61 %。另外,在18~30 ℃范围内,PS-L品系体细胞再生体中均无精子囊出现(表 1)。

|
表 4 温度对圆紫菜突变型品系(PS-L)叶状体体细胞发育分化的影响 Tab.4 The effect of temperature on the development and differentiation of the single cells isolated from the blade of mutant strain (PS-L) in Pyropia suborbiculata |
根据圆紫菜离体单细胞再生体中各发育类型形成的时间顺序及其百分比的相关变动情况,可认为再生体中不同类型的形成是因其在藻体中所处的分化阶段不同所致。圆紫菜叶状体细胞的发育分化可分为以下几个阶段。圆紫菜的壳孢子处于未分化阶段,类似于动物的原胚细胞,具有发育成完整叶状体的能力。这时的细胞处于第一个分化阶段,它们经过数次分裂形成正常叶状体。随着叶状体继续生长发育,大部分细胞进入第二分化阶段,它们在离体培养条件下形成具有类假根的畸形苗,表现为假根细长,附着力极差。当藻体细胞进入第三个分化阶段,细胞在离体条件下发育成不具假根的畸形苗,易放散单孢子。随着藻体细胞的继续分化进入第四分化阶段,它们在离体培养条件下形成细胞团,与叶状体相比,细胞团的细胞体积略大且细胞排列不规则;培养后期,易解体。当细胞进入第五分化阶段,细胞发生了质的变化,它们会分化成性母细胞。在离体培养条件下,如果是雄性性母细胞,先进行分裂形成细胞团,后细胞颜色变浅,形成精子囊,最后放掉;若是雌性性母细胞,已受精的细胞会发育成果孢子囊,后放散萌发成丝状体,未受精的细胞(果胞)不进行分裂,培养一段时间后,解体。
条斑紫菜和坛紫菜的叶状体离体单细胞的分化途径已有详细的报道[19-21]。在3种紫菜的离体单细胞再生体中均出现了正常苗、畸形苗和细胞团等类型。另外,也发现它们的离体单细胞的分化途径大致相似,均经历了由正常苗分化到细胞团,最后形成性细胞的过程。
3.2 光强和温度对圆紫菜叶状体体细胞发育分化的影响光强对圆紫菜叶状体体细胞不同类型的形成没有较大影响,但是弱光会抑制体细胞的分裂速度,这一结论与光强对条斑紫菜[22]和坛紫菜[10]体细胞发育的影响相似;但光强对圆紫菜体细胞再生体的单孢子放散具有一定的影响,低光强和高光强都会抑制单孢子的放散,这一结论与条斑紫菜[22]相符。李世英等[23]证明了高光强不利于条斑紫菜单孢子的放散,据此推测光强影响紫菜叶状体和体细胞再生体的单孢子放散机理是相似的。
温度对圆紫菜离体细胞发育分化有较为明显的影响。在18、21和24 ℃组中,再生体各类型比例均没有较明显的变化,但在27 ℃组中,再生体中放散单孢子的个体明显增多,说明适当的高温(27 ℃)可促进再生体放散单孢子。在高等植物中,植物组织短期内可对极端温度做出应激反应,延缓或避免高温对其组织细胞的伤害,在几小时内完成抗热性锻炼,这期间可能导致细胞畸形,但当高温时间延长,细胞结构和功能被伤害,组织细胞因过量蒸腾作用而脱水,导致代谢失调,光合作用和呼吸作用速率降低,随之生物膜透性丧失,质液外渗,细胞死亡[24]。在本文高温组(27~30 ℃)的再生体中,正常苗的比例极少,而畸形苗的比例较高,我们推测高温对藻类细胞的作用机理也与高等植物类似。另外,在30 ℃下,圆紫菜离体单细胞仍具有较高的存活率,这也说明圆紫菜体细胞具有较高的高温耐受性。
3.3 圆紫菜叶状体酶法育苗的应用前景丁原平[25]将条斑紫菜的离体单细胞附于网绳上进行海上养殖(酶法育苗),发现与壳孢子育苗相比,酶法育苗具有效率高、产量高以及质量好等优点。王素娟等[9]进行了坛紫菜体细胞苗的海区实验,并取得了一定的成效。但由于这两种紫菜的单细胞在网绳上附着率较低,使得酶法育苗在生产实践中仍未得到大面积的推广利用[26]。我们推测这很可能是因为坛紫菜和条斑紫菜的叶状体经酶解后,离体单细胞形成的正常苗比例较低所致。严兴洪等[19-20]报道了条斑紫菜种藻日龄10 d时,其再生体中正常苗的百分比最高,但也仅有7.6%,且正常苗的比率随种藻日龄的增加而急剧下降;坛紫菜种藻日龄20 d时,其再生体中正常苗的百分比可达70%,但也随种藻日龄的增加而急剧下降,至种藻日龄30 d时,再生体中正常苗的比率也低于10%。在本实验中,圆紫菜叶状体的离体单细胞发育成正常苗的比例,随藻龄的增加,其下降幅度较慢,在藻龄60 d时,再生体中正常苗的比率约为40%,这在一定程度上可解决条斑紫菜酶法育苗所遇到的问题。此外,紫菜藻体分离出的离体单细胞和原生质体具有与亲本相同的遗传特性[27],由此发育形成的叶状体性状稳定,这将为圆紫菜的遗传育种提供较好的材料。
| [1] |
SUTHERLAND J E, LINDSTROM S C, NELSON W A, et al. A new look at an ancient order:generic revision of the Bangiales (Rhodophyta)[J]. Journal of Phycology, 2011, 47(5): 1131-1151. |
| [2] |
张全斌, 赵婷婷, 綦慧敏, 等. 紫菜的营养价值研究概况[J]. 海洋科学, 2005, 29(2): 69-72. ZHANG Q B, ZHAO T T, QI H M, et al. Review of the nutritional properties of nori[J]. Marine Sciences, 2005, 29(2): 69-72. |
| [3] |
朱建一, 严兴洪, 丁兰平, 等. 中国紫菜原色图集[M]. 北京: 中国农业出版社, 2016: 22. ZHU J Y, YAN X H, DING L P, et al. Color atlas of Chinese laver[M]. Beijing: China Agriculture Press, 2016: 22. |
| [4] |
戴继勋. 用细胞工程技术发展我国的紫菜养殖业[J]. 生物工程进展, 2000, 20(6): 3-4, 8. DAI J X. Development of Porphyra cultivation with cell engineering[J]. Progress in Biotechnology, 2000, 20(6): 3-4, 8. |
| [5] |
方宗熙, 戴继勋, 唐延林, 等. 紫菜营养细胞的酶法分离和在水产养殖中的应用[J]. 海洋科学, 1986, 10(3): 46-47. FANG Z X, DAI J X, TANG Y L, et al. Isolation of the vegetative cells of Porphyra yezoensis Ueda with enzymes and its application in aquaculture[J]. Marine Science, 1986, 10(3): 46-47. |
| [6] |
唐延林. 紫菜营养细胞和原生质体的分离和培养[J]. 山东海洋学院学报, 1982, 12(4): 37-50. TANG Y L. Isolation and cultivation of the vegetative cells and protoplasts of Porphyra suborbiculata Kjellman[J]. Journal of Shandong College of Oceanology, 1982, 12(4): 37-50. |
| [7] |
严兴洪, 王素娟. 紫菜体细胞发育与分化的研究[J]. 海洋科学, 1989, 6(6): 28-32. YAN X H, WANG S J. Studies on the development and differentiation of somatic cell in Porphyra spp.(Rhodophyta)[J]. Marine Science, 1989, 6: 28-32. |
| [8] |
戴继勋, 包振民, 唐延林, 等. 紫菜叶状体细胞的酶法分离及其养殖研究[J]. 生物工程学报, 1988, 4(2): 133-137, 164. DAI J X, BAO Z M, TANG Y L, et al. Studies on isolation of the thallodic cells of Porphyra with enzymes and cultivation of these cells[J]. Chinese Journal of Biotechnology, 1988, 4(2): 133-137, 164. |
| [9] |
王素娟, 孙云龙, 路安明, 等. 坛紫菜营养细胞和原生质体培养研究Ⅱ.直接育苗下海养殖的实验研究[J]. 海洋科学, 1987(1): 1-7, 73-74. WANG S J, SUN Y L, LU A M, et al. A study on the cultivation of the vegetative cells and protoplasts of Porphyra haitanensis Ⅱ. The cultivation of the young buds isolated vegetative cells in sea[J]. Marine Science, 1987(1): 1-7, 73-74. |
| [10] |
严兴洪, 王素娟. 温度、光强和盐度对坛紫菜体细胞发育的影响[J]. 热带海洋, 1993, 12(1): 94-99. YAN X H, WANG S J. The effects of temperature, light intensity and salinity on the development of somatic cells from Porphyra haitanensis(Rhodophyta)[J]. Tropic Oceanology, 1993, 12(1): 94-99. |
| [11] |
徐建荣, 姚文煜, 陆勤勤, 等. 不同植物激素对条斑紫菜体细胞生长发育的影响[J]. 水产养殖, 2003, 24(3): 33-35. XU J R, YAO W Y, LU Q Q, et al. The influence of different phytohormones on growth and development of isolated cells of Porphyra yezoensis[J]. Journal of Aquaculture, 2003, 24(3): 33-35. |
| [12] |
滕亚娟, 王兴强, 王萍, 等. 温度和营养盐对条斑紫菜体细胞生长发育的影响[J]. 渔业经济研究, 2007(5): 37-40. TENG Y J, WANG X Q, WANG P, et al. Effects of temperature and nutrients on the growth of somatic cells in Porphyra yezoensis[J]. Fisheries Economy Research, 2007(5): 37-40. |
| [13] |
曾呈奎, 张德瑞, 张峻甫, 等. 中国经济海藻志[M]. 北京: 科学出版社, 1962: 103. ZENG C K, ZHANG D R, ZHANG J F, et al. Chinese economic seaweed[M]. Beijing: Science Press, 1962: 103. |
| [14] |
MONOTILLA W D, NOTOYA M. Morphological and physiological responses of Porphyra suborbiculata Kjellman (Bangiales, Rhodophyta) blades from five localities[J]. Botanica Marina, 2004, 47(4): 323-334. |
| [15] |
赵爽, 丁洪昌, 刘长军, 等. 圆紫菜人工色素突变体的诱导与分离[J]. 海洋学报, 2019, 41(2): 114-122. ZHAO S, DING H C, LIU C J, et al. Induction and isolation of pigmentation mutants in Pyropia suborbiculata Kjellman (Bangiales, Rhodophyta)[J]. Haiyang Xuebao, 2019, 41(2): 114-122. |
| [16] |
严兴洪, 李琳, 陈俊华, 等. 坛紫菜的单性生殖与遗传纯系分离[J]. 高技术通讯, 2007, 17(2): 205-210. YAN X H, LI L, CHEN J H, et al. Parthenogenesis and isolation of genetic pure strains in Porphyra haitanensis(Bangiales, Rhodophyta)[J]. High Technology Letters, 2007, 17(2): 205-210. |
| [17] |
YAN Y H, ARUGA Y. Genetic analysis of artificial pigmentation mutants in Porphyra yezoensis Ueda (Bangiales, Rhodophyta)[J]. Phycological Research, 2000, 48(3): 177-187. |
| [18] |
严兴洪, 梁志强, 宋武林, 等. 坛紫菜人工色素突变体的诱变与分离[J]. 水产学报, 2005, 29(2): 166-172. YAN X H, LIANG Z Q, SONG W L, et al. Induction and isolation of artificial pigmentation mutants in Porphyra haitanensis Chang et Zheng (Bangiales, Rhodophyta)[J]. Journal of Fisheries of China, 2005, 29(2): 166-172. |
| [19] |
严兴洪, 刘新轶, 张善霹. 条斑紫菜叶状体细胞的发育与分化[J]. 水产学报, 2004, 28(2): 145-154. YAN X H, LIU X Y, ZHANG S P. Development and differentiation of gametophytic blade cells in Porphyra yezoensis Ueda[J]. Journal of Fisheries of China, 2004, 28(2): 145-154. |
| [20] |
严兴洪, 刘旭升. 坛紫菜雌雄叶状体的细胞分化比较[J]. 水产学报, 2007, 31(2): 184-192. YAN X H, LIU X S. Comparison on cell differentiation of male and female blades in Porphyra haitanensis(Bangiales, Rhodophyta)[J]. Journal of Fisheries of China, 2007, 31(2): 184-192. |
| [21] |
杨锐, 徐红霞, 徐丽宁. 坛紫菜体细胞的几种发育途径[J]. 海洋湖沼通报, 2006(3): 60-66. YANG R, XU H X, XU L N. The development patterns of single somatic cell from Porphyra haitanensis thallus[J]. Transactions of Oceanology and Limnology, 2006(3): 60-66. |
| [22] |
何培民, 王素娟. 外界因素对条斑紫菜体细胞分化发育的影响-Ⅰ.温度、光强实验[J]. 海洋科学, 1991, 4: 61-65. HE P M, WANG S J. Effects of external factors on differentiation and development of somatic cells in Porphyra yezoensis Ⅰ. Temperature and illumination[J]. Marine Science, 1991, 4(4): 61-65. |
| [23] |
李世英, 王继成. 光线强度对条斑紫菜单孢子形成、放散和附着的影响[J]. 海洋科学, 1984(2): 41-43. LI S Y, WANG J C. The influence of the light intensity on the formation, discharge and adherence of monospores[J]. Marine Sciences, 1984(2): 41-43. |
| [24] |
王钦. 高温对草坪草细胞的伤害[J]. 草业科学, 1993, 10(4): 66-68. WANG Q. High-temperature damage to turf plants cells[J]. Pratacultural Science, 1993, 10(4): 66-68. |
| [25] |
丁原平. 紫菜叶状体细胞的分离及酶法育苗试验[J]. 齐鲁渔业, 2001, 18(4): 29-30. DING Y P. Study on isolated cells of Prophyra with enzymes and seeding of these cells[J]. Shandong Fisheries, 2001, 18(4): 29-30. |
| [26] |
王莉, 孔凡娜, 茅云翔, 等. 坛紫菜配子体离体细胞发育研究[J]. 中国海洋大学学报, 2010, 40(12): 81-88. WANG L, KONG F N, MAO Y X, et al. Studies on the development of cells isolated from gametophytes in Porphyra haitanensis[J]. Periodical of Ocean University of China, 2010, 40(12): 81-88. |
| [27] |
戴继勋. 用海藻细胞工程技术发展我国的海水养殖业[J]. 世界科技研究与发展, 2002, 24(3): 28-31. DAI J X. Developing the aquaculture of China using marine algae cytotechnology[J]. World Sci-Tech R & D, 2002, 24(3): 28-31. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


