2. 上海海洋大学 极地研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室极地海洋生态系统研究室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 210306
南极磷虾通常指南极大磷虾(Euphausia superba ,以下简称“磷虾”),个体最大体长可达70 mm,体质量2 g[1]。磷虾是维持整个南大洋生态系统运转的驱动力[2],也是南大洋规模最大的渔业捕捞对象[2-4]。目前,位于斯科舍海海域的南极半岛(含布兰斯菲尔德海峡)、南奥克尼群岛以及南乔治亚群岛周围水域是磷虾渔业的3个主要渔场[5-6]。该海域一直为磷虾环南极分布的关键水域,而由斯科舍海东部向北延伸至52°S附近的南乔治亚群岛东北部的磷虾丰度更高[7-9]。布兰斯菲尔德海峡和南乔治亚岛是我国磷虾渔业的主要渔场[5, 10],冬季磷虾渔场也由之前的南乔治亚岛拓展到南极半岛附近,除去作业要求、作业风险、市场影响和捕捞技术等因素的影响[11],磷虾渔场的这种变动也在一定程度上反映出资源结构上的变化。由此,研究冬季磷虾资源变动有助于探究磷虾越冬机制、预测来年磷虾的性成熟时间和产卵期以及明晰渔场的变化及其形成机制[12-14]。渔业资源种群结构研究含体长、性比及性成熟度等,为了解渔业资源特点、动态和合理开发与养护提供必不可少的科学依据[15]。目前,关于磷虾种群结构的研究多集中在夏季,例如:时永强等[14]分析了2008年夏季威德尔海及其邻近水域与2009年夏季普利兹湾及其邻近海域的磷虾种群结构,两年间的调查结果表明磷虾的丰度存在年间变化;朱国平等[9]对2010年夏初乔治王岛北部与西部之间水域的磷虾种群组成进行分析,结果表明当年夏季该海域的磷虾雌性个体数量显著高于雄性个体,且雌性未成熟个体占比较高。总的来讲,针对磷虾全年或冬季种群结构的研究极为有限,而对磷虾种群进行跨区域、多年度的长期持续观察将为阐明磷虾种群的时空变动及探究其触发机制提供极为关键的基础数据[16]。为此,本研究对2017年冬季磷虾的种群参数,如体长、性比和性成熟度等进行分析,以期了解该水域磷虾种群结构的变化,为进一步掌握其资源动态与渔业管理等提供科学依据。
1 材料与方法 1.1 样本来源磷虾样本由登临我国磷虾拖网加工船“龙腾”号的科学观察员随机采取,采样时间为冬季(2017年5月28日—8月11日)。5月和6月样品来源于布兰斯菲尔德海峡(Bransfield Strait,BS),而7月和8月样品来源于南乔治亚岛东北水域(South Georgia Island,SG)。样本采集工具为商业性中层磷虾拖网,系四片式单船中层拖网,囊网网目尺寸为15 mm。所有样本收集后用塑料试管单个保存于-20 ℃的冻库中,以便运回陆基实验室开展分析。
样本运回陆基实验室后,在总样本量1942尾中每月随机选取至少40尾磷虾个体,共取样207尾,样本站位见图 1。被选取的磷虾样本于常温解冻,并测量其标准体长(Standard length,LS,mm)、湿体质量(Wet mass,MW,g)和性成熟度。标准体长测量依据MAUCHLINE[17]的标准,即由额角最前端至尾节末端之间的长度。性成熟度的划分结合MAKAROV等[18]与BARGMANN[19]的划分标准进行判定,分为幼体、未成熟个体(雄性分为2AM、2BM、2CM三期,雌性分为2BF、2CF、2DF、2EF四期)、成熟个体(雄性分为3AM、3BM两期,雌性分为3BF、3CF、3DF、3EF四期)。

|
图 1 斯科舍海及采样站点 Fig. 1 The Scotia Sea and the sampling locations |
以5 mm为体长间距探究冬季各月磷虾体长组成的变化,利用协方差分析(ANCOVA)检验布兰斯菲尔德海峡和南乔治亚岛两区域的磷虾体长-湿质量关系之间是否存在显著差异。利用Shapiro-Wilk正态性检验分析各月份/区域间性成熟度是否符合正态分布,并使用Wilcoxon检验或Friedman检验分析两个或以上样本总体间是否存在显著性差异。
利用百分比相似性指数(percentage similarity index,PSI)估算各月份以及区域间磷虾性成熟度组成的相似性[20]。具体计算公式如下:
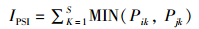 (1)
(1)
式中:IPSI为月份(区域)间各性成熟度等级所占比例的相似性PSI值;Pik为第i个月份(区域)中性成熟度为k的磷虾所占比例;Pjk为第j个月份(区域)中性成熟度为k的磷虾所占比例;S为性成熟度等级个数。通常认为,当PSI≥80时,两者之间相似[21]。显著性水平设定为P<0.05。数据无特殊说明均以平均值±标准差(Mean±SD)表示。数据的相似性分析由Excel 2017处理,正态性检验、差异性分析利用SPSS 19.0处理。
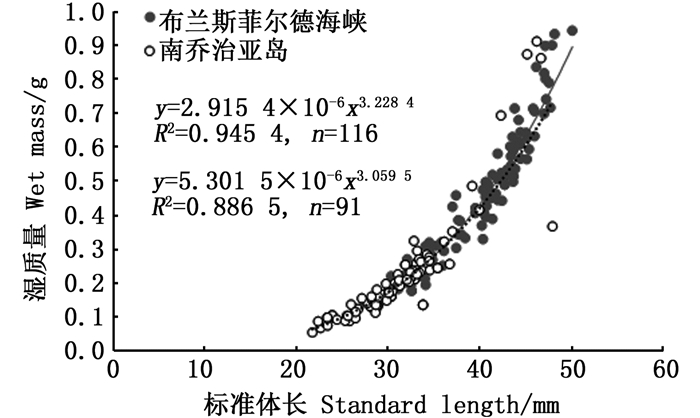
2 结果 2.1 基本生物学信息磷虾样本:体长范围为21.71~50.11 mm,平均体长为(35.93±6.87)mm,优势体长范围为25~45 mm;湿质量范围为0.055~0.945 g,平均湿质量为(0.352±0.215) g。样本的体长-体质量符合典型的幂指数关系MW =3.939 3×10-6LS3.146 3(R2 = 0.947 3, n=207),布兰斯菲尔德海峡和南乔治亚岛的磷虾样本体长-体质量关系分别为MW =2.915 4×10-6LS3.228 4(R2 = 0.945 4, n=116)和MW =5.301 5×10-6LS3.059 5(R2 = 0.886 5, n=91),见图 2。由协方差分析可知,布兰斯菲尔德海峡与南乔治亚岛两区域间的磷虾体长-湿质量关系存在显著性差异(F=4.482, P<0.05)。样品中共120尾雌性和87尾雄性,雌、雄比为1.38:1,所有样品中无幼体;其中布兰斯菲尔德海峡磷虾性比为1.42:1,南乔治亚岛磷虾性比为1.33:1。
|
图 2 2017年冬季布兰斯菲尔德海峡和南乔治亚岛东北水域磷虾体长-湿质量关系 Fig. 2 Length-wet mass relationship of Antarctic krill in the Bransfield Strait and the northeastern South Georgia in winter 2017 |
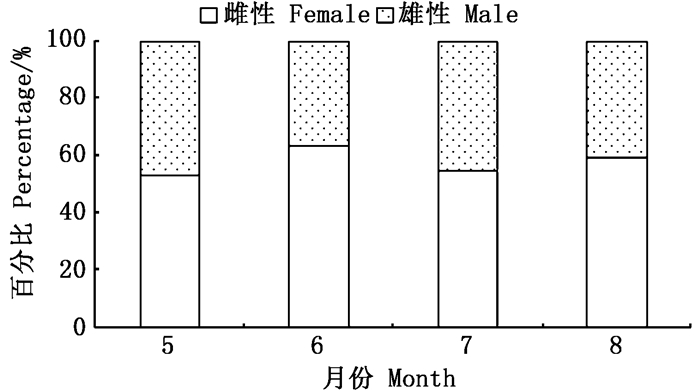
由图 3可以看出,冬季各月磷虾雌性占比稍高于雄性。对5—8月各月磷虾性成熟度分布进行Shapiro-Wilk检验,结果显示5月磷虾性成熟度呈正态分布(W=0.908,P>0.05),而6月(W=0.862,P<0.05)、7月(W=0.710,P<0.01)和8月(W=0.600,P<0.01)磷虾性成熟度均呈非正态分布。
|
图 3 2017年斯科舍海冬季磷虾性比例月变化 Fig. 3 Monthly variation in sex ratio of Antarctic krill in the Scotia Sea in winter 2017 |
由相邻月份间磷虾性成熟度等级占比的相似性来看,5月与6月间及7月与8月间的相似性较高(PSI分别为79.31和81.97),6月与7月间的相似性较低(PSI=61.65)。非参数检验结果显示,5—8月各月磷虾性成熟度分布之间均不存在显著差异(5月与6月,Wilcoxon检验,P>0.05;6月与7月,Wilcoxon检验,P>0.05;7月与8月,Wilcoxon检验,P>0.05;5—8月,Friedman检验,P>0.05)。
由性成熟度分布见图 4,5月末:雌性个体多为未成熟个体(2F,占比为50%,且集中于2CF和2DF期),极少数雌性个体为成熟个体(3F,占比仅为3.45%);雄性磷虾未成熟个体(2M)比例少于成熟个体(3M),占比分别为18.97%和27.59%。6月:雌性个体均为未成熟个体,且占比高于5月,为63.79%,集中于2BF、2CF和2DF期,其中2BF期占比较5月显著增高;雄性未成熟个体比例高于成熟个体,占比分别为22.41%和13.79%。7月:雌性个体多为未成熟个体(占比为53.06%,且集中于2BF期),仅个别雌性磷虾为成熟个体(占比为2.04%);雄性未成熟个体明显多于成熟个体(占比分别为36.73%和8.16%)。8月:雌、雄磷虾均为未成熟个体,占比分别为59.52%和40.48%。

|
图 4 2017年冬季斯科舍海磷虾性成熟度月分布 Fig. 4 Monthly variation in sexual maturity of Antarctic krill in the Scotia Sea in winter 2017 |
总体结果:5—8月雌性磷虾多为未成熟个体,5月、7月发现极少数雌性成熟个体(占比均小于3.5%),6月、8月均未出现雌性成熟个体;雄性成熟个体仅于5月稍多于未成熟个体,且随月份增加其占比逐渐减少,甚至于8月未发现成熟个体。整体来说,随着月份的增加,处于较低性成熟度等级的雌性个体所占比例显著提高,且雄性个体的成熟个体数量呈下降趋势。
2.3 种群结构区域差异对两个区域的磷虾体长、湿质量进行比较可知,2017年冬季南乔治亚岛磷虾平均体长、湿质量明显小于布兰斯菲尔德海峡。
对各区域磷虾性成熟度分布进行Shapiro-Wilk检验,结果显示:布兰斯菲尔德海峡磷虾性成熟度呈正态分布(W=0.901,P=0.136),而南乔治亚岛磷虾性成熟度呈非正态分布(W=0.657,P<0.001);冬季布兰斯菲尔德海峡(BS)和南乔治亚岛(SG)间磷虾种群结构虽不存在显著差异(Wilcoxon检验,P>0.05),但相似性较低(PSI=50.49<80)。
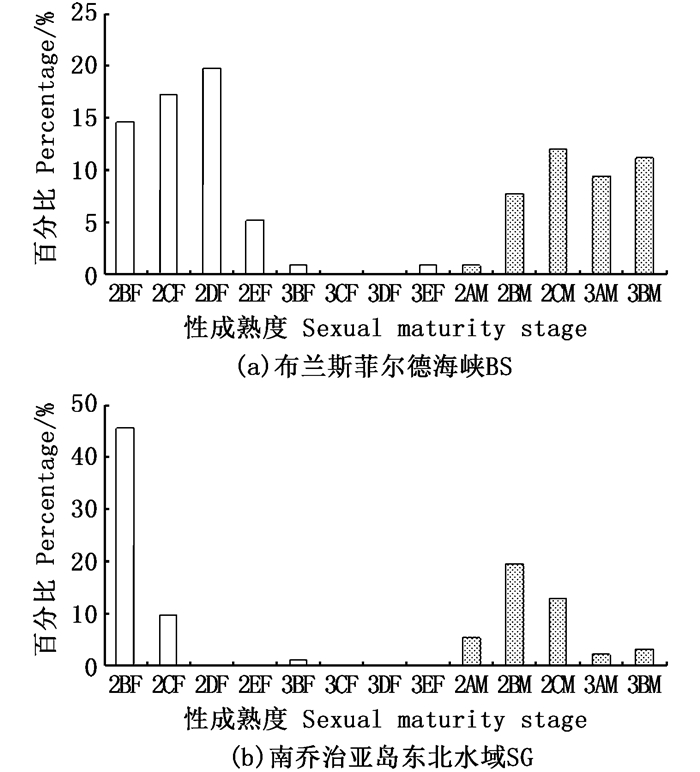
布兰斯菲尔德海峡区域,雌性多为未成熟个体(未成熟个体与成熟个体占比分别为56.90%和1.72%),雄性未成熟个体与成熟个体比例相当(占比均为20.69%),见图 5。南乔治亚岛东北水域区域,雌性近乎均为未成熟个体(未成熟个体与成熟个体占比分别为56.04%和1.10%),雄性未成熟个体显著多于成熟个体(占比分别为38.46%和4.40%)。总的来讲,随月份增加,两个区域内雌、雄个体的成熟个体数量减少,而未成熟个体数量逐渐增加。
|
图 5 2017年冬季布兰斯菲尔德海峡水域和南乔治亚岛东北水域磷虾性成熟度分布 Fig. 5 Distribution in sexual maturity of Antarctic krill in Bransfield Strait and the northeastern South Georgia in winter 2017 |
由于环境条件极其恶劣,加之后勤补给十分困难,迄今为止针对冬季磷虾的研究非常有限。目前仅有两项研究[16, 22]专门针对冬季磷虾种群结构进行了分析。基于波兰阿克托夫斯基站周边水域收集的样本(网目尺寸为60 μm),STEPNIK[22]对1979年乔治王岛海军湾磷虾种群结构周年变化进行了研究,结果显示,冬季(5月底—8月)大个体磷虾数量开始下降,种群平均体长逐渐减小。丁博等[16]对2016年斯科舍海磷虾种群结构的近周年变化进行了研究,该研究对布兰斯菲尔德海峡及南乔治亚岛的调查月份分别为5月及6—8月,研究结果发现:雌性磷虾仅于5月占比过半,且随月份增加雌性占比显著下降,而雌性未成熟个体的比例也随时间推移呈下降趋势;雄性磷虾均处于未成熟个体发育后期及成熟个体阶段。为了进一步探究冬季磷虾种群结构的年间变化,对比丁博等[16]和本研究的结果(图 6)可以看出:(1)尽管2016年与2017年5月磷虾样本均来源于布兰斯菲尔德海峡,但2016年雌性多为即将成熟的未成熟个体,而2017年雌性则多处于由幼体发育成未成熟个体阶段;2017年雄性未成熟个体比例显著高于2016年。(2)6月,2017年磷虾样本取自靠近南极半岛的布兰斯菲尔德海峡,而2016年磷虾样本来源于靠北的南乔治亚岛。2016年雌性磷虾有成熟个体出现,但未出现处于2BF阶段的磷虾,性成熟度集中于2DF、2EF阶段,而2017年雌性均为未成熟个体,且多处于2BF、2CF和2DF阶段;对于雄性,2016年成熟个体的比例显著高于2017年;(3)7月和8月,2016年及2017年样本均来源于南乔治亚岛。7月除少量个体外,两年的雌性磷虾均为未成熟个体,但2017年处于2BF阶段的磷虾占比极高;而就雄性磷虾而言,2016年成熟个体比例显著高于未成熟个体,2017年则为仅极少数个体为成熟个体。8月,2016年雌性磷虾占比极低且多为未成熟个体,而2017年雌性磷虾均处于2BF和2CF阶段,且占比高达60%;雄性磷虾中,2016年成熟个体比例较高,而2017年均为未成熟个体。由此可见,排除地域因素(6月)可能导致的差异,冬季斯科舍海磷虾种群结构存在着较为显著的年间差异。

|
图 6 2016与2017年冬季各月磷虾性成熟度分布 Fig. 6 Monthly distribution in sexual maturity of Antarctic krill in winter 2016 and 2017 |
对比2016年和2017年冬季各月磷虾平均体长变化、体长分布(图 7和8)进一步发现:(1)2016年各月平均体长较为相似,基本维持44 mm左右,而2017年各月平均体长则呈现出较为明显的下降趋势;(2)2016年,各月磷虾体长基本上呈现单峰分布,种群中主要以3+和4+龄虾为主[23],而2017年,5—7月磷虾体长均呈现出双峰分布,且种群中2+龄虾的比例要明显高于2016年同期,尤其是冬季中后期的南乔治亚岛水域。

|
图 7 2016年和2017年冬季各月磷虾平均体长变化(竖线表示标准偏差) Fig. 7 Monthly variation in mean standard length of Antarctic krill in the winter, 2016 and 2017 (the vertical bars signify standard deviation) |
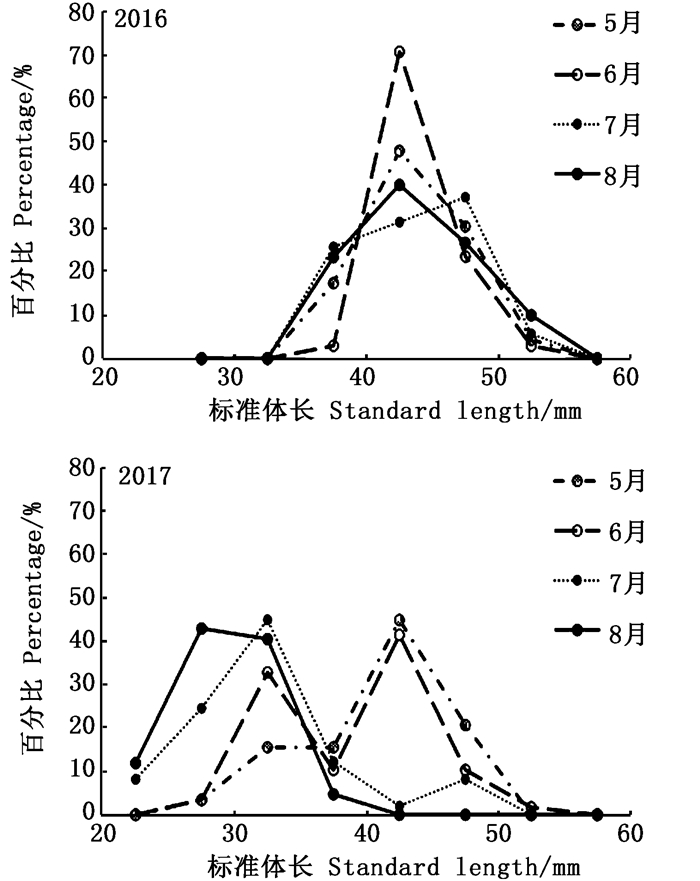
|
图 8 2016与2017年冬季磷虾体长组成月变化对比 Fig. 8 Comparative analysis in monthly variation in standard length of Antarctic krill in winter 2016 and 2017 |
再将本研究与约40年前(1979年5—8月)的磷虾种群结构研究[22]进行对比可知:1979年冬季磷虾幼体在种群中所占的比例较高(>20%),而2016和2017年均无幼体出现;1979年5—8月,雄性未成熟个体在种群中的比例呈下降趋势,这与2017年结果相反;对于雄性成熟个体,1979年各月占比较为平均(约10%),而2017年随月份增加其占比迅速降低(由27.59%降至0)。1979年及2017年,雌性未成熟个体比例均较高,且各月占比多维持在40%—60%之间;两个年份中雌性成熟个体的出现均为个例,且无抱卵雌体出现。这也验证了冬季并非磷虾的产卵季节[24-25]。
综上可知,斯科舍海磷虾种群结构不仅在夏季存在着较为显著的年际变动,在无繁殖活动发生的冬季,其种群结构也存在着年间(2016年和2017年)和年际(1979年和2017年)的变动。多变的种群结构也导致无法准确地通过现有的评估手段和预测技术对磷虾的资源变动进行预报。造成磷虾种群变动的因素较多,如繁殖和补充群体等生源要素以及水温、海冰等理化要素等。为此,开展磷虾种群结构跨区域、多年度的长期持续观察,将有助于了解该种群结构的时空变动,并进一步探究其触发机制。
| [1] |
朱国平. 南极磷虾种群生物学研究进展Ⅰ-年龄、生长与死亡[J]. 水生生物学报, 2011, 35(5): 862-868. ZHU G P. Population biology of Antarctic krill Euphausia superb. I-age, growth and mortality[J]. Acta Hydrobiologica Sinica, 2011, 35(5): 862-868. |
| [2] |
孙松, 刘永芹. 南极磷虾与南大洋生态系统[J]. 自然杂志, 2009, 31(2): 88-90, 104. SUN S, LIU Y Q. Antarctic krill and Southern Ocean ecosystem[J]. Chinese Journal of Nature, 2009, 31(2): 88-90, 104. DOI:10.3969/j.issn.0253-9608.2009.02.005 |
| [3] |
EVERSON I, MILLER DGM. Krill mesoscale distribution and abundance: results and implications of research during the BIOMASS Programme[C]//EI-SAYED S Z. Southern Ocean Ecology: the BIOMASS Perspective. Cambridge: Cambridge University Press, 1994.
|
| [4] |
NICOL S, ENDO Y. Krill fisheries:Development, management and ecosystem implications[J]. Aquatic Living Resources, 1999, 12(2): 105-120. DOI:10.1016/S0990-7440(99)80020-5 |
| [5] |
EVERSON I, GOSS C. Krill fishing activity in the southwest Atlantic[J]. Antarctic Science, 1991, 3(4): 351-358. DOI:10.1017/S0954102091000445 |
| [6] |
朱国平, 朱小艳, 徐怡瑛, 等. 2010/2011年夏季南设得兰群岛北部南极磷虾体长时空分布特征[J]. 上海海洋大学学报, 2012, 21(5): 864-871. ZHU G P, ZHU X Y, XU Y Y, et al. The spatial-temporal characteristics of length distribution for Antarctic krill (Euphausia superba) in the northern South Shetland Islands in the austral summer during 2010/2011 fishing season[J]. Journal of Shanghai Ocean University, 2012, 21(5): 864-871. |
| [7] |
MARR J W S. The natural history and geography of the Antarctic krill (Euphausia superba Dana)[J]. Discovery Report, 1964, 32: 33-464. |
| [8] |
SIEGEL V, KAWAGUCHI S, WARD P, et al. Krill demography and large-scale distribution in the southwest Atlantic during January/February 2000[J]. Deep Sea Research Part II:Topical Studies in Oceanography, 2004, 51(12/13): 1253-1273. |
| [9] |
朱国平, 朱小艳, 夏辉, 等. 2010/2011年夏季南设得兰群岛北部水域南极磷虾的种群组成[J]. 水产学报, 2013, 37(9): 1431-1440. ZHU G P, ZHU X Y, XIA H, et al. Population composition of Antarctic krill (Euphausia superba) in the northern South Shetlands Island areas during the austral summer of 2010/2011 season[J]. Journal of Fisheries of China, 2013, 37(9): 1431-1440. |
| [10] |
MURPHY E J, TRATHAN P N, EVERSON I, et al. Krill fishing in the Scotia Sea in relation to bathymetry, including the detailed distribution around South Georgia[J]. CCAMLR Science, 1997, 4(1): 1-17. |
| [11] |
朱国平, 徐怡瑛, 夏辉, 等. 2009/2010-2011/2012渔季中国南极磷虾渔业渔场时空变动[J]. 上海海洋大学学报, 2013, 22(3): 425-431. ZHU G P, XU Y Y, XIA H, et al. Spatial-temporal variation on fishing ground of Chinese Antarctic krill fishery in 2009/2010 to 2011/2012 fishing season[J]. Journal of Shanghai Ocean University, 2013, 22(3): 425-431. |
| [12] |
SUN S. Using Antarctic krill as an indicator of environmental interannual change[J]. Korean Journal of Polar Research, 1997, 8(1/2): 97-103. |
| [13] |
SHIN H C, NICOL S. Using the relationship between eye diameter and body length to detect the effects of long-term starvation on Antarctic krill Euphausia superba[J]. Marine Ecology Progress Series, 2002, 239: 157-167. DOI:10.3354/meps239157 |
| [14] |
时永强, 孙松, 李超伦, 等. 夏季南大洋南极大磷虾种群分布、结构及生长研究[J]. 极地研究, 2014, 26(4): 441-450. SHI Y Q, SUN S, LI C L, et al. The population distribution, structure, and growth condition of Antarctic krill (Euphausia superba Dana) during the austral summer in the Southern Ocean[J]. Chinese Journal of Polar Research, 2014, 26(4): 441-450. |
| [15] |
王荣, 仲学锋, 孙松, 等. 普里兹湾邻近海域大磷虾的种群结构研究[J]. 南极研究, 1993, 5(4): 1-11. WANG R, ZHONG X F, SUN S, et al. Population structure of the Antarctic krill in the Prydz Bay region, Indian Ocean sector of the Southern Ocean[J]. Antarctic Research, 1993, 5(4): 1-11. |
| [16] |
丁博, 朱国平, 张海亭. 2016年南极斯科舍海南极大磷虾种群结构的时空变化[J]. 应用生态学报, 2018, 29(8): 2763-2770. DING B, ZHU G P, ZHANG H T. Spatial-temporal variation in population structure of Antarctic krill (Euphausia superba) in the Scotia Sea, Antarctic in 2016[J]. Chinese Journal of Applied Ecology, 2018, 29(8): 2763-2770. |
| [17] |
MAUCHLINE J. Measurement of body length of Euphausia superba Dana[C]//ANON. Biomass Handbook. Cambridge: Scientific Committee on Antarctic Research, 1980: 1-9.
|
| [18] |
MAKAROV R R, DENYS C J. Stages of sexual maturity of Euphausia superba Dana[J]. BIOMASS Handbook Series, 1981, 11: 1-13. |
| [19] |
BARGMANN H E. The development and life-history of adolescent and adult krill, Euphausia superba[J]. Discovery Report, 1945, 23: 103-176. |
| [20] |
WHITTAKER R H. Communities and ecosystems[M]. New York: MacMillan, 1975.
|
| [21] |
NEWMAN R M. Comparison of encounter model predictions with observed size-selectivity by stream trout[J]. Journal of the North American Benthological Society, 1987, 6(1): 56-64. DOI:10.2307/1467524 |
| [22] |
STEPNIK R. All-year populational studies of Euphausiacea (Crustacea) in the Admiralty Bay (King George Island, South Shetland Islands)[J]. Polish Polar Research, 1982, 3: 49-68. |
| [23] |
朱国平, 吴强, 冯春雷, 等. 基于渔业调查的南极半岛北部水域南极磷虾种群年龄结构分析[J]. 生态学报, 2011, 31(16): 4620-4627. ZHU G P, WU Q, FENG C L, et al. Population age structure of Antarctic krill Euphausia superba off the northern Antarctic Peninsula based on fishery survey[J]. Acta Ecologica Sinica, 2011, 31(16): 4620-4627. |
| [24] |
TRATHAN P N, MURPHY E J. Sea surface temperature anomalies near South Georgia:Relationships with the pacific El Niño regions[J]. Journal of Geophysical Research:Oceans, 2003, 107(C4): 8075. |
| [25] |
SPIRIDONOV V A. Spatial and temporal variability in reproductive timing of Antarctic krill (Euphausia superba Dana)[J]. Polar Biology, 1995, 15(3): 161-174. |
2. Center for Polar Research, Shanghai Ocean University, Shanghai 201306, China;
3. Polar Marine Ecosystem Group, The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


