2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 海洋动物系统分类与进化上海高校重点实验室, 上海 201306
隐蔽伪装色是指背部体色深、腹部体色浅的一种体色[1],通过消除动物自身明显的阴影和三维信息,防止被捕食者或饵料生物检测,从而达到伪装隐身的目的,有利于避敌和摄食,是脊椎动物普遍采用的一种伪装策略[2]。由于水中光线主要来自水面的透射,隐蔽伪装色在鱼类中非常普遍[1, 3]。如大家熟悉的沙丁鱼(Sardine)、金枪鱼(tuna)等海洋上层鱼类,其体背部颜色很深,而腹部银白色,从上往下看,鱼类背部深色匹配海洋深色背景色,不易被发现;从下往上看,腹部银白色,匹配海表面的亮光,同样不易被发现,十分有利于鱼类避敌和摄食[1, 4-6]。近海底层鱼类,如,虾虎鱼类、鲆鲽鱼类、鲉形目鱼类等底层鱼类,其背部颜色也比腹部深很多,背部颜色匹配海洋底部环境,而腹部基本上没有颜色[2, 6]。虽然鱼类隐蔽伪装色普遍存在,但缺乏对鱼类隐蔽伪装色进行量化,本研究通过量化近海中上层鱼类和底层鱼类的隐蔽伪装色,以探讨隐蔽伪装色形成的生态学意义。
1 材料与方法 1.1 实验材料近海鱼类标本购自上海市芦潮港和福建东山岛,中上层鱼类有大甲鲹(Megalaspis cordyla)、斑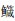
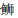

|
表 1 所采集近海鱼类的体长、体高和质量 Tab.1 The Body lengths, heights and weights of 11 fish species in this study |
在不影响体色的前提下,购买回来的样本均放在-20 ℃冰箱稍作冷冻处理,并分别取鱼身体从头部(包括头部)到尾部的背部和腹部的1/4处、1/2处和3/4处1 cm2大小的皮肤(图版Ⅰ),用中性树脂制成临时装片[7],若皮肤不舒展,可将皮肤放在0.9%的生理盐水中舒展片刻,再制作临时装片。
1.3 色素细胞统计分析按上述方法,每种鱼3尾个体共制作36张临时装片,将制好的装片放在尼康体视显微镜下拍照,每平方厘米皮肤取3个视野进行色素细胞计数,利用IBM SPSS Statistics 22.0版本对每种鱼背、腹部及中上层和底层鱼类色素细胞进行单因素方差分析(ANOVA),设定差异显著水平为0.05,当P < 0.05时为差异显著, 当P < 0.01时为差异极显著。在本研究中,我们通过比较皮肤色素细胞数量差异来衡量隐蔽伪装色程度。
2 结果 2.1 近海中上层和底层鱼类色素细胞组成和分布特征在11种近海鱼类中发现存在黑色素细胞、黄色素细胞、红色素细胞和虹彩细胞。黑色素细胞有两种形态,一种为树突状向四周散射,这种黑色素细胞比较大,另一种圆形或椭圆形,相对较小。黄色素细胞比黑色素细胞小,但比红色素细胞和虹彩细胞大,呈黄色,含有大量的带黄色的色素,黄色素细胞在鱼类背部和腹部都有分布,背部相对较多,腹部较少。红色素细胞中在皮肤中呈现红色,近海鱼类皮肤中红色素细胞含量少,有些鱼甚至没有红色素细胞。虹彩细胞,胞体很小,不同的鱼类虹彩细胞呈现蓝色、绿色或白色,在近海鱼类中,除了龙头鱼没发现虹彩细胞外,在其他鱼类皮肤中均呈现蓝色或者绿色。虹彩细胞在鱼体背腹部都有分布,且成片存在(图版Ⅰ, Ⅱ)。
2.2 近海中上层鱼类背、腹部各类型的色素细胞数量的比较通过对近海6种中上层鱼类的背部和腹部各类色素细胞数目的统计,可以发现黑色素细胞最多,例如,大甲鯵黑色素细胞数量最多,其背部平均数量为(421.3±82.3)个/cm2,腹部平均数量为(18.4±11.4)个/cm2;竹䇲鱼的黄色素细胞最多, 其背部平均数量为(180.3±44)个/cm2,腹部平均数量为(21.1±19.0)个/cm2;蓝点马鲛的虹彩细胞数量最多,其背部平均数量为(823.8±193.8)个/cm2,腹部平均数量为(549.6±225.1)个/cm2;大甲鲹的红色素细胞数量最多,其背部平均数量为(60.3±15.9)个/cm2,腹部平均数量为(5.3±2.9)个/cm2。
在近海6种中上层鱼类中,背部和腹部皮肤的黑色素细胞数量均呈现极显著差异,其背部每平方厘米皮肤黑色素细胞数依次为大甲鲹>蓝点马鲛>竹䇲鱼>蓝圆鲹>五条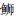
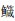





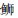

|
*表示差异显著(P < 0.05);**表示差异极显著(P < 0.01) *Indicates significant(P < 0.05); **Indicates very significant(P < 0.01) 图 1 6种近海中上层鱼类背部和腹部皮肤各种类型色素细胞数量的比较 Fig. 1 Statistical analysis of skin pigment cells in the dorsal and venter of six species in the demersal fishes of the coastal waters |
通过对近海5种底层鱼类的背部和腹部各类色素细胞数目的统计,也发现黑色素细胞最多,例如,单角革鲀黑色素细胞数量最多,其背部平均数量为(377.7±44.8)个/cm2,腹部平均数量为(107.9±29.1)个/cm2;斑尾复虾虎鱼黄色素细胞细胞最多, 其背部平均数量为(247.8±48.6)个/cm2,腹部平均数量为(14.8±8.6)个/cm2;海鳗虹彩细胞最多,其背部平均数量为(550.2±111.0)个/cm2,腹部平均数量为(851.8±215.8)个/cm2。
在近海5种底层鱼类中,背部和腹部皮肤的黑色素细胞细胞数量均呈现极显著差异,其背部每平方厘米皮肤黑色素细胞数依次为单角革鲀>斑尾复虾虎鱼>带鱼>海鳗>龙头鱼(图 2a)。底层鱼类中带鱼黄色素细胞很少,且背腹部无明显差异,其他底层鱼类均为背部多,腹部少,且差异显著,下层鱼类背部黄色素细胞平均数量依次为斑尾复虾虎鱼>单角革鲀>海鳗>带鱼(图 2b)。斑尾复虾虎鱼和海鳗的腹部虹彩细胞多,背部少,且差异显著,下层鱼类背虹彩细胞平均数量依次为海鳗>带鱼>单角革鲀>斑尾复虾虎鱼(图 2c)。底层鱼类中带鱼的红色素细胞为腹部多,背部少,且差异显著,其他底层鱼类中并未发现红色素细胞(图 2d)。

|
*表示差异显著(P < 0.05); **表示差异极显著(P < 0.01) *Indicates significant(P < 0.05); **Indicates very significant(P < 0.01) 图 2 5种近海底层鱼类背部和腹部皮肤各种类型色素细胞数量的比较 Fig. 2 Statistical analysis of skin pigment cells in the dorsal and venter of five species in the bottom fishes of the coastal waters |
11种近海鱼类背、腹部皮肤中的色素细胞,主要以黑色素细胞和黄色素细胞为主(图 3),进一步比较中上层鱼类和底层鱼类背腹部皮肤黑色素细胞和黄色素细胞数量,可以发现中上层鱼类背部黑色素细胞数量比底层鱼类的多,且差异极显著(图 3a),其腹部黑色素细胞数量要比底层鱼类少,且差异极显著(图 3b)。而中上层鱼类背部黄色素细胞数量要比底层鱼类少,且差异极显著(图 3c),而腹部黄色素细胞数量相差不大(图 3d)。通过对近海鱼类皮肤色素细胞数量差异的比较,发现中上层鱼类的平均隐蔽伪装色程度要比底层鱼类高(图 3e)。

|
*表示差异显著(P < 0.05);**表示差异极显著(P < 0.01)。 *Indicates significant(P < 0.05); **Indicates very significant(P < 0.01) 图 3 近海中上层和底层鱼类背腹部黑色素细胞黄色素细胞数量的比较 Fig. 3 Comparison of dorsal melanocytes in the demersal and bottom fishes of the coastal waters |
鱼类隐蔽伪装色的程度取决于背、腹部色素细胞数量的差异,本研究通过研究11种近海中上层和底层鱼类的背、腹部皮肤色素细胞的分布,主要是黑色素细胞最多,其次为黄色素细胞,虹彩细胞和红色素细胞数量较少。无论中上层鱼类还是底层鱼类,均为背部黑色素细胞多,腹部黑色素细胞少,且黑色素细胞数量多的皮肤中黄色素细胞数量也相应增多,即鱼体背部黄色素细胞多,腹部黄色素细胞少,结合上层和底层鱼类色素细胞的量化结果,表明近海鱼类背部体色深主要与背部的黑色素细胞和黄色素细胞数量多有关。而鱼类腹部体色浅,黑色素细胞和黄色素细胞数量少,造成背腹部体色的差异,从而形成一定程度的隐蔽伪装色。
3.2 近海鱼类的隐蔽伪装色形成机制探讨本文调查的11种近海鱼类,斑
可见,这些近海鱼类都可以在不同程度上接收到来自海面对光线,光线抵达鱼体背面要比腹面强。在牙鲆(Paraichthys olivaceus)、半滑舌鳎(Cynoglossus semilaevis)大西洋鲑(Salmo salar)、蓝点马鲛(S. niphonius)、秋刀鱼(Cololabis saira)、瓜氏
依据所统计的背、腹部黑色素细胞和黄色素细胞数量,可以发现近海中上层鱼类的隐蔽伪装色程度要高于底层鱼类,这可能与不同水深鱼类皮肤感受光线强度和光谱有关。已知从水面照射下来的光线,水深每下降100 m, 光照强度就会消减1.5个数量级[21]。对近海底层鱼类而言,由于水深度增加,且近海海水中泥沙和污染物比较多,海水的清澈程度远不如远海,因此近海底层鱼类接收到的光照强度就更弱,而近海中上层鱼类背部皮肤受到的光线强度要强很多。此外,不同波长的光可到达的水下深度也有所不同,波长较短的蓝光不易被海水吸收,其中蓝光到达深度最深为275米,而红光波长最长,到达深度仅为5米,其他波长光依次递减[21]。中上层鱼类,不同波长的光均能照射到背部,而近海底层鱼类,可能只能接收到蓝光。目前只知道蓝光能诱导近海底层鱼类牙鲆黑色素细胞的形成,而其它颜色的光线,能否诱导近海底层鱼类或近海中上层鱼类黑色素细胞和黄色素细胞的形成,需要在后续研究中展开调查。
| [1] |
ROWLAND H M. From Abbott Thayer to the present day:what have we learned about the function of countershading?[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2008, 364(1516): 519-527. |
| [2] |
STEVENS M, MERILAITA S. Animal camouflage:current issues and new perspectives[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2008, 364(1516): 423-427. |
| [3] |
MANCEAU M, DOMINGUES V S, MALLARINO R, et al. The developmental role of agouti in color pattern evolution[J]. Science, 2011, 331(6020): 1062-1065. DOI:10.1126/science.1200684 |
| [4] |
RUXTON G D, SPEED M P, KELLY D J. What, if anything, is the adaptive function of countershading?[J]. Animal Behaviour, 2004, 68(3): 445-451. |
| [5] |
KILTIE R A. Countershading:universally deceptive or deceptively universal?[J]. Trends in Ecology & Evolution, 1988, 3(1): 21-23. |
| [6] |
LECLERCQ E, TAYLOR J F, MIGAUD H. Morphological skin colour changes in teleosts[J]. Fish and Fisheries, 2010, 11(2): 159-193. |
| [7] |
史学营, 徐永江, 武宁宁, 等. 半滑舌鳎(Cynoglossus semilaevis)体表色素细胞观察及POMC表达特性分析[J]. 渔业科学进展, 2015, 36(2): 45-54. SHI X Y, XU Y J, WU N N, et al. Preliminary studies on blind-side hypermelanosis of Cynoglossus semilaevis:chromatophores observation and expression of proopiomelanocortin[J]. Progress in Fishery Sciences, 2015, 36(2): 45-54. |
| [8] |
中国科学院动物研究所.斑鱵[EB/OL].《中国动物物种编目数据库》.中国科学院微生物研究所.[2009-04-11]. Institute of Zoology, Chineses Academy of Sciences. Siniperca scherzeri[EB/OL]. Species Inventory Database of Chinese Animals. Institute of Micribilogy, Chineses Academy of Sciences.[2009-04-11]. |
| [9] |
陈永祥. 千种鱼虾蟹贝藻类图[M]. 上海: 学林出版社, 2013: 52. CHEN Y X. Thousand species of fish, shrimp, crab and algae[M]. Shanghai: Xuelin Publishing House, 2013: 52. |
| [10] |
戴泉水, 汪伟洋, 卢振彬, 等. 福建近海大甲鲹生物学特性及其资源前景[J]. 福建水产, 1986(4): 1-8. DAI Q S, WANG W Y, LU Z B, et al. Biological characteristics and resource prospects of Megalaspis cordyla in Fujian offshore[J]. Journal of Fujian Fisheries, 1986(4): 1-8. |
| [11] |
陆忠康. 日本鰤鱼和真鲷沿海养殖方法与技术[J]. 现代渔业信息, 1990, 5(7): 20-23. LU Z K. Method and technology for coastal culture of Japanese Seriola quinqueradiata and pagrosomus major[J]. Modern Fisheries Information, 1990, 5(7): 20-23. |
| [12] |
蒋日进, 徐汉祥, 金海卫, 等. 东海蓝圆鲹的摄食习性[J]. 水产学报, 2012, 36(2): 216-227. JIANG R J, XU H X, JIN H W, et al. Feeding habits of blue mackerel scad Decapterus maruadsi Temminck et Schlegel in the East China Sea[J]. Journal of Fisheries of China, 2012, 36(2): 216-227. |
| [13] |
刘静, 宁平. 黄海鱼类组成、区系特征及历史变迁[J]. 生物多样性, 2011, 19(6): 764-769. LIU J, NING P. Species composition and faunal characteristics of fishes in the Yellow Sea[J]. Biodiversity Science, 2011, 19(6): 764-769. |
| [14] |
宋娜, 宋林, 高天翔, 等. 斑尾复虾虎鱼群体遗传多样性比较分析[J]. 水产学报, 2011, 35(3): 321-326. SONG N, SONG L, GAO T X, et al. Comparative analysis of genetic diversity of Synechogobius ommaturus based on the mitochondrial DNA control region[J]. Journal of Fisheries of China, 2011, 35(3): 321-326. |
| [15] |
张石天, 洪小括. 浙南沿岸6种经济种类幼体分布及张网作业对其损害的调查[J]. 上海海洋大学学报, 2012, 21(3): 403-409. ZHANG S T, HONG X K. Study on the distribution of larvae of six economic species and the damage of set net on them along southern coast of Zhejiang[J]. Journal of Shanghai Ocean University, 2012, 21(3): 403-409. |
| [16] |
李振华, 卢占晖, 朱文斌. 东海单角革鲀成鱼群体秋季摄食习性的初步分析[J]. 浙江海洋学院学报(自然科学版), 2015, 34(5): 433-438. LI Z H, LU Z H, ZHU W B. Preliminary study on the feeding habits of Aluterus monoceros adult group in east China in autumn[J]. Journal of Zhejiang Ocean University (Natural Science), 2015, 34(5): 433-438. DOI:10.3969/j.issn.1008-830X.2015.05.007 |
| [17] |
朱元鼎, 张春霖, 成庆泰. 东海鱼类志[M]. 北京: 科学出版社, 1963: 551. ZHU Y D, ZHANG C L, CHENG Q T. East Sea Fish[M]. Beijing: Science Press, 1963: 551. |
| [18] |
王小谷, 孙栋, 林施泉. 长江口及其邻近海域仔鱼的生态学研究[J]. 上海海洋大学学报, 2017, 26(5): 733-742. WANG X G, SUN D, LIN S Q. The ecological study of fish larvae in the Yangtze River Estuary and adjacent waters[J]. Journal of Shanghai Ocean University, 2017, 26(5): 733-742. |
| [19] |
陈新页, 郭华, 鲍宝龙. 牙鲆仔鱼SWS1基因克隆及5个视蛋白基因的表达[J]. 上海海洋大学学报, 2015, 24(5): 641-649. CHEN X Y, GUO H, BAO B L. Cloning of SWS1 gene and expression of five opsin genes in larval flounder Paralichthys olivaceus[J]. Journal of Shanghai Ocean University, 2015, 24(5): 641-649. |
| [20] |
SHAO C W, BAO B L, XIE Z Y, et al. The genome and transcriptome of Japanese flounder provide insights into flatfish asymmetry[J]. Nature Genetics, 2017, 49(1): 119-124. |
| [21] |
COLLIN S P, HART N S. Vision and photoentrainment in fishes:the effects of natural and anthropogenic perturbation[J]. Integrative Zoology, 2015, 10(1): 15-28. |
2. National experimental teaching demonstration center of aquatic science, Shanghai Ocean University, Shanghai 201306, China;
3. Classification and evolution of marine animal system of Shanghai Ocean University Key Laboratory of Shanghai University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


