2. 农业农村部大洋渔业开发重点实验室, 上海 201306;
3. 上海海洋大学 生态与环境学院, 上海 201306
基于生态系统的渔业管理(ecosystem-based fishery management,EBFM)已成为渔业管理发展的主要趋势之一[1]。由于生态系统固有的复杂性,EBFM方法体系的建立和发展仍处于起步阶段[2],它的前提是了解生态系统的结构,而食物网是生态系统结构和过程的基础。因此,EBFM的研究需要与食物网研究相结合。Ecopath with Ecosim(EwE)是全球海洋和水生生态系统建模最常用的工具之一[3-4],使用Ecopath中各种生态网络分析的指标,如混合营养效应分析(mixed trophic impact,MTI),可以评估生态系统的结构和成熟度。
目前,全球已利用Ecopath建立了452个海洋生态系统模型,主要集中在大西洋的中部和北部,其中太平洋区域有17个,仅占全球Ecopath生态系统模型的3.8%[5]。热带太平洋区域渔业资源丰富,是世界金枪鱼渔业的主要捕捞区域,但对其生态系统的研究报道却很少。以往的研究[6]表明,海洋生态系统结构容易受到长期渔业捕捞的影响。除了捕捞量的影响外,渔获个体大小组成的影响也不容忽视,因为种群中不同大小的个体对生态系统结构、特别是食物网结构的影响不同。利用Ecopath生态系统模型,研究捕捞个体的大小对热带太平洋生态系统结构的影响方面,尚未见有报道。
生态系统结构的比较研究,可以为揭示人类活动和环境变化对生态系统的影响提供基础。LIRA等[7]将巴西东北部建立的所有河口模型按照热带、亚热带和温带的分类进行了比较,结果显示热带比亚热带和温带生态系统更加成熟。马孟磊等[2]基于胶州湾渔业资源与生态环境调查数据,对比分析了不同时期生态系统结构和功能变化以及系统发育特征,结果显示,在过去30多年胶州湾生态系统成熟度和稳定性不断降低,发育过程出现由成熟向幼态的逆行演替现象。2003年,OLSON等[8]利用Ecopath建立了东太平洋首个生态系统模型,其利用的数据是1997年之前的东太平洋金枪鱼渔业资料和生物学资料(故本文称之为1997年模型)。因此,本文在OLSON等[8]研究的基础上,构建了2017年东太平洋生态系统Ecopath模型,并与1997年模型对比,分析20年来该生态系统营养级结构、能量转化效率和系统发育特征变化,探讨捕捞对该生态系统的影响。
1 材料与方法 1.1 方法综述Ecopath模型定义生态系统由一系列生物学和生态学特征相似的功能组组成,所有功能组成分基本覆盖生态系统能量流动的全过程[9],各功能组的相互联系充分体现整个系统的能量循环过程。根据营养平衡原理,模型定义生态系统中每个功能组的能量输入和输出保持平衡,这是模型建立的前提。本文沿用OLSON等[8]的方法,对东太平洋生态系统分成39个功能组。
根据最近东太平洋的渔业数据以及鱼类摄食数据,利用EwE软件构建2017年东太平洋生态系统模型,并将此模型与OLSON等[8]建立的1997年模型进行比较,分析不同时期东太平洋生态系统结构和功能变化以及系统发育特征。由于东太平洋渔业中涉及的金枪鱼类体型较大,考虑到同种鱼类、不同大小的个体因摄食对象不同,对生态系统营养结构的影响往往有差异,因此,本文参照OLSON等[8]的方法,将黄鳍金枪鱼和大眼金枪鱼两个主要捕捞种类分成大个体、小个体。但是,由于黄鳍和大眼金枪鱼在相对资源量统计中并未区分个体大小,需要根据模型功能组的划分情况,对相对资源量按大个体、小个体进行分割。分割比例成为模型的重要不确定性来源。为此,本文设置3个分割比例水平,从而建立3个模型(表 1):模型1沿用1997年模型的分割比例,根据近年来对金枪鱼大小个体生物量的分析;模型2和模型3黄鳍和大眼金枪鱼大、小个体资源量分割比例分别设为1:4和1:5。

|
表 1 3个2017年模型黄鳍和大眼金枪鱼不同分割比例及其相对生物量 Tab.1 The relative biomass of Yellowfin and Bigeye tuna by three models in 2017 |
本文中建模区域与1997年OLSON等[8]建立的模型区域相同,其中,渔业数据来源于美洲间热带金枪鱼委员会(Inter-American Tropical Tuna Commission,IATTC),覆盖区域范围:50°N~50°S以及150°W以东至美洲的边界(图 1),摄食数据来源于中国金枪鱼延绳钓科学观察员分4个航次从东太平洋采集的鱼类胃含物样品,每个航次的采样站点维持在80~100个,本研究共计397个站点,图 1的黑色三角区域是每个航次的站点集合。采样范围为热带太平洋东部(5°57′S~25°00′N,125°00′W ~164°30′W),采样时间为2017年6—12月。采样的鱼类样品数量共计208尾,主要包含黄鳍金枪鱼(YFT)、沙氏刺鲅(WAH)、剑鱼(SWO)、旗鱼(SFA)和大眼金枪鱼(BET),其中前两者大小个体的体长临界值为90 cm,SWO和SFA为150 cm,BET则为80 cm。在模型平衡的情况下,鱼类的生产量/生物量(production/biomass, P/B)的值等于瞬时总死亡率(Z),本文利用GULLAND[10]提出的总渔获量曲线法来估算Z,瞬时总死亡率(Z)等于捕捞死亡率(F)与自然死亡率(M)之和,本文的M利用PAULY[1]提出的经验公式进行估算。消费量/生物量(consumption/biomass, Q/B)的值根据PALOMARES等[11]提出的尾鳍外形比的多元回归模型计算。对于P/B和Q/B的值难以确定的其他功能组,本文主要参考纬度与本研究区域相似的西太平洋和中部太平洋模型中的类似功能组,并且结合国际鱼类信息网站(www.fishbase.org)上记载的信息予以确定。东太平洋生态系统的有机碎屑量根据PAULY等[12]提出的使用有机碎屑与初级生产碳的经验公式估算。
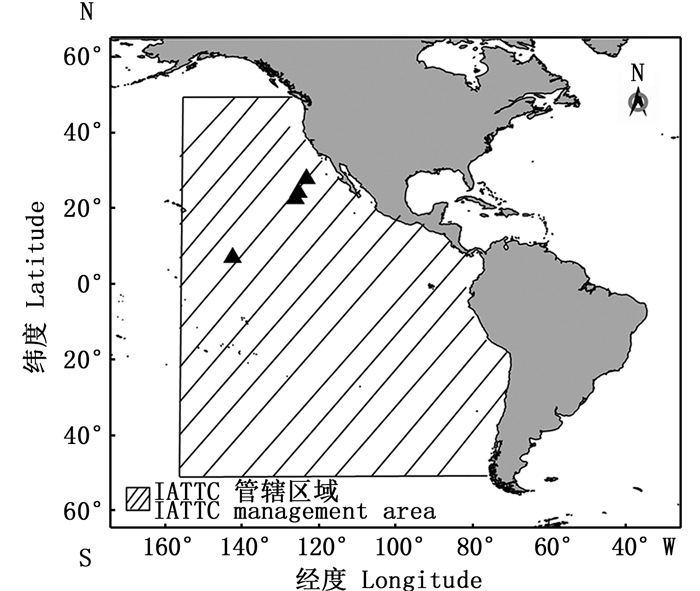
|
图 1 东太平洋生态系统模型区域与摄食样品采集位置 Fig. 1 Eastern Pacific Ocean ecosystem modeling area and sampling locations of feeding data |
在生态系统模型中,功能组之间通过捕食关系紧密联系。在Ecopath建模中需输入所有功能组的食物组成。摄食数据主要通过胃含物实验获取,当部分功能组缺乏胃含物分析数据时,借鉴纬度和生态系统特征相似的区域的数据[7]。构建食物组成矩阵的基础数据来源于胃含物的物种鉴定。本研究中胃含物的鉴定法包括:胃含物形态鉴定法,DNA分析法以及耳石形态对比法。观察员将从东太平洋捕捞的鱼类进行现场解剖并取出胃含物,置于10%福尔马林中冷冻保存并运回国内实验室。之后借助体视显微镜和解剖镜对样品中形态较完整、有明显外观特征以及不易被消化外壳的物种参照海洋生物分类学[13]和图鉴资料[14]进行初步鉴定。肉眼分辨不出的物种取其背部肌肉(避免鱼刺和鱼鳞),细分成0.2~0.5 g的肌肉样本保存于95%的酒精溶液中以备DNA鉴种,并取其左、右矢耳石用于拍照对比分析,后续进行DNA分析和耳石形态鉴定,尽可能分类到最低单元[15],从而得到2017年模型的食物组成矩阵(表 2)。其中,捕食者按列表示,被捕食者按行表示,数字代表不同的功能组,表中加粗数值已通过模型调整,每个捕食者的食物组成总和必须为1。
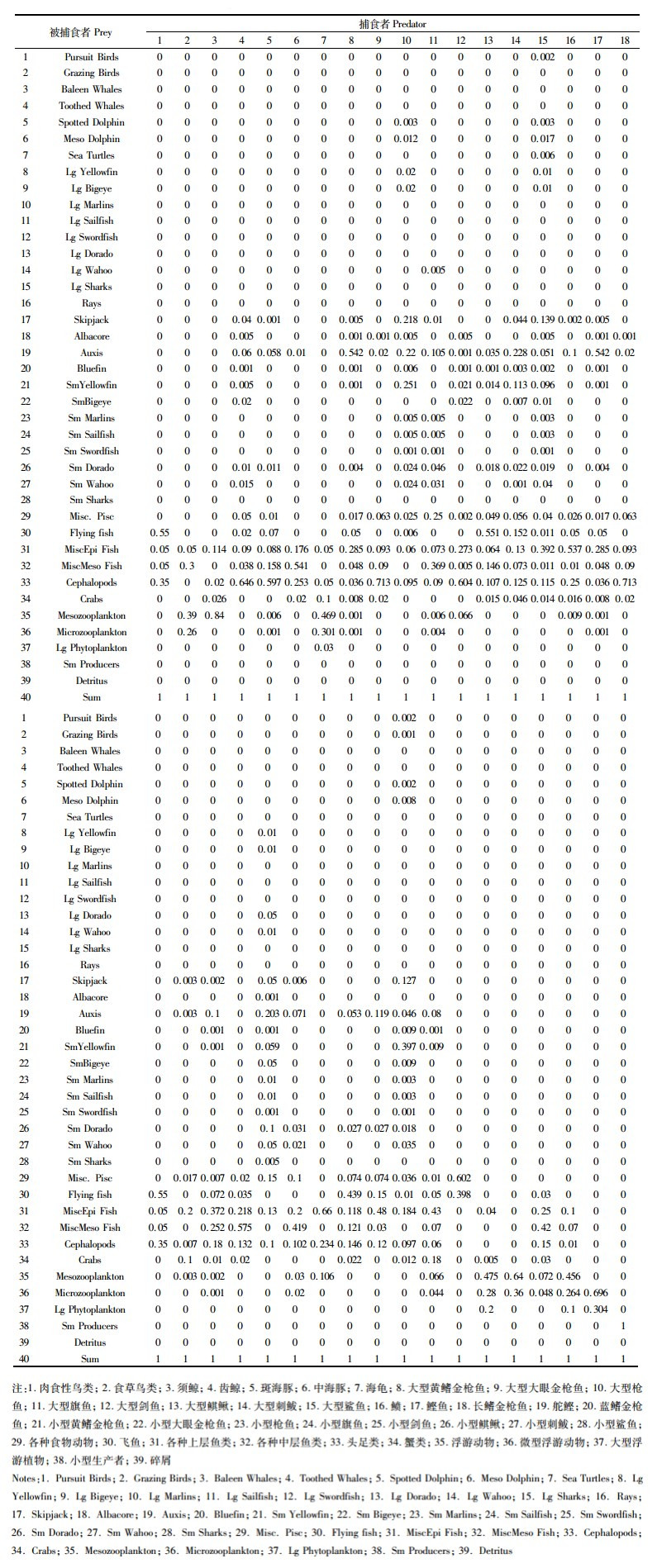
|
表 2 平衡后的东太平洋生态系统模型食物组成矩阵 Tab.2 Matrix of diet composition for the balanced Eastern Pacific Ocean ecosystem model |
通过Ecopath模型可以评估生态系统的恢复力、成熟度和稳定性属性[16],本文主要通过能量通道示意图、混合营养分析模块以及相对总影响与相对生物量的关系图来分析2017年模型的状态。Ecopath模型可以将生态系统中复杂的能量流动过程以能量通道图的方式简化(图 2)。生态系统中各个功能组之间存在直接或间接的捕食或竞争关系,在Ecopath模型中,可通过混合营养分析(图 3)来分析单个功能组对其他功能组的直接和间接影响[17]。根据模型中输出的各功能组相对生物量与相对总影响的数据,运用R语言进行处理得出两者的关系图(图 4),并以此确定该生态系统的关键种。
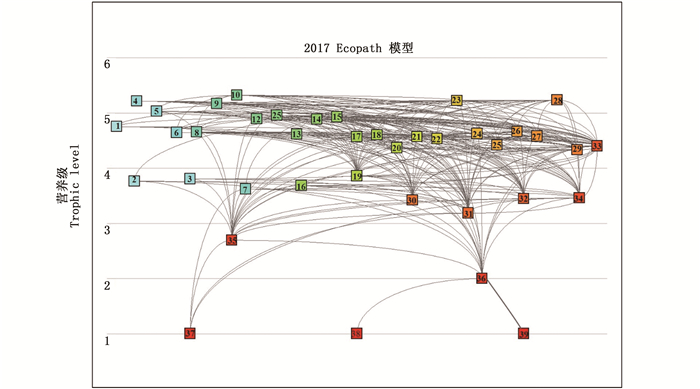
|
数字代表功能组 Number represents functional group 图 2 东太平洋生态系统2017年模型的能量通道示意图 Fig. 2 Energy flow diagram in the 2017 Ecopath Ecosystem model of the eastern Pacific Ocean |

|
空心方格表示该功能组生物量的增加对其他功能组生物量的增加起促进作用,实心方格表示起抑制作用,颜色的深浅表示影响的强弱 Positive impacts are shown in hollow squares, while negative impacts are shown in solid squares, and intensity of the color shows the strength of the impact 图 3 东太平洋生态系统混合营养关系图 Fig. 3 Mixed Trophic Impact in the eastern Pacific Ocean Ecopath model |

|
图 4 东太平洋Ecopath模型的相对总影响与相对生物量之间的关系 Fig. 4 Relationship between relative total impact and relative biomass for the eastern Pacific Ocean Ecopath model |
将全部参数输入模型之后,在通常情况下第一次运行时模型不平衡,即不满足热力学定律,必须修改参数值,直到平衡模型[18]。一般而言,当模型所有功能组的EE值都小于1时,认为模型处于平衡状态。然而,模型平衡是手动调节完成的,必须进行一致性检查。在本研究中,主要考虑了总效率(gross efficiency,GE)和营养级(trophic level,TL)两个检查指标。总效率被定义为生产量与消耗量(P/Q)之比[19]。通常来说,鱼类的P/Q值的范围是从0.05至0.15,而对于其他生物的P/Q值介于0.1~0.3,但对于生长速度较快的生物如细菌,P/Q值可能更高[20-21]。营养级表征生物功能和通过食物网的能量流动。在生态系统的食物网中,顶级捕食者是高等生物,其次是小型顶级捕食者和食鱼类生物。头足类动物和甲壳类动物是浮游生物与鱼类之间的联系,浮游植物与浮游动物和微生物之间的联系。
2 结果 2.1 一致性检查在本模型中,鱼类GE值的范围介于0.041(大型鲨鱼)到0.142(各种上层鱼类)之间,其他生物GE值范围介于0.238(微型浮游动物)到0.286(头足类),结果在合理范围内。营养级方面,较小的上层鱼类(飞鱼,TL 3.2)、头足类动物(TL 4.4)和中层鱼类(TL 3.4)是许多上层掠食者的主要饵料。小型鱼类和甲壳类动物捕食浮游动物群,食草微型浮游动物(TL 2)以生产者、浮游植物和细菌(TL 1)为食。营养级的范围介于1(碎屑和2个浮游植物群)到5.321(大个体枪鱼),与CHRISTENSEN等[22]总结的营养级范围基本吻合。
2.2 食物网结构和关键种分析 2.2.1 东太平洋生态系统食物网图 2是东太平洋生态系统能量通道的示意图,功能组之间的灰色连接表示各物种之间的捕食关系。从图 2可以看出,东太平洋生态系统的食物网较为复杂,营养流动主要包含2条途径:分别是以碎屑开始的碎屑食物链(功能组39)和从浮游植物(功能组37和38)开始的牧食食物链。其中,通过牧食链流入生态系统的能量占总能量流动的59%,而来源于碎屑链的比例为41%,表明该区域能量流动以牧食食物链传递为主。
2.2.2 混合营养效应(MTI)Ecopath模型可通过混合营养分析来计算生态系统各功能组之间的相互关系(图 3)。横纵坐标轴的数字(1~39)代表功能组标号(表 2),字母(A~E)代表不同的捕捞方式,本文主要考虑延绳钓(字母B)对于功能组的影响。从图 3可以看出:渔业捕捞(延绳钓)强度的增大和齿鲸(功能组4)的增加对众多功能组起消极作用,说明他们对整个生态系统的影响较大;碎屑、初级生产者、浮游植物和浮游动物以及底栖动物对多数功能组存在明显的正效应;高营养级功能群显示为负影响,表明具有相似生态位,相互间存在食物上的竞争。
2.2.3 关键种根据模型输出的相对生物量与相对总影响的数据并作其关系图(图 4),可以确定关键种。相对生物量越小,对生态系统的影响越大即为关键种。图中的数字代表功能组,圆的大小与各组的相对生物量成正比。图 4表明,东太平洋生态系统的关键种是齿鲸(功能组4),这与混合营养关系分析图中的结果一致。其余功能组,尽管相对总影响的值较低,但却是将能量从食物链底部传递至顶级食肉动物的重要节点,这些功能组包括微型浮游动物(功能组36)、小型生产者(功能组37)和小型生产者(功能组38)。
2.3 模型比较 2.3.1 2017年模型与1997年模型比较表 3为东太平洋生态系统两个模型的总体特征参数对比。2017年模型的系统总流量相较于1997年模型增加了8.5%,表明系统规模变大;2017年模型流向碎屑的总量为3.310×108 t/(km·a),1997年为3.079×108 t/(km·a),表明有更多的能量流向碎屑没有进入系统的再循环,即进入系统的再循环被沉积,不利于系统的利用。
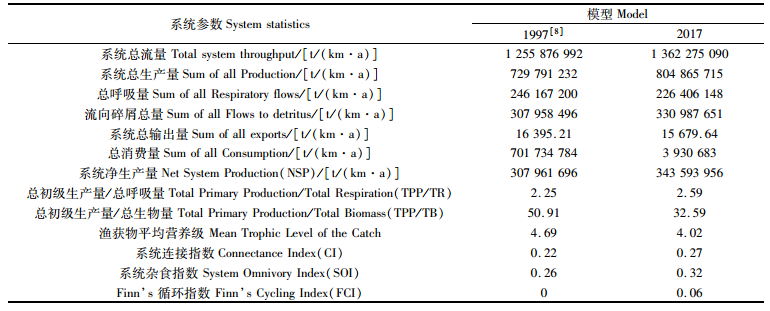
|
表 3 1997年模型和2017年模型生态系统总特征参数比较 Tab.3 Comparison of statistics for eastern Pacific Ocean Ecopath model between 1997 and 2017 |
2017年比1997年的总初级生产量/总呼吸量(total primary production/total respiration,TPP/TR)值降低了35.9%,但是仍然远大于1,表明该系统仍有大量能量剩余。另外,模型中系统净生产量(net system production,NSP)值都较高,说明生态系统仍有较高的剩余生产量有待利用。在系统的成熟度方面,2017年的系统连接指数(connectance index,CI)从0.22增加到0.27,系统杂食指数(system omnivoryindex, SOI)也增加了23.8%,表明各功能组之间食物网趋向复杂,生态系统的成熟度提高。2017年Finn’s循环指数(finn’scycling index,FCI)较高,但均小于0.1,表明该海域物质和能量再循环率较低,系统成熟度仍较低。
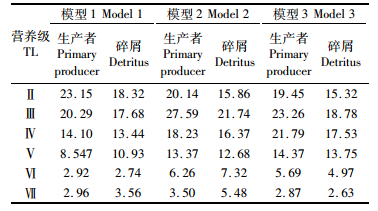
2.3.2 3个不同生物量比例的模型结果对比根据黄鳍和大眼金枪鱼大个体、小个体不同分割比例构建的3个模型中(表 5),均是第Ⅱ营养级转化效率最高,从营养级Ⅲ开始转化效率呈现递减的趋势,其中模型2的变化幅度最大。由此可见,低营养级间的能流转化效率相对较高,而高营养级间的能流转化效率相对较低。模型一的能量转换效率较低,主要发生在营养级Ⅰ和Ⅱ间,分别为23.15%和20.29%;营养级V的转换效率偏低,仅为2.92%。在模型2和模型3中,初级生产者到第Ⅱ营养级的转换效率分别为20.14%和19.45%,而碎屑到第Ⅱ营养级的转换效率为15.86%和15.32%,表明碎屑链的重要性略有降低。结果表明,两种主要金枪鱼不同大小个体的生物量比例变化对生态系统结构存在影响。根据生态金字塔能量转换的“十分之一定律”[23],3个模型的总体能量转换效率均达到最适程度。
|
表 4 3个东太平洋生态系统模型各营养级的转化效率 Tab.4 Comparison of transfer efficiency of discrete trophic levels in Eastern Pacific Ocean ecosystem in three models |
生态模型是分析和解决生态学问题的重要工具[24]。本文根据鱼类摄食数据以及渔业数据,通过构建Ecopath模型分析了2017年东太平洋生态系统的营养结构和能量流动,MTI的分析表明,东太平洋生态系统是一个受捕捞影响较为显著的海洋生态系统。渔业捕捞对大部分的鱼类功能组表现出负效应,即捕捞强度的增大,鱼类的生物量就会受到制约,这也解释了大多数鱼类功能群体的EE值偏高的原因。关键种是生态系统中生物量相对较少但在食物网中起结构性作用的物种,它的移除可导致生态系统发生根本的变化[25]。MTI(图 3)以及相对总影响与相对生物量之间的关系图(图 4)都表明了齿鲸是本生态系统中的关键种,其种群数量变化对其他物种生物丰度变化乃至整个生态系统变化起重要作用。TPP/TR的值大于1,说明系统中仍有较多的剩余能量未消耗[26-28]。
通过建立2017年东太平洋生态系统Ecopath模型,对比20年来东太平洋生态系统模型的总特征参数(表 3)可以发现,2017年生态系统的规模扩大。对比两个时期高营养级鱼类(金枪鱼)的生物量可以发现,黄鳍金枪鱼、蓝鳍金枪鱼以及大眼金枪鱼均存在不同程度的减少,下降幅度较大的是黄鳍金枪鱼,相比1997年减少了30.7%。这与PREIKSHOT等[29]在2013年的研究结果吻合,文中指出乔治亚海峡在1980—2010年间高营养级鱼类的生物量呈现出衰减的趋势,说明东太平洋与全球高营养级鱼类的衰退趋势情况基本相符。此外,渔获物营养级的变化也是东太平洋生态系统特征变化的重要表现,2003年渔获物的平均营养级是4.685,2017年减小了14.1%,这与PAULY等[30]认为渔获物平均营养级在捕捞影响下呈现下降趋势的结论一致,该研究综合全球渔业统计报告显示从1950年到1994年渔获物的平均营养级平均每10年下降0.05,该生态系统营养级降低很大程度上应该是环境因素和捕捞因素的共同作用结果[31-33]。
在生态系统的特征属性中,TPP/TR、TPP/TB与成熟度有关,在发育初期,TPP/TR的值远远超过1;随着生态系统的发育,呼吸量逐渐增大至接近生产量,TPP/TR逐渐减小直至接近1[34]。CHRISTENSEN等[22]通过比较41种不同的生态系统Ecopath模型,表明TPP/TR和TPP/TB可作为表征系统成熟度的指标。这与ODUM[16]的研究结果基本吻合,文中指出TPP/TR、系统净生产量(NSP)等是表征系统成熟度的重要指标。在成熟的生态系统中,系统没有多余的生产量再利用,TPP/TR值接近于1,NSP值接近于0,忍受外来侵扰的能力越强[35]。本文中两个模型的TPP/TR的值分别为2.251和2.593,表明系统抵抗外力干扰的能力较差,处于不稳定的状态。CI和SOI是表征生态系统中食物网联系复杂程度的指标,其值接近于1则系统越成熟更稳定[36],东太平洋两个阶段生态系统的CI值为0.218和0.272,这就表明该生态系统的营养关系较为简单,食物网的复杂程度偏低。FCI是表征生态系统生产率和再循环比率的指数。FCI的值介于0到0.1之间是低再循环率的早期开发阶段,FCI的值大于1表明系统处于高再循环率的成熟阶段[37-40],然而本文两个模型中的FCI值均小于0.1,表明东太平洋生态系统的再循环率较低。综上,现阶段东太平洋生态系统尚处于欠成熟的发展阶段,稳定性较低,生物资源种类组成较为简单。
过度捕捞对海洋生态系统具有负面影响,是引起系统受损的首要原因[41-43]。渔获量有两个主要属性,一是渔获的总量,二是渔获的体长(或年龄)组成。多数捕捞渔获量不按个体大小进行统计,而不同大小的个体在食物网中的作用往往不同。本文假设黄鳍和大眼金枪鱼这两个主要捕捞种类的大、小个体相对资源量统计存在不确定性,并考虑3个比例水平分别构建3个生态系统模型。结果表明,这一相对资源量统计误差,明显影响了我们对生态系统的认识。因此,在今后类似的研究中,应充分考虑主要捕捞种类不同体长组的营养结构及其对生态系统的影响。
| [1] |
PAULY D. On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fish stocks[J]. ICES Journal of Marine Science, 1980, 39(2): 175-192. DOI:10.1093/icesjms/39.2.175 |
| [2] |
马孟磊, 徐姗楠, 许友伟, 等. 基于Ecopath模型的胶州湾生态系统比较研究[J]. 中国水产科学, 2018, 25(2): 413-422. MA M L, XU S N, XU Y W, et al. Comparative study of Jiaozhou Bay ecosystem based on an Ecopath model[J]. Journal of Fishery Sciences of China, 2018, 25(2): 413-422. |
| [3] |
KELLING S, HOCHACHKA W M, FINK D, et al. Data-intensive science:a new paradigm for biodiversity studies[J]. BioScience, 2009, 59(7): 613-620. DOI:10.1525/bio.2009.59.7.12 |
| [4] |
MICHENER W K, JONES M B. Ecoinformatics:supporting ecology as a data-intensive science[J]. Trends in Ecology & Evolution, 2012, 27(2): 85-93. |
| [5] |
COLLÉTERM, VALLS A, GUITTONJ, et al. Globaloverview of the applications of the Ecopath with Ecosim modeling approach using theEcoBase models repository[J]. Ecological Modelling, 2015, 302: 42-53. DOI:10.1016/j.ecolmodel.2015.01.025 |
| [6] |
VASSLIDES J M, JENSEN O P. Quantitativevs. Semiquantitative ecosystem models:comparing alternate representations of an estuarine ecosystem[J]. Journal of Coastal Research, 2017, 78(s1): 287-296. |
| [7] |
LIRA A, ANGELINI R, LOCH F L, et al. Trophic flow structure of a neotropical estuary in northeastern Brazil and the comparison of ecosystem model indicators of estuaries[J]. Journal of Marine Systems, 2018, 182: 31-45. DOI:10.1016/j.jmarsys.2018.02.007 |
| [8] |
OLSON R J, WATTERS G M. A model of the pelagic ecosystem in the eastern tropical Pacific Ocean[J]. Inter-American Tropical Tuna Commission Bulletin, 2003, 22(3): 133-218. |
| [9] |
陈作志, 邱永松. 南海北部生态系统食物网结构、能量流动及系统特征[J]. 生态学报, 2010, 30(18): 4855-4865. CHEN Z Z, QIU Y S. Assessment of the food-web structure, energy flows, and system attribute of northern South China Sea ecosystem[J]. Acta Ecologica Sinica, 2010, 30(18): 4855-4865. |
| [10] |
GULLAND J J A. The fish resources of the ocean[M]. Surrey: Fishing News (Books) Ltd, 1971.
|
| [11] |
PALOMARES M L D, PAULY D. Predicting food consumption of fish populations as functions of mortality, food type, morphometrics, temperature and salinity[J]. Marine and Freshwater Research, 1998, 49(5): 447-453. DOI:10.1071/MF98015 |
| [12] |
PAULY D, SORIANO-BARTZ M L, PALOMARES M L D. Improved construction, parametrization and interpretation of steady-state ecosystem models[M]//CHRISTENSEN V, PAULY D. Trophic Models of Aquatic Ecosystems.Manila: ICLARM Conference Proceeding, 1993: 1-13.
|
| [13] |
成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987. CHENG Q T, ZHENG B S. Chinese fish system search[M]. Beijing: Science Press, 1987. |
| [14] |
戴小杰, 许柳雄. 世界金枪鱼渔业渔获物物种原色图鉴[M]. 北京: 海洋出版社, 2007. DAI X J, XU L X. Illustrated handbook of World tuna fishery catch species[M]. Beijing: China Ocean Press, 2007. |
| [15] |
朱国平, 许柳雄, 周应祺, 等. 印度洋中西部和大西洋西部水域大眼金枪鱼的食性比较[J]. 生态学报, 2007, 27(1): 135-141. ZHU G P, XU L X, ZHOU Y Q, et al. A comparative study of feeding behavior of Thunnusobesusin the west-central Indian Ocean and the western Atlantic Ocean[J]. Acta Ecologica Sinica, 2007, 27(1): 135-141. DOI:10.3321/j.issn:1000-0933.2007.01.016 |
| [16] |
ODUM E P. The strategy of ecosystem development[J]. Science, 1969, 164(3877): 262-270. DOI:10.1126/science.164.3877.262 |
| [17] |
ULANOWICZ R E, PUCCIA C J. Mixed trophic impacts in ecosystems[J]. Coenoses, 1990, 5: 7-16. |
| [18] |
CHRISTENSEN V, WALTERS C J. Ecopath with Ecosim:methods, capabilities and limitations[J]. Ecological Modelling, 2004, 172(2/4): 109-139. |
| [19] |
徐超, 王思凯, 赵峰, 等. 基于Ecopath模型的长江口生态系统营养结构和能量流动研究[J]. 海洋渔业, 2018, 40(3): 309-318. XU C, WANG S K, ZHAO F, et al. Trophic structure and energy flow of the Yangtze Estuary ecosystem based on the analysis with Ecopath model[J]. Marine Fisheries, 2018, 40(3): 309-318. DOI:10.3969/j.issn.1004-2490.2018.03.006 |
| [20] |
MENDOZA J J. A preliminary biomass budget for the Northeastern Venezuela shelf ecosystem[M]//CHRISTENSEN V, PAULY D.Trophic Models of Aquatic Ecosystems.Manila: ICLARM Conference Proceeding, 1993, 26: 285-297.
|
| [21] |
PALOHEIMO J E, DICKIE L M. Food and growth of fishes:Ⅲ. Relations among food, body size, and growth efficiency[J]. Journal of the Fisheries Research Board of Canada, 1966, 23(8): 1209-1248. DOI:10.1139/f66-111 |
| [22] |
CHRISTENSEN V, PAULY D. Trophic models of aquatic ecosystems[M]. Manila: International Center for Living Aquatic Resources Management, 1993.
|
| [23] |
LINDEMAN R L. The trophic-dynamic aspect of ecology[J]. Bulletin of Mathematical Biology, 1991, 53(1/2): 167-191. |
| [24] |
李云凯, 刘恩生, 王辉, 等. 基于Ecopath模型的太湖生态系统结构与功能分析[J]. 应用生态学报, 2014, 25(7): 2033-2040. LI Y K, LIU E S, WANG H, et al. Analysis on the ecosystem structure and function of Lake Taihu based on Ecopath model[J]. Chinese Journal of Applied Ecology, 2014, 25(7): 2033-2040. |
| [25] |
PAINE R T. A note on trophic complexity and community stability[J]. The American Naturalist, 1969, 103(929): 91-93. DOI:10.1086/282586 |
| [26] |
杨林林, 姜亚洲, 袁兴伟, 等. 象山港生态系统结构与功能的Ecopath模型评价[J]. 海洋渔业, 2015, 37(5): 399-408. YANG L L, JIANG Y Z, YUAN X W, et al. Evaluation on the ecosystem structure and function of Xiangshan Bay based on Ecopath model[J]. Marine Fisheries, 2015, 37(5): 399-408. DOI:10.3969/j.issn.1004-2490.2015.05.002 |
| [27] |
FIELD J C, FRANCIS R C, AYDIN K. Top-down modeling and bottom-up dynamics:linking a fisheries-based ecosystem model with climate hypotheses in the Northern California Current[J]. Progress in Oceanography, 2006, 68(2/4): 238-270. |
| [28] |
VIANA A P, LUCENA-FRÉDOU F, MÉNARDF, et al. Length-weight relations of 70 fish species (Actinopterygii) from tropical coastal region of Pernambuco, Northeast Brazil[J]. Acta Ichthyologicaet Piscatoria, 2016, 46(3): 271-277. DOI:10.3750/AIP2016.46.3.12 |
| [29] |
PREIKSHOT D, BEAMISH R J, NEVILLE C M. A dynamic modeldescribing ecosystem-level changes in the Strait of Georgiafrom 1960 to 2010[J]. Progress in Oceanography, 2013, 115: 28-40. DOI:10.1016/j.pocean.2013.05.020 |
| [30] |
PAULY D, CHRISTENSEN V, DALSGAARD J, et al. Fishing down marine food webs[J]. Science, 1998, 279(5352): 860-863. DOI:10.1126/science.279.5352.860 |
| [31] |
FINNEY B P, GREGORY-EAVESI, DOUGLAS M S V, et al. Fisheries productivity in the north eastern Pacific Ocean over the past 2, 200 years[J]. Nature, 2002, 416(6882): 729-733. DOI:10.1038/416729a |
| [32] |
WASSERMAN R J, NOYON M, AVERY T S, et al. Trophic level stability-inducing effects of predaceous early juvenile fish in an estuarine mesocosmstudy[J]. PLoS One, 2013, 8(4): e61019. DOI:10.1371/journal.pone.0061019 |
| [33] |
LIBRALATO S, CHRISTENSEN V, PAULY D. A method for identifying keystone species in food web models[J]. Ecological Modelling, 2006, 195(3/4): 153-171. |
| [34] |
王晓红, 李适宇, 彭人勇. 南海北部大陆架海洋生态系统演变的Ecopath模型比较分析[J]. 海洋环境科学, 2009, 28(3): 288-292. WANG X H, LI S Y, PENG R Y. Establishment and comparative analysis of Ecopath model of ecosystem evolvement in northern continental shelf of South China Sea[J]. Marine Environmental Science, 2009, 28(3): 288-292. DOI:10.3969/j.issn.1007-6336.2009.03.014 |
| [35] |
SHANNON L J, MOLONEY C L. An ecosystem framework for fisheries management in the southern Benguela upwelling system[J]. African Journal of Marine Science, 2004, 26(1): 63-77. DOI:10.2989/18142320409504050 |
| [36] |
马孟磊, 陈作志, 许友伟, 等. 基于Ecopath模型的胶州湾生态系统结构和能量流动分析[J]. 生态学杂志, 2018, 37(2): 462-470. MA M L, CHEN Z Z, XU Y W, et al. Analysis of structure and energy flow in Jiaozhou Bay ecosystem based on Ecopathmodel[J]. Chinese Journal of Ecology, 2018, 37(2): 462-470. |
| [37] |
COLL M, LIBRALATO S. Contributions of food web modelling to the ecosystem approach to marine resource management in the Mediterranean Sea[J]. Fish and Fisheries, 2012, 13(1): 60-88. DOI:10.1111/j.1467-2979.2011.00420.x |
| [38] |
CORRALES X, COLL M, TECCHIO S, et al. Ecosystem structure and fishing impacts in the northwestern Mediterranean Sea using a food web model within a comparative approach[J]. Journal of Marine Systems, 2015, 148: 183-199. DOI:10.1016/j.jmarsys.2015.03.006 |
| [39] |
ANGELINI R, ALOISIO G R, CARVALHO A R. Mixed food web control and stability in a Cerrado river (Brazil)[J]. Pan-American Journal of Aquatic Sciences, 2010, 5(3): 421-431. |
| [40] |
JACKSON J B C, KIRBY M X, BERGERW H, et al. Historical overfishing and the recent collapse of coastal ecosystems[J]. Science, 2001, 293(5530): 629-637. DOI:10.1126/science.1059199 |
| [41] |
ARONSON J, FLORET C, LE FLOCH E, et al. Restoration and rehabilitation of degraded ecosystems in arid and semi-arid lands. Ⅰ. A view from the south[J]. Restoration Ecology, 1993, 1(1): 8-17. |
| [42] |
OKEY T A, PAULY D, ALLEN J, et al. Trophic mass-balance model of Alaska's prince William sound ecosystem, for the post-spill period 1994-1996[J]. Fisheries Centre Research Reports, 1998, 7: 1198-6727. |
| [43] |
TAM J, TAYLOR M H, BLASKOVIC V, et al. Trophic modeling of the northern Humboldt Current Ecosystem, Part Ⅰ:comparing trophic linkages under La Niña and El Niño conditions[J]. Progress in Oceanography, 2008, 79(2/4): 352-365. |
2. Key Laboratory of Oceanic Fisheries Exploitation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
3. College of Marine Ecology and Environment, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


