2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 水域环境生态上海高校工程研究中心, 上海 201306
大黄鱼(Larimichthys crocea)是我国四大海水经济鱼类之一,有“海水国鱼”美名之称,其肉质鲜嫩,味道鲜美,营养丰富,深受人们喜爱[1]。20世纪80年代,我国大黄鱼人工繁殖取得成功,大黄鱼产业由原来海洋捕捞进入人工养殖时代,并且是我国海水网箱养殖单一产量最高的鱼类,已被农业部确定为我国6种最具优势出口水产品之一[2]。目前,我国大黄鱼全年养殖总产量已达到20万t(鲜重),主要养殖集中在福建宁德和浙江象山港,其中福建宁德养殖产量占全国70%[3]。大黄鱼养殖海域适宜盐度范围一般为10~40[4]。
然而,由于我国大黄鱼养殖主要为海湾粗放型投饵养殖模式,大部分为冰鲜杂鱼投喂,颗粒饵料投喂比例不到30%。依照颗粒饵料和冰鲜饵料投喂3: 7比例计算,我国每年养殖20万t大黄鱼大约需要使用100万t冰鲜饵料。即每年有近80万t冰鲜饵料未被利用而进入养殖海域,有机质污染巨大,并可进一步引起海湾富营养化加剧、赤潮爆发,甚至发生流行传染病[5]。福建霞浦白沙角、福鼎区域曾爆发过毁灭性寄生虫病,并导致区域养殖全军覆没[6]。2018年4月,福建宁德蕉城、福鼎、霞浦等大黄鱼主养区又暴发了严重病害,部分海区死亡率达到50%。可见这种传统养殖模式急需新的生态养殖技术替代。
多营养层次综合养殖(integrated multi-trophic aquaculture, IMTA)作为一种可持续的养殖方式已经得到了国内外广泛的关注[7-9]。在IMTA生态养殖系统中,深水网箱养殖的鱼类通过饵料喂养,部分漏食的大颗粒饵料沉降至底部可以被底部养殖的海参或沙蚕等底栖生物吞食清除,部分漏食的微小颗粒则被周边养殖的贝类滤食摄入,而残饵及鱼类粪便等可溶性的氮磷等无机营养物质被周边养殖的大型海藻或水生植物吸收同化,并且大型海藻或水生植物吸收动物排放出来的CO2,并通过光合作用释放O2,提高水中溶解氧,极大改善了水质,有效地降低了养殖区域富营养化风险,并为养殖鱼类、贝类等经济动物提供了良好生境[10]。且滤食性动物可以将水体中的残饵和粪便再次利用,从而提高饵料的利用率,减少养殖过程中污染物的排放[11]。使系统内物质得到循环利用,在减轻养殖对环境压力的同时,提高养殖品种的多样性和经济效益,促进养殖产业的健康发展。我国双沟湾IMTA生态养殖系统已世界闻名,每年产出5万t贝类,8万t海带,2003—2004年桑沟湾的总服务价值为6.07×108元[12-13]。
本实验针对杭州湾海域特殊的环境条件,建立了低盐度环境下的IMTA生态养殖系统,并试图在低盐度海域及优质海水中养殖大黄鱼,为上海近海养殖高品质大黄鱼奠定基础。
1 材料与方法 1.1 主要海洋生物养殖种类穗花狐尾藻(Myriophyllum spicatum)和近江牡蛎(Crassostrea rivularis)在上海金山近岸湿地采集。大黄鱼(Larimichthys crocea)共100尾,规格为(575.32±9.86)g,由宁波市象山港水产引种育种有限公司提供。
1.2 IMTA养殖海区选择养殖海区选为杭州湾北部金山海域,该海域与东海长江相邻,由大坝围成封闭性海域,面积为1.19 km2,盐度为5~6,水温为12.1~28.3 ℃。
1.3 IMTA生态养殖系统建立 1.3.1 鱼类养殖装置与方法深水网箱为青岛启航网箱工程技术有限公司制造和提供,为圆形PVC管框架,直径为13 m,衣网深度7 m,材质为PE无结网,网目大小为2.5 cm。
2016年8月,采用活鱼运输车将象山港深水网箱养殖系统养殖的大黄鱼成鱼100尾经过5 h长途运输至上海金山城市沙滩封闭海域,并立即投放于深水网箱海水中。采用藻-贝-鱼IMTA生态养殖模式,养殖过程中每天投喂配合饲料(水分、粗蛋白、粗脂肪和粗灰分的含量分别为10.64%、40.15%、15.68%、14.37%)3次,每天投喂量为鱼体总质量的3%。养殖3个月后随机捕捞10尾杭州湾生态养殖的大黄鱼,平均体质量为(661.2±11.76)g,平均体长为(32.6±2.38)cm,放入带有冰块的泡沫箱中运回实验室进行检测分析。
1.3.2 贝类养殖装置与方法使用维尼纶绳的网片作为牡蛎生长的附着基,待到长出幼苗后,将网片移至修复区域继续养殖,牡蛎有效养殖网片面积为400 m×0.5 m,生态修复期间贝类的平均特定增长率为4.89%。
1.3.3 水生植物养殖装置与方法采用直径为3~4 mm维尼纶绳编织为大小2.0 m×2.5 m养殖网帘,网帘网目大小为15 cm,将穗花狐尾藻绑均匀捆在网帘上,密度为0.5 kg/m2,采用网床悬挂养殖方式,共养殖300张网帘,穗花狐尾藻养殖藻总重量为5 t。生态修复期间平均特定增长率为6.23%。
1.4 水样采集与分析试验期间每个月进行水样采集,采样后低温条件下迅速运往实验室进行分析,样品中硝态氮、亚硝态氮、铵态氮、磷酸盐和化学需氧量(COD)的含量均按照GB 17378.4—2007标准进行分析。
1.5 大黄鱼样品处理随机对生态养殖与非生态养殖的各10尾大黄鱼进行体长和体质量的测量,然后解剖去除鳞片,称量内脏和肝脏的重量,取侧线以上白肌,用冷冻干燥机将其冷冻干燥72 h,粉碎放入4 ℃冰箱保存待测,并记录干燥前后的质量。
1.6 大黄鱼生长率和形态学指标检测大黄鱼的特定生长率(SGR)、肥满度(K)、脏体指数(VSI)和肝体指数(HSI)根据下列公式进行计算。
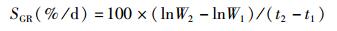 (1)
(1)
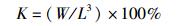 (2)
(2)
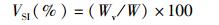 (3)
(3)
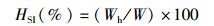 (4)
(4)
式中:SGR为特定生长率;K为肥满度;VSI为脏体指数;HSI为肝体指数;W1和W2分别表示在t1和t2时大黄鱼的质量,g;,W表示鱼体的总质量,g;L表示鱼的体长,cm;Wv表示鱼的内脏质量,g;Wh表示鱼的肝脏质量,g。
1.7 大黄鱼中营养成分分析大黄鱼肌肉中水分、粗蛋白、粗脂肪和粗灰分含量分别采用冷冻干燥法、凯氏定氮法、索氏抽提法和马弗炉灼烧法测定[14]。
大黄鱼氨基酸组成分析根据国标(GB/T 5009.124—2003),采用酸水解法,测定16种氨基酸。将50 mg的肌肉干样和10 mL 6 mol/L的盐酸混合,放入液氮中冷冻,用真空泵抽至真空,然后将真空的水解管封口放入110 ℃烘箱中水解22 h。冷却后将水解液过滤并定容至50 mL,取1 mL定容后的溶液加入少量水放入真空干燥器进行干燥,重复干燥1~2次,最后蒸干,加入pH 2.2的缓冲液溶解,过滤离心,取上清液使用氨基酸自动分析仪(型号:Biochrom 30, 产地:英国)进行检测分析。由于酸水解过程中会破坏色氨酸的结构,因此本实验未能测得色氨酸的数据。
大黄鱼脂肪酸组成分析按国标(GB/T 22223—2008)的方法,使用乙醚石油醚提取肌肉干样中的脂肪,而后加入8 mL 2%的氢氧化钠溶液放入80 ℃的水浴中进行冷凝回流,待油滴消失后加入7 mL 15%的三氟化硼甲醇溶液,继续回流2 min。待冷却后加入10 mL正庚烷和饱和的氯化钠溶液,静置分层后吸取上层提取液5 mL至30 mL试管中,加入3 g无水硫酸钠振荡后静置5 min取上清液使用气相色谱仪(型号:Agilent 6890,产地:美国)进行测定。
1.8 数据统计与分析使用SPSS 21.0对数据进行t检验,数据以平均值±标准差(mean±SD)表示。当P < 0.05表示差异显著。
2 结果 2.1 杭州湾低盐度封闭海域生态修复效果针对该海域低盐度特征,特筛选出穗花狐尾藻和近江牡蛎对该海域水体进行生态修复。经过6个月(3—9月)生态修复后,水质由原来Ⅳ类提高到Ⅰ~Ⅱ类,透明度由原来0.6 m提高到0.9 m,硝态氮、亚硝态氮、铵态氮、磷酸盐和COD平均浓度分别下降58.82 %和37.50 %、55.32 %、53.85 %和45.18 %(表 1),富营养化程度从中度富营养化降到贫营养水平。
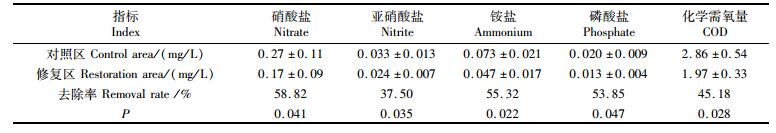
|
表 1 生态修复前后营养盐的平均浓度变化情况 Tab.1 Changes in the average concentration of nutrients before and after ecological restoration |
养殖过程中使用配合饵料进行投喂,大黄鱼在生态养殖过程成活率达到94%,最大特定生长率为(0.22%±0.018%)/d(表 2),非生态养殖大黄鱼的成活率为67%,特定增长率为(0.31%±0.024%)/d。
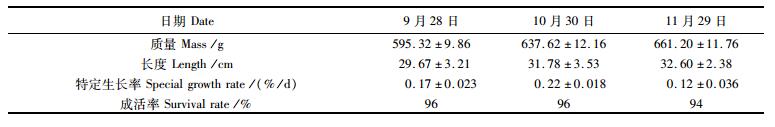
|
表 2 生态养殖大黄鱼成活率和特定生长率 Tab.2 Survival and specific growth rate of ecological farmed large yellow croaker |
表 3数据显示生态养殖的大黄鱼肥满度、脏体指数和肝体指数含量分别为1.82±0.25、3.18 %±0.22 %和1.36 %±0.32%,均显著低于非生态养殖的大黄鱼13.7%、24.5 %、25.7 %(P < 0.05)。
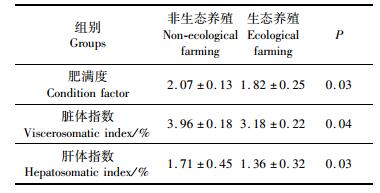
|
表 3 两组大黄鱼的形态学指标 Tab.3 Morphological indices of yellow large croaker in two groups |
由表 4可知,生态养殖大黄鱼肌肉中水分及粗灰分含量均显著地高于非生态养殖的大黄鱼(P<0.05),粗蛋白的含量极显著地高于非生态的大黄鱼(P<0.01),而粗脂肪的含量显著地低于非生态的大黄鱼(P<0.05),表明利用IMTA的方式进行生态养殖,在相同的质量下可以获得更多的粗蛋白和更少的粗脂肪。
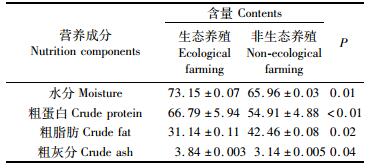
|
表 4 生态养殖和非生态养殖大黄鱼肌肉中常规营养成分分析(%干重) Tab.4 Comparision of nutrient composition of muscles of ecological farmed and non-ecological farmed large yellow croaker(% dry weight) |
由表 5可知,生态养殖大黄鱼肌肉中氨基酸总量显著高于单养大黄鱼,其中生态养殖的大黄鱼必需氨基酸的缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、苏氨酸(Thr)、苯丙氨酸(Phe)和赖氨酸(Lys)含量均显著高于非生态养殖大黄鱼的20.7%、36.0%、22.1%、20.5%、20.1%、25.2%和18.2%,说明生态养殖较非生态养殖条件下的大黄鱼具有更高的营养价值。两组大黄鱼的呈味氨基酸谷氨酸、精氨酸、丙氨酸和甘氨酸差异均不显著,只有生态养殖大黄鱼的天冬氨酸显著高于非生态养殖大黄鱼,且生态养殖与非生态养殖大黄鱼肌肉中呈味氨基酸总量差异不显著,表明在生态养殖和非生态养殖大黄鱼在鲜美程度上几乎没有差别。
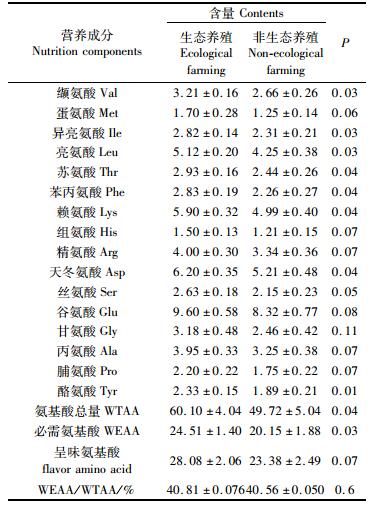
|
表 5 生态养殖与非生态养殖大黄鱼肌肉中氨基酸含量(%干重) Tab.5 Amino acid composition of muscles of ecological farmed and non-ecological farmed large yellow croaker(% dry weight) |
由表 6可知生态养殖和非生态养殖大黄鱼肌肉均检测到以下3类脂肪酸,包括饱和脂肪酸(SFA)10种,单不饱和脂肪酸(MUFA)7种和多不饱和脂肪酸(PUFA)8种。其中生态养殖大黄鱼的C20:1n9、C18:3n3和C22:1n9显著高于非生态养殖大黄鱼,而C20:2显著低于非生态养殖大黄鱼,其他脂肪酸相对含量均无显著差异。
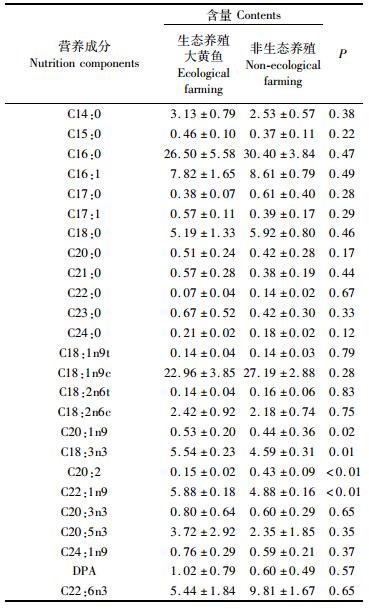
|
表 6 生态养殖与非生态养殖大黄鱼肌肉中脂肪酸相对含量(%干重) Tab.6 Fatty acid relative content of muscles of ecological farming and non-ecological farmed yellow large croaker(% dry weight) |
肝脏是鱼类解毒和代谢的重要器官,也是脂肪代谢的主要器官[15]。亚硝酸盐可结合血液中的血红蛋白,形成高铁血红蛋白,从而使血红蛋白失去携氧气能力,当达到一定浓度时甚至会导致养殖生物组织缺氧、神经麻痹、甚至窒息死亡[16-17]。氨氮含量过高会造成鱼的鳃丝扭曲、鳃上皮增生、鳃丝粘连,同时肝组织变得松软、易破碎,肝实质细胞的细胞质明显减少,甚至有空泡化的出现[18]。本研究结果显示,非生态养殖大黄鱼肌肉中脂肪的蓄积程度与脏体指数、肝体指数呈正相关,且均显著高于生态养殖模式下的大黄鱼,随着鱼体中脂肪的含量增加,脏体指数和肝体指数也随之增加,这与黄春红等[19]的研究结果相似。在非生态养殖模式下,养殖产生的废物会在养殖区域大量堆积,这些废物通过微生物的分解和有机氮的矿化、降解作用产生NH4-N,在O2的参与下NH4-N经过硝化作用转化为NO2-N并进一步氧化为NO3-N,随着养殖活动的不断进行,水中NH4-N和NO2-N会不断积累,大黄鱼长期处于这种状态会降低鱼体内酶的活性,影响正常的生长和代谢活动,抑制免疫系统的功能,进而增加患病的风险[20-21]。
3.2 生态养殖对环境和生物的影响利用IMTA系统进行生态养殖,可以增加水体中的溶氧量,调节pH,降低水体中亚硝态氮和氨氮的含量,调节水体中的氮磷含量比例,增加水体中浮游生物的数量,丰富水产动物的饵料结构[22-23],为鱼类提供良好的生长环境,因此或能加强鱼类的活动能力、代谢能力和脂肪的氧化供能,减少脂肪的积累,减轻肝脏的代谢负担,并提高鱼类对饵料的利用率和蛋白质在机体中的沉积。通过生态养殖,有效地增加了大黄鱼肌肉中粗蛋白、灰分和水分的含量,而且增加了必需氨基酸缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、苏氨酸(Thr)、苯丙氨酸(Phe)和赖氨酸(Lys)的含量,同时降低了大黄鱼肌肉中脂肪的积累,表明不同的养殖模式并未改变大黄鱼体内的脂肪酸组成情况。非生态养殖大黄鱼粗脂肪含量高可能是由于肥胖原因导致的,大黄鱼的生活环境和运动状况是影响其脂肪酸组成的主要因素[24]。
3.3 低盐度养殖的应用前景我国虽然有辽阔的海域面积,但海水养殖一般分布在受风浪影响较小的内湾,养殖空间严重不足[25]。探索低盐度下名贵鱼种(大黄鱼)的养殖技术,有助于充分利用河口地区的水域资源。同时,低盐度生态养殖技术应用于路基IMTA工厂化养殖,高盐度的海水稀释后,海水的富营养化程度也随之降低,减轻了富营养化对水产生物造成的影响,结合IMTA生态养殖技术,可以达到降低养殖成本,收获更多的产物,提高水产品的品质,减少污染物的排放,循环用水的目的,为提高养殖水产品的营养价值提供了基础资料和理论依据,促进了水产养殖业的可持续发展,具有广阔的应用前景。
| [1] |
马睿.营养与养殖大黄鱼品质之间关系的初步研究[D].青岛: 中国海洋大学, 2014. MA R. Preliminary study on relationship between nutrition and fish quality of farmed large yellow croaker (Pseudosciaena crocea)[D]. Qingdao: Ocean University of China, 2014. |
| [2] |
福建省科学技术厅. 大黄鱼养殖[M]. 北京: 海洋出版社, 2004. Fujian Provincial Science and Technology Department. Breeding and farming of Pseudosciaena crocea[M]. Beijing: China Ocean Press, 2004. |
| [3] |
胡云华. 2017福建宁德大黄鱼市场调查报告[J]. 广东饲料, 2018, 27(4): 13-15. HU Y H. 2017 market survey of Ningde Pseudosciaenacrocea in Fujian[J]. Guangdong Feed, 2018, 27(4): 13-15. |
| [4] |
李兵.大黄鱼室内低盐养殖的初步研究[D].上海: 上海海洋大学, 2012. LI B. The indoor low sanility culture of Pseudosciaena crocea[D]. Shanghai: Shanghai Ocean University, 2012. |
| [5] |
PARK H J, HAN E, LEE W C, et al. Trophic structure in a pilot system for the integrated multi-trophic aquaculture off the east coast of Korean peninsula as determined by stable isotopes[J]. Marine Pollution Bulletin, 2015, 95(1): 207-214. |
| [6] |
孙志宇, 郑昌峰, 武晓燕, 等. 福建霞浦海区刺激隐核虫虫株鉴定及生活史观察[J]. 福建师范大学学报(自然科学版), 2011, 27(2): 101-108. SUN Z Y, ZHENG C F, WU X Y, et al. The strain and life-cycle of Cryptocaryon irritans isolated from Pseudosciaena crocea cultured in Xiapu, Fujian[J]. Journal of Fujian Normal University (Natural Science Edition), 2011, 27(2): 101-108. |
| [7] |
SCHUENHOFF A, SHPIGEL M, LUPATSCH I, et al. A semi-recirculating, integrated system for the culture of fish and seaweed[J]. Aquaculture, 2003, 221(1/4): 167-181. |
| [8] |
ZHOU Y, YANG H S, HU H Y, et al. Bioremediation potential of the macroalga Gracilaria lemaneiformis(Rhodophyta) integrated into fed fish culture in coastal waters of north China[J]. Aquaculture, 2006, 252(2/4): 264-276. |
| [9] |
TROELL M, RÖNNBÄCK P, HALLING C, et al. Ecological engineering in aquaculture:use of seaweeds for removing nutrients from intensive marsiculture[J]. Journal of Applied Phycology, 1999, 11(1): 89-97. |
| [10] |
MAO Y Z, YANG H S, ZHOU Y, et al. Potential of the seaweed Gracilaria lemaneiformis for integrated multi-trophic aquaculture with scallop Chlamys farreri in North China[J]. Journal of Applied Phycology, 2009, 21(6): 649. |
| [11] |
FERREIRA J G, HAWKINS A J S, MONTEIRO P, et al. Integrated assessment of ecosystem-scale carrying capacity in shellfish growing areas[J]. Aquaculture, 2008, 275(1/4): 138-151. |
| [12] |
王晓敏.桑沟湾多营养级综合养殖模式下浮游植物群落结构研究[D].广州: 暨南大学, 2017. WANG X M. Studies on phytoplankton community under integrated multi-trophic aquaculture modes in Sanggou Bay[D]. Guangzhou: Ji'nan University, 2017. |
| [13] |
张朝晖.桑沟湾海洋生态系统服务价值评估[D].青岛: 中国海洋大学, 2007. ZHANG C H. The valuation of marine ecosystem services in Sanggou Bay[D]. Qingdao: Ocean University of China, 2007. |
| [14] |
李德发. 现代饲料生产[M]. 北京: 中国农业大学出版社, 1997. LI D F. Modern feed production[M]. Beijing: China Agriculture Press, 1997. |
| [15] |
CHATZIFOTIS S, PANAGIOTIDOU M, PAPAIOANNOU N, et al. Effect of dietary lipid levels on growth, feed utilization, body composition and serum metabolites of meagre (Argyrosomus regius) juveniles[J]. Aquaculture, 2010, 307(1/2): 65-70. |
| [16] |
余瑞兰, 聂湘平. 分子氨和亚硝酸盐对鱼类的危害及其对策[J]. 中国水产科学, 1999, 6(3): 73-77. YU R L, NIE X P. Toxicity of molecular ammonia&nitrite to fishes and the control measures[J]. Journal of Fishery Sciences of China, 1999, 6(3): 73-77. |
| [17] |
王明学, 吴卫东. NO2--N对鱼类毒性的研究概况[J]. 中国水产科学, 1997, 4(5): 85-90. WANG M X, WU W D. A survey of research on the effect of nitrite toxicity on fish[J]. Journal of Fishery Sciences of China, 1997, 4(5): 85-90. |
| [18] |
洪磊, 张秀梅. 环境胁迫对鱼类生理机能的影响[J]. 海洋科学进展, 2004, 22(1): 114-121. HONG L, ZHANG X M. Effects of environmental stress on physiological function of fish[J]. Advances in Marine Science, 2004, 22(1): 114-121. |
| [19] |
黄春红, 曾斌, 陆东东, 等. 生物学指标在评定养殖鲫肝脏脂肪蓄积程度中的作用[J]. 水产学报, 2015, 39(1): 108-117. HUANG C H, ZENG B, LU D D, et al. Functions of body indices in evaluating the degree of lipid accumulation in livers of cultured Carassius auratus[J]. Journal of Fisheries of China, 2015, 39(1): 108-117. |
| [20] |
董双林, 潘克厚, BROCKMANN U. 海水养殖对沿岸生态环境影响的研究进展[J]. 青岛海洋大学学报, 2000, 30(4): 575-582. DONG S L, PAN K H, BROCKMANN U. Review on effects of mariculture on coastal environment[J]. Journal of Ocean University of Qingdao, 2000, 30(4): 575-582. |
| [21] |
王文博, 李爱华. 环境胁迫对鱼类免疫系统影响的研究概况[J]. 水产学报, 2002, 26(4): 368-374. WANG W B, LI A H. The effect of environmental stress to fish immune system[J]. Journal of Fisheries of China, 2002, 26(4): 368-374. |
| [22] |
何培民, 刘媛媛, 张建伟, 等. 大型海藻碳汇效应研究进展[J]. 中国水产科学, 2015, 22(3): 588-595. HE P M, LIU Y Y, ZHANG J W, et al. Research progress on the effects of Macroalgae on carbon sink[J]. Journal of Fishery Sciences of China, 2015, 22(3): 588-595. |
| [23] |
李百安.大黄鱼(Pseudosciaena crocea)、罗非鱼(Oreochramis miloticas×O. aureus)的肌肉品质研究[D].上海: 上海海洋大学, 2016. LI B A. Study on flesh quality of large yellow croaker (Pseudosciaena crocea) and tilapia (Oreochramis niloticas×O. aureus)[D]. Shanghai: Shanghai Ocean University, 2016. |
| [24] |
徐继林, 严小军, 罗瑜萍, 等. 岱衢族野生大黄鱼与养殖大黄鱼肌肉脂类和脂肪酸组成的比较研究[J]. 中国食品学报, 2008, 8(1): 108-114. XU J L, YAN X J, LUO Y P, et al. Comparison of lipids and fatty acids composition in muscle between wild and farmed Pseudosciaena crocea from Tai-chu race[J]. Journal of Chinese Institute of Food Science and Technology, 2008, 8(1): 108-114. |
| [25] |
高广斌, 耿红卫, 邹积波, 等. 大连沿海网箱养殖现状及存在的问题[J]. 中国水产, 2006, 369(8): 13. GAO G B, GENG H W, ZOU J B, et al. Current situation and problems of cage culture in Dalian coastal area[J]. China Fisheries, 2006, 369(8): 13. |
2. College of Life and Fisheries, Shanghai Ocean University, Shanghai 201306, China;
3. Engineering Research Center for Water Environment Ecology, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


