2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 广东省水产养殖污染修复生态工程技术研究中心, 广东 广州 510380
池塘养殖已成为我国水产养殖的主要方式,其产量占全国养殖总产量的49%。其中,淡水池塘养殖产量占淡水养殖总产量的72%[1]。养殖池塘作为一个人为控制的封闭生态系统,随着养殖生产的进行,进入池塘的残饵、排泄物、生物残体等有机物越来越多,水产养殖尾水的随意排放造成了严重的环境污染问题。
草鱼作为我国养殖量最大的鱼类,同时也是目前世界上产量居第2位的淡水鱼类,2016年占全国淡水鱼产量的20.95%,年产量已达589万t[1]。研究[2]表明:草鱼主养池塘随尾水排放而带来氮、磷排放量分别为86.55 kg/hm2和10.21 kg/hm2,对周围水域环境造成了一定的污染。据统计,我国每年约有4.77×104 t含氮和3.75 ×103 t含磷的养殖尾水直接排放到临近水域中[3]。有研究[4]表明水体真核微生物结构的变化可以改善养殖水质,进而减少养殖尾水对周围水域生态环境的污染。FAN等[5]和ALKHAMIS等[6]的研究结果显示浮游生物可以吸收氨氮和硝酸盐用于自身生长,从而降低水体中的氨氮等营养物质。同时,在水体中添加外源益生菌可以通过改变水体真核生物群落结构进而改善水质,李卓佳等[7]和张庆等[8]研究表明在养殖池塘中添加芽孢杆菌制剂,可以通过改善水环境微生物群落的生物量和结构来改善整个虾池的水质环境;古长庆等[9]和张云[10]的研究表明在池塘中添加复合微生物制剂可以改变藻类种群的组成、数量和生物量,从而降低养殖水体中硝酸盐和氨氮的含量。但关于添加芽孢杆菌对草鱼池塘真核微生物的影响未见报道。
为了研究添加芽孢杆菌对草鱼池塘水体中真核微生物群落结构和理化因子影响,探明在草鱼养殖中真核微生物群落结构与池塘水体理化因子的关系,本研究比较分析了中山市民众镇的3个实验组(添加芽孢杆菌池塘)和3个对照组(普通池塘)表层和底层水体理化指标,并采用高通量测序技术对表层和底层水体中真核微生物群落进行了研究,以期了解添加芽孢杆菌池塘与普通池塘真核微生物群落构成差异以及理化因素的差异,为分析评价添加芽孢杆菌对池塘真核微生物群落结构和养殖环境的影响提供理论支撑。
1 材料与方法 1.1 样品的采集和处理2017年8月和9月两次采集于中山市民众镇华辰养殖场的3个实验组池塘(面积1 hm2,平均水深1.80 m,养殖密度约为37 500尾/hm2),每天分3次向全部实验组池塘拌饲投喂共80 g含量为1.0×1010 cfu/g的芽孢杆菌制剂(广州先得生物技术有限公司),主要成分为地衣芽孢杆菌,选择与其临近且管理模式相同和放养密度接近的3个池塘作为对照池塘(面积0.97 hm2,平均水深1.85 m)。使用5点采样法(先确定池塘对角线的中点作为中心采样点,再在池塘对角线上选择4个与中心采样点距离相等的点作为采样点),采集表层水(深度为0.2 m)和底层水(深度为1.2 m)各200 mL,采集后对5个采样点水样进行混合。一部分样品被用来立即测量物理化学指标,另一部分样品采集后置于含冰袋的恒温箱中,运回实验室进一步处理,并在水样采集后12 h内将这些水样通过0.22 μm核孔过滤器(直径为47 mm)过滤,然后保存在- 80 ℃直到DNA提取。
1.2 理化因子测定用YSI(ProPlus,USA)对每个池塘的温度(T)、溶解氧(DO)、酸碱度(pH)进行原位测量。采用国标法测定水体中的氨氮(NH4+-N)、硝酸盐(NO3--N)、磷酸盐(PO4--P)、总氮(TN)和总磷(TP)的含量[11]。
1.3 MetaVxTM文库构建和Illumina MiSeq测序高通量测序文库的构建和基于Illumina MiSeq平台的测序由GENEWIZ公司(苏州,中国)完成。本研究使用Qubit 2.0 Fluorometer (Invitrogen, Carlsbad, CA)检测DNA样品的浓度,使用MetaVxTM文库构建试剂盒(GENEWIZ, Inc., South Plainfield, NJ, USA)构建测序文库[12]。
用水体DNA提取试剂盒(Omega,USA)提取水体微生物总DNA。将提取的水体总DNA送至苏州金唯智生物科技有限公司,以50~100 ng DNA为模板,PCR扩增真菌18S rDNA上包括V7和V8的2个高度可变区。采用包含“CGWTAACGAACGAG”序列的上游引物和包含“AICCATTCAATCGG”序列的下游引物扩增全长V7和V8区。另外,通过PCR向18S rDNA的PCR产物末端加上带有Index的接头,以便进行NGS测序[12]。
使用Agilent 2100生物分析仪(Agilent Technologies, Palo Alto, CA, USA)检测文库质量,并且通过Qubit检测文库浓度。DNA文库混合后,按Illumina MiSeq(Illumina, San Diego, CA, USA)使用说明书进行PE250/300双端测序,由MiSeq自带的MiSeq Control Software (MCS)读取序列信息[12]。
1.4 数据分析双端测序得到的正反向reads首先进行两两组装连接,过滤拼接结果中含有N的序列,保留序列长度大于200 bp的序列。经过质量过滤,去除嵌合体序列,最终得到的序列用于OTU分析,使用VSEARCH(1.9.6)进行序列聚类(序列相似性设为97%),比对的18S rRNA参考数据库是Silva 128[13]。然后用RDP classifier (Ribosomal Database Program)贝叶斯算法对OTU的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。基于OTU的分析结果,采用对样本序列进行随机抽样的方法,分别计算Shannon、Chao1等α多样性指数。
所有数据均以平均值±标准差(mean±SD)表示。采用单向方差分析方法对两种池塘样品中水体理化指标及水体中真核微生物属、种的丰度差异进行比较分析。采用CANOCO 4.5对池塘微生物群落组成与环境因子进行CCA分析。
2 结果 2.1 实验池塘和对照池塘水体理化指标测定由表 1可知,8月实验组池塘水体中TN、NH4+-N、NO3--N含量显著低于对照组(P < 0.05),而T、DO、pH、TP、PO4--P含量无明显差异(P>0.05)。9月实验组池塘水体中TN、TP、NH4+-N、NO3--N含量显著低于对照组(P < 0.05),而T、DO、pH、PO4--P含量无明显差异(P>0.05)。8、9月份两组池塘表层与底层水体中T、DO、pH、TN、TP、NH4+-N、NO3--N、PO4--P含量无明显差异(P>0.05)。

|
表 1 实验组和对照组水体理化指标 Tab.1 Water physical and chemical indicators of experimental group and control group |
由表 2可知,8月和9月实验组池塘水体真核微生物Shannon多样性指数和Chao1多样性指数显著高于对照组(P < 0.05)。
|
表 2 两组池塘水体真核微生物群落多样性指数 Tab.2 Eukaryotic microbial community diversity index in water of two kinds of ponds |
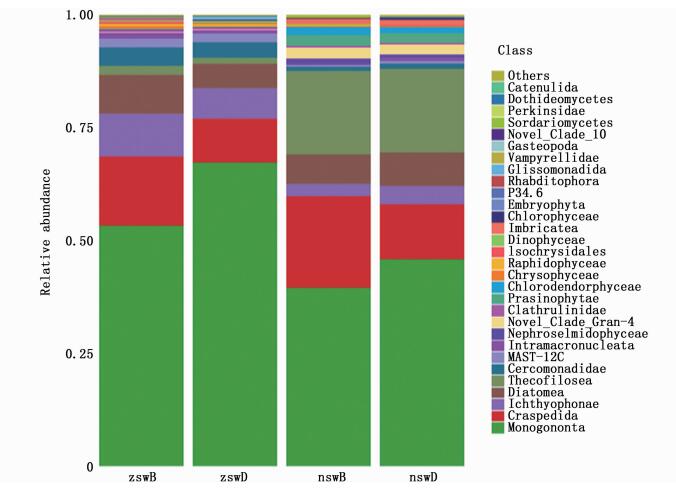
由图 1可知,在纲水平下,实验组和对照组池塘表层水体真核微生物群落结构与底层水体真核微生物群落结构均无显著差异(P>0.05)。实验组池塘水体真核微生物构成按照相关丰富度由高到低排序依次为单巢纲(Monogononta)、Craspedida、Ichthyophonae、硅藻纲(Diatomea)、Cercomonadidae、MAST-12C、Thecofilosea、Intramacronucleata。对照组池塘水体真核微生物构成按照相关丰富度由高到低排序依次为单巢纲、Thecofilosea、Craspedida、硅藻纲、Prasinophytae、Chlorodendrophyceae、Imbricatea、Cercomonadidae。实验池塘水体真核微生物中单巢纲、Craspedida、硅藻纲、Ichthyophonae、Cercomonadidae、Intramacronucleata、MAST-12C、金藻纲的绝对丰富度显著高于对照组池塘(P < 0.05)。实验组池塘水体真核微生物中Thecofilosea、Imbricatea、Isochrysidales、Chlorodendrophyceae、Prasinophytae的绝对丰富度显著低于对照组池塘(P < 0.05)。实验组池塘水体真核微生物中酵母纲(Saccharomycetes)、子囊菌纲(Sordariomycetes)、外担菌纲(Exobasidiomycetes)、银耳纲(Tremellomycetes)、Nephroselmidophyceae的绝对丰富度与对照组无显著差异(P>0.05)。
|
zswB代表 8月和9月实验组池塘的水体表层样品,zswD代表 8月和9月份实验组池塘的水体底层样品,nswB代表 8月和9月对照组池塘的水体表层样品,nswD代表 8月和9月对照组池塘的水体底层样品 zswB represents the water surface samples of experimental group ponds in August and September, zswD represents the water bottom samples of experimental group ponds in August and September, and nswB represents the water surface samples of control ponds in August and September. nswD represent the water bottom samples of control ponds in August and September 图 1 纲水平下两组池塘水体真核微生物群落结构 Fig. 1 Composition of eukaryotic microbial communities in two types of ponds water bodies at the class level |
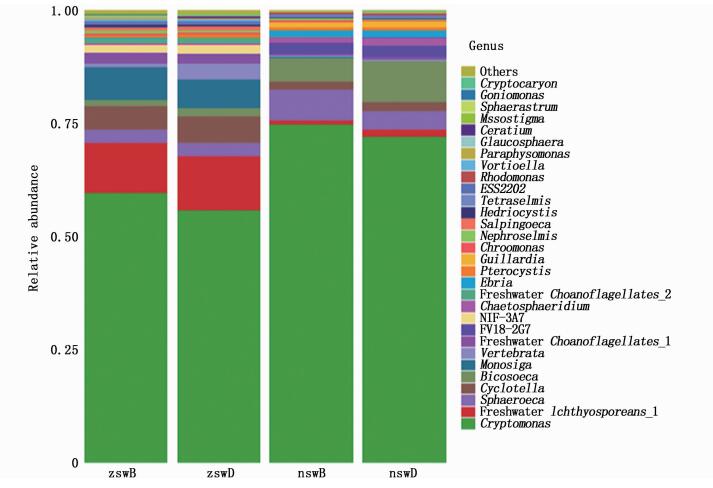
由图 2可知,实验组池塘表层水体真核微生物群落结构与底层水体真核微生物群落结构无显著差异(P>0.05),对照组池塘表层水体真核微生物群落结构与底层水体真核微生物群落结构也无显著差异(P>0.05)。在属水平下,实验组池塘水体真核微生物构成按照相关丰富度由高到低排序依次为隐藻属(Cryptomonas)、Freshwater Ichthyosporeans 1、单领鞭毛虫属(Monosiga)、小环藻属(Cyclotella)、Sphaeroeca、Vertebrata、NIF-3A7、Freshwater Choanoflagellates 1。对照组池塘水体真核微生物构成按照相关丰富度由高到低排序依次为隐藻属、杯鞭虫属(Bicosoeca)、Sphaeroeca、FV18-2G7、小环藻属、毛球藻属(Chaetosphaeridium)、Ebria、Guillardia。在属水平下,实验组池塘水体真核微生物中的Vertebrata、小环藻属、单领鞭毛虫属、NIF-3A7、丝孢酵母属(Trichosporon)、管鞭毛虫属(Salpingoeca)、蓝隐藻属(Chroomonas)、红囊藻属(Hedriocystis)的绝对丰富度显著高于对照组池塘(P < 0.05),但隐藻属、杯鞭虫属、Sphaeroeca、FV18-2G7、毛球藻属、Ebria、Guillardia的绝对丰富度显著低于对照组池塘(P < 0.05),两组池塘中Freshwater Choanoflagellates 1、Mesostigma、Pterocystis、Nephroselmis的绝对丰富度无显著差异(P>0.05)。
|
zswB代表 8月和9月实验组池塘的水体表层样品,zswD代表 8月和9月份实验组池塘的水体底层样品,nswB代表 8月和9月对照组池塘的水体表层样品,nswD代表 8月和9月对照组池塘的水体底层样品 zswB represents the water surface samples of experimental group ponds in August and September, zswD represents the water bottom samples of experimental group ponds in August and September, and nswB represents the water surface samples of control ponds in August and September. nswD represent the water bottom samples of control ponds in August and September 图 2 属水平下两组池塘水体真核微生物群落结构 Fig. 2 Composition of eukaryotic microbial communities in two types of ponds water bodies at the genus level |
由表 3可知,在种水平下,实验组池塘水体真核微生物中的梅尼小环藻(Cyclotella meneghiniana)、Catenaria uncinata、Monosiga ovata的绝对丰富度显著高于对照组池塘(P < 0.05),但Chroomonas caudata、Cyanophora paradoxa的绝对丰富度显著低于对照组池塘(P < 0.05)。两组池塘中Moniliella sp. BH010、Clonostachys rosea、Rhizophydium sp. JEL317等26种真核微生物没有显著差异。

|
表 3 实验组池塘水体和对照组池塘水体中存在显著差异的真核微生物种类的绝对丰富度(P < 0.05) Tab.3 Absolute abundance of eukaryotic microorganism in the experimental group ponds water and ordinary pond water at the species level(P < 0.05) |
由图 3可知,实验组池塘水体真核微生物群落组成与对照组池塘差异显著,而两组池塘表层水体和底层水体真核微生物群落组成相似。影响两组池塘水体真核微生物构成的理化因子主要是总磷、磷酸盐、氨氮、硝酸盐。

|
环境变量用箭头表示。zswB代表实验组池塘水体表层样品;zswD代表实验组池塘水体底层样品;nswB代表对照组池塘水体表层样品;nswD代表对照组池塘水体底层样品。N1代表氨氮;N2代表亚硝酸盐;N3代表硝酸盐;N代表总氮;P代表总磷;P1代表磷酸盐 Environmental variables were indicated as arrows. zswB represents experimental group ponds water surface sample; zswD represents experimental group ponds water bottom sample; nswB represents the control ponds water surface sample; nswD represents the control pond water bottom sample. N1 represents ammonia nitrogen; N2 represents nitrite nitrogen; N3 represents nitrate nitrogen; N represents total nitrogen; P represents total phosphorus; P1 represents phosphate 图 3 环境变量相关的真核微生物群落的典范对应分析(CCA)排序图 Fig. 3 Canonical correspondence analysis (CCA) ordination diagram of eukaryotic microbial community associated with environmental variables |
养殖尾水排放给周围环境带来的污染现已成为被广泛关注的热点,特别是新修订的《水污染防治法》在全国推行之后。张大弟等[14]调查表明每公顷精养池塘通过排放尾水而释放的TN和TP的量分别为101 kg和11 kg;戴修赢[2]共调查了432.18 hm2的草鱼主养池塘,得出草鱼主养池塘因换水而造成的氮、磷排放量分别为86.55 kg/hm2和10.21 kg/hm2;PÁEZ-OSUNA等[15]的研究表明,每公顷虾池通过养殖废水释放的氮和磷的量分别为15.2 kg和13.5 kg。因此,调控养殖池塘水质、减少养殖尾水的排放对有效保护养殖水域周围的生态环境有重要意义。而水体中真核微生物的代谢分解对水体中营养物质的分解有显著影响,有研究[7-10]表明通过向养殖池塘中添加外源益生菌可以改变真核微生物群落结构,从而达到对养殖水体水质的改善。
微生物群体感应(quorum sensing)是微生物通过释放自诱导信号分子来协调群体行为的通讯系统。当环境中信号分子浓度达阈值时,微生物表面或胞内特定受体与之结合,从而引起级联反应,多效调控微生物的次级代谢产物合成和形态分化等重要生理过程[16]。有研究[17]表明一些微生物群落丰度的变化会引起微生物之间的群体感应,从而导致微生物群落中其他某些种类的微生物增加或者减少。因此推测添加外源益生菌改变真核微生物群落结构可能是通过微生物群落间的群体感应来实现的。
实验组池塘水体真核微生物群落多样性显著高于对照组池塘。而物种多样性越丰富,其所在的生态系统越稳定[18-19]。这说明实验组池塘生态系统相对于对照组池塘生态系统更加稳定。
实验组池塘水体中的氨氮和硝酸盐含量显著低于对照组,而氨氮和硝酸盐等营养物质的含量与水体中藻类的种类和数量息息相关[6]。实验组池塘水体真核微生物在种水平下的梅尼小环藻、Catenaria uncinata、Monosiga ovata的绝对丰富度显著高于对照组池塘。BERMAN等[20]用不同种类的氮源培养藻类,研究结果表明小环藻属可以有效吸收氨氮和硝酸盐用于自身生长。黄光华等[21]通过在育苗水体中接种小环藻调节育苗水质,结果表明小环藻属对水质有显著的调节作用,可以减少水体中的氨氮和亚硝酸盐。由于梅尼小环藻属于小环藻属,推测其也可能有较强的吸收氨氮和硝酸盐的功能。因此可以推断,梅尼小环藻在两组不同模式池塘丰度的差异性可能是实验组池塘水体总氮、氨氮和硝酸盐含量低于对照组池塘的主要原因之一。
在属水平下,实验组池塘水体真核微生物中的Vertebrata、小环藻属、Sphaeroeca、单领鞭毛虫属、Freshwater Choanoflagellates 1、NIF-3A7、丝孢酵母属、管鞭毛虫属、蓝隐藻、红囊藻的绝对丰富度显著高于对照组池塘。LIU等[22]通过A2O和AO工艺处理污水,发现丝孢酵母属可以去除污水中硝酸盐。还有研究[20-21]表明小环藻属有除去硝酸盐的作用。因此我们推断出实验组池塘水体中丝孢酵母属、蓝隐藻属、红囊藻属和小环藻属丰度高于对照组池塘,可能是造成实验组池塘水体中的总氮、硝酸盐和氨氮含量显著低于对照组池塘的主要原因。
同时,本研究表明,实验组和对照组表层与底层水体微生物构成及理化指标无显著差异,说明目前集约化养殖池塘由于养殖设备(如增氧机等)的使用,导致水体理化指标上下差距不大。有研究[23]表明水产养殖池塘中不同深度的水体的微生物构成非常相似,FAN等[24]在罗非鱼的密集养殖中得出的结果进一步证实了这一结论,并进一步推测水产养殖池塘不同水体的微生物构成十分相似可能是和水体相似的理化条件有关[23]。这与本研究的结果一致。
| [1] |
张显良, 肖放, 李书民, 等. 中国渔业统计年鉴2017[M]. 北京: 中国农业出版社, 2017. ZHANG X L, XIAO F, LI S M, et al. China fisheries statistical yearbook 2017[M]. Beijing: China Agriculture Press, 2017. |
| [2] |
戴修赢.苏州地区七种养殖池塘水质及其氮、磷收支研究[D].苏州: 苏州大学, 2010. DAI X Y. Studies on the water quality and nitrogen, phosphorus budgets of seven types of aquaculture ponds in Suzhou region[D]. Suzhou: Soochow University, 2010. |
| [3] |
YANG P, LAI D Y F, JIN B S, et al. Dynamics of dissolved nutrients in the aquaculture shrimp ponds of the Min River estuary, China:Concentrations, fluxes and environmental loads[J]. Science of the Total Environment, 2017, 603-604: 256-267. |
| [4] |
SU X M, STEINMAN A D, XUE Q J, et al. Temporal patterns of phyto-and bacterioplankton and their relationships with environmental factors in Lake Taihu, China[J]. Chemosphere, 2017, 184: 299-308. |
| [5] |
FAN C, GLIBERT P M, ALEXANDER J, et al. Characterization of urease activity in three marine phytoplankton species, Aureococcus anophagefferens, Prorocentrum minimum, and Thalassiosira weissflogii[J]. Marine Biology, 2003, 142(5): 949-958. |
| [6] |
ALKHAMIS Y, QIN J G. Comparison of N and P requirements of Isochrysis galbana under phototrophic and mixotrophic conditions[J]. Journal of Applied Phycology, 2015, 27(6): 2231-2238. |
| [7] |
李卓佳, 林亮, 杨莺莺, 等. 芽孢杆菌制剂对虾池环境微生物群落的影响[J]. 农业环境科学学报, 2007, 26(3): 1183-1189. LI Z J, LIN L, YANG Y Y, et al. Influence of Bacillus on the microbial communities in shrimp ponds[J]. Journal of Agro-Environment Science, 2007, 26(3): 1183-1189. |
| [8] |
张庆, 李卓佳, 陈康德. 复合微生物对养殖水体生态因子的影响[J]. 上海水产大学学报, 1999, 8(1): 43-47. ZHANG Q, LI Z J, CHEN K D. The effects of microbiological compound on ecological factors in culture waters[J]. Journal of Shanghai Fisheries University, 1999, 8(1): 43-47. |
| [9] |
古长庆, 李君文, 晁福寰, 等. 微生物制剂在水产养殖中应用的研究[J]. 水产科学, 2004, 23(3): 21-25. GU C Q, LI J W, CHAO F H, et al. Studies on microbiological preparation applied in aquatic product[J]. Fisheries Science, 2004, 23(3): 21-25. |
| [10] |
张云.不同类群代表性浮游植物对尿素的生理生态响应[D].广州: 暨南大学, 2013. ZHANG Y. Comparative study on the ecophysiological responses of different groups of phytoplankton to urea[D]. Guangzhou: Jinan University, 2013. |
| [11] |
国家环境保护总局, 《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 236-257. The State Environmental Protection Administration, The Water and Wastewater Monitoring Analysis Method Editorial Board. Water and wastewater monitoring analysis method[M]. 4th ed.. Beijing: China Environmental Science Press, 2002: 236-257. |
| [12] |
MARGULIES M, EGHOLM M, ALTMAN W, et al. Genome sequencing in microfabricated high-density picolitre reactors[J]. Nature, 2005, 437(7057): 376-380. |
| [13] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. |
| [14] |
张大弟, 张晓红, 章家骐, 等. 上海市郊区非点源污染综合调查评价[J]. 上海农业学报, 1997, 13(1): 31-36. ZHANG D D, ZHANG X H, ZHANG J Q, et al. Integrated research and evaluation on nonpoint source pollution in Shanghai suburbs[J]. Acta Agriculturae Shanghai, 1997, 13(1): 31-36. |
| [15] |
PÁEZ-OSUNA F, GUERRERO-GALVÁN S R, RUIZ-FERNÁNDEZ A C. Discharge of nutrients from shrimp farming to coastal waters of the gulf of California[J]. Marine Pollution Bulletin, 1999, 38(7): 585-592. |
| [16] |
SCHIKORA A, SCHENK S T, HARTMANN A. Beneficial effects of bacteria-plant communication based on quorum sensing molecules of the N-acyl homoserine lactone group[J]. Plant Molecular Biology, 2016, 90(6): 605-612. |
| [17] |
齐枝花, 于鑫, 余萍, 等. 细菌细胞间通讯的群感效应[J]. 微生物学通报, 2005, 32(2): 128-133. QI Z H, YU X, YU P, et al. Quorum-sensing:a mechanism of bacterial cell-to-cell communication[J]. Microbiology, 2005, 32(2): 128-133. |
| [18] |
TILMAN D, REICH P B, KNOPS J M. Biodiversity and ecosystem stability in a decade-long grassland experiment[J]. Nature, 2006, 441(7093): 629-632. |
| [19] |
FLÖDER S, JASCHINSKI S, WELLS G, et al. Dominance and compensatory growth in phytoplankton communities under salinity stress[J]. Journal of Experimental Marine Biology and Ecology, 2010, 395(1/2): 223-231. |
| [20] |
BERMAN T, CHAVA S, OCEANOGRAPHIC I. Algal growth on organic compounds as nitrogen sources[J]. Journal of Plankton Research, 1999, 21(8): 1423-1437. |
| [21] |
黄光华, 江林源, 卢小花, 等. 小环藻在罗氏沼虾人工育苗中的应用研究[J]. 安徽农业科学, 2011, 39(13): 7849-7850, 7853. HUANG G H, JIANG L Y, LU X H, et al. Study on the application of Cyclotella sp. in the artificial breeding of Macrbrachium rosenbergii[J]. Journal of Anhui Agricultural Sciences, 2011, 39(13): 7849-7850, 7853. |
| [22] |
LIU X C, YANG M, ZHANG Y, et al. Microbial community comparison of different biological processes for treating the same sewage[J]. World Journal of Microbiology and Biotechnology, 2007, 23(1): 135-143. |
| [23] |
FAN L M, BARRY K, HU G D, et al. Bacterioplankton community analysis in tilapia ponds by Illumina high-throughput sequencing[J]. World Journal of Microbiology and Biotechnology, 2016, 32(1): 10. |
| [24] |
FAN L M, CHEN J Z, MENG S L, et al. Characterization of microbial communities in intensive GIFT tilapia (Oreochromis niloticus) pond systems during the peak period of breeding[J]. Aquaculture Research, 2017, 48(2): 459-472. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Guangdong Ecological Remediation of Aquaculture Pollution Research Center, Guangzhou 510380, Guangdong, China
 2020,
Vol. 29
2020,
Vol. 29



