2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306
茎柔鱼广泛分布于东太平洋加利福尼亚北部至智利南部,是世界上最重要的头足类资源之一[1-3],尤其在秘鲁沿岸及外海资源丰富。ARGUELLES等[4]认为秘鲁海域存在两个群体,胴长大小分别小于490 mm和大于520 mm, 而NIGMATULLIN等[5]根据性成熟个体的胴长大小,将其划分为大、中、小3个群体;刘必林等[6]推断秘鲁外海不是茎柔鱼的主要产卵场,但沿岸海域可能是其主要产卵场。茎柔鱼眼睛晶体是重要的视觉器官,由前后两个半球组成,由于眼睛晶体记录了头足类生长的大量生物学与生态学信息,且形态结构稳定、易提取、易保存,因此,通常被作为研究头足类生活史过程的有益补充[7], 其功能与脊椎动物的眼睛晶体相似[8],主要用于辅助捕食和躲避敌害[9]。
国外学者[10-11]较早开展了鱼类和头足类眼睛晶体微结构的研究,并在单鳍多线鱼(Pleurogrammus monopterygius)[12]、太平洋鲱(Clupea pallasii)[12]、大王乌贼(Architeuthis dux)[13]、红色肠腕蛸(Enteroctopus megalocyathus)[14]、枪乌贼(Loligo vulgaris)[15]和福氏枪乌贼(Loligo forbesii)[15]等的年龄和生长研究中得到了应用,然而关于头足类眼睛晶体微结构的研究,国内尚属空白。本文以秘鲁外海茎柔鱼(Dosidicus gigas)为例, 观察分析了其眼睛晶体的微结构特征, 通过与耳石判定的日龄做比较以确定眼睛晶体的生长纹是否具有日周期性, 建立了胴长、体质量和眼睛晶体生长纹的关系。研究结果有助于拓宽头足类生活史研究手段, 为我国头足类的研究提供重要基础。
1 材料与方法 1.1 样本来源茎柔鱼样本于2013年7月—10月采集于秘鲁外海。随机抽取127尾于实验室解冻后对胴长(Mantel length, ML)进行测定,发现雌性胴长范围为222~399 mm,雄性胴长范围为218~391 mm,属中小型群体;提取耳石和眼睛晶体,分别保存于75%的酒精溶液中。使用电子游标卡尺测量眼睛晶体的直径(Diameter, D),并找出对应耳石分别进行切片制作[16], 除去样本损失,共得到113个眼睛晶体和耳石的切片。
1.2 眼睛晶体切片制作取出保存在离心管中的眼睛晶体,用游标卡尺测定晶体最大直径。由于眼睛是由前后两个部分组成的(图 1),取出后将两者分离,保存体积较大的后半部分(图 2a),使其平放于包埋盒中(图 2b),倒入配置好的冷埋树脂溶液进行包埋(图 2c),在常温避光处放置待其硬化;将硬化后的树脂块用强力热熔胶粘于载玻片上,先将底部磨平(图 2d),然后倒转180°研磨另一面(图 2e),研磨时先后以120、600、1 200、2 500目水磨砂纸研磨成约0.5 mm的薄片,最后以0.05 μm氧化铝剂抛光研磨面(图 2f)。

|
图 1 眼睛晶体示意图 Fig. 1 Diagrams of eye lens of D.gigas |

|
a.已分离的眼睛晶体的后半部分;b.塑料磨具;c.经过冷埋树脂包埋的眼睛晶体后部;d-f.切割后的树脂块粘于载玻片上并研磨至赤道面 a.the second half of the separated eye lens; b.plastic abrasive tools; e.the back of the eye lens embedded in the cold resin; d-f.the cut resin block is adhered to the slide and ground to the equatorial surface 图 2 眼睛晶体切片制作流程图 Fig. 2 Flow charts of eye lens preparation |
将制作好的眼睛晶体切片在Olympus显微镜下,以1 000×进行观察,采用控制摄像系统(charged coupled device, CCD)将眼睛晶体切片由核心至最外圈的生长纹进行拍照,然后用Photoshop 7.0图像处理软件将照片进行拼接处理。生长纹计数时,由中心至边缘依次计数,边缘空白处的生长纹由邻近的生长纹宽度进行推测,每个样本分别独立计数3次,采用变异系数(coefficient of variation,CV)检验计数的准确性,其计算公式如下
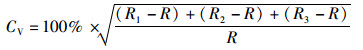 (1)
(1)
式中:R1、R2、R3分别代表的是3次独立计数的结果,R为这3次独立计数的平均值。
1.4 耳石日龄鉴定根据DAWE等[16]的方法对其耳石进行包埋、切割、研磨、抛光、拍照、图片合成、生长纹计数等。ARKHIPKIN[17]提出,在一般情况下,分类地位相近的两个种类,如果其中一个种类的轮纹日周期性得到证实,则可认为另外一种耳石轮纹也具有日周期性,而有研究通过化学标记法证实了阿根廷滑柔鱼耳石轮纹的日周期性[18]。因此,将茎柔鱼耳石中所观测到的生长纹数量看作为其实际日龄。
1.5 眼睛体生长纹周期性检验采用配对样本t检验,检验眼睛晶体生长纹与耳石日龄之间是否有差异;拟合眼睛晶体生长纹与耳石日龄之间的线性方程,采用协方差分析(ANCOVA)检验斜率是否为1,截距是否为0。
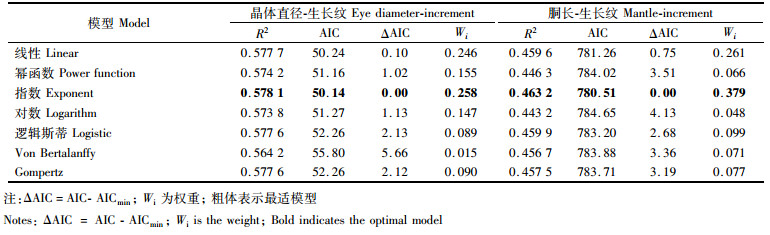
1.6 建立生长方程采用线性、幂函数、指数、对数、逻辑斯蒂、von Bertalanffy和Gompertz等7个生长模型来拟合茎柔鱼眼睛晶体直径、胴长与眼睛晶体生长纹的关系。以赤池信息准则(akaike information criterion, AIC)作为模型选择的参数指标,其选择的标准是AIC越小越好,但AIC在小样本、样本相对于自变量个数较小时表现不佳,可能会出现高估模型参数的情况[19],因此通过AIC差值Δi和权重Wi来辅助生长模型的选择,AIC值最小、Δi<2且Wi值最大的为最适生长模型[20-22]。其计算公式分别如下
 (2)
(2)
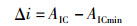 (3)
(3)
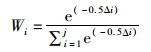 (4)
(4)
式中:k为模型的参数数量;n为样本数量;RSS为剩余平方和;AICmin为7个模型中AIC最小的值;j为候选模型的个数。
2 结果 2.1 眼睛晶体微结构眼睛晶体由前后两个部分组成,前半部分所占体积较小,后半部分所占体积较大(图 1a)。两者之间有隔膜隔开,其中,在后半部分中直径最大处所处的圆环为赤道(图 1b),周期性的生长带明显,由明纹和暗纹组成,明暗纹交替出现,生长纹由核心分布至边缘,核心部分的生长纹形状不规则,常出现分叉现象(图 3),且与相邻生长纹之间的间距较大(图版-1, 2),随后生长纹的形状趋于规律和平稳,接近圆环形,生长纹很少出现分叉,生长纹之间的间距也在逐渐变小(图版-3, 4),随着生长纹向外继续延伸到外区时,生长纹几乎没有分叉,生长纹之间的间距变更小(图版-5, 6)。

|
图中黑圈圈出点为分叉点 The point cireled in black is bifureation point 图 3 茎柔鱼眼睛晶体微结构拼合图 Fig. 3 Light microstructure splice chart of eye lens of D.gigas |

|
1和2所示均为核心区生长纹,1中最小的园环为核心;3和4所示为中区生长纹,黑圈所圈部分为拼合过程中所识别的自然标记物;5和6所示为外区,其中5为整个眼睛晶体的最后一部分 Both 1 and 2 are growth increments in the core area, and the smallest ring in 1 is the core; 3 and 4 show the growth increments in the middle part, and the circled part in the black circle is the natural marker identified in the assembly process; 5 and 6 are the outer regions, where 5 is the last part of the entire eye lens 图版 茎柔鱼眼睛晶体微结构图 Plate Light microstructure of eye lens of D.gigas |
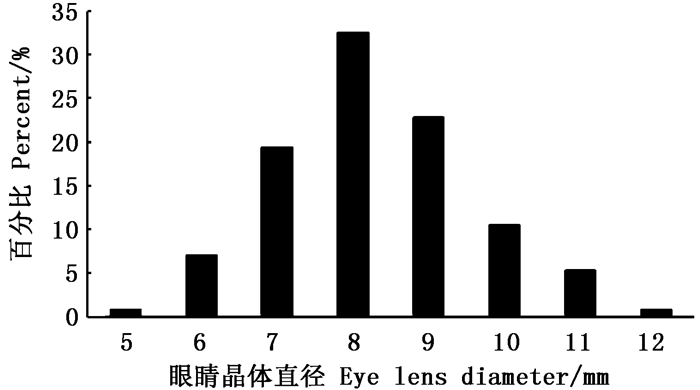
从本次采集的茎柔鱼眼睛晶体直径组成来看,晶体直径在4~12 mm范围内,平均直径(7±1) mm,优势直径为6~10 mm(图 4),占个体总样本的85.84%。
|
图 4 茎柔鱼眼睛晶体直径组成 Fig. 4 Diameter frequency distribution of eye lens of D.gigas |
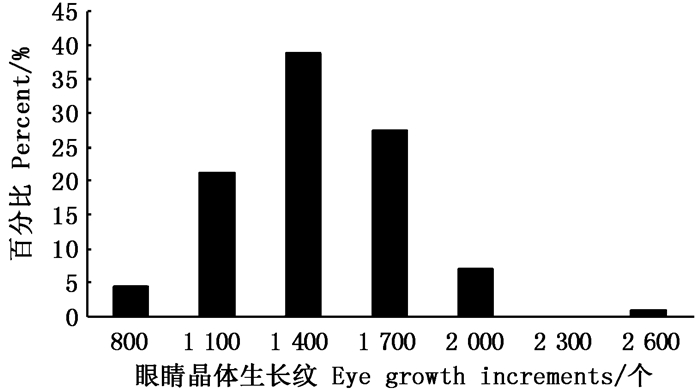
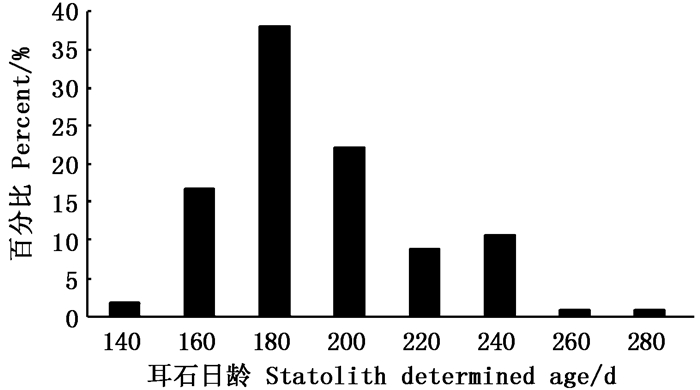
从本次采集的茎柔鱼眼睛晶体生长纹组成来看:晶体生长纹范围为509~2 342个,优势组为800~1 700个(图 5),占个体总样本的87.61%;耳石日龄范围为120~260 d,优势组为140~200 d(图 6),占个体总样本的76.99%。通过与耳石日龄的对比分析发现,茎柔鱼眼睛晶体平均每天生长(7±2)个生长纹。
|
图 5 茎柔鱼眼睛晶体生长纹组成 Fig. 5 Growth increments frequency distribution of eye lens of D.gigas |
|
图 6 茎柔鱼耳石日龄组成 Fig. 6 Statolith determined age frequency distribution of D.gigas |
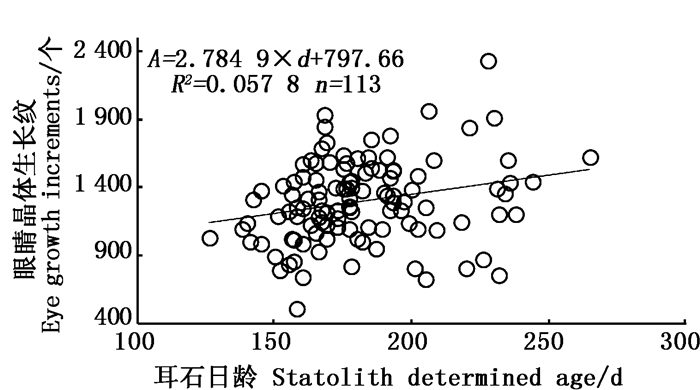
分析结果显示,3次独立计数CV值为2.86%,明显小于5%,表明眼睛晶体生长纹计数准确。配对样本t检验显示晶体生长纹数目与耳石日龄差异显著P<0.05)。此外,协方差分析结果显示,眼睛晶体与耳石日龄线性回归方程斜率与1存在显著差异(图 7,P<0.05),截距与0存在显著差异P<0.05),R2值较小,说明眼睛晶体的生长纹并不像耳石日龄一样具有“一日一轮”的特性。
|
图 7 茎柔鱼眼睛晶体生长纹数目与耳石日龄的关系 Fig. 7 Relationship between number of growth increments of eye lens and statolith determined age for D.gigas |
根据最小AIC法、Δi和Wi的比较(表 1)可知,茎柔鱼眼睛晶体直径与生长纹的关系既适合指数曲线表达,又可用线性方程来描述(表 1),通过两者的比较,认为指数曲线为最优模型(图 8),其关系式如下:
|
表 1 线性、幂函数、指数等7个生长方程拟合茎柔鱼胴长-生长纹、眼睛晶体直径-生长纹参数值 Tab.1 Parameters of linear, power, exponential, logarithmic, logistic, von Bertalanffy and Gompertz models fitted to D-growth increments and ML-growth increments data for D.gigas |
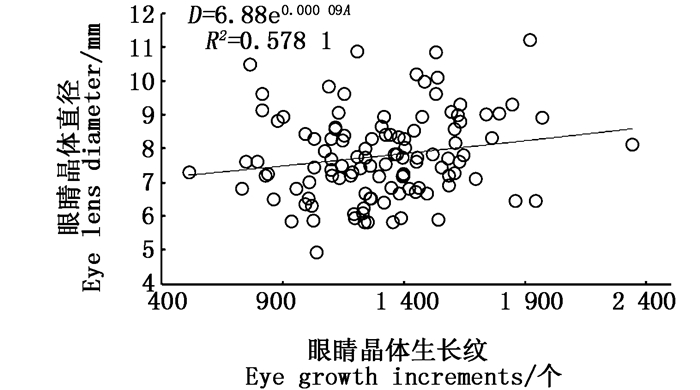
|
图 8 眼睛晶体直径与生长纹关系 Fig. 8 Correlations of D to the number of growth increments of eye lens for D.gigas |
 (5)
(5)
式中:D为直径,mm;A为眼睛晶体生长纹,个。
2.6 晶体生长纹与胴长关系根据最小AIC法、Δi和Wi的比较(表 1)可知,茎柔鱼胴长与眼睛晶体生长纹的关系适合指数曲线(表 1)和线性来描述(表 1),通过两者比较,认为指数曲线为最优模型(图 9),其关系式如下:
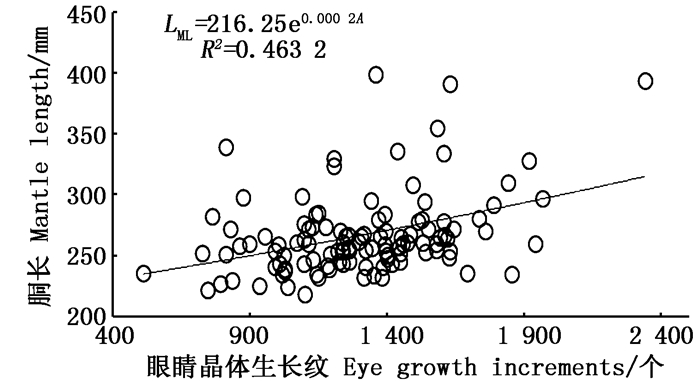
|
图 9 柔鱼胴长与眼睛晶体生长纹数目关系 Fig. 9 Correlations of ML to the number of growth increments of eye lens for D.gigas |
 (6)
(6)
式中:LML为胴长,cm;A为眼睛晶体生长纹, 个。
3 讨论结合了茎柔鱼硬组织关于微结构的部分研究内容,对茎柔鱼耳石、角质颚、内壳和眼睛晶体微结构的特点进行了汇总(表 2),分析比较晶体生长纹在头足类年龄鉴定中的优势,判断其是否有利于做出准确的年龄鉴定。研究结果发现:眼睛晶体和其他硬组织一样,从核心至外围都有生长纹分布; 耳石和角质颚可以依据生长纹宽分为明显的核心区、中区和外围区,但是眼睛晶体和内壳却没有明显的过渡区;眼睛晶体生长纹以环形围绕核心分布,呈同心圆形,而其他硬组织都依据外表形状呈现出不同的规则,如耳石和内壳都呈环形,角质颚呈“<”形。此外,还发现茎柔鱼耳石、角质颚和内壳的生长纹都具有日周期性,但是眼睛晶体生长纹则不具有日周期性,分析认为其不适宜做年龄鉴定。

|
表 2 茎柔鱼耳石、角质颚、内壳和眼睛晶体生长纹特点 Tab.2 Increments features of statolith, beak, gladius and eye lens of D.gigas |
有研究表明,红色肠腕蛸的眼睛晶体直径为4.75~9.82 mm[14],枪乌贼的眼睛晶体生长纹数目为雄性98~520个,雌性113~428个[15],福式枪乌贼的眼睛晶体生长纹数目为雄性150~543个,雌性150~495个[15]。根据本文所采茎柔鱼眼睛晶体直径、生长纹和耳石日龄的频率分布图发现,眼睛晶体直径大小主要分布在6~10 mm范围内,晶体生长纹主要分布在800~1 700个范围内,相对于以往研究的物种,茎柔鱼的晶体直径更大,生长纹的个数更多,这种现象可能依种类和生活环境的不同而变化[26]。耳石日龄频率分布图表明,此次研究所用样本年龄偏小,主要为140~200 d,随着茎柔鱼年龄的增大,眼睛晶体的直径和生长纹可能会继续增长。
在兔子[27]、袋鼠[28-30]、牛[31]等哺乳动物中,眼睛晶体的直径、干重被用于年龄的鉴定。在鲤鱼(Cyprinus carpio L)[32]、细条石颌鲷(Lithognathus mormyrus)[33]、项带重牙鲷(Diplodus vulgaris)[33]等鱼类中,眼睛晶体的干重、直径被用于年龄鉴定。而头足类中,O’SHEA[13]和CÁRDENAS等[14]通过对大王乌贼和红色肠腕蛸眼睛晶体生长纹的描述和计数,发现晶体生长纹不具有日周期性,但可用于个体的生长分析。AGUS等[15]通过拟合枪乌贼和福式枪乌贼生长纹与胴长、体质量关系,认为眼睛晶体的生长纹数目与个体生长存在相关关系,并认为指数模型为最适生长模型。根据本文所采样本发现,茎柔鱼眼睛晶体平均每天生长7条生长纹,同样不具有日周期性,且眼睛晶体生长纹与眼睛晶体直径、胴长之间呈指数生长模型。结果虽然否定了茎柔鱼眼睛晶体生长纹的日周期性,但可依据此指标,用于个体生长分析。
根据最小AIC法,认为茎柔鱼眼睛晶体的生长纹与晶体直径、胴长之间的最适生长模型均为指数模型。但从ΔAIC值来看,线性模型也是一个潜在的生长模型。这说明,茎柔鱼眼睛晶体生长纹增长的速率与晶体直径增长的速率、胴长增长的速率相比稍微慢一点。但根据头足类的一般生长规律[16],胴长、晶体直径与年龄的关系应呈显著的逻辑斯蒂关系,而拟合出的指数模型可能是逻辑斯蒂模型的前一部分,这可能与所采用的样本年龄偏小,导致年龄范围涉及较窄有关。
4 结论与展望过去几十年,耳石微结构分析被认为是研究头足类年龄和生长最有效的方法[34],但近年来,有不少学者尝试研究其体内的其他硬组织的生长纹,如角质颚[35]、内壳[36]、眼睛晶体[14],与耳石研究取长补短。本研究发现,眼睛晶体生长纹不具有日周期性,且经常出现分叉的现象,使生长纹计数时误差增大;也有研究[37]表明,眼睛晶体的第一条轮纹是在胚胎Ⅸ期形成的,造成第一条生长纹无法准确判断。因此认为,茎柔鱼眼睛晶体生长纹并不适合做年龄鉴定,但可用于生长分析。目前,眼睛晶体中丰富的蛋白质含量成为国内外学者的研究热点,通过眼睛晶体从外围至核心的分层剥离,可以分析个体完整的生活史信息, 如:通过晶体核心处的碳氮稳定同位素的值可以推测其出生位置;结合耳石日龄可以判断个体食性转变的时期;由碳氮稳定同位素比值的不断变化推测洄游路径等等。未来应更多地结合环境因子,如海表面温度、叶绿素浓度和溶解氧含量等因素进行综合研究,从而更准确地分析其生活史信息。
| [1] |
TAIPE A, YAMASHIRO C, MARIATEGUI L, et al. Distribution and concentrations of jumbo flying squid (Dosidicus gigas) off the Peruvian coast between 1991 and 1999[J]. Fisheries Research, 2001, 54(1): 21-32. DOI:10.1016/S0165-7836(01)00377-0 |
| [2] |
WALUDAC. Quantifying light-fishing for Dosidicus gigas in the eastern Pacific using satellite remote sensing[J]. Remote Sensing of Environment, 2004, 91(2): 129-133. DOI:10.1016/j.rse.2004.02.006 |
| [3] |
陈新军, 赵小虎. 秘鲁外海茎柔鱼产量分布及其与表温关系的初步研究[J]. 上海水产大学学报, 2006, 15(1): 65-70. CHEN X J, ZHAO X H. Preliminary study on the catchdistribution of Dosidicus gigas and its relationship with seasurface temperaturein the offshore waters of Peru[J]. Journal of Shanghai FisheriesUniversity, 2006, 15(1): 65-70. |
| [4] |
ARGUELLES J, RODHOUSE P G, VILLEGAS P, et al. Age, growth and population structure of the jumbo flying squid Dosidicus gigas in Peruvian waters[J]. Fisheries Research, 2001, 54(1): 51-61. DOI:10.1016/S0165-7836(01)00380-0 |
| [5] |
NIGMATULLIN C M, NESIS K N, ARKHIPKIN A I. A review of the biology of the jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae)[J]. Fisheries Research, 2001, 54(1): 9-19. DOI:10.1016/S0165-7836(01)00371-X |
| [6] |
刘必林, 陈新军, 陈海刚, 等. 秘鲁外海茎柔鱼繁殖生物学研究[J]. 上海海洋大学学报, 2016, 25(3): 445-453. LIU B L, CHEN X J, CHEN H G. Reproduction of the Humboldt squid (Dosidicus gigas) off Peru[J]. Journal of Shanghai Ocean University, 2016, 25(3): 445-453. |
| [7] |
许巍, 刘必林, 陈新军, 等. 眼睛晶体在头足类生活史分析中的研究进展[J]. 大连海洋大学学报, 2018, 33(3): 408-412. XU W, LIU B L, CHEN X J, et al. Research advancements on role of eye lens in reconstruction of cephalopod life history[J]. Journal of Dalian Fisheries University, 2018, 33(3): 408-412. |
| [8] |
PACKARD A. Cephalopods and fish:the limits of convergence[J]. Biological Reviews, 1972, 47(2): 241-307. |
| [9] |
NILSSON D E, WARRANT E J, JOHNSEN S, et al. A unique advantage for giant eyes in giant squid[J]. Current Biology, 2012, 22(8): 683-688. DOI:10.1016/j.cub.2012.02.031 |
| [10] |
WILLEKENS B, VRENSEN G, JACOB T, et al. The ultrastructure of the lens of the cephalopod Sepiola:a scanning electron microscopic study[J]. Tissue and Cell, 1984, 16(6): 941-950. DOI:10.1016/0040-8166(84)90073-9 |
| [11] |
CLARKE M R. Age determination and common sense[M]//OKUTANI T, O'DOR R K, KUBORERA T.Recent Advances in Cephalopod Fisheries Biology. Tokyo: Tokai University Press, 1993: 670-678.
|
| [12] |
FERENBAUGH J. Elemental analysis of otoliths and eye lenses in the assessment of Steller sea lion diets[D]. Texas: Texas Tech University, 2007: 637-643.
|
| [13] |
O'SHEA S. Estimating age and growth rate in Architeuthisdux[D]. Auckland: Auckland University of Technology, 1998.
|
| [14] |
CÁRDENASE R B, CORREA S M, GUZMAN R C, et al. Eye lens structure of the octopus Enteroctopus megalocyathus:evidence of growth[J]. Journal of Shellfish Research, 2011, 30(2): 199-204. DOI:10.2983/035.030.0201 |
| [15] |
AGUS B, MEREU M, CANNAS R, et al. Age determination of Loligo vulgaris and Loligo forbesii using eye lens analysis[J]. Zoomorphology, 2018, 137(1): 63-70. DOI:10.1007/s00435-017-0381-8 |
| [16] |
DAWE E G, NATSUKARI Y. Light microscopy[M]//JEREBP, RAGONESES, BOLETZKY S V. Squid Age Determination Using Statoliths. Mazara del Vallo, Sicily, Italy: Special Publication, 1991: 83-95.
|
| [17] |
ARKHIPKIN A I. Statoliths as 'black boxes' (life recorders) in squid[J]. Marine and Freshwater Research, 2005, 56(5): 573-583. DOI:10.1071/MF04158 |
| [18] |
刘必林, 陈新军, 陆化杰, 等. 头足类耳石[M]. 北京: 科学出版社, 2011. LIU B L, CHEN X J, LU H J, et al. The statolith of cephalopoda[M]. Beijing: Science Press, 2011. |
| [19] |
杨泱. 回归模型筛选准则及方法比较研究[J]. 昆明理工大学学报(自然科学版), 2015, 40(3): 134-138. YANG Y. Comparative research of regression model selection criteria[J]. Journal of Kunming University of Science and Technology (Natural Science Edition), 2015, 40(3): 134-138. |
| [20] |
ARKHIPKIN A, JEREB P, RAGONESES. Growth and maturation in two successive seasonal groups of the short-finned squid, Illex coindetii from the Strait of Sicily (central Mediterranean)[J]. ICES Journal of Marine Science, 2000, 57(1): 31-41. DOI:10.1006/jmsc.1999.0488 |
| [21] |
MARKAIDA U, QUIÑÓNEZ-VELÁZQUEZ C, SOSA-NISHIZAKI O. Age, growth and maturation of jumbo squid Dosidicus gigas(Cephalopoda:Ommastrephidae) from the Gulf of California, Mexico[J]. Fisheries Research, 2004, 66(1): 31-47. DOI:10.1016/S0165-7836(03)00184-X |
| [22] |
TRACEYSR, STEERMA, PECLGT. Life history traits of the temperate mini-maximalist Idiosepiusnotoides, (Cephalopoda:Sepioidea)[J]. Journal of the Marine Biological Association of the United Kingdom, 2003, 83(6): 1297-1300. DOI:10.1017/S0025315403008701 |
| [23] |
RAYA C P, HERNÁNDEZ-GONZÁLEZ C L. Growth lines within the beak microstructure of the octopus Octopus vulgaris Cuvier, 1797[J]. South African Journal of Marine Science, 1998, 20(1): 135-142. |
| [24] |
刘必林, 林静远, 陈新军, 等. 西北太平洋柔鱼角质颚微结构及其生长纹周期性研究[J]. 海洋与湖沼, 2016, 47(4): 821-827. LIU B L, LIN J Y, CHEN X J, et al. Beak microstructure and validation of growth increments of neon flying squid in the northwest pacific ocean[J]. Oceanologiaet Limnologia Sinica, 2016, 47(4): 821-827. |
| [25] |
WANG X F, LIU B L, LI J H, et al. Comparative growth increments of gladius surface and cross-sections to estimate Sthenoteuthis oualaniensisage[J]. Marine Biology, 2018, 165(4): 78. DOI:10.1007/s00227-018-3340-0 |
| [26] |
RODRÍGUEZ-DOMÍNGUEZA, ROSAS C, MÉNDEZ-LOEZAI, et al. Validation of growth increments in stylets, beaks and lenses as ageing tools in Octopus maya[J]. Journal of Experimental Marine Biology and Ecology, 2013, 449: 194-199. DOI:10.1016/j.jembe.2013.10.001 |
| [27] |
WHEELER S H, KING D R. The use of eye-lens weights for aging wild rabbits, Oryctolaguscuniculus (L.), in Australia[J]. Australian Wildlife Research, 1980, 7(1): 79-84. DOI:10.1071/WR9800079 |
| [28] |
POOLE W E, CARPENTER S M, WOOD J T. Growth of grey kangaroos and the reliability of age determination from body meausrements Ⅰ. The eastern grey kangaroo, Macropus giganteus[J]. Australian Wildlife Research, 1982, 9(1): 9-20. DOI:10.1071/WR9820009 |
| [29] |
AUGUSTEYN R C, COULSON G, LANDMAN K A. Determining kangaroo age from lens protein content[J]. Australian Journal of Zoology, 2003, 51(5): 485-494. DOI:10.1071/ZO02015 |
| [30] |
MCLEOD S R, DRUHAN J P, HACKER R B. Estimating the age of kangaroos using eye lens weight[J]. Wildlife Research, 2006, 33(1): 25-28. DOI:10.1071/WR04077 |
| [31] |
RAINES C R, DIKEMAN M E, UNRUH J A, et al. Predicting cattle age from eye lens weight and nitrogen content, dentition, and United States Department of Agriculture maturity score[J]. Journal of Animal Science, 2008, 86(12): 3557-3567. DOI:10.2527/jas.2007-0445 |
| [32] |
CRIVELLI A. The eye lens weight and age in the common carp, Cyprinus carpio L.[J]. Journal of Fish Biology, 1980, 16(5): 469-473. DOI:10.1111/jfb.1980.16.issue-5 |
| [33] |
CONIDES A J, AL-HASSAN L A J. Using eye lens diameter as age indicator of young Lithognathusmormyrus and Diplodus vulgaris[J]. Naga, 2000, 23(3): 21-22. |
| [34] |
JACKSON G D. Application and future potential of statolith increment analysis in squids and sepioids[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1994, 51(11): 2612-2625. DOI:10.1139/f94-261 |
| [35] |
PERALES-RAYA C, BARTOLOMÉA, GARCÍA-SANTAMARÍA M T, et al. Age estimation obtained from analysis of octopus (Octopus vulgaris Cuvier, 1797) beaks:Improvements and comparisons[J]. Fisheries Research, 2010, 106(2): 171-176. DOI:10.1016/j.fishres.2010.05.003 |
| [36] |
DOUBLEDAY Z A, WHITE J, PECL G T, et al. Age determination in merobenthic octopuses using stylet increment analysis:assessing future challenges using Macroctopus maorum as a model[J]. ICES Journal of Marine Science, 2011, 68(10): 2059-2063. DOI:10.1093/icesjms/fsr135 |
| [37] |
WENTWORTH S L, MUNTZ W R A. Development of the eye and optic lobe of Octopus[J]. Journal of Zoology, 1992, 227(4): 673-684. DOI:10.1111/jzo.1992.227.issue-4 |
2. National Distant-water Fisheries Engineering Research Center, Shanghai 201306, China;
3. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


