2. 上海太和水环境科技发展有限公司, 上海 200433
沉水植物可吸收水分和养料,也可以有效吸收富营养化水体中富含的氮、磷等营养物质[1]。但是,在当前环境压力下(氮磷营养盐持续输入、浓度偏高),如何有效平衡控制修复后沉水植物过度生长,成为修复系统长期稳定和生态系统管理过程中亟待解决的问题之一。
本研究立足现状,试图利用生物方法控制水生植物的生长,在应用水体植物修复技术人为干扰富营养化水体进而达到净化治理的基础上,为后期减少人为干扰的作用,通过食物链摄食方式消化水生植物。目前有研究表明草鱼可以摄食苦草,但对沉水植物的摄食影响甚大, 有时甚至出现了毁灭性破坏[2], 此外, 过量地放养最终导致生态系统退化的现象也普遍存在[3-4]。鲤[5]、螯虾等对沉水植物嫩芽均具有一定的摄食性,但这会影响沉水植物的生长和繁殖,在螯虾的牧食过程中,还会咬断沉水植物叶片,产生30%~95%的未食植物碎屑[6]。合理利用食物链的牧食方式、进行水生动物的时空配置是十分重要且复杂的。
椭圆萝卜螺(Radix swinhoei)是一种广食性的淡水螺, 是我国一种特有的常见淡水螺,属肺螺亚纲(Basommatophora)椎实螺科(Radix)萝卜螺属(Swinhoei)[7]。据文献[8]报道,椭圆萝卜螺的牧食种类很广,几乎可以牧食所有水生植物,如伊乐藻、苦草、罗氏轮叶黑藻、马来眼子菜等[9-10]。国内目前对于螺与沉水植物之间的牧食关系研究较少。肺螺亚纲的很多种类, 在宽阔的腹足前端生长着一个具齿舌的口, 在爬行的过程中, 不断从口中伸出齿舌进行刮食动作, 从而具有很强的刮食能力。由于肺螺类具有广食性特征, 很多对水生植物适口性的研究都采取肺螺作为实验动物[11]。
本文试图利用实验研究不同规格的椭圆萝卜螺对于3种常见的沉水植物的牧食选择性和牧食率,为水生生物合理配置及生态系统稳定性研究提供基础。
1 材料与方法 1.1 实验材料实验于2017年4月至5月在上海海洋大学实验室中进行。实验所用器材为11个2 L的大烧杯,并放在靠窗位置使实验接近自然光照。实验选取的沉水植物为伊乐藻(Elodea nuttallii),水盾草(Cabomba caroliniana)以及苦草(Vallisneria natans)。根据李宽意等[10]对不同规格螺的分类标准,本文选用0.78 g/个、0.28 g/个、0.06 g/个左右的大、中、小3种不同规格的椭圆萝卜螺。所有实验材料均从上海海洋大学金山基地中采集。为保证实验的严谨性和准确性,在实验前将运来的螺放置在实验水箱中驯养1周,实验前48 h,从水箱中挑选出鲜活的椭圆萝卜螺令其饥饿并作为实验对象。同时,将3种沉水植物放置在室外的大缸中进行培育,实验前,挑出3种沉水植物中发育完整且没有牧食痕迹的植株,仔细清洗后将植株表面的泥沙与浮游动物全部去除,并对洗净后的植株进行镜检,确保沉水植物的表面洁净,最后用吸水纸将植株表面的水分吸干,静置风干5 min后称量并放入实验烧杯中。实验用水为曝气1天的自来水,pH为7~8,CODMn为(11.23±2.12) mg/L,氨氮为(2.036±0.302) mg/L, 硝氮为(2.842±0.332) mg/L, 亚硝氮为(0.058±0.021) mg/L, 磷酸盐为(0.939±0.102) mg/L。
1.2 实验方法 1.2.1 不同规格的椭圆萝卜螺对沉水植物的牧食选择性及牧食率实验选择约0.78 g/个、0.28 g/个、0.06g/个3种规格的椭圆萝卜螺,每种规格取30个,放入盛有500 mL实验用水的2 L大烧杯中,放入螺之前,向每个烧杯中投入一定生物量的苦草叶片、水盾草和伊乐藻的嫩枝, 3种沉水植物的生物量比例为1:1:1,且各组差异性不显著(P>0.05)。实验持续65 h, 每个处理组设置5个重复,实验期间水温为26~30 ℃,实验结束后称量沉水植物鲜质量。
1.2.2 不同密度的椭圆萝卜螺对沉水植物的牧食选择性及牧食率实验选择0.06 g/个左右的小规格椭圆萝卜螺,3个处理组烧杯中分别放入40、80、120个/L,放入盛有500 mL实验用水的2 L大烧杯中,放入螺之前,向每个烧杯中投入一定生物量的苦草叶片、水盾草和伊乐藻的嫩枝,3种沉水植物的生物量比例为1:1:1,且各组差异性不显著。实验持续112 h, 每个处理组设置5个重复组,实验期间水温为26~30 ℃,实验结束后称量沉水植物鲜质量。
1.3 数据处理采用Origin 9.1和SPSS 19.0软件进行数据处理,并用SPSS 19.0软件中单因子方差(ANOVA)对实验结果进行差异显著性检验(P<0.01则差异性极显著,P<0.05则差异显著)。数据均以平均值±标准差(Mean ±SD)表示。
椭圆萝卜螺的牧食率的计算公式:
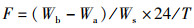 (1)
(1)
式中:F表示椭圆萝卜螺的日牧食率,mg/(g·d);Wb与Wa分别是实验前后水生植物的鲜质量,mg;Ws为椭圆萝卜螺的鲜质量, mg;T为实验持续时间周期。
椭圆萝卜螺的牧食选择性的计算方法采用牧食选择性指数公式:
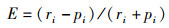 (2)
(2)
式中:E为选择指数;ri指某种沉水植物被牧食量占所有总牧食量的百分比;pi指某种沉水植物的质量占所有水草总量的百分比。当E=0时,说明椭圆萝卜螺的牧食无选择性;当0 < E < 1时,说明椭圆萝卜螺对某种沉水植物的牧食有主动选择性;当E < 0时,说明椭圆萝卜螺对该种植物的牧食有回避性。
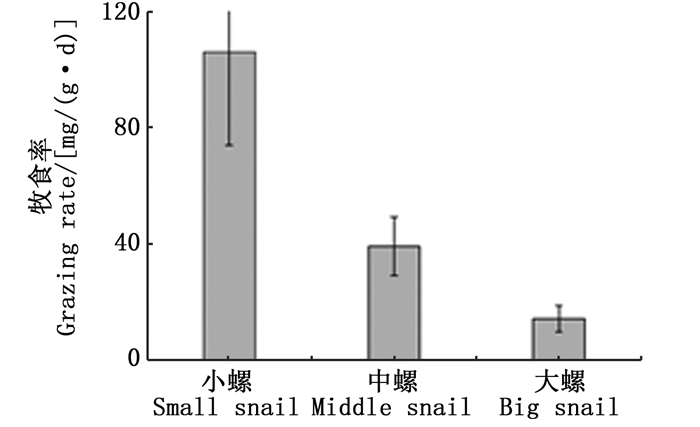
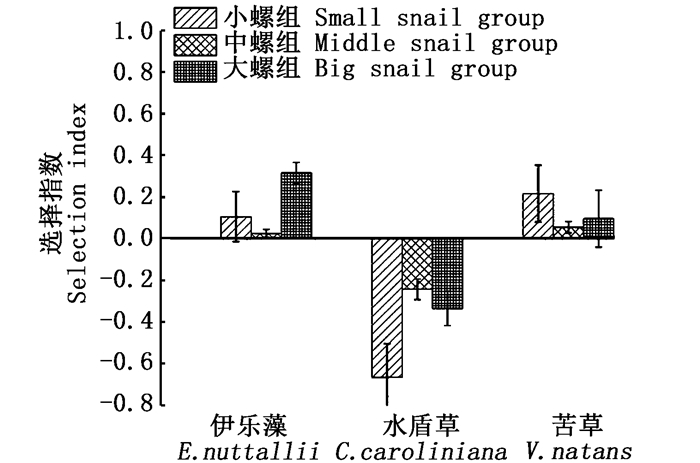
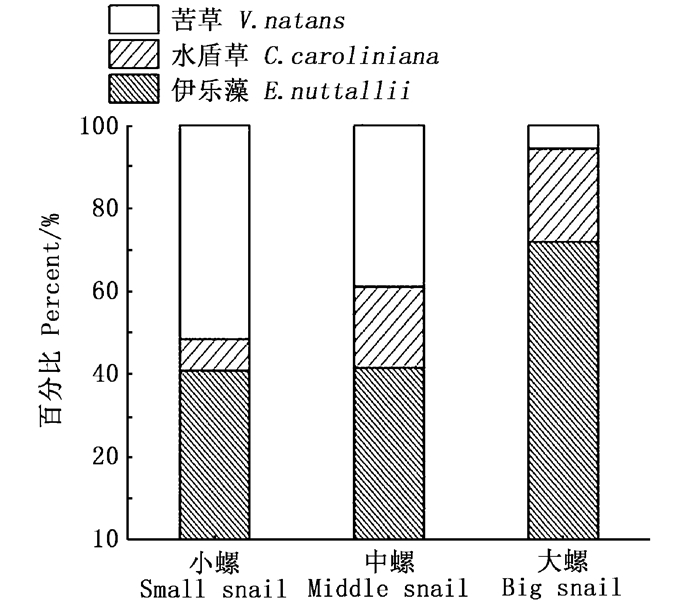
2 结果与分析 2.1 不同规格的椭圆萝卜螺对沉水植物的牧食率及牧食选择性如图 1所示,随着螺规格的增大,其对沉水植物的总牧食率越来越小。小规格的螺对沉水植物牧食率最高, 为(106.08±72.91)mg/(g·d),中规格螺为(39.41±10.02)mg/(g·d),大规格成螺为(14.17±5.63) mg/(g·d)。可见,在不同规格的牧食选择性上,小规格的螺对苦草的牧食率最高,为(163.87±59.36)mg/(g·d),中规格的螺对伊乐藻的牧食率最高,为(47.67±10.2)mg/(g·d),但与苦草差异不显著,大规格的螺对水盾草的牧食率最低, 为(2.37±1.23)mg/(g·d)。大螺、中螺对苦草及伊乐藻的牧食率与小螺相比差异极显著(P < 0.01), 中螺与大螺对苦草及伊乐藻的牧食率差异不显著(P>0.05)。不同规格的螺对水盾草牧食率较低且差异不显著(P>0.05)。不同规格的椭圆萝卜螺对沉水植物的牧食选择性具有差异,在伊乐藻和苦草存在的情况下,幼螺和中规格的螺优先牧食伊乐藻和苦草,水盾草不是螺喜好的食物。由图 2看出,3种规格的螺对苦草和伊乐藻的选择指数均大于零,对水盾草的选择指数均小于零,说明在有苦草和伊乐藻存在的条件下,3种规格的椭圆萝卜螺会优先牧食这两种沉水植物。此外,就椭圆萝卜螺的食物组成而言,随着螺规格的增大,其对伊乐藻的牧食所占比例逐渐增大,对苦草所占份额逐渐减少(图 3)。即随着螺规格的增大,在总牧食率减少的同时,其牧食选择性也有所变化。
|
图 1 不同规格的螺对沉水植物的牧食率 Fig. 1 Grazing rate of Radix swinhoei with different sizes |
|
图 2 不同规格的螺对沉水植物的牧食选择 Fig. 2 Grazing choice of Radix swinhoei with different sizes |
|
图 3 不同规格的螺对沉水植物牧食的食物组成变化 Fig. 3 Food component of Radix swinhoei with different sizes |
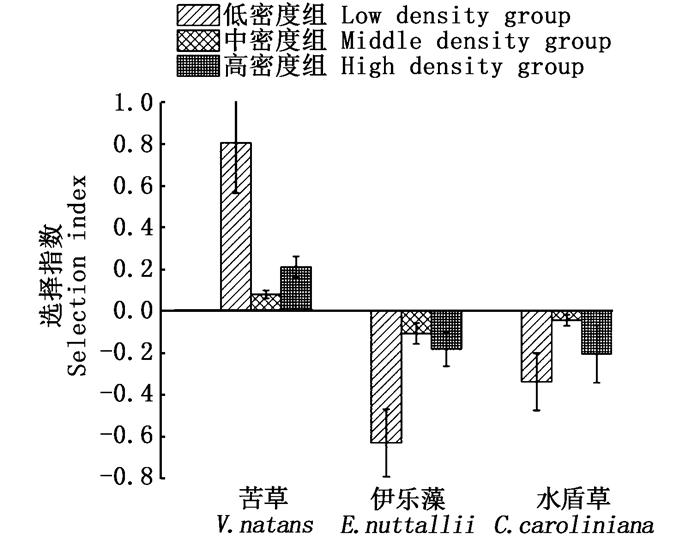
不同密度的小规格椭圆萝卜螺对沉水植物的牧食率有所差异,随着螺密度的增加,对沉水植物的总牧食量逐渐增加,分别为(1.65±0.04) g、(2.46±0.09) g、(5.30±0.23) g。但低密度与高密度的小规格螺对沉水植物的总牧食率差异不显著(P>0.05),分别为(112.15±36.75)mg/(g·d)和(125.11±45.11)mg/(g·d),中密度的螺的总牧食率较少, 为(82.06±16.68)mg/(g·d)。低密度的螺对苦草的牧食率最高,为(65.20±14.23) mg/(g·d);中密度的螺对伊乐藻牧食率最低,为(9.85±2.36)mg/(g·d)。同时,如图 4所示,不同密度的小规格椭圆萝卜螺对沉水植物的选择性有所差异,3个密度的小规格螺对苦草的选择指数均大于零,对其他两种沉水植物的选择指数均小于零,表明在有苦草存在的条件下不同密度的小规格螺都会优先牧食苦草。
|
图 4 不同密度的小规格螺对沉水植物的牧食选择 Fig. 4 Grazing choice of Radix swinhoei with different densities |
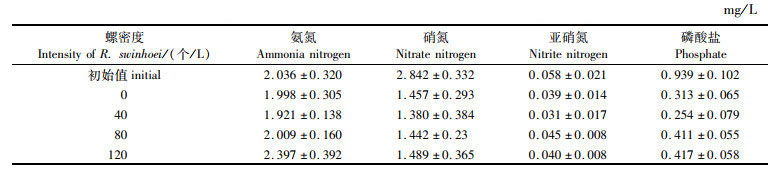
由表 1可知,对照组及各实验组营养盐浓度均低于实验初始值。实验组中随着螺密度的增加,营养盐释放量呈现增加趋势。实验结束后,低密度组的营养盐含量显著低于对照组及其他实验组。整体上高密度组的氨氮释放量最高,中密度组次之,低密度组最低。不同螺密度的实验组硝氮和亚硝氮营养盐含量变化不明显,磷酸盐含量下降较明显。
|
表 1 不同实验组水体营养盐的变化
Tab.1 Changes of nutrients under different treatments during the experiment |
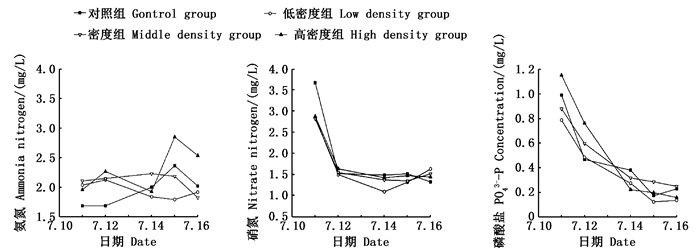
由图 5可知:在实验周期内,对照组氨氮逐渐上升,实验组氨氮在实验期间变化幅度较大,没有表现出明显的上升或下降趋势;硝氮含量整体呈下降趋势,但低密度组在后期缓慢上升;磷酸盐浓度在实验期间一直降低,对照组也一直表现逐渐下降的趋势;且对照组和实验低密度组的下降趋势较中、高密度组更快;中、高密度组与低密度组及对照组磷酸盐浓度差异显著(P < 0.05)。
|
图 5 不同密度组水体营养盐含量的变化 Fig. 5 Nutrient concentration change of Radix swinhoei with different densities |
本研究结果表明,椭圆萝卜螺牧食沉水植物会因螺的规格不同而有差异。虽然小规格螺对沉水植物的牧食量远远小于中规格和大规格螺,但小规格的椭圆萝卜螺对于3种沉水植物的总牧食率远远大于中规格与大规格螺,这与其他学者得出的实验结果一致[12-13]。原因可能是新生螺类新陈代谢较为旺盛,具有更高的代谢速率和更强的竞争能力,相比规格较大的螺需要牧食更多的食物促进发育[14-16]。但STEINMAN[17]研究发现福寿螺牧食附着藻时,小规格螺的牧食率明显低于大规格螺,这可能与螺的食性变化有关,螺规格增大改变了植物或附着生物的选择性。
另一方面,螺类的密度也是影响螺对沉水植物牧食率的因素之一。不同密度椭圆萝卜螺的食物组成有所差异。低密度时附着生物是椭圆萝卜螺的主要食物来源,但当螺密度较大时,其对苦草等水生植物的牧食量逐渐增加,表现出一定的牧食率。镜检结果表明,在本实验条件下,经过清洗的水生植物附着生物较少,对螺的牧食影响较低,因此可用于研究椭圆萝卜螺对沉水植物的牧食。杨章武等[18]的实验发现,密度超过1 500个/m2时,螺的生长速度明显低于较低密度组。本实验中,高密度组水体氨氮、亚硝氮等营养盐含量明显高于其他组。螺类密度过高,会导致水体排泄物增多,排泄物中的氨、尿素、二氧化碳等物质可能会影响水质和螺的生长,从而影响其对沉水植物的牧食率[19]。
3.2 植物特性对螺的牧食率和牧食选择性的影响螺对不同沉水植物的牧食率不同,这与螺的牧食选择性有关。PINOWSKA[20]研究表明,椭圆萝卜螺对伊乐藻具有一定的牧食率,但对水盾草的牧食率较低。这与本文研究结果相似,椭圆萝卜螺对3种沉水植物的牧食选择性有所差异,对苦草、伊乐藻的选择性较高,对水盾草的选择性较低,即在苦草、伊乐藻、水盾草同时存在的条件下会优先牧食苦草和伊乐藻,这可能是因为水生植物的生理结构、营养成分含量和分泌的化学物质直接影响螺类对它们的牧食情况[21]。魏云等[22]研究了3种沉水植物的营养成分,伊乐藻和苦草的粗纤维成分占干质量的26.71%和20.45%,远高于水盾草(9.78%)。高伟等[23]认为粗纤维更容易饱食,而本研究中椭圆萝卜螺在实验前经过48 h的饥饿处理,更喜好易饱食物,因此粗纤维含量可能是影响椭圆萝卜螺优先牧食的重要原因之一。也有国外学者研究发现,蛋白质含量与螺的适口性正相关[24], 而水盾草粗蛋白含量为6.72%,明显低于伊乐藻(23.53%)和苦草(18.95%),因此螺对水盾草的牧食偏好低于伊乐藻和苦草。此外,也有学者[11]发现沉水植物的酚类含量也可能对椭圆萝卜螺的牧食有一定影响,并选为评价椭圆萝卜螺适口性的因子。李永科[7]发现狐尾藻的酚类复合物含量极高,为35.0 mg/g干质量,苦草仅10.8 mg/g干质量,相比狐尾藻,椭圆萝卜螺更喜好牧食苦草。最后,沉水植物的生理结构也有可能导致螺的牧食选择差异。苦草叶片宽大,螺体可匍匐在叶片上,有利于其取食[16],而水盾草叶呈裂片线状,具刺状小齿,不易被螺取食,这可能也是导致水盾草不被椭圆萝卜螺选择的原因。
3.3 合理规格及密度螺的选择对生态修复工程的意义不同于经典的和非经典的生物操纵理论,椭圆萝卜螺作为一种底栖水生动物,通过对苦草等沉水植物的牧食选择,对水生生物调控有着十分重要的意义[25-26]。不同于环棱螺等底栖生物和植食性鱼类单一牧食,椭圆萝卜螺对沉水植物的牧食具有一定的独特性。它既可以牧食附着藻,也可以牧食沉水植物。修复工程通过投放螺的食物链摄食方式,可以控制苦草等沉水植物的过度生长,减少修复后期工程维护。但李宽意等[25]研究发现,当萝卜螺密度较低时(80个/m2),苦草叶片没有明显的损害痕迹,而密度升高后特别是高于240个/m2时,叶片上可见许多牧食疤痕,水面也经常漂浮破碎的苦草叶片。本文研究也表明,当螺密度达到120个/L时实验水体有大量沉水植物碎片漂浮,不仅污染水体,而且影响生态景观。所以生态修复工程中应合理地控制螺的密度[14, 16]。
3.4 结论(1) 椭圆萝卜螺对沉水植物的牧食与其自身的规格和密度均有关系,小规格螺对于苦草、伊乐藻和水盾草的总牧食率显著大于中规格螺与大规格螺,高密度螺对沉水植物的牧食量更高,且对水质有明显影响。
(2) 不同规格、不同密度的椭圆萝卜螺对3种沉水植物的牧食选择性差异较大,在苦草存在的情况下优先牧食苦草,其次为伊乐藻和水盾草,这对研究沉水植物在生态环境中的竞争优势有重要意义。
(3) 利用螺的牧食作用可以在生态修复过程中控制沉水植物的过度生长,低密度螺对水质有改善作用,但过高密度投放会对沉水植物和水质造成不利影响。因此,合理控制螺的组成及密度等对沉水植物生态修复具有重要意义。
| [1] |
张饮江, 刘晓培, 金晶, 等. 沉水植物对水体净化的研究进展[J]. 科技导报, 2012, 30(27): 72-79. ZHANG Y J, LIU X P, JIN J, et al. Research progress in submerged plant for purifying water quality[J]. Science & Technology Review, 2012, 30(27): 72-79. DOI:10.3981/j.issn.1000-7857.2012.27.012 |
| [2] |
CATARINO L F, FERREIRAM T, MOREIRA I S. Preferences of grass carp for macrophytes in Iberian drainage channels[J]. Journal of Aquatic Plant Management, 1997, 36: 79-83. |
| [3] |
杨清心, 李文朝. 高密度网围养鱼对水生植被的影响及生态对策探讨[J]. 应用生态学报, 1996, 7(1): 83-88. YANG Q X, LI W C. Effect of intensive pen fish farming on aquatic vegetation and its ecological strategy[J]. Journal of Applied Ecology, 1996, 7(1): 83-88. |
| [4] |
孙健, 贺锋, 张义, 等. 草鱼对不同种类沉水植物的摄食研究[J]. 水生生物学报, 2015, 39(5): 997-1002. SUN J, HE F, ZHANG Y, et al. The feeding behavior of grass carp (Ctenopharyngoden idellvs) on different types of submerged plants[J]. Acta Hydrobiologica Sinica, 2015, 39(5): 997-1002. |
| [5] |
JONES J I, YOUNG J O, HAYNES G M, et al. Do submerged aquatic plants influence their periphyton to enhance the growth and reproduction of invertebrate mutualists?[J]. Oecologia, 1999, 120(3): 463-474. DOI:10.1007/s004420050879 |
| [6] |
STRAND J A, WEISNER S E B. Morphological plastic responses to water depth and wave exposure in an aquatic plant (Myriophyllum spicatum)[J]. Journal of Ecology, 2001, 89(2): 166-175. DOI:10.1046/j.1365-2745.2001.00530.x |
| [7] |
李永科.沉水植物与牧食性螺类的关系研究[D].武汉: 武汉大学, 2004. LI Y K. Study on the relationship between submerged plants and herbivous snails[D]. Wuhan: Wuhan University, 2004. http://cdmd.cnki.com.cn/article/cdmd-10486-2006035427.htm |
| [8] |
LI Y K, YU D, XU X W, et al. Light intensity increases the susceptibility of Vallisneria natans to snail herbivory[J]. Aquatic Botany, 2005, 81(3): 265-275. DOI:10.1016/j.aquabot.2005.01.005 |
| [9] |
李宽意, 刘正文, 胡耀辉, 等. 椭圆萝卜螺Radix swinhoei(H. Adams)对三种沉水植物的牧食选择[J]. 生态学报, 2006, 26(10): 3221-3224. LI K Y, LIU Z W, HU Y H, et al. Snail Radix swinhoei(H. Adams) herbivory on three submerged plants[J]. Acta Ecologica Sinica, 2006, 26(10): 3221-3224. DOI:10.3321/j.issn:1000-0933.2006.10.008 |
| [10] |
闫智恒.白洋淀耳萝卜螺与沉水植物金鱼藻和菹草的生态关系研究[D].保定: 河北大学, 2009. YAN Z H. Ecological study of Radix auricularia with Ceratophyllum demersum, Potamogeton crispus in the Baiyangdian Lake[D]. Baoding: Hebei University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10075-2010023848.htm |
| [11] |
ELGER A, LEMOINE D. Determinants of macrophyte palatability to the pond snail Lymnaea stagnalis[J]. Freshwater Biology, 2010, 50(1): 86-95. |
| [12] |
LI K Y, LIU Z W, HU Y H, et al. Snail herbivory on submerged macrophytes and nutrient release:Implications for macrophyte management[J]. Ecological Engineering, 2009, 35(11): 1664-1667. DOI:10.1016/j.ecoleng.2008.05.009 |
| [13] |
FANG L, WONG PK, LIN L, et al. Impact of invasive apple snails in Hong Kong on wetland macrophytes, nutrients, phytoplankton and filamentous algae[J]. Freshwater Biology, 2010, 55(6): 1191-1204. DOI:10.1111/j.1365-2427.2009.02343.x |
| [14] |
CAO Y, LI W, JEPPESEN E. The response of two submerged macrophytes and periphyton to elevated temperatures in the presence and absence of snails:a microcosm approach[J]. Hydrobiologia, 2014, 738(1): 49-59. DOI:10.1007/s10750-014-1914-5 |
| [15] |
CARLSSON N O L, BRÖNMARK C. Size-dependent effects of an invasive herbivorous snail (Pomacea canaliculata) on macrophytes and periphyton in Asian wetlands[J]. Freshwater Biology, 2006, 51(4): 695-704. DOI:10.1111/j.1365-2427.2006.01523.x |
| [16] |
SALEWSKI V, HOCHACHKA W M, FLINKS H. Changes in Stonechat Saxicolatorquata morphology:a response to climate change?[J]. Journal of Ornithology, 2014, 155(3): 601-609. DOI:10.1007/s10336-014-1042-z |
| [17] |
STEINMAN A D. Effects of herbivore size and hunger level on periphyton communities[J]. Journal of Phycology, 1991, 27: 54-59. DOI:10.1111/j.0022-3646.1991.00054.x |
| [18] |
马进, 何文辉, 彭自然, 等. 大型溞-苦草配合处理富营养化水体的研究[J]. 上海海洋大学学报, 2018, 27(4): 515-521. MA J, HE W H, PENG Z R, et al. Study on water eutrophication treatment with Daphnia magna and Vallisneria natans control system[J]. Journal of Shanghai Ocean University, 2018, 27(4): 515-521. |
| [19] |
徐新伟, 于丹, 刘春花, 等. 椭圆萝卜螺对两种沉水植物生长的影响[J]. 水生生物学报, 2002, 26(6): 719-721. XU X W, YU D, LIU C H, et al. The influence of radix swinhoei on the growth of two species of submerged plant[J]. Acta Hydrobiologica Sinica, 2002, 26(6): 719-721. DOI:10.3321/j.issn:1000-3207.2002.06.024 |
| [20] |
PINOWSKA A. Effects of snail grazing and nutrient release on growth of the macrophytes Ceratophyllumdem ersum and Elodea canadensis and the filamentous green alga Cladophora sp.[J]. Hydrobiologia, 2002, 479(1/3): 83-94. DOI:10.1023/A:1021070616130 |
| [21] |
BOLSERR C, HAYM E, LINDQUISTN, et al. Chemical defenses of freshwater macrophytes against crayfish herbivory[J]. Journal of Chemical Ecology, 1998, 24(10): 1639-1658. DOI:10.1023/A:1020816511924 |
| [22] |
魏云, 陈源高, 刘正文, 等. 草鱼、团头鲂对伊乐藻的消化与利用[J]. 湖泊科学, 1996, 8(s1): 63-72. WEI Y, CHEN Y G, LIU Z W, et al. Digestion and utilization of Elodea nvttallil by Ctenopharynyodon idella and Megawbrama amblycephala[J]. Journal of Lake Sciences, 1996, 8(s1): 63-72. |
| [23] |
高伟, 胡灵卫, 王洁玉, 等. 伊乐藻抗椭圆萝卜螺牧食损害能力研究[J]. 水生态学杂志, 2015, 36(6): 46-50. GAO W, HU L W, WANG J Y, et al. Ability of Elodea nuttallii to resist grazing by Radix swinhoei[J]. Journal of Hydroecology, 2015, 36(6): 46-50. |
| [24] |
ELGER A, LEMOINE D. Determinants of macrophyte palatability to the pond snail Lymnaea stagnalis[J]. Freshwater Biology, 2010, 50(1): 86-95. |
| [25] |
李宽意, 刘正文, 李传红, 等. 太湖椭圆萝卜螺的食物来源分析[J]. 湖泊科学, 2008, 20(3): 339-343. LI K Y, LIU Z W, LI C H, et al. Food sources of snail Radix swinhoei in Lake Taihu[J]. Journal of Lake Sciences, 2008, 20(3): 339-343. DOI:10.3321/j.issn:1003-5427.2008.03.012 |
| [26] |
文明章.营养盐及螺牧食对沉水植物(苦草)生长的影响[D].南京: 南京信息工程大学, 2008. WEN M Z. The effects of nutrients and snails grazing on growth of submergeed macrophytes (Vallisneria spiralis)[D]. Nanjing: Nanjing University of Information Science & Technology, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10300-2008092111.htm |
2. Shanghai Taihe Water Environment Co., Ltd. Shanghai 200433, China
 2020,
Vol. 29
2020,
Vol. 29


