2. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306;
5. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071
生物个体的生长是其发育的物质基础,而发育及其成熟状况则表征其生长的质与量的变化[1-2]。头足类是高等级的海洋软体动物,除鹦鹉螺属(Nautilus)外,其生命周期短、终生一次繁殖产卵、性腺发育滞后于个体生长,且性腺成熟至繁殖死亡的时间仅占其生活史的10%~20%[3-4]。这些种类被认为是“活在今天”的机会主义者[5-6],对栖息环境的波动变化高度敏感[3],在其终生一次繁殖产卵的生活史特性下进化出了瞬时终端产卵、间歇终端产卵、多次产卵等繁殖策略[7]。通常,这些种类的同一种之内存在多产卵种群,每个产卵种群仅有一个繁殖季节[8];但是这些种类的繁衍延续往往依赖于因繁殖季节差异形成的长短寿命世代之间的繁衍交替,并且这种世代繁衍交替决定于仔鱼的孵化季节[3, 9-10]。
阿根廷滑柔鱼(Illex argentinus)隶属于头足纲(Cephalopoda)枪形目(Teuthoidea)柔鱼科(Ommastrephidae),是西南大西洋海域的特有种[11]。同时,因其资源量丰富且在南巴西外海至福克兰群岛之间季节性的索饵-产卵洄游,该种类被认为是西南大西洋生态系统中重要生态指示种,在西南大西洋生态系统中扮演着重要的“生物泵”作用[12]。此外,该种类寿命短、世代更替快,自20世纪70年代以来已成为世界渔业开发的重要经济型头足类,其渔获量占西南大西洋头足类总渔获量的87%,平均占世界头足类总产量的10%以上[13],也是我国远洋鱿钓渔业中的三大捕捞对象之一[14]。目前,国内外对阿根廷滑柔鱼的年龄生长[4, 15]、性腺发育[16-17]、繁殖产卵[18-19]和生殖投入[20-21]等进行了较多的研究,发现该种类的生长发育具有灵活的环境适应性,且与其早期生活史密切相关[11]。那么,仔鱼的孵化季节可能对该种类的早期生活史及种群延续产生重要的效应作用,并且影响着这些个体的生长发育及其生物学最小型的获得。为此,基于耳石日龄判读和孵化月份推算,利用生物统计学和广义线性混合效应模型(generalized linear mixed-effects models, GLMM)初步分析阿根廷滑柔鱼性腺成熟胴长及其生活史生长速率与孵化月份之间的效应关系,旨在丰富对该种类生长发育的认识,为可持续开发利用该种类资源提供科学基础。
1 材料与方法 1.1 样本来源阿根廷滑柔鱼样本来自我国远洋鱿钓渔业作业船新世纪52号和浙远渔807号的渔获物。样本采集时间为2007年2—5月、2008年3—5月和2010年1—3月,采集海域为西南大西洋公海40°02′S~47°14′S、57°55′W~60°47′W。海上共采集样本3 462尾(其中2007年308尾、2008年262尾、2010年2 892尾),样本采集后经冷冻保存运回实验室进行生物学分析。
1.2 生物学测定分析阿根廷滑柔鱼样本在实验室常温解冻后,进行生物学测定,测定分析项目包括胴长(mantle length, ML)、性别、性腺成熟度以及耳石摘取及其日龄读取等。胴长测定精确到1 mm。
以LIPIŃSKI等[22]的性腺成熟度划分标准为基础,结合实验的观察结果进行Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ五期的判别。其中,Ⅰ~Ⅱ期为未成熟、Ⅲ~Ⅳ期为性成熟、Ⅴ期为繁殖后。
样本耳石提取自阿根廷滑柔鱼的头部平衡囊,编号后置于95%乙醇溶液中保存,以便清除包裹耳石的软膜和表面的有机物质。耳石经研磨制备成切片后置于Olympus光学显微镜下拍照观察、计数判读轮纹数目以获得日龄数据,随后结合捕捞日期,推算其孵化日期。具体的耳石提取及其保藏方法、耳石切片研磨、微结构轮纹数目读取,以及日龄数据判读和孵化日期推算等,详见文献[23]。
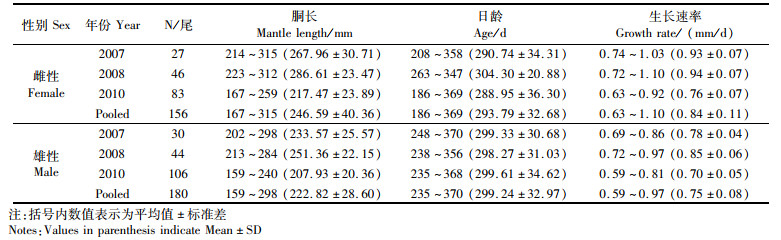
1.3 数据处理通常,阿根廷滑柔鱼与其他头足类属种相一致,其生活史表现为性腺发育滞后于肌肉生长,且性腺成熟后肌肉组织逐渐停止生长[24],性腺成熟时的体型大小基本表征为该个体的实际大小。为此,随机选取性腺发育成熟(Ⅲ~Ⅳ期)的阿根廷滑柔鱼样本336尾,其中雌性156尾、雄性180尾(表 1),以进行该种类生长发育与其孵化季节之间的关系研究,并计算个体胴长与日龄之间的比值作为其生活史平均生长速率(life history average growth rate)[3],以作为个体生长发育及性腺成熟胴长的综合表征。
|
表 1 阿根廷滑柔鱼胴长、日龄和生长速率组成 Tab.1 Mantle length, body weight and days of age of Illex argentinux |
应用单因素方差分析(one-way analysis of variance, ANOVA)进行阿根廷滑柔鱼性腺成熟个体胴长、日龄和生活史平均生长率等与其孵化季节的差异性分析,并应用Tukey HSD检验进行差异性分析后的多重差异性分析,以确定这些生长发育特性对孵化季节的响应关系。同时,因为阿根廷滑柔鱼个体大小是其生长率的函数,生长率与孵化季节密切相关[25]。为此,为了进一步确定孵化季节对阿根廷滑柔鱼生长发育及其成熟胴长获得的影响,应用广义线性混合效应模型(generalized linear mixed-effects models, GLMM)进行阿根廷滑柔鱼性腺成熟胴长与生活史平均生长速率的拟合回归分析,模型中以孵化月份(hatching month, HM)作为随机效应变量及其对生活史平均生长速率的效应影响。模型方程[26]如下:
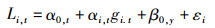 (1)
(1)
式中:Li, t为性成熟阿根廷滑柔鱼i在孵化月份t时的名义胴长(nominal mantle length),计算为阿根廷滑柔鱼i的胴长与样本年份y所有成熟个体胴长平均值之差,若差值为正,Li, t等于1,反之Li, t等于0;gi, t为性成熟阿根廷滑柔鱼i在孵化月份t时的生活史平均生长速率;αi, t为孵化月份对模型截距的随机影响;β0, y为年份对模型截距的随机影响;εi为模型误差项;αi, t为生活史平均生长速率与孵化月份交互作用对性腺成熟个体胴长的效应。
基于GLMM模型结果,进行孵化月份随机效应对性腺成熟个体名义胴长的预测,绘制生活史平均生长速率-名义胴长概率分布图,以观察孵化月份对阿根廷滑柔鱼性成熟胴长大小的效应关系[26]。实验数据以平均值±标准差(Mean±SD)表示,显著性水平为P < 0.05。所有数据处理、模型拟合回归分析在统计分析R平台[27]进行,线性混合效应模型使用程序包lme4[28]进行回归分析。
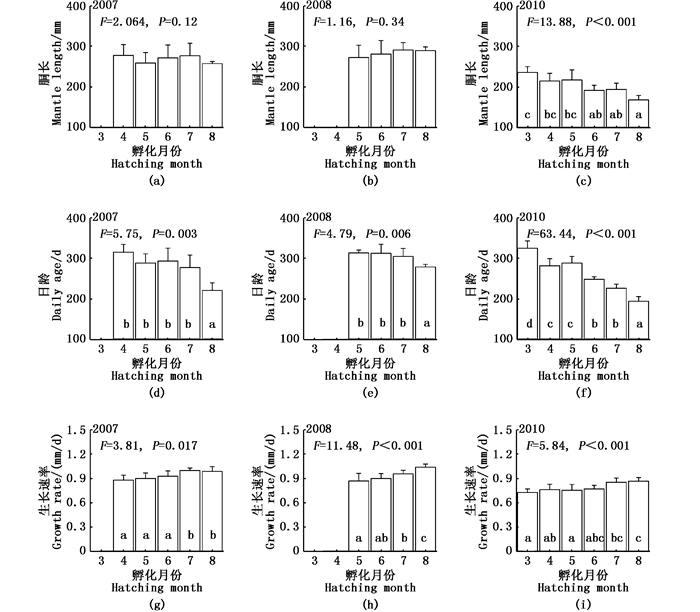
2 结果分析显示,性腺发育成熟的阿根廷滑柔鱼样本的孵化季节为南半球秋季3—5月和冬季6—8月。雌性个体中,2007年样本的孵化月份为4—8月,2008年样本以7月为主,2010年样本则以3—4月为主,见图 1a;雄性样本中,2007年样本以5月为主,2008年样本以6—7月为主,2010年样本则在3—5月相对集中,见图 1b。

|
图 1 性腺发育成熟的阿根廷滑柔鱼孵化季节分布 Fig. 1 Distribution of mature Illex argentinus in different hatching seasons |
阿根廷滑柔鱼雌性个体性成熟胴长为167~315 mm,平均值为(246.59±40.36) mm;日龄为186~369 d,平均值为(293.79±32.68) d;生活史平均生长速率为0.63~1.10 mm/d,平均值为(0.84±0.11) mm/d。见表 1。其中,2010年性腺成熟的个体最小(F=124.51, P < 0.01),胴长平均值为(217.47±23.89) mm。不同年份之间,这些性腺成熟个体的日龄没有显著差异(F= 1.52,P>0.05);然而,2010年性成熟个体的生长速率显著低于2007年和2008年(F= 131.90,P < 0.01)。
在不同孵化月份,2007年和2008年的雌性个体性腺成熟胴长均没有显著差异(2007年,F=2.06, P>0.05;2008年,F=1.16, P>0.05);随着孵化月份推移,2010年的雌性个体性成熟胴长显著下降(F=13.88, P < 0.01),且在孵化月份8月份时性成熟胴长最小(P < 0.05),见图 2a~b。然而,2007年、2008年和2010年各年份雌性个体的性成熟日龄变化相一致,随着孵化月份推移显著降低(2007年,F=5.75, P < 0.01;2008年,F=4.79, P < 0.01;2010年,F=63.44, P < 0.01),且均在孵化月份8月时日龄最小(P < 0.05),见图 2d~f。相反,各年份性成熟雌性个体的生长速率随着孵化月份推移显著地增加(2007年,F=3.81, P < 0.05;2008年,F=11.48, P < 0.01;2010年,F=5.84, P < 0.01),在孵化月份8月时生长速率最大(P < 0.05),见图 2g~i。
|
各组平均值中标示的不同字母表示Tukey HSD检验差异显著(P < 0.05) Mean values with different scripts are significantly different (P < 0.05) as determined using Tukey HSD test 图 2 阿根廷滑柔鱼雌性个体的性成熟胴长、日龄和生活史平均生长速率随孵化月份的分布 Fig. 2 Hatching monthly distribution of mantle length, days of age and average growth rate of mature female Illex argentinus |
广义线性混合效应模型(GLMM)结果显示,阿根廷滑柔鱼雌性个体性成熟胴长大小与其生活史平均生长速率密切相关(Z=4.43,P < 0.001),孵化月份的效应方差为31.10±5.58,生长速率与孵化月份交互作用的效应方差为6.81±2.61,生长速率和孵化月份等对其成熟胴长获得的合计方差解释率为87%(Rc2=0.87)(表 2)。同时,生长速率与孵化月份相互效应对成熟胴长大小的影响分布显示,孵化月份对阿根廷滑柔鱼雌性个体性成熟胴长的效应具有一致性,晚孵化个体具有较快的生长速率以达到成熟胴长(图 3)。

|
表 2 阿根廷滑柔鱼雌性个体成熟胴长与生长速率×孵化月份交互作用的广义线性混合效应模型结果 Tab.2 Generalized linear mixed-effects model results for sexual maturity size in relation to life history average growth rate × hatching month interaction effects in mature size availability of female Illex argentinus |

|
黑色圆点为名义胴长原始数据,不同透明度蓝色圆点为孵化月份随机效应影响下的名义胴长概率预测 Solid black points indicate the raw data of nominal mantle length, gradient blue points indicate the predictions of probability of nominal mantle length accounting for random effects of hatching month 图 3 生活史平均生长速率与孵化月份相互效应对阿根廷滑柔鱼雌性合体成熟胴长大小的影响 Fig. 3 The interaction effects of life history average growth rate × hatching month on the attainment of mature mantle length in female Illex argentinus |
阿根廷滑柔鱼雄性个体的性腺成熟胴长为159~298 mm,平均值为(222.82±28.60)mm;日龄为235~370 d,平均值为(299.24±32.97)d;生活史平均生长速率为0.58~0.97 mm/d,平均值为(0.75±0.08) mm/d(表 1)。类似于雌性个体,2010年性腺成熟的雄性个体胴长最小(ANOVA:F=66.53, P < 0.001),平均值为(207.93±20.36)mm。然而,这些性腺成熟个体的日龄没有显著的差异性(ANOVA,F= 0.026,P=0.97);而不同年份性腺成熟个体的生活史平均生长速率差异性显著(ANOVA,F=126.81,P < 0.001),以2010年性腺成熟个体的生长速率最低(Tukey HSD, P < 0.05),为(0.70±0.05)mm/d。
随着孵化月份推移,2007年和2010年的性腺成熟雄性个体胴长均显著下降(ANOVA: 2007年,F=3.82, P=0.022;2010年,F=18.84, P < 0.001);2008年的性腺成熟雌性个体胴长呈下降趋势,但没有显著差异(F=0.81, P=0.50),见图 4a~c。同时,随着孵化月份推移,各年份性腺成熟雄性个体的日龄显著降低(ANOVA: 2007年,F=9.67, P < 0.001;2008年,F=6.92, P=0.001;2010年,F=49.50, P < 0.001),且均在孵化月份8月份时最小(Tukey HSD, P < 0.05),见图 4d~f。然而,各年份性腺成熟雄性个体的生活史平均生长速率随着孵化月份推移逐渐增加,并且2008年和2010年的增加显著(ANOVA: 2008年,F=8.45, P < 0.001;2010年,F=6.83, P < 0.001),其中2008年个体生长速率在8月份时达到最大值(Tukey HSD, P < 0.05),2010年个体在5月和6月时的生长速率显著高于其他月份(Tukey HSD, P < 0.05),见图 4g~i。

|
各组平均值中标示的不同字母表示Tukey HSD检验差异显著(P < 0.05) Mean values with different scripts are significantly different (P < 0.05) as determined using Tukey HSD test 图 4 阿根廷滑柔鱼性成熟雄性个体的胴长、日龄和平均生长速率随孵化月份的分布 Fig. 4 Hatching monthly distribution of mantle length, days of age and average growth rate of mature male Illex argentinus |
此外,与雌性个体相一致,阿根廷滑柔鱼雄性个体成熟胴长与其生活史平均生长速率密切相关(Z=4.14,P < 0.001),孵化月份的效应方差为16.90±4.11,生长速率与孵化月份交互作用的效应方差为23.90±4.89,生长速率和孵化月份对其成熟胴长获得的合计方差解释率为84%(Rc2=0.84),见表 3。同时,生长速率与孵化月份相互效应对雄性个体成熟胴长大小的影响分布显示,早孵化的个体生长速率较慢,而晚孵化个体具有较快的生长速率以达到成熟胴长,见图 5。

|
表 3 阿根廷滑柔鱼雄性个体成熟胴长与生活史平均生长速率与孵化月份交互作用的广义线性混合效应模型结果 Tab.3 Generalized linear mixed-effects model results for sexual maturity mantle length in relation to life history average growth rate × hatching month interaction effects in mature size availability of male Illex argentinus |

|
黑色圆点为名义胴长原始数据,不同透明度蓝色圆点为孵化月份随机效应影响下的名义胴长概率预测 Solid black points indicate the raw data of nominal mantle length, gradient blue points indicate the predictions of probability of nominal mantle length accounting for random effects of hatching month 图 5 生活史平均生长率与孵化月份相互效应对阿根廷滑柔鱼雄性个体成熟胴长大小的影响 Fig. 5 The interaction effects of life history average growth rate × hatching month on the attainment of mature mantle length in male Illex argentinus |
基于耳石日龄判读分析,阿根廷滑柔鱼性腺成熟样本的最大日龄为370 d,并且2007、2008和2010年3个年份样本的平均日龄差异不显著(P>0.05),说明这些个体的生命周期应该在15个月以内。该结果与ARKHIPKIN等[25]所研究阿根廷专属经济区外水域的阿根廷滑柔鱼性腺成熟群体的年龄相近(~360 d),而高于巴西南部海域性腺成熟个体的年龄(~280 d)[17]。基于孵化月份推算,阿根廷滑柔鱼性腺成熟样本的孵化月份在南半球3—8月份,其中2010年的样本孵化月份最全,2007和2008年样本的孵化月份则分别在4—8月份和5—8月份,表明这些性腺成熟样本均属于秋生群和冬生群[23]。ARKHIPKIN等[25]的研究也发现,南半球秋冬季节是阿根廷滑柔鱼的一个孵化期,阿根廷专属经济区外海42°S和45°S~47°S的群体以秋生群和冬生群为主。
随着孵化月份推移,各年份阿根廷滑柔鱼性腺成熟个体的日龄显著降低,而生活史平均生长速率逐渐增加,并且除了2007年雄性成熟个体之外,其他年份雌雄个体的生活史平均生长速率均增加显著。这说明孵化较晚的阿根廷滑柔鱼具有较快的生长速率,结果与RODHOUSE等[29]的结果相一致。这可能是其终生一次繁殖产卵[11]的生活史策略之一,晚孵化个体以较快的生长速率以在繁殖产卵季节到来时达到性腺成熟胴长[10]。同时,头足类为典型的海洋“机会主义者”,生长发育与栖息水域的水温、饵料丰度等密切相关[5, 9]。比如,福氏枪乌贼(Loligo forbesi)仔鱼在饲养水温14 ℃时的生长速率为3.6%体质量/d,而在饲养水温17.25 ℃时的生长速率则高达8.0%体质量/d[10]。而且,这些种类的代谢速率快,饵料丰富时可持续摄食而不存在过度摄食的情况[30]。既有研究[21, 31-32]也表明,阿根廷滑柔鱼的生长发育与其栖息水域环境密切相关,适宜的水温、丰富的饵料生物是仔稚鱼存活、生长发育的关键环境因子。在西南大西洋,海洋环境有着明显季节变化,水温和初级生产力等在上半年(1—6月)呈现逐渐降低的趋势,而下半年(7—12月)则逐渐趋好[33-35]。因此,随着孵化月份(南半球3—8月)推移,早孵化与晚孵化的阿根廷滑柔鱼仔鱼将会经历不同的水域环境变化过程和生长发育过程[31-32]。其中,早孵化的阿根廷滑柔鱼仔稚鱼(3—4月孵化)将经历水温和初级生长力较低的南半球秋冬季节,而那些在晚秋-冬季孵化的仔稚鱼(5—8月份孵化)则经历水温逐渐升高、初级生长率逐渐加强的南半球春夏季[11]。随之,早孵化的个体其生活史生长速率相对较低,而晚孵化的个体则具有较快的生长速率。
同时,广义线性混合效应模型的结果显示,阿根廷滑柔鱼性腺成熟个体名义胴长与其生活史平均生长速率密切相关,并且孵化月份对其性腺成熟胴长获得的效应影响具有一致性。这结果与福赛思假设(Forsythe Hypothesis)[10]相统一,即较晚孵化的个体比孵化较早,年龄更长的个体具有更快的生长速率。然而,随着孵化月份推移,2007和2008年雌性性腺成熟个体的胴长大小没有显著的差异性,而2010年性腺成熟个体的胴长下降显著;雄性成熟个体胴长在2007年和2010年时随着孵化月份推移显著下降,2008年性腺成熟个体胴长大小没有差异性。一方面,说明孵化月份对阿根廷滑柔鱼性腺成熟胴长大小的影响存在一定的年间差异性,并且也可能存在雌雄差异性。另一方面,这种现象可能与其“活在今天”的生活史策略[5]密切相关,即这些生命周期短的种类充分利用适宜的自然条件快速生长发育,以响应即将到来的繁殖季节[3, 36]。此外,这些种类性腺发育滞后于肌肉组织生长,而性腺发育成熟之后其肌肉组织生长速率迅速降低甚至停止[24],为性腺发育投入更多的能量以供给配子发生[19-20]。因此,该种类性腺成熟胴长获得对孵化月份的响应可能是这些短生命周期种类在其生长速率、肌肉组织生长与生殖繁衍之间的权衡[37],以实现生殖产出及其后代存活的最优化[7]。
综上所述,阿根廷滑柔鱼的生长发育与孵化季节密切相关,较早孵化个体的生长速率较低、晚孵化个体的生长速率较快以达到其性腺成熟胴长。同时,孵化季节对阿根廷滑柔鱼性腺成熟个体大小获得的影响与福赛思假设[10]相统一,并且这种影响效应可能是这些短生命周期种类在生长速率、肌肉组织生长与生殖繁衍之间的一种权衡[37],使其生长发育有效响应并利用适宜的外界环境,实现生殖产出及其后代存活的最优化[7]。然而,这些种类对栖息环境的波动变化高度敏感[3],今后的研究仍需加强样本采集以及生活史环境因子(如水温、叶绿素浓度等)收集,以充分认知孵化季节对其生长发育的效应影响。此外,由于阿根廷滑柔鱼孵化季节对其生长发育有着重要的效应影响,而孵化季节往往与渔业时间有所重叠,因此,在进行该种类资源评估和管理方法制定[38]时,需要增加考虑孵化季节对个体生长发育的影响,保证每个孵化季节有足够的性腺成熟个体数量,以确保并维持补充群体资源量及其可持续利用。
| [1] |
MILLER T J, CROWDER L B, RICE J A, et al. Larval size and recruitment mechanisms in fishes:toward a conceptual framework[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1988, 45(9): 1657-1670. DOI:10.1139/f88-197 |
| [2] |
BERKELEY S A, CHAPMAN C, SOGARD S M. Maternal age as a determinant of larval growth and survival in a marine fish, Sebastes melanops[J]. Ecology, 2004, 85(5): 1258-1264. DOI:10.1890/03-0706 |
| [3] |
BOYLE P, RODHOUSE P. Cephalopods:ecology and fisheries[M]. Oxford, UK: Wiley-Blackwell, 2005.
|
| [4] |
SCHWARZ R, PEREZ J A A. Age structure and life cycles of the Argentine shortfin squid Illex argentinus (Cephalopoda:Ommastrephidae) in southern Brazil[J]. Journal of the Marine Biological Association of the United Kingdom, 2013, 93(2): 557-565. DOI:10.1017/S0025315412000331 |
| [5] |
PECL G T, MOLTSCHANIWSKYJ N A. Life history of a short-lived squid (Sepioteuthis australis):resource allocation as a function of size, growth, maturation, and hatching season[J]. ICES Journal of Marine Science:Journal du Conseil, 2006, 63(6): 995-1004. DOI:10.1016/j.icesjms.2006.04.007 |
| [6] |
魏广恩, 陈新军, 李纲. 西北太平洋柔鱼洄游重心年际变化及预测[J]. 上海海洋大学学报, 2018, 27(4): 573-583. WEI G E, CHEN X J, LI G. Interannual variation and forecasting of Ommastrephes bartramii migration gravity in the northwest Pacific Ocean[J]. Journal of Shanghai Ocean University, 2018, 27(4): 573-583. |
| [7] |
ROCHA F, GUERRA Á, GONZÁLEZ Á F. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 2001, 76(3): 291-304. DOI:10.1017/S1464793101005681 |
| [8] |
O'DOR R. Squid life-history strategies[R]. FAO fisheries technical paper, No.376. Rome: FAO, 1998: 233-254.
|
| [9] |
PECL G. Flexible reproductive strategies in tropical and temperate Sepioteuthis squids[J]. Marine Biology, 2001, 138(1): 93-101. DOI:10.1007/s002270000452 |
| [10] |
FORSYTHE J W. Accounting for the effect of temperature on squid growth in nature:from hypothesis to practice[J]. Marine and Freshwater Research, 2004, 55(4): 331-339. DOI:10.1071/MF03146 |
| [11] |
RODHOUSE P G K, ARKHIPKIN A I, LAPTIKHOVSKY V, et al. Illex argentinus, Argentine shortfin squid[M]//ROSA R, PIERCE G, O'DOR R. Advances in Squid Biology, Ecology and Fisheries. Part Ⅱ-Oegopsid Squids. New York: Nova Science Publishers, 2013: 109-148.
|
| [12] |
ARKHIPKIN A I. Squid as nutrient vectors linking Southwest Atlantic marine ecosystems[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2013, 95: 7-20. DOI:10.1016/j.dsr2.2012.07.003 |
| [13] |
F AO. Review of the state of world marine fishery resources[M]. Rome: Food and Agriculture Organization of the United Nations, 2011: 1-18.
|
| [14] |
陈新军, 陆化杰, 刘必林, 等. 大洋性柔鱼类资源开发现状及可持续利用的科学问题[J]. 上海海洋大学学报, 2012, 21(5): 831-840. CHEN X J, LU H J, LIU B L, et al. Current exploitation and some scientific issues in the sustainable utilization of Ommastrephidae[J]. Journal of Shanghai Ocean University, 2012, 21(5): 831-840. |
| [15] |
陆化杰, 陈新军, 方舟, 等. 西南大西洋阿根廷滑柔鱼耳石微结构及生长特性[J]. 渔业科学进展, 2012, 33(3): 15-25. LU H J, CHEN X J, FANG Z, et al. Statolith microstructure and growth characteristics of Illex argentinus in the southwest Atlantic Ocean[J]. Progress in Fishery Sciences, 2012, 33(3): 15-25. DOI:10.3969/j.issn.1000-7075.2012.03.003 |
| [16] |
林东明, 孙程婕, 宣思鹏, 等. 雌性阿根廷滑柔鱼性腺发育阶段的脂肪酸组成及其变化[J]. 上海海洋大学学报, 2019, 28(3): 409-418. LIN D M, SUN C J, XUAN S P, et al. Fatty acid composition and its changes during sexual maturation in female Illex argentinus[J]. Journal of Shanghai Ocean University, 2019, 28(3): 409-418. |
| [17] |
SCHWARZ R, PEREZ J A A. Growth model identification of short-finned squid Illex argentinus (Cephalopoda:Ommastrephidae) off southern Brazil using statoliths[J]. Fisheries Research, 2010, 106(2): 177-184. DOI:10.1016/j.fishres.2010.06.008 |
| [18] |
LAPTIKHOVSKY V V, NIGMATULLIN C M. Egg size, fecundity, and spawning in females of the genus Illex (Cephalopoda:Ommastrephidae)[J]. ICES Journal of Marine Science:Journal du Conseil, 1993, 50(4): 393-403. DOI:10.1006/jmsc.1993.1044 |
| [19] |
LIN D M, CHEN X J, CHEN Y, et al. Ovarian development in Argentinean shortfin squid Illex argentinus:group-synchrony for corroboration of intermittent spawning strategy[J]. Hydrobiologia, 2017, 795(1): 327-339. DOI:10.1007/s10750-017-3154-y |
| [20] |
林东明, 陈新军, 魏嫣然, 等. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入[J]. 水产学报, 2017, 41(1): 70-80. LIN D M, CHEN X J, WEI Y R, et al. Energy accumulation of both somatic and reproductive tissues and its allocation to reproduction in Argentinean short-fin squid (Illex argentinus)[J]. Journal of Fisheries of China, 2017, 41(1): 70-80. |
| [21] |
LIN D M, CHEN X J, WEI Y R, et al. The energy accumulation of somatic tissue and reproductive organs in post-recruit female Illex argentinus and the relationship with sea surface oceanography[J]. Fisheries Research, 2017, 185: 102-114. DOI:10.1016/j.fishres.2016.09.023 |
| [22] |
LIPIŃSKI M R, UNDERHILL L G. Sexual maturation in squid:quantum or continuum?[J]. South African Journal of Marine Science, 1995, 15(1): 207-223. DOI:10.2989/02577619509504844 |
| [23] |
陆化杰, 陈新军. 利用耳石微结构研究西南大西洋阿根廷滑柔鱼的日龄、生长与种群结构[J]. 水产学报, 2012, 36(7): 1049-1056. LU H J, CHEN X J. Age, growth and population structure of Illex argentinus based on statolith microstructure in Southwest Atlantic Ocean[J]. Journal of Fisheries of China, 2012, 36(7): 1049-1056. |
| [24] |
ARKHIPKIN A. Age, growth, stock structure and migratory rate of pre-spawning short-finned squid Illex argentinus based on statolith ageing investigations[J]. Fisheries Research, 1993, 16(4): 313-338. DOI:10.1016/0165-7836(93)90144-V |
| [25] |
ARKHIPKIN A, LAPTIKHOVSKY V. Seasonal and interannual variability in growth and maturation of winter-spawning Illex argentinus (Cephalopoda, Ommastrephidae) in the Southwest Atlantic[J]. Aquatic Living Resources, 1994, 7(4): 221-232. DOI:10.1051/alr:1994025 |
| [26] |
ZUUR A F, IENO E N, WALKER N J, et al. Mixed effects models and extensions in ecology with R[M]. New York: Springer-Verlag, 2009.
|
| [27] |
R CORE TEAM. R:A language and environment for statistical computing[M]. Vienna, Austria: R Foundation for Statistical Computing, 2018.
|
| [28] |
BATES D, MÄCHLER M, BOLKER B, et al. Fitting linear mixed-effects models using lme4[J]. Journal of Statistical Software, 2015, 67(1): 54008. |
| [29] |
RODHOUSE P G, HATFIELD E M C. Dynamics of growth and maturation in the cephalopod Illex argentinus de Castellanos, 1960(Teuthoidea:Ommastrephidae)[J]. Philosophical Transactions of the Royal Society of London B:Biological Sciences, 1990, 329(1254): 229-241. DOI:10.1098/rstb.1990.0167 |
| [30] |
BORER K T. Control of food intake in Octopus briareus Robson[J]. Journal of comparative and Physiological Psychology, 1971, 75(2): 171-185. DOI:10.1037/h0030815 |
| [31] |
ANDERSON C I H, RODHOUSE P G. Life cycles, oceanography and variability:ommastrephid squid in variable oceanographic environments[J]. Fisheries Research, 2001, 54(1): 133-143. DOI:10.1016/S0165-7836(01)00378-2 |
| [32] |
VIDAL E A G, HAIMOVICI M, HACKBART V C S. Distribution of paralarvae and small juvenile cephalopods in relation to primary production in an upwelling area off southern Brazil[J]. ICES Journal of Marine Science:Journal du Conseil, 2010, 67(7): 1346-1352. DOI:10.1093/icesjms/fsq080 |
| [33] |
VIÑAS M D, NEGRI R M, CEPEDA G D, et al. Seasonal succession of zooplankton in coastal waters of the Argentine Sea (Southwest Atlantic Ocean):prevalence of classical or microbial food webs[J]. Marine Biology Research, 2013, 9(4): 371-382. DOI:10.1080/17451000.2012.745003 |
| [34] |
DIAS C O, ARAUJO A V, VIANNA S C, et al. Spatial and temporal changes in biomass, production and assemblage structure of mesozooplanktonic copepods in the tropical south-west Atlantic Ocean[J]. Journal of the Marine Biological Association of the United Kingdom, 2015, 95(3): 483-496. DOI:10.1017/S0025315414001866 |
| [35] |
RUMBOLD C, OBENAT S, VELAZQUEZ S N, et al. Seasonal variation of peracarid assemblages in natural and artificial marine environments of the Southwestern Atlantic Ocean[J]. Marine Biodiversity, 2018, 48(4): 1743-1754. DOI:10.1007/s12526-017-0663-x |
| [36] |
LAPTIKHOVSKY V, NIKOLAEVA S, ROGOV M. Cephalopod embryonic shells as a tool to reconstruct reproductive strategies in extinct taxa[J]. Biological Reviews, 2017, 93(1): 270-283. |
| [37] |
STEARNS S C. The path to life history evolution[J]. The Bulletin of the Ecological Society of America, 2014, 95(2): 121. DOI:10.1890/0012-9623-95.2.23 |
| [38] |
陈新军. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策[J]. 上海海洋大学学报, 2019, 28(3): 321-330. CHEN X J. Development status of world cephalopod fisheries and suggestions for squid jigging fishery in China[J]. Journal of Shanghai Ocean University, 2019, 28(3): 321-330. |
2. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
5. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, Shandong, China
 2020,
Vol. 29
2020,
Vol. 29


