2. 浙江省海洋水产研究所, 浙江 舟山 316021;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 农业农村部大洋渔业开发重点实验室, 上海 201306;
6. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
长蛸(Octopus minor)隶属于头足纲(Cephalopoda),八腕目(Octopoda),蛸科(Octopodidae),广泛分布于中国、韩国和日本的温带沿岸海域,在我国各海域沿岸均有分布[1-2]。浙江的近海海域具有丰富的头足类资源,随着日本无针乌贼(Sepiella japonica)经历了过度开发直接导致资源量下降后,许多新的头足类资源种类被不断地开发[3-5]。近些年来,针对浙江沿岸海域的头足类群落分布的变化已有较多的研究[3, 5],头足类群落的种类组成已经发生了很大的变化:以往主要为以日本无针乌贼为主的乌贼科(Sepiidae)种类和以剑尖枪乌贼(Loligo edulis)为主的枪乌贼科(Loliginidae)种类[4-5]组成;近些年来,长蛸、短蛸(Amphioctopus fangsiao)等蛸科种类在春夏季的浙江北部近岸海域占有较大的比重,且不同年月间存在较大的差异[3, 5]。海洋环境是影响头足类栖息分布的主要因素[6],而目前研究主要集中在远洋中上层柔鱼类中[7-8],而针对海洋环境对蛸类分布影响的研究却很少。前人研究通常利用广义加性模型(generalized addictive model,GAM)来作为主要研究方法[9],近些年来,随着计算机技术的不断发展,机器学习方法也逐渐被人们所熟知,其中提升回归树(boosted regression tree,BRT)方法以其优良的算法,很好地结合了提升(boosting)和分类回归树(classification and regression tree, CART)两种技术,通过将大量的简单决策树组合来达到优化模型的目的[10-11],并应用于渔业相关分析[12]中。因此,本研究基于多年对浙江北部近岸海域的拖网调查数据,选取长蛸这一常见种类,分析其时空分布变化,并利用提升回归树方法研究影响长蛸分布的主要环境因素,为合理开发我国近岸头足类资源和渔业政策管理提供科学依据。
1 材料与方法 1.1 调查区域及站点本研究调查区域位于浙江北部沿岸海域(122°E~124°E,29°N~31°N),调查时间集中在春夏季,分别为2014年4—7月,2015年4—5和7月以及2016年4—5月,上述月份每月均开展一个航次调查,共设站点45个,2014年共调查站点40个,2015年为35个,2016年为38个,分布如图 1。
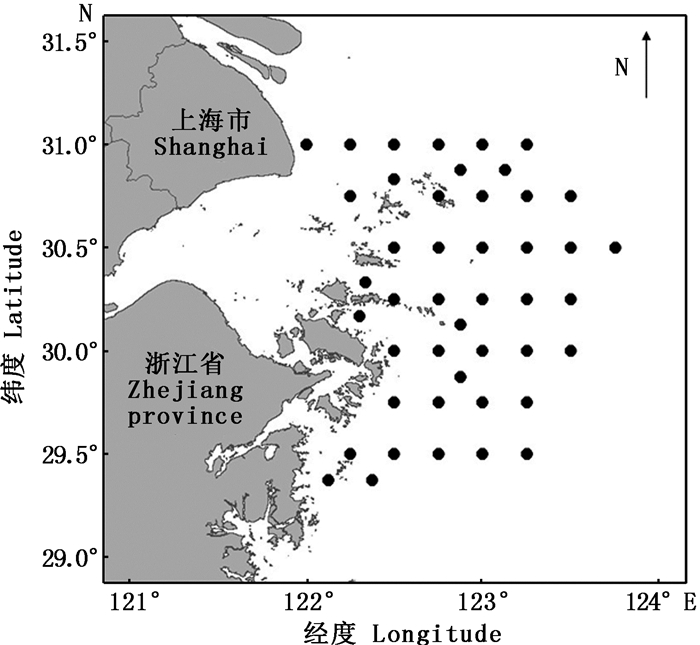
|
图 1 浙江北部沿岸海域调查站点图 Fig. 1 Sampling stations of survey along north coast of Zhejiang province |
调查船为“浙普渔43019号”,船长30 m,型宽6 m,总吨位96 t,主机功率184 kW;调查渔具针对调查海域水深、底质状况定制的单船底层有翼单囊拖网,网具主尺度58 m×28 m,上纲长40 m、下纲长45 m、网目尺寸25 mm。作业期间渔船拖速在2.5~3.5 kn范围内,站位拖曳时间在0.5~1.0 h内,均白天进行作业调查。拖曳时为确保网具性能发挥,视水深、流速等具体情况适时调整浮沉力、拖速、曳纲长度等参数。
1.3 数据分析 1.3.1 渔获物统计每网调查的渔获物带回实验室,首先进行分类系统整理,然后挑选出长蛸,统计体质量和尾数。由于每网次的拖网时间和拖速均不同,为了能够更好地分析数据,将拖网时间均设定为1 h,拖速为3 kn进行标准化处理,从而得到对应的长蛸单位网次的相对渔获量(C,g/h)。
1.3.2 时空分布变化规律由于各个调查站点的渔获量的值相差较大,因此将所计算的相对渔获量进行对数转换ln(C+1),使数据服从正态分布[7]。同时,为了研究长蛸的时空分布变化,将转换后的相对渔获量对年度平均和月度平均分别进行统计,绘制对应的时空分布变化图,同时根据统计结果,计算3年均有的调查月份,4月和5月的渔场重心,计算公式[8]如下:
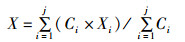 (1)
(1)
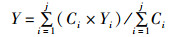 (2)
(2)
式中:X、Y分别为某一月份的渔获量重心位置,分别是经度和纬度;Ci为站点i的渔获量;Xi为某一月份站点i中心点的经度;Yi为某一月份站点i中心点的纬度;j为某一月份站点的总个数。
1.3.3 主要影响环境因子长蛸是典型的底栖型物种,因此本研究选择的主要因子为底层温度(sea buttom temperature, SBT)、底层盐度(sea buttom salinity, SBS)、溶解氧(dissolved oxygen, DO)、捕捞深度(Depth),以及时空因子年(Year)、月(Month)、经度(Longitude)和纬度(Latitude)。目前有较多的模型用于分析渔获量与环境之间的关系,如广义线性模型(generalized linear model, GLM)、GAM和随机森林等。本研究采用提升回归树模型(BRT),主要内容可理解为M棵分类回归树相加的形式:
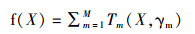 (3)
(3)
式中:X为SBT、SBS等预测变量,Tm(X,γm)为第m棵分类回归树,γm为其参数,代表了该决策树的分裂点和每个叶子结点的赋值,求解γm的过程即单棵决策树的学习过程。
通过逐步迭代法来对确定的决策树进行学习。学习过程中,需要针对装袋分数(bagging fraction)、学习率(learning rate,lr)和树的复杂度(tree complexity,tc)3项参数进行选择,本研究中装袋分数选择0.5,lr和tc需要模拟不同的设置来优化选择,本研究选择设置lr为0.001、0.005和0.01,tc为1、2、4和8,通过模型预测过程和预测偏差选择最优lr和tc,具体方法参考高峰等[12]。确定最佳决策树数量后,计算提升回归树中的预测因子相对重要性的平方,通过归一化处理,使得所有因子相加之和为1,以百分数的形式表征因子的影响程度。
上述分析均使用R 3.2.3软件进行分析[13],其中绘图使用“ggplot2”、“sp”和“maptools”包,BRT模型分析使用“gbm”包。
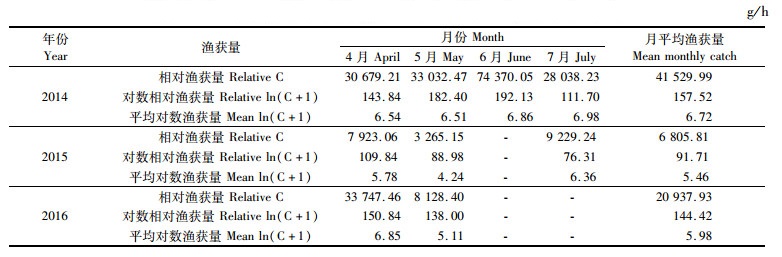
2 结果 2.1 不同年月长蛸资源的变化规律分析结果表明,从月平均渔获量来看,2014年4月和5月的长蛸资源要明显高于2015和2016年(表 1)。2014年4—7月平均相对渔获量(41 529.99 g/h)为2015年4—5、7月平均相对渔获量(6 805.81 g/h)的6倍多,是2016年4—5月平均相对渔获量(20 937.93 g/h)的2倍多。从月间分布来看,4月份渔获量相对较高,5月份开始有所下降,而在6—7月份再度回升。对比相同的月份:4月份,2016年的渔获量最高,平均对数渔获量为6.85 g/h,2015年的渔获量最低,平均对数渔获量仅为5.78 g/h;5月份,2014年的渔获量最高,平均对数渔获量为6.51 g/h,2015年的渔获量最低,平均对数渔获量仅为4.24 g/h。不同年月间的差异明显。
|
表 1 不同年月长蛸资源量变化 Tab.1 Biomass variation of Octopus minor in different years and months |
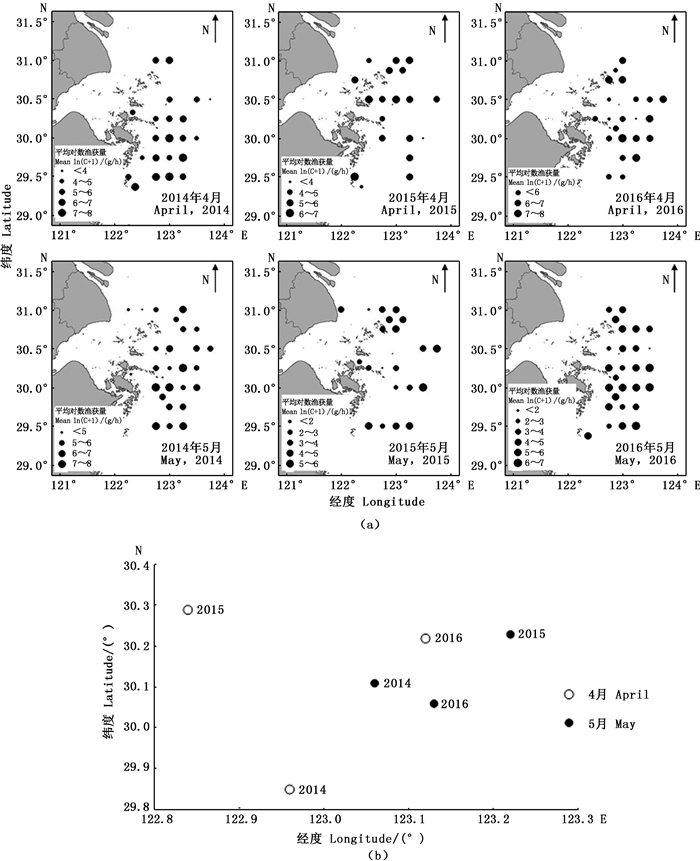
以4—5月为例,2014和2016年在几乎所有的站点均有长蛸捕获,而2015年有近一半的站点未捕获长蛸个体。2014和2016年渔获量较高的站点主要分布在30°N,123°E附近;而2015年则主要分布在30.5°N~31°N,122.5°E~130°E范围内,渔场略微向北移动(图 2a)。从月间变化来看,2014年4—5月渔场重心由南向北移动,2016年渔场重心由北向南略微移动,而2015年渔场重心呈现自西向东移动的规律(图 2b)。
|
图 2 不同年月长蛸平均对数渔获量分布(a)及渔场重心变化(b) Fig. 2 Distribution of Octopus minor mean log catch(a) and variation of fishing ground gravity (b) in different years and months |
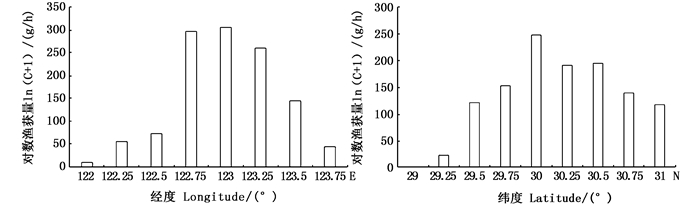
不同经纬度的长蛸渔获量存在一定的差异。调查统计发现,主要渔获量分布在122.75°E~123.25°E,30°N~30.5°N海域。在经度上,123°E的累积对数渔获量[ln(C+1)]最高,为306.73 g/h,占总渔获量的25.68%,其次为122.75°E,为297.51 g/h,占总渔获量的24.91%,优势经度分布范围在122.75°E~123.25°E,占总渔获量的72.45%;在纬度上,30°N的累积对数渔获量[ln(C+1)]最高,为248.58 g/h,占总渔获量的20.82%,其次为30.5°N,为195.81 g/h,占总渔获量的16.40%,优势纬度分布范围在29.75°N~30.5°N,占总渔获量的66.18%。见图 3。
|
图 3 不同经纬度长蛸对数渔获量分布 Fig. 3 Distribution of Octopus minor log catch in different longitude and latitude |
以2014年为例,不同月份的渔场变化如图 4。4月份的渔获量主要分布在122.75°E~123.25°E,29.5°N~30.75°N;5月份的渔获量主要分布在122.75°E~123.25°E,29.5°N~30°N;6月份的渔获量主要分布在123°E~124°E,30°N~30.75°N;7月份的渔获量主要分布在122.75°E~123.25°E,29.75°N~30.25°N。从月间的渔场重心变化来看,4月至6月的渔场重心一直向东北方向移动,到7月份,渔场重心稍往西南方向移动。

|
图 4 不同月份长蛸平均对数渔获量经纬度分布(a)及渔场重心分布(b) Fig. 4 Longitude and latitudinal distribution of Octopus minor mean log catch (a) and fishing ground gravity (b) in different months |
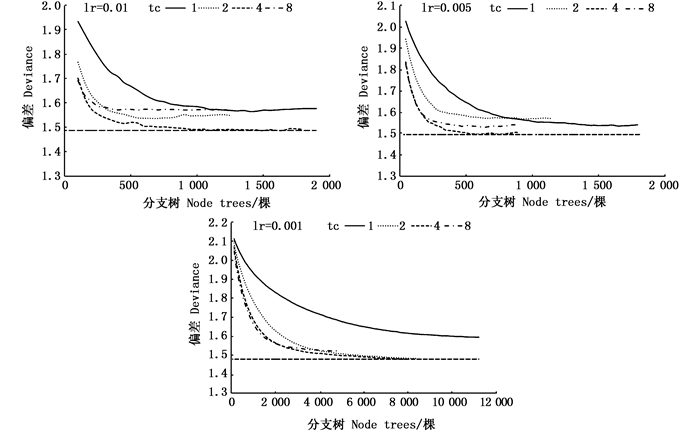
对3种不同学习率(lr)和4种复杂度(tc)进行模拟分析。结果发现,lr为0.01时,tc为1、2、4和8的模型在500棵决策树前预测偏差处于下降趋势,且在tc为4时在1 900棵决策树达到最小预测值,其平均预测偏差为1.54。lr为0.005时,tc为1、2、4和8的模型在1 000棵决策树前预测偏差处于下降趋势,且在tc为4时在1 800棵决策树达到最小预测值,其平均预测偏差为1.53。lr为0.001时,分支树的数量较大,在2 000棵决策树以内预测偏差均处在下降状态,2 000~8 000棵之间的决策树趋于平缓,且在tc为4时在8 050棵决策树达到最小预测值,其平均预测偏差为1.52,拟合曲线均较为平滑。见图 5。因此,本研究选择lr为0.001和tc为4作为模型的参数进行后续分析。
|
图 5 不同学习率和复杂度下预测偏差与分支树的关系 Fig. 5 The relationship between predictive deviance and number of node trees for models fitted with learning rate and tree complexity |
提升回归树分析发现:底层溶解氧对渔获量的影响最大,占所有影响因子的45.5%;年和盐度分别为第二和第三位,分别占13.1%和11.6%;随后依次为深度(10.7%)、底层温度(7.3%)、纬度(4.7%)、月(4.7%)以及经度(2.3%)。可见环境因子所占的比例较大。从环境因子变化上来看,溶解氧为4~7 mg/L,渔获量随溶解氧含量的上升而上升,随后在达到8 mg/L之前大幅下降;底层盐度在33~35出现震荡变化;深度变化在30 m以下较低,在50 m达到较高的水平,随后再次下降;其他的因子变化不明显。在时空因子中:年效应在2014年处于较高位置,渔获量较高,在2015和2016年处于较低位置,渔获量较低;月效应在4月份处在高位,其他月份波动不大;纬度在29.5°N~30°N有小幅上升;经度在122.5°E后存在阶梯式上升。见图 6。
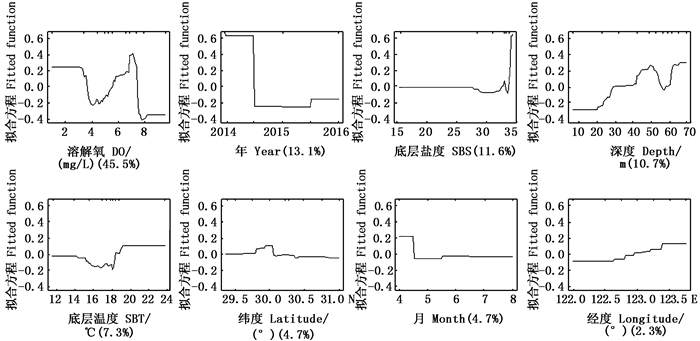
|
图 6 基于提升回归树的时空与环境因子效应对长蛸渔获量的影响 Fig. 6 Effects of spatial-temporal and environment factors on Octopus minor catch derived from the BRT analysis |
浙江近岸的头足类资源非常丰富,根据前人[14-15]的研究发现,主要以经济型的枪乌贼类(剑尖枪乌贼L. edulis和杜氏枪乌贼Loligo duvaucelii)、乌贼类(日本无针乌贼S. japonica、虎斑乌贼Sepia pharaonic和神户乌贼Sepia kobiensis)和小型头足类(多钩钩腕乌贼Abralia multihamata和柏氏四盘耳乌贼Euprymna berryi)为主。近些年来,由于过度捕捞,一些常见的经济型种类资源不断下降,而新的头足类资源(如太平洋褶柔鱼Todarodes pacificus和金乌贼Sepia esculenta)则开始不断地被利用[16]。近年的调查发现,东海近岸营养盐类在底层含量最高[17],因此这也直接影响了蛸类的资源(主要是长蛸和短蛸)分布[3, 5]。长蛸在舟山群岛海域(即本研究海域)分布广泛,根据吴常文等[18]报道,长蛸繁殖期一般在3—6月,在4—5月的旺季,长蛸会从深水区向浅水区移动,到近海各岛礁区产卵。研究发现,4月份的渔获量在历年中均为最高,也进一步验证了长蛸的生活习性。覃涛等[3]认为,夏季长蛸在舟山渔场的渔获量为1 000~20 000 g/h,其中有部分站点为5 000~20 000 g/h。本研究中,在4—5月,有4个站点的渔获量超过5 000 g/h,与前述研究中出现的情况类似。根据吴常文等[18]的描述,4—5月捕获的个体大多数为繁殖群体或繁殖后索饵群体,因此大多停留在浅水区海域。根据本研究中长蛸的渔场重心变化来看,虽然有逐步向西北方向移动的趋势,但是移动的经纬度范围非常小,基本上在123 °E、30°N海域附近,几乎没有太大的变化,也可以说明此海域为长蛸的主要产卵场。
分析头足类与所处海洋环境之间的关系,是预测渔场和建立预报模型的研究基础。相关研究在大洋性头足类种类中已有大量涉及[19-20],但仍然较少出现在近海头足类种类的相关研究中。目前广泛采用GAM模型来进行分析,但GAM模型对数据有着一定的要求,同时需要提前对数据进行检验,在一定程度上限制了该方法的应用[21]。提升回归树(BRT)以其较高的预测精度,同时不易出现过度拟合的特点,近几年来已较为广泛地应用于渔业建模中,并且将该模型分析结果与传统方法进行对比,更能突显其应用优势[12, 22]。一般认为,在环境因子中,头足类受到水温的影响较大,是影响头足类栖息地的重要因子之一。而针对底栖型种类而言,在较深的水层中,水温的季节性变化较小,头足类所受的影响并不明显。长蛸栖息于靠近岸边的礁石区,盐度和水深的变化相对比较明显,这在相关的调查研究和养殖试验中也有所发现[18, 23]。年效应是唯一影响超过10%的时空因子,这可能是由于数据的不完整性所造成的(2016年仅有4—5月的数据),同时2015年的强厄尔尼诺现象也在一定程度上影响了长蛸的栖息地,造成渔获量的下降。
溶解氧对渔获量的影响在所有因子中是最高的。头足类的所有活动,包括捕食、摄食和繁殖等,均需要消耗大量的氧气,溶解氧含量不足或过高,都会直接影响到个体的活动,因此溶解氧是头足类栖息的重要因素之一。通过本研究的实测数据发现,溶解氧为4~7 mg/L,随着氧含量的上升,渔获量逐渐增加,尤其在6~7 mg/L,增加明显。由于调查季节所属的长蛸大多为繁殖群体,因此可以认为,4~7 mg/L是长蛸的适宜溶解氧,6~7 mg/L为最适宜。JESÚS等认为,合适的溶解氧范围对真蛸(Octopus vulgaris)的呼吸活动也至关重要[24]。对于中上层的柔鱼类来说,溶解氧及所处的水层其深度也直接影响到了茎柔鱼(Dosidicus gigas)的分布,进而影响其下一年的资源量[25]。海水中的溶解氧在不同的海域有着巨大的差异,由于其暂时无法通过较为简便的卫星遥感反演技术得到相关的数据(如海表面温度SST、叶绿素a浓度均已实现),只能通过海上实测的方式获取宝贵数据,因此目前较少有研究涉及此环境数据,后续研究应该对此环境因子提高关注。
根据2014—2016年春夏季浙江北部沿岸拖网调查数据,选取长蛸为研究对象,分析时空分布变化和环境因素对长蛸渔获量的影响,为后续长蛸的相关生产作业提供可靠依据。随着近些年海洋生物种类结构的变化,在控制捕捞强度的同时,也应该更加关注对新资源的开发和利用。同时,在研究环境与渔获量之间的关系时,也应当更多地从物种生活习性的角度出发,找到最为合适的环境因子。
| [1] |
JEREB P, ROPER C F E, NORMAN M D, et al. Cephalopods of the World. An annotated and illustrated catalogue of species known to date. Volume 3. Octopods and vampire squids[J]. FAO Species Catalogue for Fishery Purposes, 2014(4): 72. |
| [2] |
董正之. 中国动物志-软体动物门, 头足纲[M]. 北京: 科学出版社, 1988: 206. DONG Z Z. On the present status and exploratory problems of resource of Todarodes pacificus, in the Yellow Sea[M]. Beijing: Science Press, 1988: 206. |
| [3] |
覃涛, 俞存根, 陈全震, 等. 舟山渔场及邻近海域头足类(Cephalopod)种类组成和数量分布[J]. 海洋与湖沼, 2011, 42(1): 124-130. QIN T, YU C G, CHEN Q Z, et al. Species composition and quantitative distribution study on Cephalopod in the Zhoushan fishing ground and adjacent waters[J]. Oceanologia et Limnologia Sinica, 2011, 42(1): 124-130. |
| [4] |
俞存根, 虞聪达, 宁平, 等. 浙江南部外海头足类种类组成和数量分布[J]. 海洋渔业, 2009, 31(1): 27-33. YU C G, YU C D, NING P, et al. Species composition and quantitative distribution of cephalopod in the offshore waters of southern Zhejiang province[J]. Marine Fisheries, 2009, 31(1): 27-33. DOI:10.3969/j.issn.1004-2490.2009.01.004 |
| [5] |
朱文斌, 薛利建, 卢占晖, 等. 东海南部海域头足类群落结构特征及其与环境关系[J]. 海洋与湖沼, 2014, 45(2): 436-442. ZHU W B, XUE L J, LU Z H, et al. Cephalopod community structure and its relationship with environmental factors in the southern East China Sea[J]. Oceanologia et Limnologia Sinica, 2014, 45(2): 436-442. |
| [6] |
曹杰, 陈新军, 刘必林, 等. 鱿鱼类资源量变化与海洋环境关系的研究进展[J]. 上海海洋大学学报, 2010, 19(2): 232-239. CAO J, CHEN X J, LIU B L, et al. Review on the relationship between stock recruitment of squid and oceanographic environment[J]. Journal of Shanghai Ocean University, 2010, 19(2): 232-239. |
| [7] |
BEVERTON R J H, HOLT S J. On the dynamics of exploited fish populations[M]. Netherlands: Springer, 1993.
|
| [8] |
SATO T, HATANAKA H. A review of assessment of Japanese distant-water fisheries for cephalopods[C]//CADDY J F. Advances in Assessment of World Cephalopod Resources. Roma: FAO 1983.
|
| [9] |
PANG Y M, TIAN Y J, FU C H, et al. Variability of coastal cephalopods in overexploited China Seas under climate change with implications on fisheries management[J]. Fisheries Research, 2018, 208: 22-33. DOI:10.1016/j.fishres.2018.07.004 |
| [10] |
ELITH J, LEATHWICK J R, HASTIE T. A working guide to boosted regression trees[J]. Journal of Animal Ecology, 2008, 77(4): 802-813. DOI:10.1111/j.1365-2656.2008.01390.x |
| [11] |
BRIEMAN L, FRIEDMAN J, OLSHEN R, et al. Classification and regression trees[M]. Belmont: Wadsworth International Group, 1984: 1-368.
|
| [12] |
高峰, 陈新军, 官文江, 等. 基于提升回归树的东、黄海鲐鱼渔场预报[J]. 海洋学报, 2015, 37(10): 39-48. GAO F, CHEN X J, GUAN W J, et al. Fishing ground forecasting of chub mackerel in the Yellow Sea and East China Sea using boosted regression trees[J]. Acta Oceanologica Sinica, 2015, 37(10): 39-48. DOI:10.3969/j.issn.0253-4193.2015.10.004 |
| [13] |
R CORE TEAM. R: A language and environment for statistical computing[EB/OL]. Vienna: R Foundation for Statistical Computing. (2018-12-10). https://www. R-project.org/.
|
| [14] |
宋海棠, 丁天明, 余匡军. 东海北部头足类的种类组成和数量分布[J]. 浙江海洋学院学报(自然科学版), 1999, 18(2): 99-106. SONG H T, DING T M, YU K J. Species composition & quantitative distribution of cephalopod in the north of East China Sea[J]. Journal of Zhejiang Ocean University (Natural Science), 1999, 18(2): 99-106. DOI:10.3969/j.issn.1008-830X.1999.02.001 |
| [15] |
叶林安, 王莉波, 江志法, 等. 2015年东海区营养盐的分布变化特征[J]. 上海海洋大学学报, 2017, 26(3): 432-439. YE L A, WANG L B, JIANG Z F, et al. Seasonal variations of distribution characteristics of nutrients in the East China Sea in 2015[J]. Journal of Shanghai Ocean University, 2017, 26(3): 432-439. |
| [16] |
吴常文, 董智勇, 迟长凤, 等. 曼氏无针乌贼(Sepiella maindroni)繁殖习性及其产卵场修复的研究[J]. 海洋与湖沼, 2010, 41(1): 39-46. WU C W, DONG Z Y, CHI C F, et al. Reproductive and spawning habits of Sepiella maindroni off Zhejiang, China[J]. Oceanologia et Limnologia Sinica, 2010, 41(1): 39-46. |
| [17] |
马迪, 金岳, 陈芃, 等. 基于角质颚形态的东海2种常见乌贼类的种类判别[J]. 上海海洋大学学报, 2018, 27(4): 594-602. MA D, JIN Y, CHEN P, et al. Species identification of Sepioidea in the East China Sea based on beak morphology[J]. Journal of Shanghai Ocean University, 2018, 27(4): 594-602. |
| [18] |
吴常文, 吕永林. 浙江北部沿海长蛸Octopus variabilis生态分布初步研究[J]. 浙江水产学院学报, 1999, 14(2): 148-150. WU C W, LV Y L. A preliminary study of ecological distribution of Octopus variabilis in northern part of Zhejiang Sea[J]. Journal of Zhejiang College of Fisheries, 1999, 14(2): 148-150. |
| [19] |
余为, 陈新军, 易倩. 不同气候模态下西北太平洋柔鱼渔场环境特征分析[J]. 水产学报, 2017, 41(4): 525-534. YU W, CHEN X J, YI Q. Analysis of variations in the environmental conditions on the fishing ground of neon flying squid (Ommastrephes bartramii) in the northwestern Pacific Ocean under different climate modes[J]. Journal of Fisheries of China, 2017, 41(4): 525-534. |
| [20] |
武胜男, 余为, 陈新军. 太平洋褶柔鱼秋生群产卵场环境变化及对资源丰度的影响[J]. 海洋渔业, 2018, 40(2): 129-138. WU S N, YU W, CHEN X J. Variations in environmental conditions on the spawning grounds of autumn cohort of Todarodes pacificus and their impacts on squid abundance[J]. Marine Fisheries, 2018, 40(2): 129-138. DOI:10.3969/j.issn.1004-2490.2018.02.001 |
| [21] |
陈新军, 高峰, 官文江, 等. 渔情预报技术及模型研究进展[J]. 水产学报, 2013, 37(8): 1270-1280. CHEN X J, GAO F, GUAN W J, et al. Review of fishery forecasting technology and its models[J]. Journal of Fisheries of China, 2013, 37(8): 1270-1280. |
| [22] |
MARTÍNEZ-RINCÓN R O, ORTEGA-GARCÍA S, VACA-RODRÍGUEZ J G. Comparative performance of generalized additive models and boosted regression trees for statistical modeling of incidental catch of wahoo (Acanthocybium solandri) in the Mexican tuna purse-seine fishery[J]. Ecological Modelling, 2012, 233(2): 20-25. |
| [23] |
NG'AMBI J W, 陈武, 王春琳, 等. 长蛸对几个环境因子的耐受能力及栖息习性研究[J]. 水产科学, 2010, 29(2): 74-78. NG'AMBI J W, CHEN W, WANG C L, et al. Habit and adaptability of common octopus Octopus variabilis to certain environmental factors[J]. Fisheries Science, 2010, 29(2): 74-78. DOI:10.3969/j.issn.1003-1111.2010.02.003 |
| [24] |
VALVERDE J C, GARCÍA B G. Suitable dissolved oxygen levels for common octopus (Octopus vulgaris Cuvier, 1797) at different weights and temperatures:analysis of respiratory behaviour[J]. Aquaculture, 2005, 244(1/4): 303-314. |
| [25] |
TRÜBENBACH K, PEGADO M R, SEIBEL B A, et al. Ventilation rates and activity levels of juvenile jumbo squid under metabolic suppression in the oxygen minimum zone[J]. Journal of Experimental Biology, 2013, 216: 359-368. DOI:10.1242/jeb.072587 |
2. Marine Fisheries Research Institute of Zhejiang Province, Zhoushan 316021, Zhejiang, China;
3. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
6. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


