2. 淮阴师范学院, 江苏 淮安 223001;
3. 江苏盱眙满江红龙虾产业园有限公司, 江苏 淮安 223001
克氏原螯虾(Procambarus clarkii)俗称小龙虾,属于节肢动物门(Arthropoda),甲壳纲(Crustacea),十足目(Decapoda),爬行亚目(Reptantia),螯虾科(Cabaridae),原螯虾属(Procambarus)[1]。克氏原螯虾产业已在水产养殖业中占有重要地位并具有较大社会意义[2]。随着市场对克氏原螯虾需求量的不断增加,对于克氏原螯虾的繁殖这一环节又提出了新的要求。至今低繁殖率的问题仍制约着克氏原螯虾产业的发展,这就需要研究克氏原螯虾生物学特性[3-4],完善苗种繁殖生产技术途径,在探究克氏原螯虾繁殖习性的同时,也要在分子层面上对克氏原螯虾的性腺发育及其繁殖进行研究。
泛素(ubiquitin)是一类由76个氨基酸残基组成的小分子蛋白质,在结构上保守性非常高,分子量约为8 ku。泛素在各种真核细胞中广泛表达,以单体、二聚体或寡聚体形式处于动态平衡状态[5]。泛素化修饰过程由泛素激活酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)和泛素连接酶(ubiquitin-protein ligase,E3)三种酶共同催化完成,将泛素共价连接到底物的赖氨酸残基上[6-7]。其中E1负责激活泛素分子,由于E1 的高效性,细胞内有足够活化形式的泛素分子供后续的连接反应,E2 s与E3 s的配对决定了底物的泛素化修饰类型,不同的E2 s和E3 s的组合使底物发生多种类型的泛素化修饰,而E3负责特异性的识别靶标底物[8-13]。许多研究表明,泛素蛋白酶体途径(ubiquitin proteasome pathway,UPP)在动物的性腺发育以及繁殖过程中都发挥了重要的调控作用。SHEN等[14]通过克隆获得了日本囊对虾(Marsupenaeus japonicus)的泛素结合酶基因 E2r,认为其参与了配子的发生及发育,并且通过研究表明该基因的表达量在卵巢Ⅲ期达到最高值。KWON等[15]研究发现,泛素羧基末端水解酶(Ubiquitin carboxy-terminal hydrolase,UCH)L1与L4在小鼠的精原细胞中高表达,而UCHL3与UCHL5则在精母细胞和精子细胞中高表达,这说明UCH在小鼠配子的发生和发育中发挥着重要的作用,不同基因发挥的作用也存在差异。
本实验以克氏原螯虾为研究对象,对泛素结合酶E2基因进行了克隆与表达分析,为研究克氏原螯虾卵巢发育分子调控机制提供参考资料。
1 材料与方法 1.1 实验材料克氏原螯虾于2017年采自江苏盱眙满江红龙虾产业园有限公司。
1.2 实验方法 1.2.1 基因克隆采用Trizol法提取各组织的总RNA,经1%琼脂糖凝胶电泳检测其质量,NanoDrop2000分光光度计检测其浓度。以总RNA为模板,按照逆转录试剂盒说明书和SMART RACE cDNA Amplification试剂盒说明书进行反转录合成cDNA以及5′/3′-RACE-Ready cDNA。根据已构建的克氏原螯虾转录组文库中UB-E2基因的部分序列,设计短片段引物F1、F2(表 1)用于目的片段的扩增。以SMART RACE cDNA为模板,以基因特异性引物GSP-F2(或GSP-R2)与TaKaRa试剂盒内的UPM引物,按照说明书分别进行3′RACE和5′RACE扩增(表 1)。1.5%琼脂糖凝胶电泳检测后割胶回收,纯化后连接到GEM-T Easy载体上,再转化至E.coli DH5α感受态细胞,并挑选阳性克隆进行测序检验。

|
表 1 实验中所用到的引物及序列 Tab.1 The primers and sequences in this experiment |
采用DNAstar软件进行序列拼接得到完整的cDNA序列。利用NCBI网站上的ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)对序列预测开放阅读框,用Protparam(https://web.expasy.org/protparam/)预测其理化参数,用SigalP(http://www.cbs.dtu.dk/services/SignalP/)预测其信号肽位置,用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析其跨膜结构,用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测其蛋白质的三级结构。通过NCBI网站查找其他物种的UB-E2基因的氨基酸序列,利用BioEdit软件对其氨基酸序列进行多重比对,并用MEGA5软件构建NJ(Neighbor joining)系统进化树。
1.2.3 组织表达分析将克氏原螯虾于实验室暂养一周,取克氏原螯虾眼柄、鳃、肝胰腺、心脏、肌肉、肠和不同发育时期的卵巢组织并提取RNA,根据TaKaRa试剂盒说明书合成用于RT-PCR反应的各组织及卵巢发育各时期的cDNA。以RT-F3和RT-R3(表 1)为荧光定量引物,以EIF[16](表 1)作为内参基因,每个样本设置3个重复。反应体系如下:SYBR Premix Ex TaqⅡ10 μL,ddH2O 6.8 μL,RT-F3与RT-R3各0.8 μL,cDNA 1.6 μL。反应程序为95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 10 s;65 ℃ 5 s。通过2-ΔΔCT法[17]分析UB-E2基因在克氏原螯虾各组织及性腺发育各时期的相对表达量。采用SPSS 18.0软件[18]对数据进行单因素方差分析(ANOVA),并通过SigmaPlot13.0[19]绘制图片。
1.2.4 17α-羟孕酮刺激检测实验克氏原螯虾于实验室养殖水桶(60 cm×90 cm)中暂养一周,随机挑选45只虾,活体解剖取其性腺以确定其性腺发育时期。实验设置试验组与对照组,每组设置3个重复,每个养殖水桶中放置15只虾。养殖水桶内设置水葫芦水草以及PVC管、塑料水瓶等物品制作的人工模拟洞穴,并采用气石增氧。
用BS124S型多功能精密电子天平称取17α-羟孕酮0.2 g溶于无水乙醇中,再用生理盐水配制成0.2%的工作液。将配制好的工作液置于烧杯中,对试验组进行浸泡处理,浸泡其腹部,浸泡时间为1 min,采用实验前浸泡、10天后浸泡、20天后浸泡处理,对照组不作处理。分别于实验10天、20天、30天后从试验组与对照组取虾10只,活体解剖取其卵巢,观察其卵巢发育形态,然后保存并切片。切片用于HE染色观察,保存的卵巢组织提取RNA后,采用RT-PCR技术测定处理前后基因在卵巢中的表达量变化。
2 结果 2.1 克氏原螯虾UB-E2基因的克隆与序列分析克氏原螯虾UB-E2基因的cDNA序列全长3 943 bp,包括305 bp的5′端非编码区(5′-UTR),675 bp的开放阅读框(ORF),2 963 bp的3′端非编码区(3′-UTR), 在3′-UTR有加尾信号AATAA。ORF编码224个氨基酸,相对分子量23.93 ku,等电点为8.61。在其82~219位氨基酸序列为泛素结合酶家族特有的结构域,属于典型的UB-E2基因(图 1)。

|
图 1 克氏原螯虾UB-E2基因cDNA序列及其编码的氨基酸序列
Fig. 1 Nucleotide and deduced amino acid sequences of UB-E2 in Procambarus clarkii
下划线表示其结构域,波浪线表示加尾信号,双下划线表示起始密码子,*表示终止密码子 The underline indicates the ubiquitin-conjugating enzyme domain, the wave line indicates putative polyadenylation signals, the double underline indicates initiation codon, the asterisk indicates stop codon |
SignalP分析表明,克氏原螯虾UB-E2蛋白没有信号肽。TMHMM分析表明,UB-E2蛋白没有跨膜结构,不属于跨膜蛋白。通过Phyre2预测分析UB-E2蛋白的三级结构(图 2),其中α螺旋占推测序列的26.34%,β螺旋占推测序列的12.05%,其余则为无规则卷曲为主。

|
图 2 克氏原螯虾UB-E2蛋白的三维结构预测
Fig. 2 Three dimensional structure prediction of UB-E2 protein in Procambarus clarkii
|
氨基酸多重序列比对后发现(图 3),克氏原螯虾UB-E2氨基酸序列与黄翅菜叶蜂(Athalia rosae,XP-012264123.1)UB-E2氨基酸序列的相似性最高,为98%,与凡纳滨对虾(Litopenaeus vannamei,AFU93451.1)、斑节对虾(Penaeus monodon,ACD13594.1)的相似性为81%。MEGA5建立NJ系统进化树(图 4)显示,克氏原螯虾与凡纳滨对虾和斑节对虾亲缘关系最近,聚为一支,再与黄翅菜叶蜂、二疣犀甲(Oryctes borbonicus,KRT78970.1)、果蝇(Drosophila willistoni,XP-002064658.1)和美洲鲎(Limuluspolyphemus,XP-013778274.1)等节肢动物聚为一大支;鱼类、哺乳类等单独聚为一支。

|
图 3 不同物种UB-E2多重氨基酸序列比较
Fig. 3 Multiple alignment of UB-E2 amino acid sequence in different species
克氏原螯虾(P.clarkii);凡纳滨对虾(L.vannamei,AFU93451.1);斑节对虾(P.monodon,ACD13594.1);黄翅菜叶蜂(A.rosae,XP-012264123.1);二疣犀甲(O.borbonicus,KRT78970.1);美洲鲎(L.polyphemus,XP-013778274.1);果蝇(D.willistoni,XP-002064658.1);斑马鱼(Danio rerio,NP-001003494.1);人类(Homo sapiens,NP-689866.1);小家鼠(Mus musculus,NP-659088.1)
|

|
图 4 不同物种UB-E2蛋白的系统进化分析
Fig. 4 Phylogenetic analysis of UB-E2 protein in different species
|
荧光定量结果显示(图 5),克氏原螯虾UB-E2基因在各组织中均有表达,其中在卵巢组织中的表达量显著高于眼、鳃、肝脏、心脏、肠、肌肉等组织(P<0.05)。而在卵巢发育各个时期中(图 6),UB-E2基因在初期表达量最低,在成熟期表达量最高,并且从发育初期到成熟期,基因的表达量是递增的。
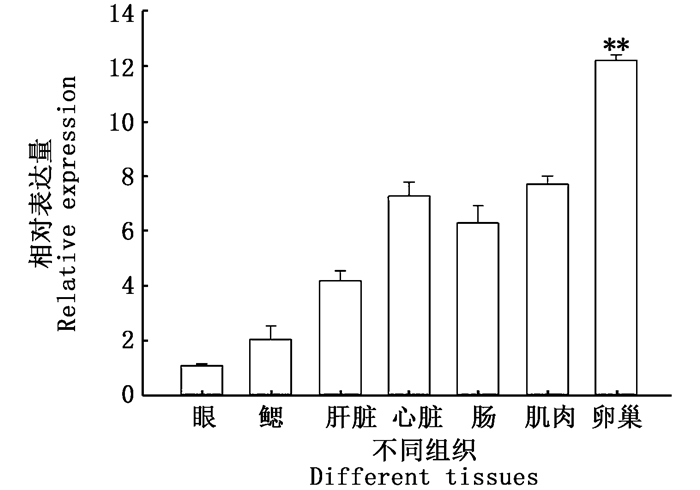
|
图 5 克氏原螯虾UB-E2基因在不同组织中的表达量
Fig. 5 Distribution pattern of UB-E2 in various tissues of Procambarus clarkii
柱状图中标注星号表示UB-E2基因在卵巢中的表达量显著高于其他组织,P<0.05 The asterisk on the histogram indicates that the expression of UB-E2 in ovaries were significantly higher than other tissues, P < 0.05 |
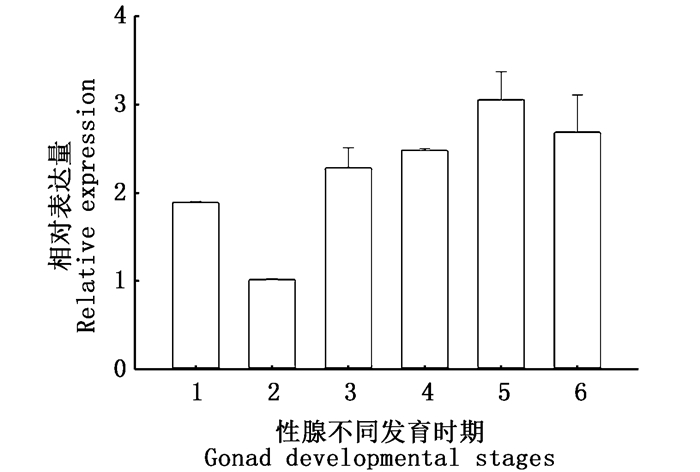
|
图 6 克氏原螯虾UB-E2基因在卵巢发育不同时期的表达量
Fig. 6 The expression of UB-E2 during gonad developmental stages in Procambarus clarkii
1.未发育期;2.发育初期;3.卵黄发生前期;4.卵黄发生期;5.成熟期;6.产卵后期 1. Undeveloped period; 2. Early development; 3. Early stage of vitellogenesis; 4. vitellogenic stage; 5. mature period; 6. Anaphase of spawning |
HE染色结果显示(图版),第10天,试验组克氏原螯虾卵巢处于发育初期,对照组处于未发育期与发育初期之间;第20天,试验组处于卵黄发生前期,对照组处于发育初期;第30天,试验组处于卵黄发生期,对照组处于卵黄发生前期。
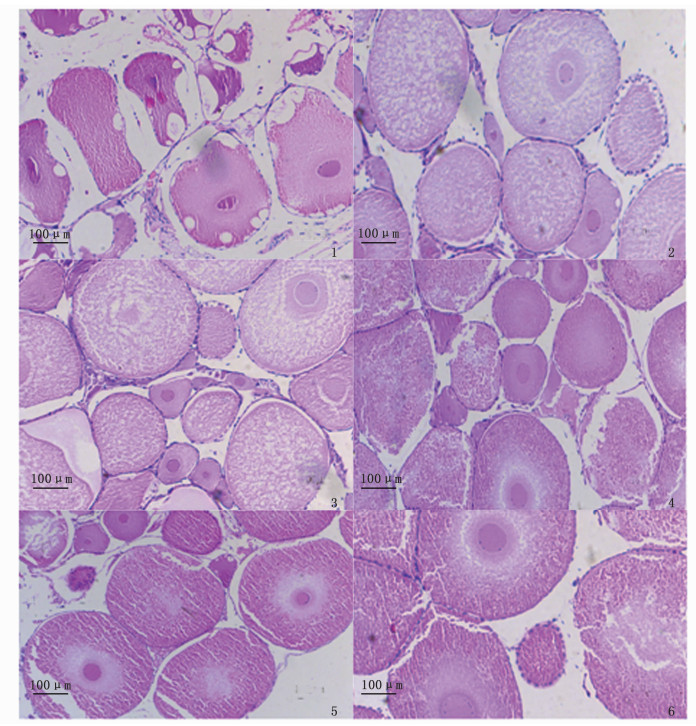
|
图版 克氏原螯虾卵巢HE染色 Plate Developing stage of ovary in Procambarus clarkii with hematoxylin and eosin 1、3、5为对照组,2、4、6为试验组;1、2为实验第10天,3、4为实验第20天,5、6为实验第30天 1, 3 and 5 were the control groups, 2, 4 and 6 were the experimental groups; 1 and 2 were tenth day, 3 and 4 were twentieth day, and 5 and 6 were thirtieth day |
荧光定量结果显示,克氏原螯虾UB-E2基因(图 7)在第30天的试验组性腺中表达量最高,在第10天的试验组性腺中表达量最低,其中第10天试验组的表达量低于对照组,第20、30天试验组的表达量显著高于对照组(P<0.05)。

|
图 7 克氏原螯虾UB-E2基因在卵巢激素刺激前后不同天数的表达量
Fig. 7 Expression of UB-E2 gene in Procambarus clarkii on different days before and after ovarian hormone stimulation
|
泛素结合酶E2是泛素化过程中不可缺少的一个酶,在泛素化过程中发挥着重要的作用。泛素结合酶有许多种,含有16~18 ku的泛素结合结构域(UBC),并且有一个保守的活性位点半胱氨酸残基[20]。泛素结合酶可以通过保守的半胱氨酸与泛素C端形成硫酯键,与泛素连接酶E3形成复合物[21]。本研究结果显示,克氏原螯虾UB-E2基因的氨基酸序列与节肢动物UB-E2基因的氨基酸序列具有较高的同源性,与节肢动物聚为一大支。在图 3中,克氏原螯虾UB-E2基因的氨基酸序列与凡纳滨对虾和斑节对虾UB-E2基因的氨基酸序列长度相同,而其他节肢动物则与以上三者长度不同,因此出现了比对相似度高而同源性相对低的情况。而比对图中所有物种UB-E2氨基酸序列中的结构域序列,相似度均在91%以上,从而得出UB-E2基因在其进化过程中高度保守,与傅明俊等[22]所得结论相同,可以推测UB-E2基因在节肢动物中的作用有一定的相似性。
UB-E2基因具有多种功能,其在卵子的发生和发育过程中也起到了重要作用。有研究表明,Ube2C与小鼠卵母细胞的减数分裂有关[23],Ube2C、Ube2S以及Ube2D对于卵母细胞第一极体的排出有重要作用,并且与配子的发生有关[24]。另外,LEELATANAWTT等[25]研究发现UB-E2基因参与了斑节对虾的性腺发育过程。在本研究中,克氏原螯虾UB-E2基因在各组织中都有表达,但是在卵巢组织中的表达量显著高于其他组织,这与泛素结合酶E2r 基因在克氏原螯虾卵巢中的表达情况一致[26],由此可以推测UB-E2基因与克氏原螯虾的性腺发育有关,并且可能发挥着重要的作用。在卵巢的发育过程中,卵细胞内会进行一系列的蛋白质降解,而泛素化过程是细胞内蛋白质降解的主要途径。本研究中,UB-E2基因的表达量从卵巢发育初期到成熟期逐渐递增,说明该基因可能参与了卵细胞内相关蛋白质的降解过程。这些结果表明UB-E2基因可能与卵巢的卵黄发生和积累以及成熟有关,其相关具体的功能和作用机制还有待进一步研究。
17α-羟孕酮能够促进动物机体的性腺发育,同样对甲壳类动物的性腺发育也有促进作用。有研究表明[27],17α-羟孕酮能够促进南美白对虾(Penaeus vannamei)性腺中卵母细胞的发育,使之体积加快增大。同样赵维信等[28]发现17α-羟孕酮对罗氏沼虾(Macrobrachium rosenbergii)卵黄发生前期和卵黄发生期卵母细胞卵径增大均有极显著刺激作用。本研究发现,在相同生活条件下,在一个月的实验周期中分3次使用17α-羟孕酮刺激克氏原螯虾,试验组的性腺发育比对照组的性腺发育快了一个时期。这表明17α-羟孕酮刺激加快了克氏原螯虾性腺发育的速度。与孙瑞杰[29]对17α-羟孕酮对克氏原螯虾卵巢同步发育的影响的研究结果相同。图 6的结果显示UB-E2基因的表达量从卵巢发育初期到成熟期逐渐递增,结合图版可以看出,激素刺激后基因表达量的情况与图 6中的发育时期一一对应并且一致,同时UB-E2基因在克氏原螯虾卵巢中的表达量显著上升,说明在克氏原螯虾生长情况相同的条件下性腺发育加快时,基因的表达量也具有着显著的变化。综上可以推测,UB-E2基因在克氏原螯虾的发育过程中,可能通过UPP参与了抑制卵巢发育相关蛋白的降解,从而促进了卵巢的发育及卵黄的发生和积累。
本研究克隆获得了UB-E2基因cDNA全长,通过生物信息学分析以及系统进化分析了解了该基因的进化特征,通过荧光定量和激素刺激实验证明了该基因在克氏原螯虾性腺发育过程中的作用,为克氏原螯虾性腺发育的分子调控机制提供分子生物学资料。
| [1] |
黄文虎, 龚世园. 克氏原螯虾雄性生殖系统的超微结构[J]. 水产学报, 2012, 36(4): 514-521. HUANG W H, GONG S Y. Histological studies on the male reproductive system of Procambarus clarkii[J]. Journal of Fisheries of China, 2012, 36(4): 514-521. |
| [2] |
丁建英, 康琎, 徐建荣. 克氏原螯虾肌肉营养成分分析与评价[J]. 水产科技情报, 2010, 37(6): 298-301. DING J Y, KANG J, XU J R. Nutritional composition of analysis and evaluation of Procambarus clarkii[J]. Fisheries Science & Technology Information, 2010, 37(6): 298-301. DOI:10.3969/j.issn.1001-1994.2010.06.009 |
| [3] |
慕峰, 吴旭干, 成永旭, 等. 克氏原螯虾胚胎发育的形态学变化[J]. 水产学报, 2007, 31(s1): 6-11. MU F, WU X G, CHENG Y X, et al. External morphological character during the embryonic development of Procambarus clarkii[J]. Journal of Fisheries of China, 2007, 31(s1): 6-11. |
| [4] |
李胜, 赵维信. 克氏原螯虾大颚器在卵巢发育周期中的组织结构变化[J]. 上海水产大学学报, 1999, 8(1): 12-18. LI S, ZHAO W X. Structural changes of mandibular organ during the ovary developing cycle in crayfish[J]. Journal of Shanghai Fisheries University, 1999, 8(1): 12-18. |
| [5] |
HERSHKO A, CIECHANOVER A. The ubiquitin system[J]. Annual Review of Biochemistry, 1998, 67: 425-479. DOI:10.1146/annurev.biochem.67.1.425 |
| [6] |
YE Y H, RAPE M. Building ubiquitin chains: E2 enzymes at work[J]. Nature Reviews Molecular Cell Biology, 2009, 10(11): 755-764. DOI:10.1038/nrm2780 |
| [7] |
NEUTZNER M, NEUTZNER A. Enzymes of ubiquitination and deubiquitination[J]. Essays in Biochemistry, 2012, 52: 37-50. DOI:10.1042/bse0520037 |
| [8] |
PICKART C M. Mechanisms underlying ubiquitination[J]. Annual Review of Biochemistry, 2001, 70: 503-533. DOI:10.1146/annurev.biochem.70.1.503 |
| [9] |
DIKIC I, WAKATSUKI S, WALTERS K J. Ubiquitin-binding domains - from structures to functions[J]. Nature Reviews Molecular Cell Biology, 2009, 10(10): 659-671. DOI:10.1038/nrm2767 |
| [10] |
REYES-TURCU F E, VENTⅡ K H, WILKINSON K D. Regulation and cellular roles of ubiquitin-specific deubiquitinating enzymes[J]. Annual Review of Biochemistry, 2009, 78: 363-397. DOI:10.1146/annurev.biochem.78.082307.091526 |
| [11] |
NIJMAN S M B, LUNA-VARGAS M P A, VELDS A, et al. A genomic and functional inventory of deubiquitinating enzymes[J]. Cell, 2005, 123(5): 773-786. DOI:10.1016/j.cell.2005.11.007 |
| [12] |
AMERIK A Y, HOCHSTRASSER M. Mechanism and function of deubiquitinating enzymes[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2004, 1695(1/3): 189-207. |
| [13] |
丁祺, 宋旭东. 泛素化/去泛素化系统介导的蛋白质降解与肿瘤关系的研究[J]. 中国医药指南, 2009, 7(9): 46-49. DING Q, SONG X D. Study on the relationship between protein degradation and tumor mediated by ubiquitination/deubiquitination system[J]. Guide of China Medicine, 2009, 7(9): 46-49. DOI:10.3969/j.issn.1671-8194.2009.09.023 |
| [14] |
SHEN B L, ZHANG Z P, WANG Y L, et al. Differential expression of ubiquitin-conjugating enzyme E2r in the developing ovary and testis of penaeid shrimp Marsupenaeus japonicus[J]. Molecular Biology Reports, 2009, 36(5): 1149-1157. DOI:10.1007/s11033-008-9291-7 |
| [15] |
KWON J, WANG Y L, SETSUIE R, et al. Developmental regulation of ubiquitin C-terminal hydrolase isozyme expression during spermatogenesis in mice[J]. Biology of Reproduction, 2004, 71(2): 515-521. DOI:10.1095/biolreprod.104.027565 |
| [16] |
JIANG H C, QIAN Z J, LU W, et al. Identification and characterization of reference genes for normalizing expression data from red swamp crawfish Procambarus clarkii[J]. International Journal of Molecular Sciences, 2015, 16(9): 21591-21605. DOI:10.3390/ijms160921591 |
| [17] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] |
GIGLIOTTI E. Discovering statistics using SPSS. Second Edition[J]. Journal of Advanced Nursing, 2007, 58(3): 303. |
| [19] |
WASS J A. SigmaPlot 11: Now with Total SigmaStat Inte-gration[Z]. Scientific Computing, 2009.
|
| [20] |
FURUKAWA M, OHTA T, XIONG Y. Activation of UBC5 ubiquitin-conjugating enzyme by the RING finger of ROC1 and assembly of active ubiquitin ligases by all cullins[J]. Journal of Biological Chemistry, 2002, 277(18): 15758-15765. DOI:10.1074/jbc.M108565200 |
| [21] |
SUNG P, PRAKASH S, PRAKASH L. Mutation of cysteine-88 in the Saccharomyces cerevisiae RAD6 protein abolishes its ubiquitin-conjugating activity and its various biological functions[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(7): 2695-2699. DOI:10.1073/pnas.87.7.2695 |
| [22] |
傅明骏, 赵超, 周发林, 等. 斑节对虾泛素结合酶PmUbc基因的克隆及表达分析[J]. 南方水产科学, 2015, 11(6): 41-48. FU M J, ZHAO C, ZHOU F L, et al. Molecular cloning and expression analysis of Ubiquitin-conjugating enzyme gene from black tiger shrimp (Penaeus monodon)[J]. South China Fisheries Science, 2015, 11(6): 41-48. DOI:10.3969/j.issn.2095-0780.2015.06.006 |
| [23] |
BEN-ELIEZER I, POMERANTZ Y, GALIANI D, et al. Appropriate expression of Ube2C and Ube2S controls the progression of the first meiotic division[J]. The FASEB Journal, 2015, 29(11): 4670-4681. DOI:10.1096/fj.15-274522 |
| [24] |
KIRENBERG I, SHAHAR-POMERANTZ Y, ELBAZ J, et al. New insights into the ubiquitin-proteasome pathway in oocytes resuming meiosis[J]. Biology of Reproduction, 2012(s1): 126. |
| [25] |
LEELATANAWTT R, SITTIKANKEAW K, YOCAWIBUN P, et al. Identification, characterization and expression of sex-related genes in testes of the giant tiger shrimp Penaeus monodon[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2009, 152(1): 66-76. |
| [26] |
钱照君, 祝天谅, 姜虎成, 等. 克氏原螯虾泛素结合酶E2r基因的克隆及表达分析[J]. 上海海洋大学学报, 2016, 25(5): 641-651. QIAN Z J, ZHU T L, JIANG H C, et al. Molecular cloning and expression analysis of ubiquitin-conjugating enzyme E2r in Procambarus clarkii[J]. Journal of Shanghai Ocean University, 2016, 25(5): 641-651. |
| [27] |
TSUKIMURA B, KAMEMOTO F I. In vitro stimulation of oocytes by presumptive mandibular organ secretions in the shrimp, Penaeus vannamei[J]. Aquaculture, 1991, 92: 59-66. DOI:10.1016/0044-8486(91)90008-U |
| [28] |
赵维信, 贾江, 安苗. 外源激素和眼柄提取物对罗氏沼虾卵母细胞的离体诱导作用[J]. 上海水产大学学报, 1996, 5(4): 221-225. ZHAO W X, JIA J, AN M. In vitro induction effects of exogenous hormones and eyestalk extracts on the oocytes of Macrobrachium rosenbergii[J]. Journal of Shanghai Fisheries University, 1996, 5(4): 221-225. |
| [29] |
孙瑞杰.克氏原螯虾卵巢同步发育及产卵环境的研究[D].武汉: 华中农业大学, 2009. SUN R J. Study on ovarian synchronization development and spawning environment of Procambarus clarkii[D]. Wuhan: Huazhong Agricultural University, 2009. http://cdmd.cnki.com.cn/article/cdmd-10504-2010010768.htm |
2. Huaiyin Teachers College, Huaian 223001, Jiangsu, China;
3. Manjianghong Lobster Industry Co Ltd Jiangsu Xuyi, Huaian 223001, Jiangsu, China
 2018,
Vol. 27
2018,
Vol. 27


