2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学 水产动物遗传育种上海市协同创新中心, 上海 201306
七彩神仙鱼(Symphysodon haraldi)是一种非常受欢迎的热带观赏鱼养殖品种,在德国、美国和东南亚一些国家(如中国、马来西亚、新加坡和越南等)均有养殖[1],在水产养殖产业中占据十分重要的地位[2]。我国七彩神仙鱼养殖主要集中在香港、台湾、广东、上海和天津。目前,关于七彩神仙鱼营养需求和饲料配制的研究很少,还没有开发出合适的专业配合饲料可供商业化养殖使用,饲料营养已成为制约其发展的主要问题之一[2-3]。
因其具有非常高的观赏价值和经济价值,近年来大家对七彩神仙鱼的关注越来越多,同时也开展了许多科学研究,但与营养相关的研究较少。先前有学者对七彩神仙鱼蛋白需求[2, 4]进行了报道。最近研究发现,七彩神仙鱼肌肉脂肪酸组成特征为多不饱和脂肪酸(PUFA)≈饱和脂肪酸(SFA)>单不饱和脂肪酸(MUFA)[3],仔鱼体内总脂肪含量会随着生长发育时期的进行而减少[5],七彩神仙鱼对脂肪需求量范围为12.02%~17.17%[6]。饵料中类胡萝卜素[7-8]和雨生红球藻(Haematococcus pluvialis)[9]的添加能有效促进鱼体内色素的积累,提高个体的免疫能力和抗氧化能力[10]。但目前,七彩神仙鱼对钙、磷元素营养需求相关的研究还未有报道。钙和磷是鱼类生长代谢所必需的常量矿物质元素,也是水生动物继蛋白质和脂肪之后最为重要的营养元素,在机体骨骼代谢和发育过程中起着十分重要的作用[11]。另有研究表明,钙等金属离子能以不同方式与消化酶及其代谢活性产物结合而改变消化酶活性,影响生物对营养物质的吸收利用,进而影响生物的生长和存活[12]。
本研究设置了12种不同钙、磷水平的饵料进行养殖实验,旨在探究饵料中不同钙、磷水平对七彩神仙鱼幼鱼生长、体组成及消化酶活性的影响,研究结果将为七彩神仙鱼商业化养殖过程中饵料钙、磷的添加提供科学的指导,同时也为七彩神仙鱼配合饲料的开发提供理论依据。
1 材料与方法 1.1 饵料制作饵料主要原料为去脂牛心。采购的冰鲜牛心经绞肉机(RY-22S型电动绞肉机,苏州正台元精器械有限公司,中国江苏)5 mm孔板和3 mm孔板先后两次绞碎,以氯化钙为钙源设置0%、0.5%、1.0%和1.5%(干重)4个钙添加梯度,以磷酸二氢钾为磷源设置0%、0.5%和1.0%(干重)3个磷添加梯度,同时添加适量复合矿物质和复合维生素预混料,并用微晶纤维素调节钙、磷添加时的质量平衡,共搭配制成12种实验饵料,依次分组编号1至12,其中第1组为对照组(钙、磷添加量均为0%)。饵料原料依照由少至多逐级混合的原则,在强力高速搅拌机(B20-S型,南通恒泰食品机械,中国江苏)中搅拌均匀。搅拌好的饵料置于-20 ℃冷冻后切成小块,再用绞肉机经3 mm孔板绞出条状,再次冷冻后破碎成长条颗粒状并在-20 ℃保存待用。氯化钙和磷酸二氢钾均为AR级,购自国药集团化学试剂有限公司。实验饵料原料组成及常规营养成分见表 1。

|
表 1 实验饵料配方及其常规营养成分(湿重) Tab.1 Ingredients and proximate compositions of experimental diets wet basis |
七彩神仙鱼幼鱼由上海海洋大学观赏水族养殖实验室提供。将同一批生长状况良好、规格统一的幼鱼置于实验条件下驯化2周以适应养殖环境,期间每天饱食投喂对照组饵料3次。驯化结束后,挑选360尾初始体质量为(4.98±0.26) g,初始体长为(4.55±0.25) cm的个体,随机分配到12个组,每组3个重复,每个养殖缸(35 cm×45 cm×35 cm,以有效水体计)投放10尾鱼。实验过程中,缸内均保持24 h曝气,并设加热装置以维持养殖水温恒定。实验过程中溶氧大于5 mg/L,水温为(29.0±0.5) ℃,pH为7.8±0.3。养殖水体中钙和总磷浓度分别为(36.50±0.48) mg/L和(1.42±0.04) mg/L。实验期间每天从8:00至20:00保持12 h光照。
实验幼鱼每天按体质量占比5%~6%在8:00、13:00和18:00时分3次进行投喂,养殖周期为8周。每天投食量根据天气变化及前一天鱼的摄食情况进行微调。每次投喂1 h后用虹吸管清理粪便和收集残饵,并填补吸污损失的水量,每天换水1/3左右。实验过程中对死亡的鱼进行称量、记录和保存。
1.3 样品采集养殖实验开始和结束时,将实验鱼进行24 h饥饿处理后对每缸鱼进行称重和测量,计算其增重率和特定生长率等生长参数。驯化结束,随机取鱼9尾,用MS-222(500 mg/L)麻醉后保存在-80 ℃作为实验初始时全鱼样品,测定其常规成分和钙、磷含量。再随机取鱼18尾,麻醉后在冰台上对鱼进行解剖,取出内脏团并分离出肝脏和全肠。肝脏和肠道样品在0.68%的生理盐水中清洗干净,滤纸吸干水分后称重,随后立即装入提前灭菌并编号的离心管并置于液氮中保存。为期8周的养殖实验结束时,将空腹处理24 h的实验鱼每缸随机取6尾,其中3尾作为终末全鱼样品,另外3尾麻醉后进行肝脏和肠道的取样、处理和保存。自实验开始日起,缸内养殖水每周(当天第一次投喂前)取样一次,检测其中钙、磷含量。
1.4 检测方法采用AOAC标准方法[13]对饵料和全鱼常规营养成分进行分析。水分测定采用105 ℃烘箱(DHG-9245A型,上海慧泰仪器制造有限公司,中国上海)干燥法;粗蛋白含量(N × 6.25)的测定采用凯氏定氮法,样品经硫酸消化后用凯氏自动分析仪Kjeltec 2300(FOSS Tecator,瑞典)分析得到结果;灰分测定采用550 ℃灼烧法,干燥后的样品经电炉(FL-2Y型,邦西仪器科技(上海)有限公司,中国上海)炭化后在马弗炉(SXL-1008型,上海精宏实验设备有限公司,中国上海)中灼烧12 h;粗脂肪测定采用氯仿/甲醇[V(氯仿)/V(甲醇)=2: 1]提取法[14]。
饵料及全鱼中钙和总磷含量分别采用高锰酸钾滴定法(GB/T 6436—2002)和钼黄分光光度法(GB/T 6437—2002)测定。养殖水中钙和总磷浓度分别采用EDTA滴定法(GB/T 7476—1987)和钼酸铵分光光度法(GB/T 11893—1989)测定。
肠道蛋白酶、淀粉酶和脂肪酶活力,肝脏中谷草转氨酶和谷丙转氨酶活力,以及组织匀浆中蛋白浓度均参照南京建成试剂盒说明书进行测定。1个蛋白酶活力单位定义为每毫克组织蛋白在37 ℃下每分钟分解蛋白生成1 μg氨基酸。1个脂肪酶活力单位定义为37 ℃环境下,每克组织蛋白在反应体系中与底物反应1分钟消耗1 μmol底物。1个淀粉酶活力单位定义为每毫克蛋白在37 ℃与底物作用30分钟,水解10 mg淀粉。通过标准曲线查得的卡门氏单位与待测组织匀浆液蛋白浓度的比值为谷草(或谷丙)转氨酶活力。在温度25 ℃,pH 7.4,波长340 nm,光径1 cm的条件下,1 mL血清在1 min内所生成的丙酮酸,使NADH氧化成NAD+而引起吸光度下降0.001为1个卡门氏单位。
每天第一次投喂前使用YSI便携式多功能水质测定仪(ProPlus Multi-parameter WQ Meter, USA)对水温、溶氧和pH进行测定。
1.5 数据计算及分析存活率(survival rate,SR)、增重率(weight gain rate,WGR)、饵料系数(feed conversion ratio,FCR)、体重特定生长率(specific growth rate of weight,SGRW)、体长特定生长率(specific growth rate of length,SGRL)以及沉积率(deposition rate,DR)的计算公式如下:
 (1)
(1)
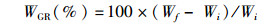 (2)
(2)
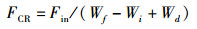 (3)
(3)
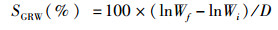 (4)
(4)
 (5)
(5)
 (6)
(6)
式中:Nf表示终末数量;Ni表示初始数量;Wf表示终末体重(g);Wi表示初始体重(g);Wd表示死亡鱼重(g);Fin表示饵料摄入量(g);D表示养殖天数;Lf表示终末体长(cm);Li表示初始体长(cm);DRA表示A的沉积率;CAf表示终末时鱼体内A的含量;CAi表示初始时鱼体内A的含量;CA表示饵料中A的含量;A表示粗脂肪或粗蛋白或灰分。
实验原始数据用Excel 2013软件进行计算和初步处理,采用IBM SPSS statistics 19.0进行双因子方差分析(Two-way ANOVA),并用Turkey检验法对数据进行多重比较,显著性水平为P < 0.05,实验统计分析结果采用平均值±标准差表示。
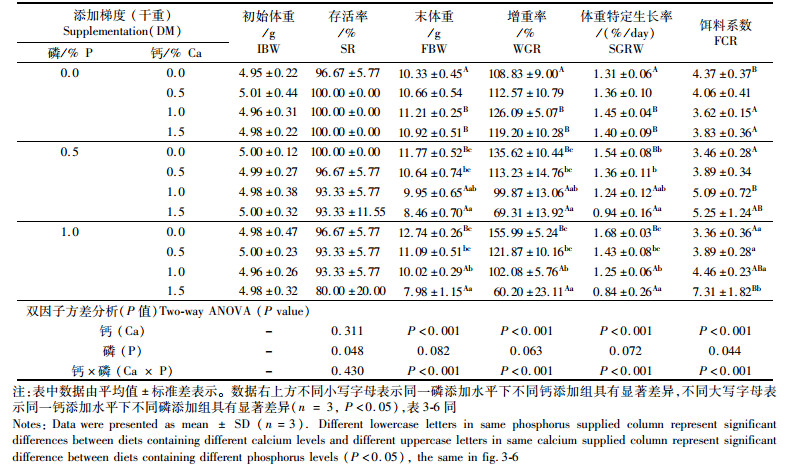
2 结果 2.1 饵料中不同钙磷水平对七彩神仙鱼幼鱼生长和存活的影响由表 2可知,饵料中钙水平对存活率没有影响,钙、磷的添加对存活率没有交互作用(P > 0.05),但存活率随着磷含量的升高而显著降低(P < 0.05)。钙、磷对体质量特定生长率具有显著交互作用。磷添加量为0.5%或1.0%时,幼鱼体质量特定生长率随着饵料中钙水平的提高而显著下降(P < 0.05);当饵料中不添加钙时,与对照组相比,磷的添加能显著提高体重特定生长率。饵料系数则与体质量特定生长率表现出相反的趋势。
|
表 2 饵料中不同钙磷添加水平对七彩神仙鱼(Symphysodon haraldi)幼鱼生长和存活的影响 Tab.2 Effect of dietary calcium and phosphorus supplementation on growth performance and survival rate of juvenile discus fish (Symphysodon haraldi) |
由表 3可知,终末体长、体高和体长特定生长率与饵料中钙水平显著相关(P < 0.05),与磷水平没有显著相关性(P > 0.05)。钙和磷的单独添加对体长/体高的比值以及眼径/体长的比值均没有显著影响,而两者对终末体长、体高和体长/体高的比值具有显著交互作用(P < 0.05)。幼鱼体长特定生长率随着饵料中钙水平的升高而下降,钙添加量为1.5%的组体长特定生长率显著低于不添加钙的组。当饵料中磷添加量为0.5%或1.0%时,体长和体高随饵料中钙水平的增加而降低,磷添加量为1.0%时效果更为显著(P < 0.05)。饵料中不添加钙时,幼鱼体长/体高的比值随着磷水平的升高而显著下降;磷添加量为1.0%时,体长/体高的比值随着钙水平的增加呈先升高后降低的趋势(P < 0.05)。钙、磷添加量分别为0.0%和1.0%的组,体长/体高具有最低平均值(1.27),且此时具有最大体长特定生长率(0.47%/day)。
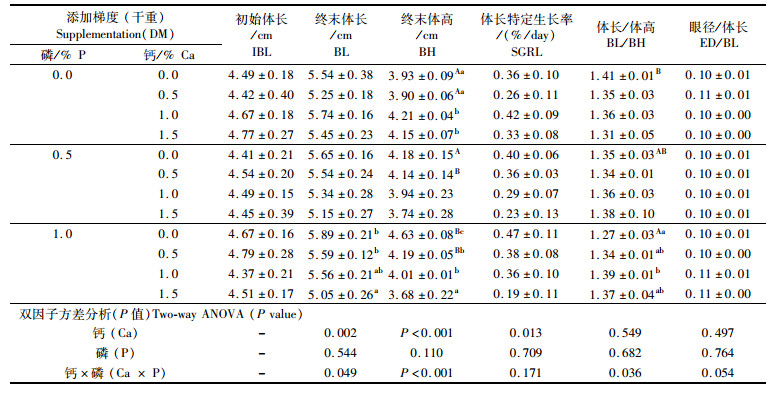
|
表 3 饵料中不同钙磷添加水平对七彩神仙鱼(Symphysodon haraldi)幼鱼形态学参数的影响 Tab.3 Effect of dietary calcium and phosphorus supplementation on morphometric parameters of juvenile discus fish (Symphysodon haraldi) |
由表 4可知,全鱼水分、粗蛋白、粗脂肪和灰分含量均受到饵料钙、磷添加量的显著影响(P < 0.05)。除全鱼粗脂肪含量之外,饵料钙、磷对其他三者具有显著的交互作用。全鱼水分含量范围为77.46%~80.36%。同对照组相比较,饵料中钙和磷的添加均显著降低全鱼粗脂肪含量(P < 0.05)。全鱼粗脂肪含量随着钙的添加呈现先降低后回升的趋势。饵料中钙、磷的添加均能提高全鱼灰分含量。当磷添加量为0.5%时,钙含量的添加能显著提高全鱼水分含量,降低粗蛋白含量(P < 0.05),在磷添加量为0.5%的条件下,钙的添加量为0%和1.5%时,全鱼粗蛋白含量分别具有最高值(15.25%)和最低值(12.60%)。
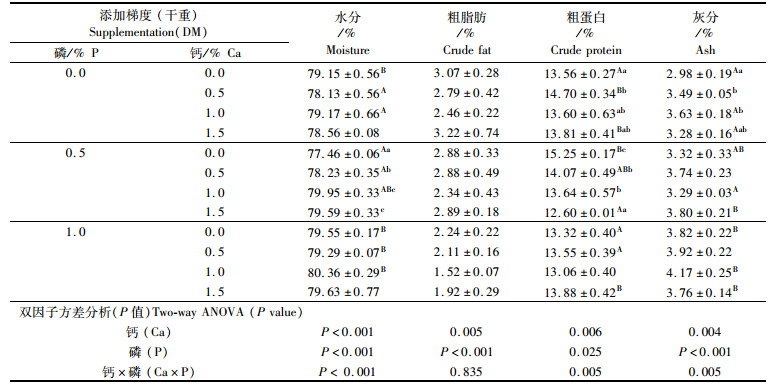
|
表 4 饵料中不同钙磷添加水平对七彩神仙鱼(Symphysodon haraldi)幼鱼体组成的影响 Tab.4 Effect of dietary calcium and phosphorus supplementation on proximate composition of whole fish of juvenile discus fish (Symphysodon haraldi) |
全鱼脂肪沉积率随饵料中磷添加水平的升高而显著降低,随着钙添加水平的升高呈先降低后回升的趋势(表 5)。饵料中不添加磷时,全鱼粗蛋白质沉积率随着钙水平的提高先增加后降低;当饵料中磷的添加量为0.5%或1.0%时,全鱼粗蛋白沉积率随钙水平的增加而显著降低(表 5),不添加钙的组全鱼粗蛋白沉积率显著大于添加量为1.5%的高钙添加组,但与添加量为0.5%的低钙添加组相比无显著差异(P > 0.05)。不添加磷时,全鱼灰分沉积率随饵料中钙水平的增加先升高后降低;当有磷添加时,钙的过量添加会降低全鱼灰分沉积率(表 5),钙、磷添加量分别为1.5%和1.0%的组具有最小均值。
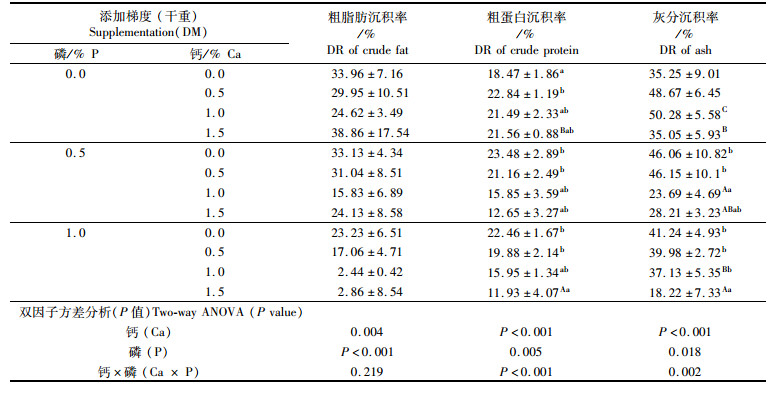
|
表 5 饵料中不同钙磷添加水平对七彩神仙鱼(Symphysodon haraldi)幼鱼粗脂肪沉积率、粗蛋白沉积率及灰分沉积率的影响 Tab.5 Effect of dietary calcium and phosphorus supplementation on crude fat, crude protein and ash deposition rate (DR) of whole fish of juvenile discus fish (Symphysodon haraldi) |
由表 6可知,肠道蛋白酶活力随饵料中钙添加量的升高而显著下降(P < 0.05)。而饵料中钙和磷都对肠道脂肪酶活力有显著影响,脂肪酶活力随饵料中钙水平的增加而降低(P < 0.05),随饵料中磷水平的增加先降低后回升。饵料中钙和磷的单独添加对肠道淀粉酶活力没有显著影响,钙、磷对淀粉酶活力具有显著的交互作用。饵料中添加1.0%磷时,淀粉酶活力随着钙水平的升高而显著下降(P < 0.05)。肝脏谷草转氨酶活力受饵料中钙水平的影响较大,其活力随饵料中钙浓度增加先降低再升高,后又降低。饵料中钙、磷水平对肝脏谷丙转氨酶活力交互作用显著,饵料中磷添加量为0%时,钙的添加显著降低肝胰脏中谷丙转氨酶活力;饵料中钙的添加量为0%时,磷的添加也显著降低谷丙转氨酶活力。
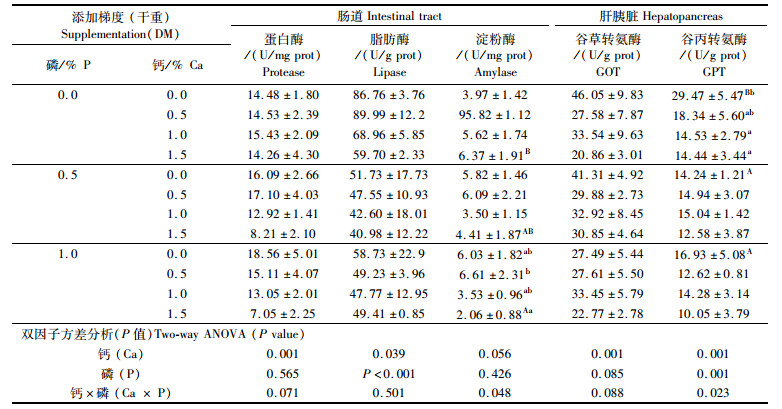
|
表 6 饵料中不同钙磷水平对七彩神仙鱼(Symphysodon haraldi)消化酶及谷草和谷丙转氨酶活力的影响 Tab.6 Effect of dietary calcium and phosphorus supplementation on specific activities of digestion enzyme in the intestine, and GOT and GPT specific activities in the hepatopancreas of juvenile discus fish (Symphysodon haraldi) |
有研究指出,水产动物对钙的需求量比对其他矿物质的需求量要高,当鱼类摄入钙量不足时会引发钙缺乏症而导致生长性能下降[15-16]。在本研究中,不添加磷的情况下,对照组的鱼并没有表现出明显的营养缺陷症状。随着饵料中钙水平的增加,幼鱼体重特定生长率略有提高,但与对照组相比并无显著差异。OGINO和TAKEDA[17]曾报道,养殖水体中钙的含量为20 mg/L时,鲤鱼(Cyprinus carpio)饵料中无需额外添加钙就能满足正常生长。在本实验养殖水体中钙的含量为36.5 mg/L,比鲤鱼养殖水中钙含量更高,而接近于孔雀鱼(Poecilia reticulata)[18]的研究(40 mg/L)。有报道称,某些种类的鱼能通过鳃的吸收作用,轻松地从养殖水体中获取它们生长代谢所需的65%~80%的钙[19]。SCHWARZ[20]也同样认为鱼类能从水环境中获取充足的钙,建议在配制饵料时应该适当降低饵料当中钙的含量。因此,本研究推测七彩神仙鱼幼鱼可能主要通过吸收水中的钙来满足自身生长需求,而不是通过食物获得。饵料中只添加磷的组幼鱼体重特定生长率显著提高,而同时添加钙时,体重特定生长率则急剧下降。这是因为饵料中钙水平的增加降低了饵料利用率(饵料系数增加),使鱼生长的能量需求难以得到满足,从而导致特定生长率下降[21]。饵料中钙含量超过磷含量的时候,钙和磷就会结合成为难以被吸收利用的磷酸钙,从而降低生物对磷的吸收和利用率[22]。这可能是导致体重特定生长率下降的另一个原因。值得注意的是,随着饵料中磷的不断添加,鱼的存活率逐渐下降。这种现象在虹鳟(Oncorhynchus mykiss)和虹鳟鱼苗的研究中也有报道[23-24]。本实验双因素分析结果表明,存活率的下降只与饵料中磷水平显著相关,因此存活率降低很可能是磷的过量添加所致。尽管钙水平对存活率没有直接显著影响,但钙、磷之间的相互作用显著降低了实验鱼的生长性能,这也可能导致较低存活率的出现[22, 24]。
3.2 饵料钙磷水平对七彩神仙鱼全鱼体组成的影响为期56天的养殖实验结束时全鱼常规成分具有显著变化。饵料中磷的添加显著抑制了全鱼粗脂肪的沉积。该结果与斑点叉尾(Ictalurus punctatus)[26]和虹鳟[23]上的研究相似。YE等[27]在石斑鱼(Epinephelus coioides)幼鱼的研究中也发现,不添加磷的组全鱼和肌肉脂肪含量均比添加磷的组要高。另外还发现,不添加钙的组鱼的摄食量比添加钙的组要高。然而脂肪的过量沉积主要是因为磷的缺乏导致一系列中间代谢受阻,而不是简单地摄食量的增加引起的[25]。ROY和LALL[28]对黑线鳕鱼(Melanogrammus aeglefinus Linnaeus)的研究中提出,无机磷的缺乏可能抑制了游离脂肪酸与辅酶A结合成脂酸辅酶A的酯化过程,从而降低了脂肪作为能源物质的利用率。此外,磷的缺乏会促进氨基酸通过柠檬酸循环向脂肪酸转化的过程,增加生物体内脂肪的沉积[29]。饵料中磷的添加会阻碍这些促进脂肪积累的过程,或提高原来体内脂肪的消耗,从而降低全鱼脂肪含量。没有添加磷的情况下,全鱼粗蛋白含量随饵料中钙水平升高呈先增后减的趋势,而当饵料中磷添加量较低(0.5%)时,全鱼粗蛋白含量随着钙含量的增加而显著下降。如上文所述,饵料磷含量较低的情况下,饵料中钙水平的提高会显著降低饵料及磷的利用率,而磷水平较高时,钙的负面抑制作用会得到解除,对饵料利用率没有显著影响。因此,磷添加量为1.0%时,随着饵料中钙水平的升高,全鱼粗蛋白含量没有显著变化。
3.3 饵料钙磷对七彩神仙鱼消化酶和代谢酶活力的影响鱼类食性与消化机能相适应,食性的不同会直接影响消化酶的分泌,同时饵料营养成分及含量的不同也会引起消化酶活性的明显差异[30]。在本研究中,七彩神仙鱼肠道蛋白酶和脂肪酶的活性均随饵料中钙水平的升高而降低(P < 0.05)。吴众望等[12]的研究中发现,2×10-3 mol/L的钙离子对缢蛏(Sinonovacula constricta)蛋白酶具有显著的抑制作用,与本实验结果较为相似。而皱纹盘鲍(Haliotis discus hannai Ino)[31]和三疣梭子蟹(Portunus trituberculatus)[32]上的研究显示,5×10-3 mol/L的钙离子对蛋白酶表现出激活作用。不同研究结果的差异与实验对象的种类和离子浓度有很大关系,许多金属离子是消化酶的激活剂或抑制剂, 在不同浓度下, 离子的影响程度也会不一样。已有研究证实, 金属离子能以不同的形式与酶及其活性代谢产物,以及底物产生极强的亲和力,既可能置换酶活性中心的必需金属,也可能结合酶分子中的咪唑基、巯基、羟基、氨基、肽基等功能基团从而导致酶失活[12]。各种消化酶的发生是随着消化道的发育而逐步变化完善的。莫桑比克罗非鱼(Tilapia mossambica Peters)[33]和点带石斑鱼(Epinephelus malabaricus)[30]的研究表示,饵料对鱼类脂肪酶的影响比较复杂,还有待进一步研究。
3.4 仙鱼幼鱼对钙磷的需要量存活率、增重率和特定生长率等常被用作探讨鱼类对钙、磷适宜需求量的参考指标[34]。本实验结果表明,饵料中钙和磷的添加量分别为0%和1.0%时,七彩神仙鱼幼鱼生长表现最好,此时能获得最大体重特定生长率,且存活率较高,但与钙、磷添加量分别为0.0%和0.5%的组相比没有显著差异(P > 0.05)。以生长表现和存活率作为评判依据,建议七彩神仙鱼幼鱼饵料中钙、磷添加量分别为0%和0.5%。七彩神仙鱼外形独特,作为观赏鱼而言,体型也值得考虑。从表 3的结果可知,钙和磷的添加量分别为0%和1.0%的组体长/体高最接近于1,即个体长得更圆,且此时具有最大的体长特定生长率,因此,若以体长/体高为评估依据,钙和磷的添加量则应分别为0%和1.0%。
不同种类的鱼对钙、磷的需求量有很大差异,因此,养殖对象的种类是影响其对钙、磷需求量的主要自身因素。其次,同一种鱼在不同的生长阶段对矿物元素的需求量也会有所差异,尤其处于幼鱼阶段和繁殖阶段的鱼对钙、磷元素会有特别的需求。另外,鱼在养殖过程中的健康状况会很大程度上影响其对钙、磷元素的吸收能力。当养殖的鱼类处于应激状态时,其对钙、磷元素的需求量和吸收能力都会有所提高[35]。由于鱼类多能直接捕获并吸收周围水体中溶解的钙离子,因此其对饵料中钙的需求量会受养殖环境中钙离子浓度及其他生化组成、水温和pH等的严重影响[21]。而水中磷的含量一般都很低,鱼类对磷的需求主要从饵料中获得[36-37]。鱼类消化系统的差异[38-39]和饵料中钙、磷元素的添加形式也是影响鱼类对钙、磷需求量的重要因素。
综上所述,饵料中磷水平的适当添加能显著提高七彩神仙鱼幼鱼生长性能,促进其体内钙磷沉积,而添加过量则会降低鱼的存活率。饵料中钙水平过高会降低幼鱼体长、体高和体长特定生长率。钙、磷对幼鱼生长具有交互作用,饵料中磷含量较高时钙的添加显著抑制幼鱼生长。在本研究条件下(养殖水中钙含量为36.5 mg/L),幼鱼能从养殖水环境中获取到钙,人工饵料(牛心汉堡)中无需额外添加就能满足其正常生长需求。以增重率、体重特定生长率和存活率综合考虑,七彩神仙鱼幼鱼饵料中钙和磷的适宜添加量分别为0%和0.5%(干重),饵料中钙、磷实际含量分别为0.03%和0.33%(湿重)。
| [1] |
CHONG A, HASHIM R, ALI A, et al. Amino acid profile of various body tissues and eggs of discus fish, Symphysodon aequifasciata[J]. Journal of Applied Aquaculture, 2004, 16(1/2): 157-168. |
| [2] |
CHONG A, HASHIM R, ALI A. Assessment of soybean meal in diets for discus (Symphysodon aequifasciata HECKEL) farming through a fishmeal replacement study[J]. Aquaculture Research, 2003, 34(11): 913-922. DOI:10.1046/j.1365-2109.2003.00945.x |
| [3] |
王磊, 陈再忠, 冷向军, 等. 野生及人工养殖七彩神仙鱼肌肉成分的比较[J]. 上海海洋大学学报, 2016, 25(5): 719-725. WANG L, CHEN Z Z, LENG X J, et al. Comparison of muscle composition of wild and cultured discus fishes Symphysodon spp[J]. Journal of Shanghai Ocean University, 2016, 25(5): 719-725. |
| [4] |
CHONG A S C, HASHIM R, ALI A B. Dietary protein requirements for discus (Symphysodon spp.)[J]. Aquaculture Nutrition, 2000, 6(4): 275-278. DOI:10.1046/j.1365-2095.2000.00151.x |
| [5] |
刘林林, 李杨, 黄旭雄, 等.七彩神仙(Symphysodon aequifasciata)早期发育过程中脂肪及脂肪酸含量的分析[C]//第九届世界华人鱼虾营养学术研讨会论文集.厦门: 中国水产学会, 2013. LIU L L, LI Y, HUANG X X, et al. The changes on total lipids and fatty acid profiles of Symphysodon aequifasciata during the early development[C]//The ninth symposium of world's Chinese Scientisis on Nutrition and Feeding of Finfish and Shellfish. Xiamen: China Sciecy of Fisheries, 2013. |
| [6] |
王吉桥, 耿加振, 姜玉声, 等. 饲料中脂肪含量对七彩神仙鱼幼鱼生长和消化的影响[J]. 水产学杂志, 2009, 22(1): 24-30. WANG J Q, GENG J Z, JIANG Y S, et al. The effect of dietary fat levels on growth and digestibility in juvenile discus Symphysodon aequifasciata[J]. Chinese Journal of Fisheries, 2009, 22(1): 24-30. DOI:10.3969/j.issn.1005-3832.2009.01.006 |
| [7] |
宋雪璐, 李小勤, 陈再忠, 等. 叶黄素对七彩神仙鱼生长和体色的影响[J]. 水产学报, 2017, 41(4): 566-572. SONG X L, LI X Q, CHEN Z Z, et al. Effect of dietary xanthophyll on the growth and body color of discus fish (Symphysodon aequifasciata)[J]. Journal of Fisheries of China, 2017, 41(4): 566-572. |
| [8] |
LIU X D, WANG H X, CHEN Z Z. Effect of carotenoids on body colour of discus fish (Symphysodon aequifasciatus axelrodi Schultz, 1960)[J]. Aquaculture Research, 2016, 47(4): 1309-1314. DOI:10.1111/are.2016.47.issue-4 |
| [9] |
王磊, 陈再忠, 冷向军, 等. 饲料中添加雨生红球藻对七彩神仙鱼生长、体色及抗氧化力的影响[J]. 淡水渔业, 2016, 46(6): 92-97. WANG L, CHEN Z Z, LENG X J, et al. Effect of Haematococcus pluvialis on growth, body color and antioxidation capacity of discus fish Symphysodon haraldi[J]. Freshwater Fisheries, 2016, 46(6): 92-97. DOI:10.3969/j.issn.1000-6907.2016.06.016 |
| [10] |
SONG X L, WANG L, LI X Q, et al. Dietary astaxanthin improved the body pigmentation and antioxidant function, but not the growth of discus fish (Symphysodon spp.)[J]. Aquaculture Research, 2017, 48(4): 1359-1367. DOI:10.1111/are.13200 |
| [11] |
宋俊英.淡水养殖条件下鲈饲料钙元素的营养生理研究[D].厦门: 集美大学, 2015. SONG J Y. Studies on dietary calcium nutritional physiology of Japanese seabass Lateolabrax japonicusin freshwater[D]. Xiamen: Jimei University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10390-1015342597.htm |
| [12] |
吴众望, 潘鲁青, 董双林. 9种金属离子对缢蛏消化酶活力的影响[J]. 中国水产科学, 2003, 10(4): 297-300. WU Z W, PAN L Q, DONG S L. Effects of nine metal ions on digestive enzyme activities of Sinonovacula constricta[J]. Journal of Fishery Sciences of China, 2003, 10(4): 297-300. DOI:10.3321/j.issn:1005-8737.2003.04.007 |
| [13] |
AOAC. Official methods of analysis of AOAC international[M]. 16th eds. Arlington, VA, USA: AOAC International, 1995.
|
| [14] |
BLIGH E G, DYER W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099 |
| [15] |
CHEN K, JIANG W D, WU P, et al. Effect of dietary phosphorus deficiency on the growth, immune function and structural integrity of head kidney, spleen and skin in young grass carp (Ctenopharyngodon idella)[J]. Fish & Shellfish Immunology, 2017, 63: 103-126. |
| [16] |
DESCHAMPS M H, POIRIER S N, DEMANCHE A, et al. Preliminary study for phenotypic description of vertebral abnormalities in triploid trout subjected to prolonged deficiency in phosphorus[J]. Journal of Applied Ichthyology, 2014, 30(4): 833-839. DOI:10.1111/jai.2014.30.issue-4 |
| [17] |
OGINO C, TAKEDA H. Mineral requirements in fish-Ⅲ: Calcium and phosphorus requirements in carp[J]. Nippon SuiSan Gakkaishi, 1976, 42(7): 793-799. DOI:10.2331/suisan.42.793 |
| [18] |
SHIM K F, HO C S. Calcium and phosphorus requirements of guppy Poecilia reticulata[J]. Nippon SuiSan Gakkaishi, 1989, 55: 1947-2953. DOI:10.2331/suisan.55.1947 |
| [19] |
CHAITANAWISUTI N, SUNGSIRIN T, PIYATIRATITIVORAKUL S. Effects of dietary calcium and phosphorus supplementation on the growth performance of juvenile spotted babylon Babylonia areolata culture in a recirculating culture system[J]. Aquaculture International, 2010, 18(3): 303-313. DOI:10.1007/s10499-009-9244-8 |
| [20] |
SCHWARZ F J. Determination of mineral requirements of fish[J]. Journal of Applied Ichthyology, 1995, 11(3/4): 164-174. |
| [21] |
WESLLEY F, BRAGA J G A. Dietary total phosphorus supplementation in goldfish diets[J]. Latin American Journal of Aquatic Research, 2016, 44(5): 129-136. |
| [22] |
CHAVEZ-SANCHEZ C, MARTINEZ-PALACIOS C, MARTINEZ-PEREZ G, et al. Phosphorus and calcium requirements in the diet of the American cichlid Cichlasoma urophthalmus (Gunther)[J]. Aquaculture Nutrition, 2000, 6(1): 1-9. DOI:10.1046/j.1365-2095.2000.00118.x |
| [23] |
SATOH S, PORE-NGAM N, TAKEUCHI T, et al. Effect of various types of phosphorus on zinc availability to rainbow trout[J]. Nippon Suisan Gakkaishi, 1993, 59: 1395-1400. DOI:10.2331/suisan.59.1395 |
| [24] |
FONTAGNE S, SILVA N, BAZIN D, et al. Effects of dietary phosphorus and calcium level on growth and skeletal development in rainbow trout (Oncorhynchus mykiss) fry[J]. Aquaculture, 2009, 297(1/4): 141-150. |
| [25] |
VIELMA J, KOSKELA J, RUOHONEN K. Growth, bone mineralization, and heat and low oxygen tolerance in European whitefish (Coregonus lavaretus L.) fed with graded levels of phosphorus[J]. Aquaculture, 2002, 212(1/4): 321-333. |
| [26] |
EYA J C, LOVELL R T. Available phosphorus requirements of fool-size channel catfish (Icatlurus punctatus) fed pratical diets in pond[J]. Aquaculture, 1997, 154(3/4): 283-291. |
| [27] |
YE C X, LIU Y J, TIAN L X, et al. Effect of dietary calcium and phosphorus on growth, feed efficiency, mineral content and body composition of juvenile grouper, Epinephelus coioides[J]. Aquaculture, 2006, 255(1/4): 263-271. |
| [28] |
ROY P K, LALL S P. Dietary phosphorus requirement of juvenile haddock (Melanogrammus aeglefinus L.)[J]. Aquaculture, 2003, 221(1/4): 451-468. |
| [29] |
RODEHUTSCORD M. Response of rainbow trout (Oncorhynchus mykiss) growing from 50 to 200 g to supplements of dibasic sodium phosphate in a semipurified diet[J]. The Journal of nutrition, 1996, 126(1): 324-331. DOI:10.1093/jn/126.1.324 |
| [30] |
逯尚尉, 刘兆普, 余燕. 不同饵料对点带石斑鱼幼鱼生长、营养成分及组织消化酶活性的影响[J]. 上海海洋大学学报, 2010, 19(5): 648-653. LU S W, LIU Z P, YU Y. Effect of different diets on growth, nutritive composition and digestive enzyme activities of juvenile Epinephelus malabaricus[J]. Journal of Shanghai Ocean University, 2010, 19(5): 648-653. |
| [31] |
杨蕙萍, 童圣英, 王子臣. 皱纹盘鲍蛋白酶的研究[J]. 水产学报, 1997, 21(2): 128-133. YANG H P, TONG S Y, WANG Z C. The study of protease in Haliotis discus Hannai Ino[J]. Shuichan xuebao, 1997, 21(2): 128-133. |
| [32] |
胡毅, 潘鲁青. 10种金属离子对三疣梭子蟹中肠腺消化酶活性的影响[J]. 热带海洋学报, 2006, 25(6): 52-57. HU Y, PAN L Q. Effects of ten metal ions on digestive enzyme activities of Portunus trituberculatus[J]. Journal of Tropical Oceanography, 2006, 25(6): 52-57. DOI:10.3969/j.issn.1009-5470.2006.06.009 |
| [33] |
NAGASE G. Contribution to the physiology of digestion in Tilapia mossambica Peters: digestive enzymes and the effects of diets on their activity[J]. Zeitschrift Für Vergleichende Physiologie, 1964, 49(3): 270-284. DOI:10.1007/BF00298199 |
| [34] |
PRABHU P A J, SCHRAMA J W, KAUSHIK S J. Quantifying dietary phosphorus requirement of fish-a meta-analytic approach[J]. Aquaculture Nutrition, 2013, 19(3): 233-249. DOI:10.1111/anu.2013.19.issue-3 |
| [35] |
麦康森, 陈立侨. 水产动物营养与饲料学[M]. 2版. 北京: 中国农业出版社, 2011. MAI K S, CHEN L Q. Nutrition and feed of aquatic animals[M]. 2nd ed. Beijing: China Agricultural Press, 2011. |
| [36] |
CHENG K, HU C Q, LIU Y N, et al. Effects of dietary calcium, phosphorus and calcium/phosphorus ratio on the growth and tissue mineralization of Litopenaeus vannamei reared in low-salinity water[J]. Aquaculture, 2006, 251(2/4): 472-483. |
| [37] |
LALL S P. The minerals[M]//HALVER J E. HARDY R W. Fish Nutrition. 3rd ed. San Diego: Academic Press Inc., 2002.
|
| [38] |
HUA K, BUREAU D P. Modelling digestible phosphorus content of salmonid fish feeds[J]. Aquaculture, 2006, 254(1/4): 455-465. |
| [39] |
HUA K, BUREAU D P. Quantification of differences in digestibility of phosphorus among cyprinids, cichlids, and salmonids through a mathematical modelling approach[J]. Aquaculture, 2010, 308(3/4): 152-158. |
2. Key Laboratory ofExploration and Utilization ofAquatic Genetic Resources, Ministry ofEducation, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetic and Breeding, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


