2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
炎症是机体应对外来刺激的一种防御机制,是一种常见的病理过程[1]。然而长期的炎症反应或炎症反应过强则会诱导相关疾病的发生,如肝炎、痛风、动脉粥样硬化甚至是癌症等[2-5]。巨噬细胞是机体先天的免疫细胞,在炎症反应中起重要作用[6-7]。在LPS诱导的RAW264.7细胞中,toll-like受体4(TLR4)识别并结合LPS,进而促进炎症信号传导并诱导MAPK和NF-κB蛋白激酶的激活,导致MCP-1、IL-6、IL-1β和TNF-α等炎症因子的转录以及NO等炎性介质的释放,最终导致炎症反应[8-9]。
紫檀茋是近年来发现的一种优秀的抗氧化成分,主要存在于蓝莓、葡萄等水果中,天然来源的优势使得其在功能食品领域具有广阔的应用前景[10]。目前,关于紫檀茋的研究多集中在制备、合成和抗癌活性方面,尚未发现国内有针对紫檀茋抗炎活性的研究[11-13]。因此,本研究以LPS诱导RAW264.7巨噬细胞建立炎症模型,观察紫檀茋对炎症介质和炎性因子生成的影响,并对其抗炎机制进行进一步的探究,为紫檀茋合理开发利用提供理论依据。
1 材料与方法 1.1 实验材料小鼠RAW264.7细胞株购自中国科学院上海细胞库;紫檀茋(Pterostilbene, Pte;纯度99%)购自中国杭州瑞树生化有限公司;脂多糖(L4391,0111:B4)购自美国Sigma公司;一氧化氮(NO)测定试剂盒购自中国南京建成生物工程研究所;Trizol试剂,PrimeScriptTM reagent Kit with gDNA Eraser逆转录试剂盒购自日本TaKaRa公司;Faststart Essential DNA Green Master实时定量PCR试剂盒购自瑞士Roche公司;一抗:anti-ERK1/2, anti-p-ERK1/2, anti-JNK, anti-p-JNK, anti-p38, anti-p-p38, anti-NF-kB p65, anti-NF-kB p-p65,二抗:HRP -Linked antibody购自美国Cell Signaling公司。
1.2 实验方法 1.2.1 RAW264.7细胞培养RAW264.7细胞使用含10%FBS、1%青链霉素的DMEM高糖培养基在37 ℃,5% CO2浓度中进行培养。细胞生长至80%~90%后进行传代,1~2 d换液1次、3~4 d传代1次。细胞传代3次,待细胞状态稳定后进行下一步实验。
1.2.2 RAW264.7细胞炎症模型的建立将处于对数生长期的RAW264.7细胞以2×106个/mL接种到6孔板中,每孔2 mL,置于细胞培养箱中使细胞稳定生长,待细胞贴壁后,随机分为4组,每个处理组设3个平行,分别加入0、50、100和200 ng/mL的LPS进行刺激24 h,促使细胞产生炎症因子。采用qPCR法检测LPS刺激的RAW264.7细胞中炎症因子MCP-1、IL-6、IL-1β和TNF-α表达量来确定LPS诱导炎症的合适浓度。
1.2.3 细胞活力的测定为避免加入的紫檀茋因浓度过大而导致细胞损伤,设置浓度梯度的紫檀茋,采用结晶紫染色法[14]检测紫檀茋对细胞存活率的影响,以确定最终实验浓度。将RAW264.7细胞以2×104个/mL接种到96孔板中,每孔200 μL,置于细胞培养箱中使细胞稳定生长,待细胞贴壁后,加入DMSO溶解的紫檀茋,浓度依次为0、5、10、15和20 μmol/L,每一浓度重复5孔,培养24 h后用结晶紫染色法染色,在酶联免疫检测仪(SynergyTM Mx,美国BioTek) 570 nm处测量各孔的吸光值。
1.2.4 NO释放量的测定LPS刺激RAW264.7细胞后会释放大量的NO,而NO化学性质活泼,在体内代谢很快转化为硝酸盐(NO3-)和亚硝酸盐(NO2-),通过检测培养基中硝酸盐和亚硝酸盐含量来反映NO生成。调整细胞悬液浓度为2×105个/mL,接种于12孔培养板,待细胞长至60%~70%后,分为3组处理,分别为对照组、LPS处理组及LPS加紫檀茋组,每组设置3个平行,继续培养24 h。收集培养基,600 g离心5 min取上清,参照一氧化氮(NO)试剂盒说明操作,通过测定540 nm处吸光值来衡量培养基中NO的含量。计算公式如下:
 (1)
(1)
式中:C-为NO2-/NO3-含量, μmol/L;An为样品的测定OD值;A0为空白OD值;A为标准品的OD值;C为标准品的浓度, 100 μmol/L;n为样品测试前稀释倍数。
1.2.5 细胞总RNA提取、逆转录及Realtime-PCR将RAW264.7细胞转入到6孔板中,每孔中的细胞个数为2×106个/mL,每孔2 mL,待细胞长至60%~70%后,分为3组处理,分别为对照组、LPS处理组及LPS加紫檀茋组,每组设置3个平行,继续培养24 h。收集细胞,采用Trizol试剂提取总RNA,通过测定吸光值OD260和OD280并计算其比值来判断RNA的纯度并测定其浓度,按照cDNA逆转录试剂盒将mRNA逆转录成cDNA;通过特异性引物进行Realtime-PCR扩增,18S作为内参,检测对应炎症因子的表达量,引物序列见表 1。此反应依照Faststart Essential DNA Green Master试剂盒进行,扩增程序:95 ℃,10 min;95 ℃,10 s;60 ℃,10 s;72 ℃,10 s;45个循环。

|
表 1 引物序列 Tab.1 Primer sequences |
将RAW264.7细胞转入到6孔板中,每孔中的细胞个数为2×106个/mL,每孔2 mL,细胞培养48 h后,分为3组处理,分别为对照组、LPS处理组和LPS加紫檀茋组,每组设置3个平行,培养30 min后,PBS冲洗2遍,RIPA裂解液提取蛋白,收集细胞蛋白,定量,等量蛋白上样,进行SDS-PAGE电泳,半干转PVDF膜,5%脱脂牛奶封闭1 h,一抗4 ℃过夜,PBST洗膜3次,HRP标记二抗30 min,PBST洗膜3次,ECL化学发光显色反应,用凝胶成像分析系统成像。
1.3 统计学处理实验数据采用Graph Pad Prism 5.0软件进行处理,所有数值以Mean ± SEM表示,组间比较采用方差分析和t检验,P<0.05为差异显著。
2 结果 2.1 不同浓度LPS对RAW264.7细胞炎症因子表达的影响为确定LPS诱导炎症的合适浓度,分别检测了50、100和150 ng/mL的LPS刺激RAW264.7细胞对炎症因子表达量的影响。MCP-1、IL-6、IL-1β和TNF -α是免疫细胞分泌的一系列重要炎症因子。由图 1可知,3种浓度梯度的LPS在处理细胞24 h后,均能诱导RAW264.7细胞提高炎症因子 MCP-1、IL-6、IL-1β和TNF-α基因的表达量。在100 ng/mL的LPS刺激下,对炎症因子表达上调已经达到极显著的效果(P<0.001),细胞产生明显的炎症反应,且未见细胞损伤,因此后续实验选用100 ng/mL的LPS刺激细胞产生炎症。
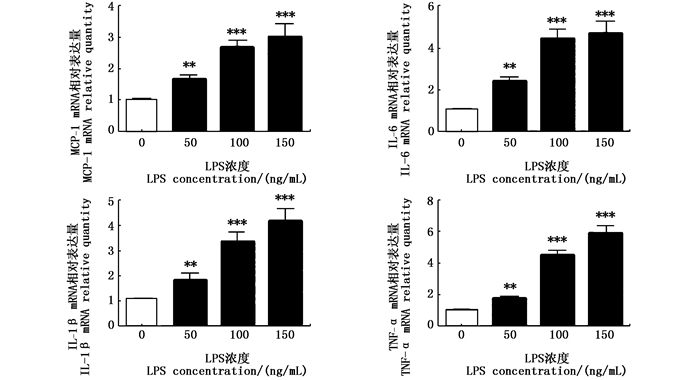
|
与空白组比较,** P < 0.01; ***P < 0.001 Compared with the blank group, ** P < 0.01; ***P < 0.001 图 1 不同浓度LPS诱导RAW264.7细胞对炎症因子基因表达的影响 Fig. 1 Effects of different concentration of LPS on gene expression of inflammatory cytokines in RAW264.7 cells |
为明确紫檀茋的无毒作用浓度,检测了不同浓度紫檀茋对RAW264.7细胞活力的影响。图 2结果显示,不同浓度的紫檀茋处理细胞24 h后,与空白组相比,低于10 μmol/L的紫檀茋处理对细胞存活率无明显作用,超过10 μmol/L浓度的紫檀茋使细胞存活率降低到80%左右,毒性作用明显(P<0.001)。因此,最终确定使用的紫檀茋浓度为5 μmol/L。
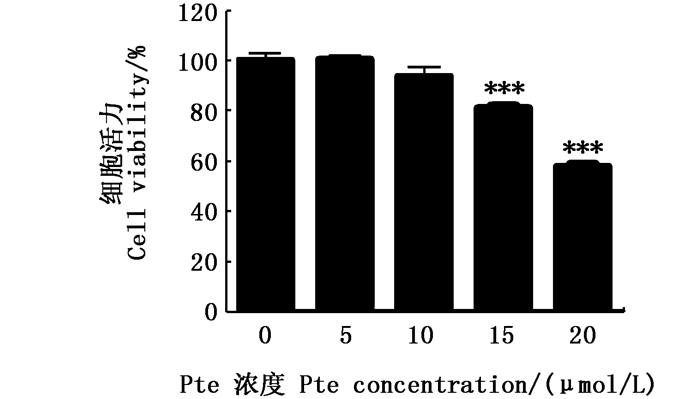
|
与空白组比较,*** P < 0.001 Compared with the blank group, ***P < 0.001 图 2 紫檀茋对RAW264.7细胞活力的影响 Fig. 2 Effects of Pte on cell viability in RAW264.7 cells |
由图 3可知,与空白组对比,100 ng/mL LPS刺激细胞后,极大提高了MCP-1、IL-6、IL-1β和TNF-α这4种炎症因子的mRNA表达水平,说明LPS刺激可以造成巨噬细胞炎症因子转录水平的显著上升,这与模型建立的结果一致。与LPS组相比,紫檀茋对上述炎症因子均有抑制作用,且效果显著(P < 0.001)。

|
与control组比较,### P < 0.001;与LPS组比较,*** P < 0.001 Compared with the control group, ### P < 0.001; Compared with the blank group, ***P < 0.001 图 3 紫檀茋对LPS刺激的RAW264.7细胞 MCP-1、IL-6、IL-1β和TNF-α表达量的影响 Fig. 3 Effects of Pte on expression of MCP-1, IL-6, IL-1β and TNF-α in LPS-induced RAW 264.7 cells |
NO是一种重要的炎性介质,参与宿主的免疫防御和调节过程。由图 4可知,紫檀茋能显著抑制细胞NO的释放,经紫檀茋处理,培养基中的NO浓度恢复至空白对照水平(P=0.001)。iNOS作为NO生成的关键限速酶,其基因表达水平是调控NO释放的重要因素,通过检测iNOS mRNA水平的表达,发现LPS可显著上调iNOS表达,而紫檀茋能够显著降低LPS诱导的iNOS表达量(P<0.001)。
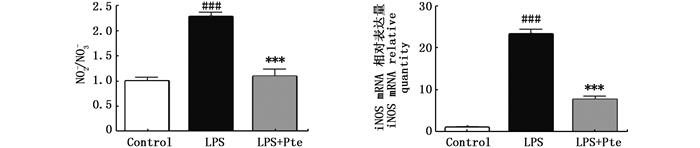
|
与control组比较,### P < 0.001;与LPS组比较,*** P < 0.001 Compared with the control group, ### P < 0.001; Compared with the blank group, ***P < 0.001 图 4 紫檀茋对LPS刺激的RAW264.7细胞NO释放量及iNOS基因表达的影响 Fig. 4 Effects of Pte on NO production and gene expression of iNOS in LPS-induced RAW 264.7 cells |
MAPK包括ERK、JNK和p38,是参与炎症相关信号通路的重要酶。因此,通过Western blot法检测了紫檀茋对LPS诱导的RAW264.7巨噬细胞中MAPK途径的影响。结果显示,紫檀茋对ERK和p38的磷酸化均有抑制作用,但对JNK没有抑制作用。另外,NF-κB在调节炎症因子中起重要作用。活化的NF-κB易位至细胞核以结合特异性DNA,进而调节各种炎性细胞因子的表达。因此,进一步检测了紫檀茋对LPS诱导的巨噬细胞中NF-κB p65磷酸化的影响,结果显示紫檀茋显著降低了p65的蛋白磷酸化水平。以上结果表明紫檀茋通过抑制MAPK和NF-κB途径抑制炎症因子基因的表达。
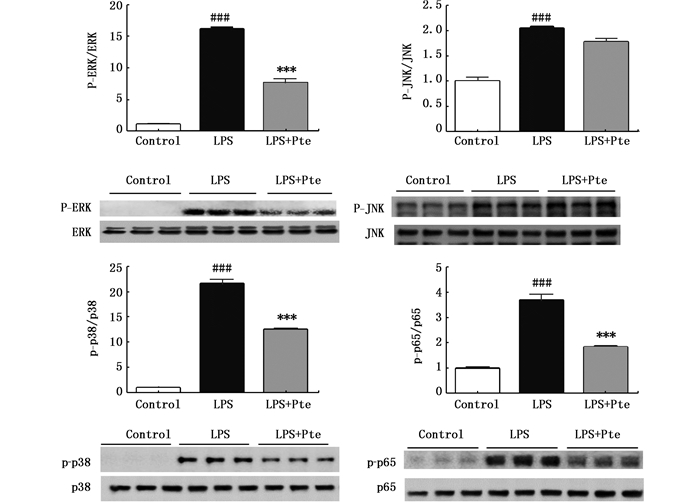
|
与control组比较,### P < 0.001;与LPS组比较,*** P < 0.001 Compared with the control group, ### P < 0.001; Compared with the blank group, ***P < 0.001 图 5 紫檀茋对LPS刺激的RAW264.7细胞MAPK和NF-κB p65蛋白表达的影响 Fig. 5 Effects of Pte on protein expression of MAPK and NF-κB p65 in LPS-induced RAW264.7 cells |
紫檀茋是一种存在于蓝莓、树莓中的多酚物质。尽管其抗炎作用少有报道,其结构类似物白藜芦醇,则被公认为具有优良的抗炎效果[15-16]。鉴于其与白藜芦醇结构类似,推测紫檀茋很有可能具有抑制炎症的作用。探究了紫檀茋在LPS刺激的RAW264.7细胞中的抗炎作用,发现紫檀茋能够显著抑制促炎因子MCP-1,IL-6,IL-1β和TNF-α在mRNA水平的表达,并能通过抑制iNOS表达来抑制LPS诱导的NO的产生。此外,还发现紫檀茋可能是通过阻断MAPK和NF-κB通路来抑制炎症反应。
MCP-1已经被证实是负责招募巨噬细胞的主要趋化因子,广泛参与了类风湿关节炎、心血管疾病和动脉粥样硬化等多种炎性疾病的发生[17]。IL-6是目前发现在慢性炎症疾病中作用最突出的细胞因子。同样,IL-1β和TNF -α能够增强巨噬细胞的敏感性,结合相应的受体,然后继续作为刺激信号激活更多的巨噬细胞,促进炎症的发展[18-19]。上述炎症因子被广泛用于指示炎症反应强度。本研究通过检测RAW264.7巨噬细胞中上述炎症因子的基因表达,证实了紫檀茋显著降低了LPS诱导的炎症因子,可以抑制炎症发生,这与白藜芦醇的抗炎作用类似。彭洁等[20]通过培养外周血单个核细胞,结果发现白藜芦醇能够有效抑制促炎因子IL-1β、IL-6及MCP-1表达。ZONG等[21]发现白藜芦醇同样能够抑制LPS诱导的RAW264.7细胞 IL-1β和TNF-α的表达。此外,我们发现紫檀茋除了抑制MCP-1、IL-6、IL-1β和TNF-α 等炎症因子的表达,同时抑制了炎性介质NO的产生,具有多靶点抑制炎症反应的特性。NO由一氧化氮合酶(NOS)催化产生,高浓度NO有一定杀菌作用,但可作为促炎介质引起全身炎症反应,在炎症相关发病过程中起关键作用[22-23]。NOS有3种亚型结构,其中诱导型一氧化氮合酶被认为是巨噬细胞中NO合成的主要限速酶。本研究表明紫檀茋通过下调iNOS的表达起到抑制NO生成的效果,这与白藜芦醇的作用途径一致[24]。
MAPK家族主要包括3种信号通路的转导,分别为ERK、JNK和p38,这3条途径在炎症反应中起重要作用[25]。ZONG等[21]研究发现白藜芦醇能够通过抑制ERK、JNK和p38的蛋白磷酸化水平来下调炎症因子的表达。与白藜芦醇不同的是,本实验结果显示紫檀茋能够有效抑制ERK和p38的磷酸化水平,而对JNK无明显抑制作用。因此,紫檀茋的抗炎作用与ERK和p38通路相关,主要通过抑制ERK和p38的磷酸化水平来下调炎症因子的表达。这可能由于两种多酚结构的不同,苯环上的羟基被甲氧基所取代,从而导致作用的途径不同。NF-κB是调节参与炎症的各种基因转录的关键核转录因子。一般而言,NF-κB以异二聚体结合ⅠκB的形式位于细胞质中。当细胞受到刺激后,ⅠκB-α被磷酸化并迅速降解,促进NF-κB p65的激活和磷酸化。活化的NF-κB易位至细胞核以结合目标DNA并诱导其下游炎性细胞因子如MCP-1,IL-6,IL-1β和TNF-α的过度表达,并最终诱导炎症反应的发生[26-27]。因此,NF-κB p65的含量和形式的变化是NF-κB途径活化的重要标志。本实验进一步探究了紫檀茋对NF-κB p65蛋白表达的影响,结果显示紫檀茋能够显著降低NF-κB p65的蛋白磷酸化水平,这表明紫檀茋对炎症因子的抑制作用部分是通过对NF-κB p65的抑制而实现的。因此,紫檀茋还可通过阻断NF-κB途径来发挥抗炎作用。
4 结论总之,紫檀茋能够显著抑制多种炎症因子的mRNA表达以及炎性介质的释放,表现出显著的改善炎症效果。对其抗炎机制的分析提示,紫檀茋可能是通过阻断MAPK和NF-κB途径的激活来抑制炎症因子的转录和表达,从而发挥抗炎的功效。因此,紫檀茋作为一种天然的多酚化合物,表现出多靶点抑制炎症反应的特性,在开发新型有效的功能性食品方面将具有很大优势。
| [1] |
LANDSKRON G, DE LA FUENTE M, THUWAJIT P, et al. Chronic inflammation and cytokines in the tumor microenvironment[J]. Journal of Immunology Research, 2014. DOI:10.1155/2014/149185 |
| [2] |
FRANCESCHI C, CAMPISI J. Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases[J]. The Journals of Gerontology. Series A, Biological Sciences and Medical Sciences, 2014, 69(s1): S4-S9. |
| [3] |
ESSER N, LEGRAND-POELS S, PIETTE J, et al. Inflammation as a link between obesity, metabolic syndrome and type 2 diabetes[J]. Diabetes Research and Clinical Practice, 2014, 105(2): 141-150. DOI:10.1016/j.diabres.2014.04.006 |
| [4] |
ELINAV E, NOWARSKI R, THAISS C A, et al. Inflammation-induced cancer:crosstalk between tumours, immune cells and microorganisms[J]. Nature Reviews Cancer, 2013, 13(11): 759-771. DOI:10.1038/nrc3611 |
| [5] |
WOJDASIEWICZ P, PONIATOWSKI Ł A, SZUKIEWICZ D. The role of inflammatory and anti-inflammatory cytokines in the pathogenesis of osteoarthritis[J]. Mediators of Inflammation, 2014. DOI:10.1155/2014/561459 |
| [6] |
GU Q L, YANG H L, SHI Q. Macrophages and bone inflammation[J]. Journal of Orthopaedic Translation, 2017, 10: 86-93. DOI:10.1016/j.jot.2017.05.002 |
| [7] |
倪湾, 李敬双, 于洋. 洋葱槲皮素对脂多糖诱导的小鼠腹腔巨噬细胞炎症反应抑制作用[J]. 食品工业科技, 2017, 38(23): 284-288. NI W, LI J S, YU Y. Inhibiting effect of onion quercetin on lipopolysaccharide-induced mice's enterocoelia macrophage inflammatory response[J]. Science and Technology of Food Industry, 2017, 38(23): 284-288. |
| [8] |
WANG T Y, WU F H, JIN Z G, et al. Plumbagin inhibits LPS-induced inflammation through the inactivation of the nuclear factor-kappa B and mitogen activated protein kinase signaling pathways in RAW 264.7 cells[J]. Food and Chemical Toxicology, 2014, 64: 177-183. DOI:10.1016/j.fct.2013.11.027 |
| [9] |
HANADA T, YOSHIMURA A. Regulation of cytokine signaling and inflammation[J]. Cytokine & Growth Factor Reviews, 2002, 13(4/5): 413-421. |
| [10] |
徐方方, 漆睿, 江斯炜, 等. 紫檀芪的研究进展[J]. 中药新药与临床药理, 2017, 28(3): 406-410. XU F F, QI R, JIANG S W, et al. Progress in pterostilbene research[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2017, 28(3): 406-410. |
| [11] |
PARK S H, JEONG S O, CHUNG H T, et al. Pterostilbene, an active constituent of blueberries, stimulates nitric oxide production via activation of endothelial nitric oxide synthase in human umbilical vein endothelial cells[J]. Plant Foods for Human Nutrition, 2015, 70(3): 263-268. DOI:10.1007/s11130-015-0488-3 |
| [12] |
王标, 杨玲英, 曾庆友. 天然抗氧化剂紫檀芪的合成[J]. 应用化工, 2015, 44(3): 431-433. WANG B, YANG L Y, ZENG Q Y. Study on the synthesis of natural antioxidant Pterostilbene[J]. Applied Chemical Industry, 2015, 44(3): 431-433. |
| [13] |
SCHNEIDER J G, ALOSI J A, MCDONALD D E, et al. Pterostilbene inhibits lung cancer through induction of apoptosis[J]. Journal of Surgical Research, 2010, 161(1): 18-22. DOI:10.1016/j.jss.2009.06.027 |
| [14] |
FEOKTISTOVA M, GESERICK P, LEVERKUS M. Crystal violet assay for determining viability of cultured cells[J]. Cold Spring Harbor Protoc, 2016. DOI:10.1101/pdb.prot087379 |
| [15] |
付光新, 姜鲜, 李佳, 等. 白藜芦醇对LPS刺激RAW264.7细胞炎症因子影响研究[J]. 现代预防医学, 2010, 37(3): 568-569, 575. FU G X, JIANG X, LI J, et al. The effects of resveratrol on inflammatory cytokines release from RAW 2647 cells induced by LPS[J]. Modern Preventive Medicine, 2010, 37(3): 568-569, 575. |
| [16] |
刘芳, 曲极冰, 李红, 等. 白藜芦醇抗炎作用机制的初步研究[J]. 中国药学杂志, 2006, 41(15): 1138-1141. LIU F, QU J B, LI H, et al. Study on anti-inflammatory mechanisms of resveratrol[J]. Chinese Pharmaceutical Journal, 2006, 41(15): 1138-1141. DOI:10.3321/j.issn:1001-2494.2006.15.007 |
| [17] |
KANDA H, TATEYA S, TAMORI Y, et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity[J]. The Journal of Clinical Investigation, 2006, 116(6): 1494-1505. DOI:10.1172/JCI26498 |
| [18] |
HUNTER C A, JONES S A. IL-6 as a keystone cytokine in health and disease[J]. Nature Immunology, 2015, 16(5): 448-457. DOI:10.1038/ni.3153 |
| [19] |
TANIGUCHI K, KARIN M. IL-6 and related cytokines as the critical lynchpins between inflammation and cancer[J]. Seminars in Immunology, 2014, 26(1): 54-74. DOI:10.1016/j.smim.2014.01.001 |
| [20] |
彭洁, 韩雪莹, 胡晓燕, 等. 白藜芦醇对外周血单个核细胞中IL-1β、IL-6、MCP-1及SOCS1/3表达的影响[J]. 山东大学学报(医学版), 2011, 49(11): 64-68. PENG J, HAN X Y, HU X Y, et al. The effect of resveratrol on expression of IL-1β, IL-6, MCP-1 and SOCS1/3 in human peripheral blood mononuclear cells[J]. Journal of Shandong University (Health Sciences), 2011, 49(11): 64-68. |
| [21] |
ZONG Y, SUN L, LIU B, et al. Resveratrol inhibits LPS-induced MAPKs activation via activation of the phosphatidylinositol 3-kinase pathway in murine RAW 264.7 macrophage cells[J]. PLoS One, 2012, 7(8): e44107. DOI:10.1371/journal.pone.0044107 |
| [22] |
HU W Z, YANG X J, ZHE C, et al. Puerarin inhibits iNOS, COX-2 and CRP expression via suppression of NF-κB activation in LPS-induced RAW264.7 macrophage cells[J]. Pharmacological Reports, 2011, 63(3): 781-789. DOI:10.1016/S1734-1140(11)70590-4 |
| [23] |
SHARMA J N, AL-OMRAN A, PARVATHY S S. Role of nitric oxide in inflammatory diseases[J]. Inflammopharmacology, 2007, 15(6): 252-259. DOI:10.1007/s10787-007-0013-x |
| [24] |
ZHONG L M, ZONG Y, SUN L, et al. Resveratrol inhibits inflammatory responses via the mammalian target of rapamycin signaling pathway in cultured LPS-stimulated microglial cells[J]. PLoS One, 2012, 7(2): e32195. DOI:10.1371/journal.pone.0032195 |
| [25] |
SHEN C Y, ZHANG W L, JIANG J G. Immune-enhancing activity of polysaccharides from Hibiscus sabdariffa Linn. via MAPK and NF-κB signaling pathways in RAW264.7 cells[J]. Journal of Functional Foods, 2017, 34: 118-129. DOI:10.1016/j.jff.2017.03.060 |
| [26] |
JIANG F, GUAN H N, LIU D Y, et al. Flavonoids from sea buckthorn inhibit the lipopolysaccharide-induced inflammatory response in RAW264.7 macrophages through the MAPK and NF-κB pathways[J]. Food & Function, 2017, 8(3): 1313-1322. |
| [27] |
TAK P P, FIRESTEIN G S. NF-κB:a key role in inflammatory diseases[J]. The Journal of Clinical Investigation, 2001, 107(1): 7-11. DOI:10.1172/JCI11830 |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


