盐度是影响鱼类各种生理活动的重要环境因子之一。河口等咸淡水交融区域内的鱼类容易受环境渗透压的影响,需要通过调节细胞膜内外的离子和水来维持细胞的渗透压[1]。肾脏、鳃和肠是参与渗透调节的主要器官,而肾脏在不同的环境盐度下的功能是不同的[2]。肾脏中含有特定的渗透信号接收细胞监测环境渗透因子浓度的变化,调节自身具有内分泌功能的细胞从而分泌特定的激素,作出相应地应答[3]。在细胞中,细胞骨架赋予细胞形状在细胞环境中的分子运输中起关键作用并形成复杂的网络[4]。然而,在渗透压感受因子识别的过程中,许多细胞的应激反应,如细胞体积的改变、细胞膜的伸缩、细胞骨架的改变和分子的聚集等,只有在渗透压骤变的情况下才会出现,这主要是因为细胞膜的渗透作用;若渗透压的改变程度较小且十分缓慢,细胞则难以出现相应的渗透反应,因此推测,细胞内外的离子变化强度是触发渗透压感受因子的原始信号[5]。另外,细胞膜上通常存在离子通道、离子转运蛋白、水通道蛋白及膜脂质等,且结合方式不同,所产生的渗透作用也不同[5]。随着对渗透胁迫所造成细胞体积变化的调控机制的深入研究,细胞体积大小的调控已被证实是渗透胁迫下鱼类细胞的应答反应[6-7]。蛋白质通过调节体内平衡过程和内在代谢来确定细胞的功能和结构表型[8]。但这些大分子在细胞内外的变化以及低渗和高渗刺激下调控机制的区别尚未清楚。因此,使用功能蛋白质组学技术来发现渗透胁迫下蛋白质的变化是至关重要的。
蛋白质组学是全面了解蛋白对环境压力反应的主要方法之一[9]。目前也开始应用于鱼类渗透压相关研究。DIETMAR[10]等通过蛋白质组学分析海水种群和淡水种群中的三刺鱼(Gasterosteus aculeatus)肾脏中的差异蛋白,发现了肾脏功能调节的多样化。MELODIE[9]等运用蛋白质组学分析了条纹鲶鱼(Pangasianodon hypophthalmus)细菌感染前后的肾脏蛋白表达变化。
金钱鱼(Scatophagus argus)作为一种广盐性鱼类,能够耐受一定范围内的盐度波动。我们的研究表明非等渗环境对金钱鱼肾细胞系的细胞生长,细胞形态,细胞体积均有影响并导致细胞损伤,引起体内和体外渗透调节相关基因和蛋白质表达变化[11-12]。本研究进一步通过蛋白质组学分析原代肾细胞内蛋白的变化趋势,为深入研究肾细胞渗透调节机制奠定基础。
1 材料与方法 1.1 实验材料金钱鱼[(40.0 ± 5.0) g]购于广东省湛江基地,取5尾金钱鱼暂养于实验室循环水[盐度为25,温度为(27 ± 2) ℃]系统中,早、晚投喂一次丰年虾,解剖取组织前两天停止喂食。
1.2 肾原代细胞培养及高、低渗处理配制3个不同渗透压的培养基,分别为300 mOsmol/L(等渗培养基)、150 mOsmol/L(低渗培养基)以及600 mOsmol/L(高渗培养基)。通过向等渗溶液添加ddH2O配制低渗溶液;通过添加无菌饱和NaCl溶液配制高渗溶液,测量渗透压(误差 < 2.0 mOsmol/L)。最后各渗透压溶液分别加入胎牛血清(fetal bovine serum,FBS),使FBS终浓度为20%,备用。
取一尾状态良好的金钱鱼,抽血后无菌操作取肾组织,用含有400 U双抗冲洗肾脏。去除肾脏中残留的血液后,将肾组织剪至1 mm3大小,放入15 mL离心管中。加入10 mL 0.25% Trypsin-EDTA,28 ℃消化30 min后加入3 mL 20% FBS的L15培养基(300 mOsmol/L)终止消化。用200目过滤细胞,细胞悬液室温离心10 min,1 000 r/min,离心后弃上清。加入5 mL 20% FBS/400 U双抗的L15培养基重悬细胞,接种至细胞培养瓶,28 ℃培养,待细胞贴壁。
用75 cm2的细胞培养瓶培养肾原代细胞,将细胞分为等渗组、低渗组、高渗组,每组3个生物学重复。细胞长至90%时,分别更换相应培养基,同时培养24 h后,收集细胞,每组提取蛋白用于蛋白质组学分析,提取RNA用于实时荧光定量(Real-time quantitative PCR,RT-qPCR)分析。
1.3 蛋白提取及SDS-PAGE凝胶电泳细胞加入150 mL SDT裂解液,沸水浴15 min,每5 min在振荡器上振荡一次,超声处理(100 W,工作10 s,间歇10 s,循环10次),12 000 g离心30 min,取上清。BCA法进行蛋白质定量。
每组样品各取20 μg蛋白质,4: 1加入5×上样缓冲液,沸水浴5 min,14 000 g离心10 min,保留上清,进行SDS-PAGE电泳后,进行考马斯亮蓝染色,检测蛋白质量。
1.4 蛋白质样品酶解每份样品取200 μg蛋白质,分别加入二硫苏糖醇,使之终浓度为100 mmol/L,沸水浴5 min后,冷却至室温;加入200 mL UA buffer,转入30 kd超滤离心管,室温离心14 000 g,15 min,弃滤液,此步骤重复1次;加入100 mL IAA,600 r/min振荡1 min,室温避光30 min后,离心14 000 g,10 min;加入100 mL UA buffer,离心14 000 g,10 min,此步骤重复2次;加入100 mL NH4HCO3 buffer,离心14 000 g,10 min,此步骤重复2次;加入40 mL Trypsin buffer,600 r/min振荡1 min后,37 ℃孵育16~18 h;将液体移至新的离心管,离心14 000 g,10 min,收集滤液,C18-SD Extraction Disk Cartridge脱盐处理,吸光度OD280定量。
1.5 LC-MS/MS及Maxquant非标记分析按定量结果取2 μg酶解产物进行LC-MS/MS分析,每个样品进样1次,采用纳升流速HPLC液相系统EASY-nLC1000进行分离,再经过色谱柱进行分离,流速为400 nL/min;酶解产物经毛细管高效液相色谱分离后用Q-Exactive质谱仪(Thermo Finnigan,硅谷,美国)进行质谱分析。LC-MS/MS原始文件导入Maxquant软件(版本号1.3.0.5)进行查库,进行非标记定量分析。数据库为Uniprot_Eupercaria_200194_20160826.fasta。
1.6 RNA提取、cDNA合成及RT-qPCR使用Trizol Reagent提取细胞样品总RNA。用琼脂糖电泳检测RNA的完整性,用Nanodrop ND-2000对RNA浓度进行测定,1.0 mg RNA为模板,以Oligo d(T)16作为接头引物,合成cDNA,-20 ℃保存备用。
使用ABI Prism 7500(Applied Biosystems,旧金山福斯特,美国)进行RT-qPCR检测,所用试剂盒为TaKaRa SYBR Premix Ex Taq Ⅱ(TaKaRa,日本)。挑选的蛋白质为低渗组细胞色素c氧化酶VIb(cytochrome c oxidase subunit VIb,COX VIb),dnaJ热休克蛋白A2(dnaJ homolog subfamily A member 2,DNAJA2),N-myc下游调节蛋白1(N-myc downstream regulated 1,NDRG-1),肌球蛋白-11(myosin-11);高渗组:纤连蛋白(fibronectin,FN),二磷酸腺苷-核糖基化因子蛋白1(ADP-ribosylation factor-like protein 1,ARF1),赖氨酸羟化酶(procollagen-lysine, 2-oxoglutarate 5-dioxygenase 2,PLOD2),脯氨酰-4-羟化酶α2(prolyl 4-hydroxylase subunit alpha-2,P4HA2),醛缩酶B(fructose-bisphosphatealdolase B,ALDOB),核糖核酸结合基序蛋白8A(RNA-binding protein 8A,RBM8A)。以β-actin作为内参基因,利用定量引物(表 1)进行RT-qPCR。反应体系为(10 mL):SYBR Premix Ex Taq Ⅱ(2 ×)5 mL,上、下游引物(10 pmol)各0.2 mL,ROX Ⅱ(50×)0.2 mL,cDNA模板1 mL,用水补至10 mL。二步法反应程序如下:(1)95 ℃,预变性30 s;(2)95 ℃变性5 s,60 ℃退火30 s,PCR反应40个循环;用2-ΔΔCT法进行分析,为确保RT-qPCR反应的准确性和可重复性,每个样品均重复测定3次,使用SPSS 16.0统计软件进行数据分析。

|
表 1 RT-qPCR引物 Tab.1 Primer used for RT-qPCR |
提取高、低渗处理组的肾原代细胞蛋白质,通过label-free蛋白定量分析法得到了3 787个蛋白质,其中,低渗组与等渗组比较得到14个显著差异蛋白,高渗组与等渗组比较得到31个显著差异蛋白(Ratio > +/ -2.0,P < 0.05)(表 2和表 3)。

|
表 2 低渗组中的差异蛋白 Tab.2 The differential proteins in hypo-group |
|
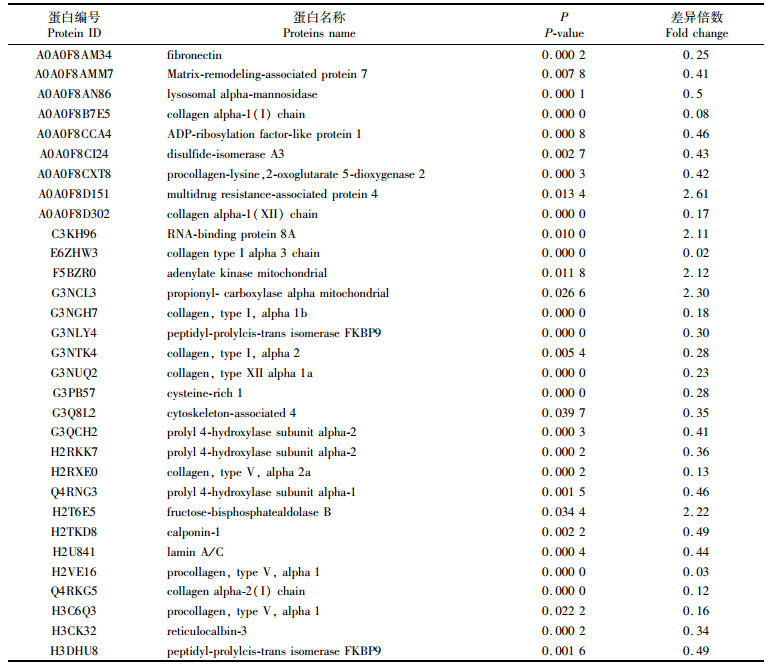
表 3 高渗组中的差异蛋白 Tab.3 The differential proteins in hyper-group |
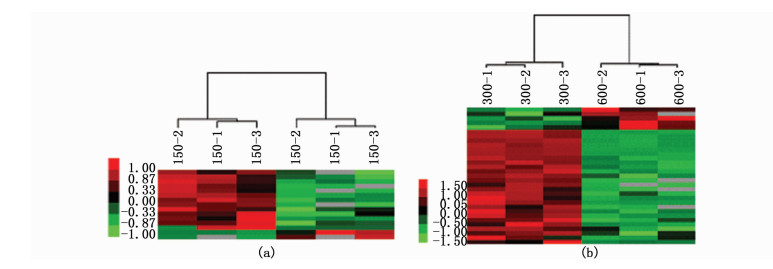
利用蛋白聚类分析高、低渗刺激后,显著变化蛋白在每个样品中的表达含量。每组3个生物学重复,红色代表表达上调,绿色代表表达下调(图 1)。从图中可以看到差异蛋白的平行性良好。
|
图 1 蛋白质聚类分析
Fig. 1 Clustering of proteins
(a)低渗组(150-1,150-2,150-3)与等渗组(300-1,300-2,300-3)比较的热图分析; (b)高渗组(600-1,600-2,600-3)与等渗组比较的热图分析 (a)Heat map analysis of hypo-osmotic group (150-1, 150-2, 150-3) compared with control group (300-1, 300-2, 300-3); (b)Heat map analysis of hyper-osmotic group (600-1, 600-2, 600-3) compared with control group |
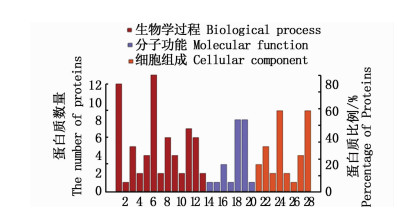
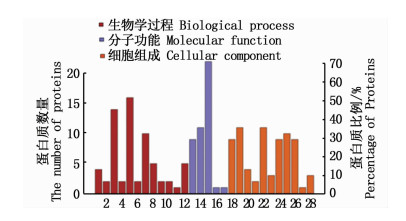
运用Uniprot蛋白数据库和GO数据库,对显著差异蛋白进行注释和功能分析(图 2和图 3)。GO功能分析结果中,主要分类包括3类,分别为细胞组成(Cellular component)、分子功能(Molecular function)以及生物学过程(Biological process)。在低渗组中,细胞组成“细胞(cell)”和“细胞器(organelle)”的比例最大,分子功能中,“结合(binding)”和“催化活性(catalytic activity)”的标注最多,生物学过程中,注释中多与“细胞过程(cell process)”相关,其次为“单组织过程(single-organism process)”;高渗组细胞组成这一类中,蛋白质主要涉及“细胞”和“细胞组分(cell part)”,分子功能中,标注为“结合”的蛋白质占大部分,其次为“催化活性”,生物学过程中,比例最大的是“细胞过程”,其次为“单组织过程”。
|
图 2 低渗差异蛋白GO功能注释
Fig. 2 GO functional annotation of hypo-osmotic differential proteins
1.单组织过程single-organism process; 2.脱毒detoxification; 3.发育过程developmental process; 4.信号signaling; 5.刺激反应response to stimulus; 6.细胞过程cell process; 7.免疫系统过程immune system process; 8.生物学过程调节regulation of biological process; 9.多细胞生物过程multicellular organismal process; 10.定位localization; 11.代谢过程metabolic process; 12.生物学调节biological regulation; 13.细胞组分的组织和生物合成cellular component organization or biogenesis; 14.抗氧化活性antioxidant activity; 15.分子传递活性molecular transducer activity; 16.结构分子活性structural molecule activity; 17.转运活性transporter activity; 18.结合binding; 19.催化活性catalytic activity; 20.电子载体活性electron carrier activity; 21.超分子复合物supramolecular complex; 22.细胞器organelle; 23.膜membrane; 24.细胞cell; 25.大分子复合物macromolecular complex; 26.膜组分membrane part; 27.细胞器组分organelle part; 28.细胞组分cell part |
|
图 3 高渗差异蛋白GO功能注释
Fig. 3 GO functional annotation of hyper-osmotic proteins
1.定位localization; 2.发育过程developmental process; 3.单组织过程single-organism process; 4.多细胞生物过程multicellular organismal process; 5.细胞过程cellular process; 6.信号signaling; 7.代谢过程metabolic process; 8.生物学过程调节regulation of biological process; 9.刺激反应response to stimulus; 10.细胞组分的组织和生物合成cellular component organization or biogenesis; 11.运动locomotion; 12.生物学调节biological regulation; 13.结构分子活性structural molecule activity; 14.催化活性catalytic activity; 15.结合binding; 16.分子功能调节物molecular function regulator; 17.转运活性transporter activity; 18.胞外区部分extracellular region part; 19.细胞组分cell part; 20.细胞器组分organelle part; 21.膜包围腔membrane-enclosed lumen; 22.细胞cell; 23.膜membrane; 24.细胞器organelle; 25.胞外区extracellular region; 26.大分子复合物macromolecular complex; 27.超分子复合物supramolecular complex; 28.膜组分membrane part |
为了验证蛋白质组数据的可靠性,挑选了10个显著差异蛋白(低渗组4个,高渗组6个),根据已有的金钱鱼转录组数据进行RT-qPCR分析(图 4和图 5)。挑选的蛋白包括细胞骨架相关蛋白、能量合成代谢相关蛋白以及蛋白结合相关蛋白等。低渗组4个蛋白的mRNA表达变化与蛋白表达变化一致;高渗组中有3个蛋白的mRNA水平与蛋白表达水平趋势相反,它们为fn、arf1和plod2。
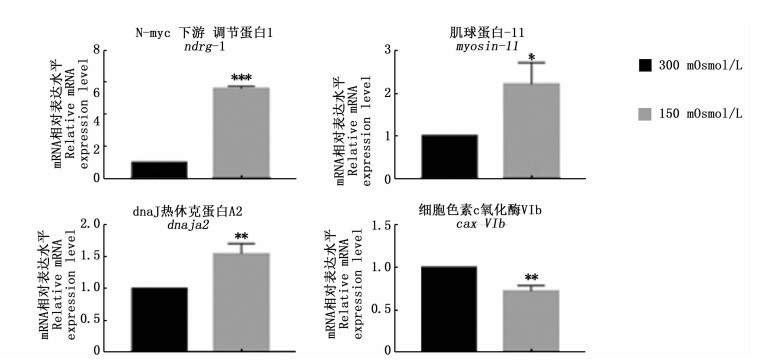
|
图 4 低渗组显著差异蛋白的mRNA表达水平
Fig. 4 mRNA expression of significantly differential proteins in hypo-osmotic group
*表示P < 0.05,**表示P < 0.01,***表示P < 0.001, 图 5同 Bars with *are P < 0.05, ** are P < 0.01, *** are P < 0.001, the same in fig. 5 |
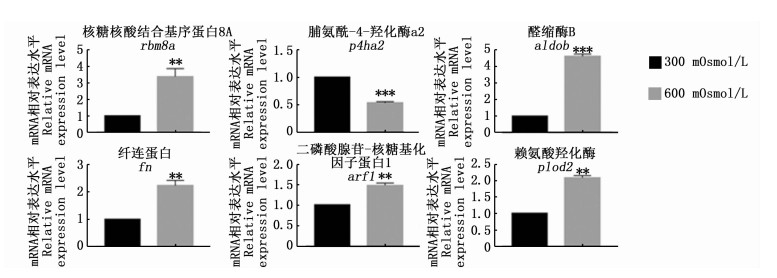
|
图 5 高渗组显著差异蛋白的mRNA表达水平
Fig. 5 mRNA expression of significantly differential proteins in hyper-osmotic group
|
本研究通过蛋白质组检测来探究蛋白质与渗透压调节的关系。比较非等渗组与对照组得到的差异显著的蛋白类型不同。差异蛋白的GO功能注释和富集分析结果说明升高或降低细胞培养基的渗透压对肾原代细胞内外的细胞结构有一定的影响。我们推测,肾细胞应对高渗和低渗的调节机制不同。非等渗刺激后,差异蛋白数量和种类较少,并且不直接与离子转运作用相关。在细胞响应外界渗透压变化时,细胞骨架也会发生相应的变化。细胞骨架蛋白有多种类型,并在细胞内行使不同的功能。这些蛋白维持着细胞结构,并连接不同的细胞器,在细胞粘连、细胞体积调节中起到了重要的作用。
低渗组中与细胞骨架相关的显著差异蛋白为type 1 cytoskeletal 18-like、微管蛋白α-4A链(tubulin alpha-4A chain)、微管蛋白β链(tubulin beta chain-like)和肌动蛋白-11(myosin-11)。微管蛋白(tubulin)虽然是形成丝状网络的微管(microtubule)亚基,但其也是一种能与微管以外的蛋白相结合,行使其他功能的胞浆蛋白[13-14]。在成核过程中,tubulin的二聚体能够自我组织形成微管,并且在调节离子通道中起到了重要作用,例如,电压依赖性阴离子通道(voltage-dependent anion channel,VDAC)[15]。VDAC是线粒体外膜上的孔蛋白,其为线粒体和胞质间包含离子泵的ADP/ATP交换通路[16]。研究表明,αβ-tubulin二聚体的C末端尾部与VDAC结合,抑制VDAC的活性,从而起到抑制线粒体供能,其中细胞色素c氧化酶(cytochrome c oxidase,COX)也随即下降[16]。在萨罗罗非鱼(Sarotherodon melanotheron)中的研究表明,从淡水转至海水中分别驯养10和45 d后,鳃中vdac、钠/钾-ATP酶(Na+/K+-ATPase α1,nkaα1 )、cox1 表达水平都显著上调,而由海水转至咸淡水中,这几个基因表达水平都有所下降[16-17]。我们的结果显示,tubulin alpha-4A chain、tubulin beta chain-like isoform X1显著上调,COX VIb显著下调,而VDAC和NKAα1并没有显著变化。因此推测,低渗刺激后,细胞内渗透压大于外界渗透压,细胞膨胀,随即大量表达细胞骨架相关蛋白,而骨架蛋白作为细胞膜与各细胞器之间的桥梁,会调节其他的离子通道。而金钱鱼肾细胞在低渗状态下具有较强的适应能力[11],在刺激24 h后,细胞已基本适应低渗环境,能量代谢、离子转运等生理活动趋于平衡。
高渗刺激时,细胞也呈现了不同的变化。在显著差异蛋白中,FN和胶原蛋白(collagen)都是细胞外基质(extracellular matrix,ECM)中与细胞骨架相关的必需蛋白质,有助于维持细胞结构和功能的完整性[18]。其中,FN在调节细胞行为和细胞信号传导中起到了重要作用[19]。研究发现,NKA活性降低将会影响细胞内Ca2+的浓度,同时伴随着钠偶联转运体梯度变化,降低细胞FN的粘附能力[20]。因此推测,这些蛋白的损伤,可能会导致离子转运失衡。而ECM和细胞骨架通过整合蛋白(intergrin)形成复合结构,这种复合结构受到蛋白质二硫键异构酶(protein disulfide isomerase,PDI)和ARF1的调控。PDI位于内质网,通过催化二硫键的形成、减少及重组来调节蛋白分泌或细胞表面蛋白的三级结构[21]。研究表明,PDI在整合蛋白的合成中起到了重要的调节作用,从而参与到细胞的粘附调节和转录后修饰[22]。在血小板和肿瘤细胞中,PDI可降低二硫键的数量来调节细胞的粘附或迁移,从而导致FN合成下降[23-24]。ARF1也介导细胞内骨架与ECM的连接,间接影响细胞骨架的重排。
我们的结果显示,PDI、FN、胶原蛋白及促进胶原蛋白合成相关酶类,如PLOD2的蛋白表达量显著降低。因此推测,细胞在高渗刺激下,细胞处于失水状态,形态骤缩,影响细胞间的粘连,从而导致FN和胶原蛋白以及相应的调节蛋白受到损害,影响细胞内稳态。而RT-PCR结果表明,fn、plod2和arf1含量升高表明,细胞在努力恢复受损蛋白,但高渗环境对细胞的损伤太大,导致24 h后仍无法恢复,因而影响各类生理活动,对细胞内其他离子转运蛋白的合成也造成一定影响,使细胞处于严重受损状态,细胞骨架的损伤严重影响离子转运等一系列生理活动,然而具体机制还需深入探讨。
本研究培养了金钱鱼肾原代细胞,经高、低渗透压刺激后,通过Label-free蛋白定量分析,得到了差异蛋白及这些差异蛋白的GO功能注释,了解到这些蛋白所行使的功能及参与的各项生理活动,着重探讨渗透调节过程中,细胞骨架在离子转运过程中起到的作用,为进一步研究细胞水平的肾脏渗透压调节机制奠定基础,而具体参与调控的蛋白研究需进一步探讨。
| [1] |
BOUTET I, LONGKY C L, BONHOMME F. A transcriptomic approach of salinity response in the euryhaline teleost, Dicentrarchus labrax[J]. Gene, 2006, 379: 40-50. DOI:10.1016/j.gene.2006.04.011 |
| [2] |
ARUNA A, NAGARAJAN G, CHANG C F. Differential expression patterns and localization of glucocorticoid and mineralocorticoid receptor transcripts in the osmoregulatory organs of tilapia during salinity stress[J]. General and Comparative Endocrinology, 2012, 179(3): 465-476. DOI:10.1016/j.ygcen.2012.08.028 |
| [3] |
KÜLTZ D. The combinatorial nature of osmosensing in fishes[J]. Physiology (Bethesda), 2010, 27(4): 259-275. |
| [4] |
KHAN H, SINGH R D, TIWARI R, et al. Mercury exposure induces cytoskeleton disruption and loss of renal function through epigenetic modulation of MMP9 expression[J]. Toxicology, 2017, 386: 28-39. DOI:10.1016/j.tox.2017.05.006 |
| [5] |
FIOL D F, KÜLTZ D. Osmotic stress sensing and signaling in fishes[J]. The FEBS Journal, 2007, 274(22): 5790-5798. DOI:10.1111/j.1742-4658.2007.06099.x |
| [6] |
BOURQUE C W. Central mechanisms of osmosensation and systemic osmoregulation[J]. Nature Reviews Neuroscience, 2008, 9(7): 519-531. DOI:10.1038/nrn2400 |
| [7] |
CHARA O, ESPELT M V, KRUMSCHNABEL G, et al. Regulatory volume decrease and Preceptor signaling in fish cells: mechanisms, physiology, and modeling approaches[J]. Journal of Experimental Zoology. Part A, Ecological Genetics and Physiology, 2011, 315A(4): 175-202. DOI:10.1002/jez.v315a.4 |
| [8] |
XIA C G, ZHANG D J, MA C N, et al. Characterization and comparison of proteomes of albino sea cucumber Apostichopus japonicus (Selenka) by iTRAQ analysis[J]. Fish & Shellfish Immunology, 2016, 51: 229-239. |
| [9] |
SCHMITZ M, MANDIKI S N M, DOUXFILS J, et al. Synergic stress in striped catfish (Pangasianodon hypophthalmus, S.) exposed to chronic salinity and bacterial infection: Effects on kidney protein expression profile[J]. Journal of Proteomics, 2016, 142: 91-101. DOI:10.1016/j.jprot.2016.04.046 |
| [10] |
KLTZ D, LI J, PAGUIO D, et al. Population-specific renal proteomes of marine and freshwater three-spined sticklebacks[J]. Journal of Proteomics, 2016, 135: 112-131. DOI:10.1016/j.jprot.2015.10.002 |
| [11] |
GUI L, ZHANG P P, LIANG X M, et al. Adaptive responses to osmotic stress in kidney-derived cell lines from Scatophagus argus, a euryhaline fish[J]. Gene, 2016, 583(2): 134-140. DOI:10.1016/j.gene.2016.02.026 |
| [12] |
SU M L, MU X J, GUI L, et al. Dopamine regulates renal osmoregulation during hyposaline stress via DRD1 in the spotted scat (Scatophagus argus)[J]. Scientific Reports, 2016, 6: 37535. DOI:10.1038/srep37535 |
| [13] |
SHELDON K L, GURNEV P A, BEZRUKOV S M, et al. Tubulin tail sequences and post-translational modifications regulate closure of mitochondrial voltage-dependent anion channel (VDAC)[J]. The Journal of Biological Chemistry, 2015, 290(44): 26784-26789. DOI:10.1074/jbc.M115.678854 |
| [14] |
YU N, SIGNORILE L, BASU S, et al. Isolation of functional tubulin dimers and of tubulin-associated proteins from mammalian cells[J]. Current Biology, 2016, 26(13): 1728-1736. DOI:10.1016/j.cub.2016.04.069 |
| [15] |
ROSTOVTSEVA T K, GURNEV P A, CHEN M Y, et al. Membrane lipid composition regulates tubulin interaction with mitochondrial voltage-dependent anion channel[J]. The Journal of Biological Chemistry, 2012, 287(35): 29589-29598. DOI:10.1074/jbc.M112.378778 |
| [16] |
TINE M, MCKENZIE D J, BONHOMME F, et al. Salinity-related variation in gene expression in wild populations of the black-chinned tilapia from various West African coastal marine, estuarine and freshwater habitats[J]. Estuarine Coastal and Shelf Science, 2011, 91(1): 102-109. DOI:10.1016/j.ecss.2010.10.015 |
| [17] |
TINE M, DE LORGERIL J, D'COTTA H, et al. Transcriptional responses of the black-chinned tilapia Sarotherodon melanotheron to salinity extremes[J]. Marine Genomics, 2008, 1(2): 37-46. |
| [18] |
KHAN H, SINGH R D, TIWARI R, et al. Mercury exposure induces cytoskeleton disruption and loss of renal function through epigenetic modulation of MMP9 expression[J]. Toxicology, 2017, 386: 28-39. DOI:10.1016/j.tox.2017.05.006 |
| [19] |
WANG K, WU F, SEO B R, et al. Breast cancer cells alter the dynamics of stromal fibronectin-collagen interactions[J]. Matrix Biology, 2017, 60-61: 86-95. DOI:10.1016/j.matbio.2016.08.001 |
| [20] |
BELUSA R, AIZMAN O, ANDERSSON R M, et al. Changes in Na+-K+-ATPase activity influence cell attachment to fibronectin[J]. American Journal of Physiology-Cell Physiology, 2002, 282(2): C302-C309. DOI:10.1152/ajpcell.00117.2001 |
| [21] |
CHEN I H, CHANG F R, WU Y C, et al. 3, 4-Methylenedioxy-β-nitrostyrene inhibits adhesion and migration of human triple-negative breast cancer cells by suppressing β1 integrin function and surface protein disulfide isomerase[J]. Biochimie, 2015, 110: 81-92. DOI:10.1016/j.biochi.2015.01.006 |
| [22] |
KOZLOV G, MÄÄTTÄNEN P, THOMAS D Y, et al. A structural overview of the PDI family of proteins[J]. The FEBS Journal, 2010, 277(19): 3924-3936. DOI:10.1111/j.1742-4658.2010.07793.x |
| [23] |
LAHAV J, JURK K, HESS O, et al. Sustained integrin ligation involves extracellular free sulfhydryls and enzymatically catalyzed disulfide exchange[J]. Blood, 2002, 100(7): 2472-2478. DOI:10.1182/blood-2001-12-0339 |
| [24] |
GOPLEN D, WANG J, ENGER P, et al. Protein disulfide isomerase expression is related to the invasive properties of malignant glioma[J]. Cancer Research, 2006, 66(20): 9895-9902. DOI:10.1158/0008-5472.CAN-05-4589 |
 2018,
Vol. 27
2018,
Vol. 27


