2. 上海海洋大学 港航生态安全研究中心, 上海 201306
船舶压载水已成为全球范围内传播海洋外来生物的主要途径之一[1-3]。为防止通过船舶压载水途径引进有害生物和病原体,压载水在排放之前应进行有效处理[4-5]。电解法是目前广泛应用于船舶压载水处理的主要技术之一[6-7],海水电解产生具有高氧化性的次氯酸溶液,从而有效杀灭细菌和大多数藻类[8]。但同时也会与海水中的天然有机物等发生氧化还原反应,生成具有致癌、致畸、致突变作用的消毒副产物(Disinfection by-products,DBPs)[9]。目前已确认的DBPs种类多达数百种,其中包括三卤甲烷(Trihalomethanes,THMs)、卤乙酸(Haloacetic acid,HAAs)、卤代乙腈等。据报道,饮用水中THMs的浓度直接影响乳腺癌、膀胱癌、结肠癌和直肠癌的发生几率[10]。碘代三卤甲烷(I-THMs)作为新型消毒副产物,其初步数据表明,碘仿(CHI3)对细菌具有诱变作用,一氯二碘甲烷(CHClI2)具有细胞遗传毒性,致突变能力更强[11-12]。天然海水较饮用水的I-浓度更高,在次氯酸钠消毒过程中,次氯酸将I-氧化为酸性更强的次碘酸,且海水中含有大量藻类物质、腐殖酸、富里酸等,这些天然有机物作为前驱物与次碘酸反应产生碘代三卤甲烷(I-THMs)[13-14]。鉴于该类消毒副产物具有极强的致癌和致突变特性,且在前期实验中测得此类物质在电解法处理压载水过程中极易生成,难以在常规处理工艺中得到有效控制,因此对其产生机制、影响因素进行研究,为防控电解法在压载水处理中产生二次污染提供理论依据,可以有效保护海洋生态环境。
1 材料与方法 1.1 仪器与材料仪器与材料包括:气相色谱分析仪(Agilent-GC7890B,美国安捷伦公司)、ECD检测器(美国安捷伦公司)、气相衬管(Agilent 5190-2295,美国安捷伦公司)、总碳分析仪(TOC-VCPN,日本岛津公司)、电热恒温水浴锅(PK-S26,上海精密科学仪器有限公司)和紫外分光光度计(752型,上海光学仪器厂)。
甲醇(HPLC/ACS级,99.9%)、甲基叔丁基醚(HPLC/ACS级,99%)、次氯酸钠(NaClO)、腐殖酸(HA)均购自Sigma-Aldrich公司。溴(Br2)和碘(I2)购自美国Accu Standard公司。一氯二碘甲烷(CHClI2)、一溴二碘甲烷(CHBrI2)、二氯一碘甲烷(CHCl2I)、二溴一碘甲烷(CHBr2I)和一氯一溴一碘甲烷(CHClBrI)均购自加拿大Can Syn Chem公司。氢氧化钠(NaOH)、碘化钠(NaI,奈≥99.5%), 硫代硫酸钠(Na2S2O3,99%)、硫酸(H2SO4)、无水亚硫酸钠(Na2SO3)均购于国药集团化学试剂有限公司。超纯水(大于18.2 MΩ·cm)是由超纯水系统(NW10VF,上海Canrex分析仪器有限公司, 中国)制备。海盐(无营养盐)购自中国广州红海公司。实验所用藻种来自中国水产科学研究院东海水产研究所。
1.2 分析方法根据US EPA Methods 551.1[15],利用GC/ECD对水中碘代三卤甲烷进行测定。气相色谱条件:采用HP-5ms毛细管色谱柱(Ultra Inert,30m×250μm ×0.25μm);进样口温度200 ℃;检测器温度290 ℃;分流进样,分流比2:1,进样量2 μL,载气为N2,流速为1 mL/min。升温程序为:35 ℃,保持时间9 min,以2 ℃/min速率升温至45 ℃,保持时间1 min,再以20 ℃/min速率升温至80 ℃,保持时间3 min,最后以15 ℃/min速率升温至220 ℃,保持时间3 min。I-THMs预处理过程为:取20 mL水样于40 mL带聚四氟乙烯衬垫的螺帽样品瓶中,加入4 mL甲基叔丁基醚(MTBE)和8 g无水Na2SO3进行萃取,于振荡器充分振荡2 min,静置30 min,分层后取1 mL上层有机溶液用于测定分析。
1.3 实验过程以次氯酸钠做为消毒剂,使用前取适量超纯水稀释后配置成次氯酸钠标准储备液,置于棕色试剂瓶中4 ℃避光保存,实验开始前测定实际有效氯含量(以Cl2计)后使用。
腐殖酸储备液的配制:称取一定量的腐殖酸粉末溶于0.1 mol/L的氢氧化钠溶液中,充分搅拌均匀,用0.45 μm的滤膜真空抽滤除去不溶物后,定容成腐殖酸贮备液。
以人工海水为研究对象,研究NaClO处理后压载水产生碘代消毒副产物及其影响因素。取一定量原始藻浓度约为5×105 cells/mL的青岛大扁藻,溶于人工海水中,得到模拟压载水。水样总有机碳(Total organic carbon, TOC)浓度为5 mg/L,温度控制在20±1 ℃,pH为8。添加预定浓度NaClO溶液处理水样,处理后取100 mL样本进行总余氯(Total residual chlorine,TRO)分析。另取20 mL样本进行I-THM6分析。
在正交矩阵实验设计采用基线条件下反应48 h。NaClO浓度为10 mg/L,I-浓度为60 μg/L,Br-浓度为68 mg/L,pH 8.0,温度20 ℃。变量参数包括反应时间(24、48、72、96、120、144 h)、温度(10、15、20、25、30 ℃)、NaClO浓度(5、8、10、12、15 mg/L)、碘浓度(10、20、40、60、100 μg/L)、溴浓度(10、30、68、80、100 mg/L),pH(4~10)和不同天然有机物来源(Natural organic matter,NOM)(大扁藻、中肋骨条藻、海洋原甲藻、混合藻、压载水、腐殖酸溶液)对样本进行I-THM6分析。
2 结果与讨论 2.1 次氯酸钠消毒过程中TRO的衰减规律 2.1.1 次氯酸钠浓度对TRO衰减的影响在NaClO不同初始投加量的情况下,TRO的衰减曲线形式接近(图 1)。随着NaClO初始浓度的升高,TRO消耗速率也逐渐增大。NaClO初始浓度C0=5 mg/L, 反应3 min后, C3=1.81 mg/L;当初始浓度增加到C0=15 mg/L,反应3 min, 后C3=9.22 mg/L。初始NaClO投加量越大,水中次氯酸浓度越高,其氧化能力越强,TRO消耗速度越快。各实验组中,水体TRO含量在反应前3 min均迅速衰减,随后衰减速度减慢,60 min后变化趋于平缓,水中天然有机物浓度降低,次氯酸钠含量减少。
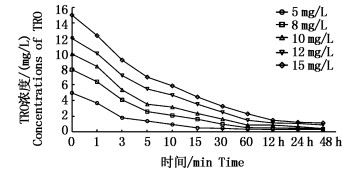
|
图 1 次氯酸钠浓度对TRO衰减的影响
Fig. 1 Effect of initial NaClO concentration on TRO attenuation
|
温度是影响化学反应速率及化学平衡的重要因素,次氯酸钠在杀灭效果和参与化学反应中,其衰减趋势与温度有关(图 2)。随着设置温度的升高,TRO消耗量在48 h内逐渐增大,温度为10 ℃时,C0=10 mg/L, 在反应3 min后, C3=5.81 mg/L;当温度增加到30 ℃时,反应3 min后, C3=3.02 mg/L。温度是影响次氯酸钠稳定性的重要因素,次氯酸钠分解速度随着温度升高而加快;当温度高于25 ℃时,分解速度明显上升。
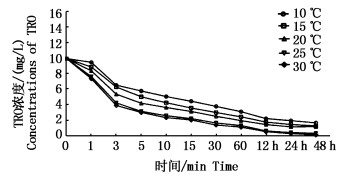
|
图 2 温度对TRO衰减的影响
Fig. 2 Effect of tempreature on TRO attenuation
|
设置次氯酸钠浓度为10 mg/L时,探讨pH对次氯酸钠消毒能力的影响(图 3)。随着pH不断降低,TRO的消耗量逐渐增大。pH=4时,C0=10 mg/L反应3 min后C3=1.52 mg/L;当pH增加到10时,反应3 min后C3=7.18 mg/L。实验表明,次氯酸钠投加量一定时,水体pH越低,水中HClO浓度越大,次氯酸钠消毒的速率越高。
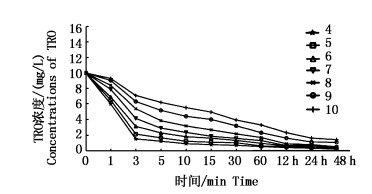
|
图 3 pH对TRO衰减的影响
Fig. 3 Effect of pH value on TRO attenuation
|
取不同藻种水样作为实验比较对象,对次氯酸钠消毒速率影响并不明显(图 4)。在各实验组中,次氯酸均于前3 min内迅速消耗,其中青岛大扁藻、中肋骨条藻、海洋原甲藻、混合藻类水样和天然海水中的TRO衰减曲线形式基本相似;腐殖酸溶液中TRO衰减速率较其他实验组更快,经48 h反应后消耗也更为彻底。
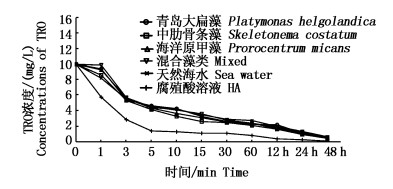
|
图 4 不同NOM对TRO衰减的影响
Fig. 4 Effect of different NOM on TRO attenuation
|
设定NaClO浓度为10 mg/L,TOC初始浓度为5.0 mg/L,I-浓度为60μg/L,Br-为68 mg/L。溶液pH=8,水温20 ℃条件下,分别于反应后24,48,72,96和120 h取水样20 mL,加入无水Na2SO3,检测水样中I-THMs生成量。结果表明,I-存在的条件下,水样经过NaClO消毒后,可生成三碘甲烷(CHI3),一溴二碘甲烷(CHBrI2),二溴一碘甲烷(CHBr2I),一氯二碘甲烷(CHClI2)以及一氯一溴一碘甲烷(CHClBrI);且以CHBrI2和CHBr2I为主要产物(图 5)。投加次氯酸钠后的24 h内,天然有机物与HClO迅速反应,I-THMs在反应进行24 h的生成量为42.52 μg/L;48 h后,I-THMs生成量达到56.27 μg/L;此后的72,96,120 h I-THMs生成量分别为58.16,59.09,60.07 μg/L。在一定次氯酸钠浓度下,I-THMs总量随着反应时间的增加而增大,48 h后增加速率减缓。
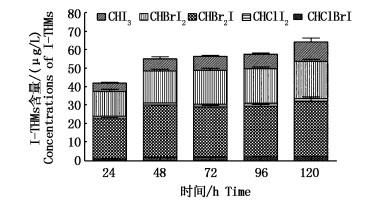
|
图 5 反应时间对I-THMs生成量的影响
Fig. 5 Effect of reaction time on the formation of iodo-trihalomethanes
|
溶液pH=8,水温20 ℃条件下,控制TOC初始浓度为5.0 mg/L,I-浓度为60 μg/L,Br-浓度为68 mg/L。设定反应时间为48 h,分别在NaClO投加量为5,8,10,12和15 mg/L情况下,检测水样中I-THMs的生成量。NaClO投加量低于10 mg/L时,I-THMs生成量随投加量增加而增加;继续增大NaClO投加量I-THMs生成量增长缓慢直至平稳状态(图 6)。NaClO投加量为5 mg/L时,I-THMs的生成量为37.8 μg/L;投加量为15 mg/L时,I-THMs的生成量为62.56 μg/L,I-THMs生成量增加了24.76 μg/L。在不同NaClO投加量下,CHClI2和CHClBrI两种物质所占比例之和分别为3.44%,5.95%,6.09%,10.39%,12.01%。通过分析可以发现,随着NaClO投加量增加,CHBrI2和CHBr2I两种物质生成量在I-THMs生成总量所占比例基本不变,CHI3呈下降趋势,CHClI2和CHClBrI两种物质生成量在I-THMs生成总量所占比例呈上升趋势。
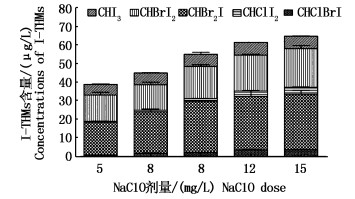
|
图 6 NaClO投加量对I-THMs生成量的影响
Fig. 6 Effect of initial NaClO concentration on the formation of iodo-trihalomethanes
|
控制NaClO浓度为10 mg/L,TOC初始浓度为5.0 mg/L,碘离子为60 μg/L,溴离子为68 mg/L,在溶液pH=8,水温分别为10 ℃、15 ℃、20 ℃、25 ℃、30 ℃条件下,反应48 h后检测水样中I-THMs的生成量。在不同温度条件下,I-THMs的生成量分别为35.89,44.27,55.87,58.35和61.48 μg/L,生成量随着温度的升高而增加(图 7)。当温度高于20 ℃时,I-THMs的生成量增加迅速,30 ℃时I-THMs的生成量比10 ℃时增加21.59 μg/L。其中,CHBr2I,CHBrI2,CHI3生成量随温度升高明显增加;CHClI2受温度影响不大,且在低温时CHClBrI难以生成。温度是影响化学反应的重要因素,温度升高使得化学反应速率加快,促进了I-THMs的生成,而I-THMs本身比较稳定,不会随着温度升高而产生分解。
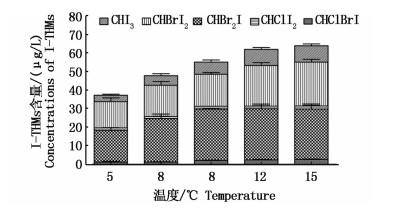
|
图 7 温度对I-THMs生成量的影响
Fig. 7 Effect of temprature on the formation of iodo-trihalomethanes
|
控制NaClO投加量10 mg/L,TOC初始浓度为5.0 mg/L,碘离子为60 μg/L,溴离子为68 mg/L,在溶液温度为20 ℃条件下,分别在pH为4,5,6,7,8,9,10时,反应48 h后检测水样中I-THMs的生成量。结果表明,随着pH升高,I-THMs的生成量不断增加(图 8)。酸性条件下,I-THMs的生成量较小;碱性条件下,I-THMs的生成量明显增大。pH=4时,I-THMs的生成量为18.83 μg/L;pH=10时,I-THMs的生成量为64.04 μg/L,生成量增加了45.21 μg/L。各生成物中CHBr2I,CHBrI2,CHI3生成量随pH升高明显增加,其中CHI3所占比例从6.45%增加至12.14%;CHClI2和CHClBrI受pH影响不大。
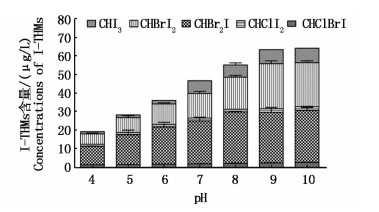
|
图 8 pH对I-THMs生成量的影响
Fig. 8 Effect of pH value on the formation of iodo-trihalomethanes
|
控制NaClO投加量为10 mg/L,TOC初始浓度为5.0 mg/L,Br-为68 mg/L。溶液pH=8,水温20 ℃条件下,设置I-浓度为10 μg/L,40 μg/L,60 μg/L,80 μg/L和100 μg/L情况下检测水样中I-THMs生成量。随着I-浓度增加,I-THMs的生成量增加。当I-含量为10 μg/L时,CHI3、CHClI2和CHClBrI三种物质很难生成,I-THMs的生成量较低;当I-含量为100 μg/L,I-THMs生成量增加至最大值。CHBr2I在I-THMs中生成量所占比例最高,但随着I-浓度增加不断减少;而CHI3含量则随着I-增多,所占I-THMs生成量比例不断增加(图 9)。
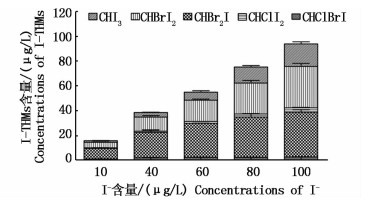
|
图 9 I-含量对I-THMs生成量的影响
Fig. 9 Effect of I- concentration on the formation of iodo-trihalomethanes
|
控制NaClO浓度为10 mg/L,TOC初始浓度为5.0 mg/L,I-浓度为60 μg/L。溶液pH=8,水温20 ℃条件下,设置Br-浓度为10,30,68,80,100 mg/L情况下检测水样中I-THMs生成量。Br-含量低于68 mg/L时,I-THMs生成量随着Br-含量的增加而增加;此后增大Br-含量,I-THMs含量不再有明显变化。在Br-溴离子含量较低时,生成I-THMs种类较多(图 10);Br-含量增加后,I-THMs主要由CHBr2I和CHBrI2两种物质组成。CHI3所占I-THMs生成量比例由Br-浓度为10 mg/L时的34.02%减少至100 mg/L时的4.21%;CHBr2I和CHBrI2所占比例均在增加;CHBr2I增长则最明显。
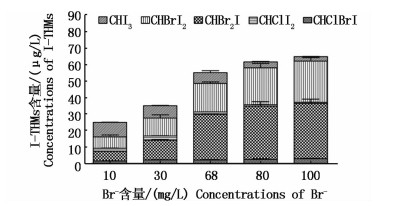
|
图 10 Br-含量对I-THMs生成量的影响
Fig. 10 Effect of Br- concentration on the formation of iodo-trihalomethanes
|
控制NaClO浓度为10 mg/L,TOC初始浓度为5.0 mg/L,I-浓度为60 μg/L,Br-浓度为68 mg/L。溶液pH=8,水温20 ℃条件下,分别在青岛大扁藻、中肋骨条藻、海洋原甲藻、混合藻类、天然海水、腐殖酸6种不同NOM来源中取水样20 mL,加入无水Na2SO3,检测水样中I-THMs生成量。实验结果表明,不同NOM来源对I-THMs的生成有直接影响(图 11)。其中青岛大扁藻、混合藻类和天然海水在处理后的I-THMs生成量较大,均接近60 μg/L,腐殖酸处理后I-THMs生成量仅为24.91 μg/L。不同NOM条件下生成I-THMs中CHBr2I含量均为最高,其中天然海水中高达46.28 μg/L。相比较而言,天然海水和腐殖酸中生成I-THMs种类较少。
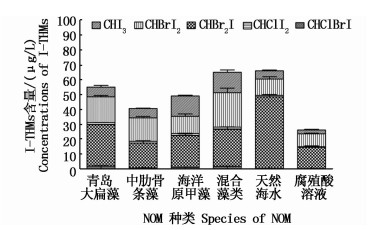
|
图 11 不同NOM对I-THMs生成量的影响
Fig. 11 Effect of different NOM on the formation of iodo-trihalomethanes
|
通过设计正交矩阵实验,主要研究了NaClO浓度、温度、pH以及不同NOM这几个因素对TRO衰减的影响。TRO衰减速率受NaClO初始浓度影响。NaClO初始浓度升高,水中ClO-浓度越大,反应速率越快,这是由于ClO-浓度增高,其氧化能力增强,水中的天然有机物更容易参与到氧化还原反应过程中,从而使ClO-消耗速率加快,在反应初期TRO迅速衰减。该结果与刘彦伟[16]等研究结果相一致,随着初始氯浓度的增大,氯衰减系数逐渐减小,氯衰减系数与初始氯浓度呈负相关。TRO衰减速率受温度影响。在刘聘等研究中,通过一级动力学模型对不同温度下余氯衰减曲线进行数据拟合,随着温度的不断上升,余氯衰减速度呈现出加快的迹象。升温提高了NaClO分解速度,分子间运动速度加快,HClO更容易通过细胞壁进入细胞内,从而加快了与胞内酶的反应速率[16]。同时在低温条件下一些不易分解的天然有机物很难与HClO发生反应,随温度的升高,继而陆续参与反应,反应速率随之加快[17]。TRO衰减速率受pH影响明显,NaClO水解形成Na+和ClO-,pH能够控制溶液中ClO-和HClO的比例[18],当pH较低时,溶液中H+含量多,易与ClO-结合生成更多的HClO,HClO氧化性强,消毒能力远大于ClO-,能够迅速与水中的天然有机物发生反应[19]。随着pH的升高,HClO含量减少,ClO-含量增加,由于ClO-氧化能力弱,导致消毒速率降低[17-18]。肖惠贞[20]等研究表明,pH升高使得游离余氯的衰减速率降低,两者结论一致。TRO衰减速率受不同NOM的影响,腐殖酸较其他藻类物质更容易与NaClO发生反应。其原因可能是腐殖酸中含有更多易于发生氧化还原反应的有机物或反应活性基团,藻类含有细胞壁的细胞结构,在与NaClO反应时须穿过细胞壁与胞内酶发生反应,反应速率降低。
3.2 次氯酸钠消毒过程中对I-THMs生成的影响因素海水中I-、Br-含量较高,藻类等天然有机物种类丰富,在NaClO消毒过程中可产生一定量的碘代消毒副产物。I-THMs生成总量受NaClO初始浓度影响。用NaClO消毒压载水时,水样存在的I-含量远远高于饮用水,HClO首先与I-发生反应生成HOI。同时过量的HClO则会与Br-发生反应生成HOBr,这3种氧化物均能与天然有机物发生反应生成相应的消毒副产物,其中HOI的氧化性最强,NaClO投加量越多,HOI含量越大,生成的碘代三卤甲烷含量就越多,这与孙仲昊[21]等研究结论一致。
I-THMs生成总量受不同温度影响。相关研究表明[22],温度每增加10 ℃,三卤甲烷的生产效率约提高一倍。升温能加速分子间运动,从而加快HOI与天然有机物反应速率;经过水解和氯化反应,使得I-THMs生成量增加。此外,温度影响物质的解离常数,低温能够抑制某些化学反应的进行。
I-THMs生成总量受不同pH影响。NaClO溶于水后除了水解成HClO,同时会产生ClO-,两者均有消毒作用。次氯酸是中性分子,更容易扩散到带负电荷的藻细胞表面;而ClO-具有负电性,导致其很难接近细胞表面,因此消毒效果明显降低。在水溶液中,pH直接影响两种物质的比例。有研究证明[23-24],碘代三卤甲烷的生成总量随着pH的增加而提高。BICHSEL等[25]发现,在形成碘代三卤甲烷的过程中,烯醇化反应、碘化反应在pH较低时会受到抑制,难以生成消毒副产物,所以提高pH能够使HClO与有机物迅速发生反应并生成碘代消毒副产物。
I-THMs生成总量受不同I-影响。经NaClO消毒后I-THMs产物中CHBr2I生成量最大。在压载水中Br-含量远大于I-含量,生成的溴碘代三卤甲烷含量最多。而PANTELAKI等[26]研究发现,随着原水中I-含量增加,CHClBrI生成量最大;在XIA等[27]研究结果中,随着IO3-浓度增大,CHI3生成量趋于最大值。虽然I-THMs总体含量随着I-含量增加而增加,但由于初始Br-、I-含量不同时,最大生成量的物质并不完全相同,由Br-、I-初始浓度决定[28]。
I-THMs生成总量受Br-影响。在NaClO消毒过程中,Br-含量增加,I-THMs随之增加至一定浓度后不再升高,说明I-可能成为反应限制因素,HClO将Br-氧化形成HOBr[28]。DUIRK等[29]人研究证明,当存在一定量的Br-时,更容易生成溴碘代三卤甲烷,随着Br-含量增加,CHBr2I和CHBrI2在I-THMs生成总量中所占比例不断增加。
I-THMs生成总量受不同NOM影响。对于不同NOM经过次氯酸钠消毒,碘代消毒副产物的生成潜力和分布比例差异较大。HUA等[30]对5种原水中的天然有机物进行了分析,研究了I-与不同分子量NOM反应生成消毒副产物的情况,得出脂肪族结构前体物更易生成碘代三卤甲烷。ZHANG等[31]用四种不同天然有机物进行分析得出黄腐酸生成I-THMs含量最大。多项研究表明,腐殖酸的结构和生成消毒副产物的数量和种类有关,生成的主要成分是间苯二酚以及具有羟基苯甲酸等带有含氧基团的芳香烃[32]。在实验中,藻类细胞结构和天然海水组成成分较腐殖酸更为复杂,经过次氯酸钠消毒后生成的消毒副产物生成量更大,种类更多。
| [1] |
胡承兵. 阻止"搭乘"于压载水中的外来生物入侵者[J]. 交通环保, 1999, 20(4): 35-39. HU C B. Alien invaders-putting a stop to the ballast water hitch-hikers[J]. Environmental Protection in Transportation, 1999, 20(4): 35-39. |
| [2] |
张硕慧. 船舶压载水转移外来物种机制的探讨[J]. 中国航海, 2002(1): 43-47. ZHANG S H. Discussion on mechanisms of Non-indigenous species transfer via ship's ballast water[J]. Navigation of China, 2002(1): 43-47. |
| [3] |
DAVID M, PERKOVIČ M. Ballast water sampling as a critical component of biological invasions risk management[J]. Marine Pollution Bulletin, 2004, 49(4): 313-318. DOI:10.1016/j.marpolbul.2004.02.022 |
| [4] |
GOLLASCH S, DAVID M, VOIGT M, et al. Critical review of the IMO international convention on the management of ships' ballast water and sediments[J]. Harmful Algae, 2007, 6(4): 585-600. DOI:10.1016/j.hal.2006.12.009 |
| [5] |
白敏冬, 张芝涛, 白希尧. 海洋生物入侵性传播及绿色防治[M]. 北京: 科学出版社, 2005: 2488-2488. BAI M D, ZHANG Z T, BAI X Y. Invasive propagation of marine organisms and green control[M]. Beijing: Science Press, 2005: 2488-2488. |
| [6] |
邱广临. 船舶压载水管理系统现状及进展研究[J]. 船舶设计通讯, 2011(s1): 44-48. QIU G L. Research on current situation and development of ballast water management system[J]. Journal of Ship Design, 2011(s1): 44-48. |
| [7] |
白敏冬, 张芝涛, 薛晓红. 海洋外来有害生物和病原体防治新技术[M]. 北京: 海洋出版社, 2010. BAI M D, ZHANG Z T, XUE X H. New techniques for the prevention and control of marine alien pests and pathogens[M]. Beijing: Ocean Press, 2010. |
| [8] |
王文成, 龚帆, 郑羽, 等. 船舶压载水处理综述[J]. 上海船舶运输科学研究所学报, 2013, 36(4): 11-14. WANG W C, GONG F, ZHENG Y, et al. A review of ship ballast water treatment[J]. Journal of Shanghai Ship and Shipping Resarch Institute, 2013, 36(4): 11-14. |
| [9] |
戚刚. 饮用水消毒副产物DBPs的研究进展[J]. 中国新技术新产品, 2012(14): 99. QI G. Research Progress on the disinfection by-product DBPs of drinking water[J]. China New Technologies and Products, 2012(14): 99. DOI:10.3969/j.issn.1673-9957.2012.14.085 |
| [10] |
仝重臣, 员建, 苑宏英, 等. 饮用水处理中氯化消毒副产物三卤甲烷和卤代乙酸研究进展[J]. 净水技术, 2012, 31(2): 6-11. TONG Z C, YUAN J, YUAN H Y, et al. Advances in Research of Trihalomethanes and Haloacetic Acids of Chlorination Disinfection By-Products in Drinking Water Treatment[J]. Water Purification Technology, 2012, 31(2): 6-11. |
| [11] |
RICHARDSON S D, FASANO F, ELLINGTON J J, et al. Occurrence and mammalian cell toxicity of iodinated disinfection byproducts in drinking water[J]. Environmental Science & Technology, 2008, 42(22): 8330-8338. |
| [12] |
KRASNER S W, WEINBERG H S, RICHARDSON S D, et al. Occurrence of a new generation of disinfection byproducts[J]. Environmental Science & Technology, 2006, 40(23): 7175-7185. |
| [13] |
NOOT D K, ANDERSON W B, DAIGNAULT S A, et al. Evaluating treatment processes with the ames mutagenicity assay[J]. Journal(American Water Works Association), 1989, 81(9): 87-102. DOI:10.1002/j.1551-8833.1989.tb03275.x |
| [14] |
PLUMMER J D, EDZWALD J K. Effect of ozone on algae as precursors for trihalomethane and haloacetic acid production[J]. Environmental Science & Technology, 2001, 35(18): 3661-3668. |
| [15] |
US EPA. METHOD 551. 1 Determination of chlorination disinfection byproducts, chlorinated solvents, and halogenated pesticides/herbicides in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection[S]. Cincinnati, OH: Environmental Protection Agency, 1995.
|
| [16] |
刘彦伟. 城市再生水氯消毒试验研究[D]. 天津: 天津大学, 2011. LIU Y W. Research of urban reclaimed water for chlorine disinfection experiment[D]. Tianjin: Tianjin University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10056-1012022935.htm |
| [17] |
刘骋. 城市再生水管网余氯衰减规律及影响因素的实验研究[D]. 天津: 天津大学, 2012. LIU P. Research of urban reclaimed water network for chlorine decay variation and influential factors[D]. Tianjin: Tianjin University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10056-1013041066.htm |
| [18] |
张茹. 次氯酸钠中水消毒的研究[D]. 北京: 中国地质大学(北京), 2006. ZHANG R. The Research on sodium hypochlorite disinfection to reclaimed water[D]. Beijing: China University of Geosciences (Beijing), 2006. http://cdmd.cnki.com.cn/Article/CDMD-11415-2006194849.htm |
| [19] |
赵琳, 王晓昌. 紫外与次氯酸钠消毒效果及影响因素研究[J]. 环境污染与防治, 2014, 36(7): 41-45. ZHAO L, WANG X C. Study on performance and influencing factors of UV disinfection and sodium hypochlorite disinfection[J]. Environmental Pollution and Control, 2014, 36(7): 41-45. |
| [20] |
肖惠贞. 常用污水消毒剂杀菌效果影响因素分析[J]. 邯郸医学高等专科学校学报, 2006, 19(3): 208-210. XIAO H Z. Study on germicidal efficacy of commonly-used sewage disinfectants and its influencing factors[J]. Journal of Handan Medical College, 2006, 19(3): 208-210. |
| [21] |
孙仲昊, 徐斌, 胡晨燕, 等. 氯胺消毒过程中碘代三卤甲烷生成的影响因素[J]. 中国给水排水, 2013, 29(5): 1-4, 9. SUN Z H, XU B, HU C Y, et al. Factors affecting iodo-trihalomethane formation during chloraminationof micro-polluted raw water[J]. China Water&Wastewater, 2013, 29(5): 1-4, 9. |
| [22] |
刘绍刚, 朱志良, 韩畅, 等. 饮用水氯化消毒过程的动力学模型研究进展[J]. 环境保护科学, 2009, 35(3): 7-10. LIU S G, ZHU Z L, HAN C, et al. Progress of chemical kinetic models for disinfection of drinking water with chlorination[J]. Environmental Protection Science, 2009, 35(3): 7-10. |
| [23] |
ZHANG J, CHEN D D, LI L, et al. Role of NOM molecular size on iodo-trihalomethane formation during chlorination and chloramination[J]. Water Research, 2016, 102: 533-541. DOI:10.1016/j.watres.2016.07.007 |
| [24] |
YE T, XU B, WANG Z, et al. Comparison of iodinated trihalomethanes formation during aqueous chlor(am)ination of different iodinated X-ray contrast media compounds in the presence of natural organic matter[J]. Water Research, 2014, 66: 390-398. DOI:10.1016/j.watres.2014.08.044 |
| [25] |
BICHSEL Y, VONGUNTEN U. Formation of iodotri-halomethanes during disinfection and oxidation of iodide-containing waters[J]. Environmental Science & Technology, 2000, 34(13): 2784-2791. |
| [26] |
PANTELAKI I, VOUTSA D. Formation of iodinated THMs during chlorination of water and wastewater in the presence of different iodine sources[J]. Science of the Total Environment, 2018, 613-614: 389-397. DOI:10.1016/j.scitotenv.2017.09.072 |
| [27] |
XIA Y, LIN Y L, XU B, et al. Iodinated trihalomethane formation during chloramination of iodate-containing waters in the presence of zero valent iron[J]. Water Research, 2017, 124: 219-226. DOI:10.1016/j.watres.2017.07.059 |
| [28] |
JONESD B, SAGLAM A, SONG H, et al. The impact of bromide/iodide concentration and ratio on iodinated trihalomethane formation and speciation[J]. Water Research, 2012, 46(1): 11-20. DOI:10.1016/j.watres.2011.10.005 |
| [29] |
DUIRK S E, LINDELL C, CORNELISON C C, et al. Formation of toxic iodinated disinfection by-products from compounds used in medical imaging[J]. Environmental Science & Technology, 2011, 45(16): 6845-6854. |
| [30] |
HUA G H, RECKHOW D A. Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size[J]. Environmental Science & Technology, 2007, 41(9): 3309-3315. |
| [31] |
ZHANG T Y, LIN Y L, WANG A Q, et al. Formation of iodinated trihalomethanes during UV/chloramination with iodate as the iodine source[J]. Water Research, 2016, 98: 199-205. DOI:10.1016/j.watres.2016.04.012 |
| [32] |
王小文, 张晓健, 陈超, 等. 芳香类有机物生成氯化消毒副产物特性及其与化学结构的关系[J]. 环境科学, 2006, 27(8): 1603-1607. WANG X W, ZHANG X J, CHEN C, et al. DBPs formation characteristics in chlorinating and relationship with chemical structure of some aromatic organic matter[J]. Environmental Science, 2006, 27(8): 1603-1607. |
2. Centre for Research on the Ecological Security of Ports and Shipping, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


