2. 上海海洋大学 港航生态安全研究中心, 上海 201306
压载水系指在船舶航行过程中,控制船舶纵倾、横倾、吃水、稳定或应力而在船上加装的水及其悬浮物。压载水载入与排出的同时伴随着入侵物种的传播问题[1]。全球80%以上的货物是通过船舶运输的,每年随之运转的压载水约为100亿吨[2]。因此携带着生物、远距离航行的船舶压载水对海洋生态系统和海洋生物多样性具有很大的威胁[2-5]。约有500种海洋入侵生物已经确认是随船舶压载水传播的[6],压载水引发的外来生物的入侵问题越来越受到重视。
船舶压载舱是封闭及黑暗无光的特殊环境,经历长时间的压载运输后,仍有一些藻类能够存活下来,压载水中存活的藻类主要为甲藻门和硅藻门的种类[7-11],少量为其它门类的种类,其中包括绿藻门的种类[12-14]。检测出绿藻门藻类的压载水多为中短途航线船舶的压载水[12],压载水中的绿藻多以淡水种类为主[14],但即使如此,绿藻种类的入侵,仍能对海洋生态环境和海洋生物造成巨大的影响,曾有报道从亚得里亚海引到法国的绿藻,在法国当地海洋生态系统中形成了优势种群,使法国本地海洋植物大量消亡[15],在来自那不勒斯(意大利)西地中海港口收集到的来自埃及(塞得港)和黎巴嫩(贝鲁特)港口的船舶的压载水中,通过形态特征和分子标记方法,识别出了两种存在暴发风险的藻种。因而对压载水中绿藻门的藻类研究亦需高度重视[16]。
在压载舱中,绿藻种群在这一黑暗无光的环境中是如何变化的,目前尚没有相关研究报道。且经历黑暗后重新排放至新环境的绿藻是否还能生长繁殖到较高的密度水平仍需进一步研究。本实验模拟压载舱无光环境,观察不同起始密度青岛大扁藻种群变化的差异,及在排载后进入光恢复阶段的青岛大扁藻(Platymonas helgolandica)与未经过黑暗处理的青岛大扁藻之间的种群变化差异,为压载水生物的入侵防控管理提供理论参考依据。
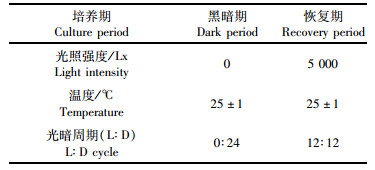
1 材料与方法本试验用的青岛大扁藻由中国水产科学研究院东海水产研究所提供。置于25±1℃,光暗比为12h:12h或0h: 24h,光照强度为5 000 Lx的恒温恒湿的光照培养箱中培养。采用f/2营养液培养,所用人工海水由redsea牌无营养盐海盐配制,均使用高压灭菌锅经121℃灭菌15 min,实验所用器皿均用15%HCl溶液浸泡24 h,随后蒸馏水洗净晾干后备用。实验中设置培养周期共为4周,分别为2周的黑暗期和2周的恢复期。实验正式开始之前,将青岛大扁藻在相应的温度条件下驯化至对数生长期,初始藻种的接种密度为5×104 cells/mL,驯化后经计算确定所需加入的藻液体积以达到相应的起始密度。第一部分为黑暗期,将培养至指数生长期的藻液导入250 mL的锥形瓶,设置5个不同的初始密度,分别为5 cells/mL、50 cells/mL、5×102 cells/mL、5×103 cells/mL、5×104 cells/mL,控制锥形瓶内溶液体积均为200 mL,该部分实验共采用30个容积为250 mL的培养瓶。每个初始密度设置3个平行,培养条件见表 1。实验第二部分选择黑暗两周后仍存活的青岛大扁藻进行恢复期培养,对经历过黑暗培养后的青岛大扁藻用10 μm生物膜进行藻细胞的收集,并通过重悬浮以及稀释的方法重新设置初始浓度为3 cells/mL、30 cells/mL、3×102 cells/mL、3×103 cells/mL、3×104 cell/mL的恢复期光复活密度,所用培养基为f/2培养基,控制锥形瓶内溶液体积均为200 mL。每个初始密度设置3个平行,培养条件见表 1。
|
表 1 青岛大扁藻培养条件 Tab.1 The growth condition of Platymonas helgolandica |
黑暗期及恢复期培养过程中,所有培养瓶在同一培养箱中进行培养,黑暗期的培养瓶用3层铝箔进行包裹。为了保证在实验过程中青岛大扁藻接触良好,每天将培养瓶中的藻液摇晃均匀数次,使瓶内的青岛大扁藻分布均匀,防止扁藻细胞的粘附和沉降。
培养过程中每隔24 h取1 mL藻液,取藻液的时候选择无光条件,避免光照影响锥形瓶内的藻液,用羧基二甲基荧光素双醋酸盐(carboxy dim ethyl fluo—rescein diacetate,CMFDA)及二乙酸荧光素(Fluoresceindiacetate,FDA)染剂对1 mL青岛大扁藻液进行双荧光染色。取样前先将各培养瓶中的藻液摇晃均匀, 由于扁藻游动迅速, 在计数之前, 用5%甲醛液固定,固定后立即采用显微镜计数的方法测定藻细胞的浓度,放置于Olympus BX53显微镜下,用标准蓝光激发绿光,每组重复取样计数三次后取其平均值。
采用Sigma Satat(SPSS 3.5)软件进行数据统计和检验。分析不同的黑暗初始密度及黑暗处理后的扁藻在不同的光恢复密度下的生长抑制率、细胞密度,以单因素方差分析(One-Way ANOVA)法来检验组间差异性,当P<0.05时具有显著性差异,P<0.01时具有极显著差异。利用Graph Pad Prism 5作图软件进行作图分析。
藻细胞的相对生长抑制率IR采用如下公式计算:
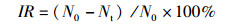 (1)
(1)
式中:IR为微藻的相对抑制率(%); Nt为某时刻黑暗培养时的藻细胞数量,N0为相应时刻单种培养时的藻细胞数量(cells/mL)。
选用Logistic非线性生长模型拟合青岛大扁藻生长过程[19-20], 应用逻辑斯蒂方程对微藻种群增长过程进行拟合,曲线模型中的参数A为极限生长量(终极生长量), k为瞬时相对生长率, B为常数尺度。将每个处理组的最高细胞密度值作为环境容纳量Y的估计值:
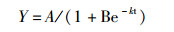 (2)
(2)
以最小二乘法对此方程进行非线性回归分析,统计分析在Sigma Satat(SPSS 3.5)软件上进行。
2 结果 2.1 不同初始密度水平对青岛大扁藻在黑暗条件中生长的影响对不同初始密度的青岛大扁藻在黑暗期的细胞的生长抑制率进行平均值检验,其中不同初始密度的扁藻细胞生长抑制率之间没有显著性差异(P=0.563>0.05)。不同培养时间的扁藻细胞生长抑制率之间也没有显著性差异(P=0.287>0.05)。
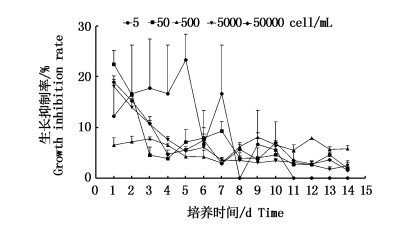
对不同的起始密度的青岛大扁藻进行黑暗处理, 起始密度为5×104 cells/mL及5×103 cells/mL两个初始细胞密度数量级最高的青岛大扁藻,生长抑制率随黑暗处理时间增加的变化非常相似(P=0.593),都是第一天生长抑制率最高,随后一直下降,密度为5×103 cells/mL的生长抑制率一直下降到第五天开始有所回升,之后就处于平缓的下降状态,密度5×104 cells/mL的生长抑制率一直下降到第四天开始有所回升,随后一直处于抑制率波动的状态;初始密度为5×102 cells/mL的青岛大扁藻的生长抑制率在开始的两天均比其他初始密度的青岛大扁藻的生长抑制率低,随后就处于波动的上升状态,在第9天达到最大平均值为8.10%;起始密度为5 cells/mL的青岛大扁藻的生长抑制率变化最为显著,这是由于细胞初始量少,细胞生长抑制率波动剧烈;初始密度为50 cells/mL的青岛大扁藻的生长抑制率在开始三天降低的幅度为所有密度级的青岛大扁藻中最大的,从平均22.49%降低到平均4.52%,随后细胞抑制率有所升高,一直到第七天开始缓慢地降低(图 1)。
|
图 1 不同初始密度的青岛大扁藻黑暗期生长抑制率变化
Fig. 1 Changes of growth inhibitory rate in different initial density of Platymonas helgolandica under dark conditions
|
从图 2可以看出,整体来说前3天内的细胞生长抑制率平均处于较高的水平,且前3天细胞数量减少最为剧烈,在第3天之后,细胞的平均生长抑制率就处于一个波动的状态,总体是一个趋于降低的状态,在黑暗处理的前七天,都会出现距离箱子高度三倍以上的极值,说明前七天对于各个初始密度水平的青岛大扁藻来说,都出现极大的生长抑制率波动,即细胞数量波动很大。
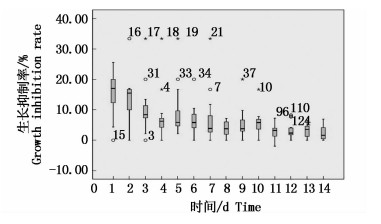
|
图 2 不同初始密度的青岛大扁藻黑暗期细胞生长抑制率箱图
Fig. 2 Cell growth inhibition rate box diagram of different initial density of Platymonas helgolandica in the dark
|
在两周的黑暗处理过后,初始密度为5 cells/mL的青岛大扁藻的去除率为100%,其次为初始密度为50 cells/mL的青岛大扁藻的去除率最高,达到96.05%,初始密度为5×104 cells/mL的青岛大扁藻的去除率高于初始密度为5×102 cell/mL及5×103 cells/mL的青岛大扁藻去除率。5×104 cells/mL的青岛大扁藻在黑暗两周后的平均去除率高于90%,这可能是由于初始密度为5×104 cells/mL的青岛大扁藻的竞争压力大,前期大量死亡的细胞导致的生存环境变化不利于剩余的青岛大扁藻生存。
2.2 黑暗处理后不同初始密度水平的青岛大扁藻光恢复的响应初始密度分别为3 cells/mL、30 cells/mL、3×102 cells/mL和3×103 cells/mL的经过黑暗处理的青岛大扁藻与未经过黑暗处理的青岛大扁藻的光恢复条件下的生长情况如图 3(a、b、c、d)所示,其中仅初始密度为3 cells/mL未处理组的青岛大扁藻生长速率显著高于黑暗处理后的青岛大扁藻(P=0.009<0.05),表现出显著相关性,其余各起始密度下的经黑暗处理与未经黑暗处理的青岛大扁藻的生长速率均无显著差异性(P>0.05);总体上,对于初始密度为3 cells/mL、30 cells/mL、3×102 cells/mL的青岛大扁藻,黑暗处理抑制了恢复光照后青岛大扁藻的生长,经过黑暗处理的青岛大扁藻的细胞密度从光恢复起的第0天到第14天一直低于未经过黑暗处理的青岛大扁藻。
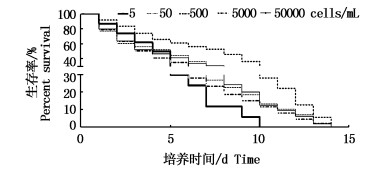
|
图 3 两周黑暗处理后不同初始密度青岛大扁藻的平均去除率
Fig. 3 Average removal rates of different initial concentrations of Platymonas helgolandica in the dark after two weeks
|
初始密度为3×103 cells/mL的青岛大扁藻细胞的生长情况与其他初始密度的青岛大扁藻有较大区别,该初始密度下,经黑暗处理的青岛大扁藻在第10天时细胞密度高于未经过黑暗处理的青岛大扁藻,并在第11,12天持续地高于未经过黑暗处理的青岛大扁藻,然而在第12天之后细胞密度迅速下降,并最终低于未经过黑暗处理的青岛大扁藻。
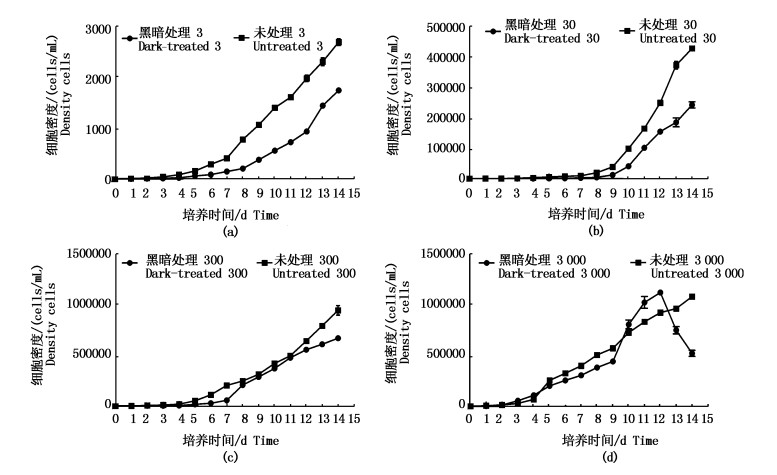
|
图 4 暗处理藻与未处理藻的光恢复生长曲线图
Fig. 4 Growth curve of dark-treated and untreated algae after light recovery
|
对于初始密度为3×104 cells/mL的青岛大扁藻来说,恢复光照后两周内均进入了指数增长的平稳期,未经黑暗处理的青岛大扁藻的生长率明显高于经过黑暗处理的青岛大扁藻(P<0.05);对于经黑暗处理的青岛大扁藻,细胞密度并没有马上就升高,而是在第1天有所降低,之后才开始逐步升高,第4天开始到第6天,升高的幅度较第2和第3天大,第6天之后就进入一个平缓期;而对于未经黑暗处理过的青岛大扁藻,细胞密度从第0天到第6天一直处于增大的过程,相同的,从第六天起进入平缓期。
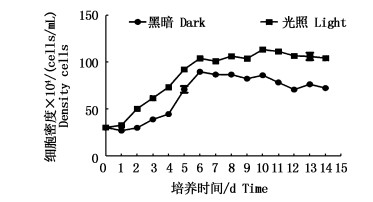
|
图 5 初始密度为3×104 cells/mL的黑暗处理后的青岛大扁藻与未处理藻的生长曲线图
Fig. 5 Growth curve of dark-treated and untreated algae with an initial density of 3×104 cells/mL
|
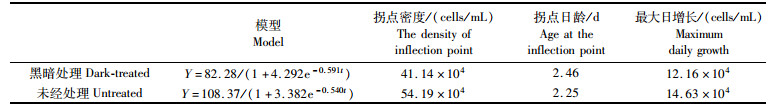
经过黑暗处理过后的初始密度为3×104 cells/mL的青岛大扁藻的最大环境承载量(Y=82.28)要比未经过黑暗处理的青岛大扁藻的最大环境承载量(Y=108.37)小约24%,经过黑暗处理后的青岛大扁藻经2.46 d达到拐点,较未经过黑暗处理的青岛大扁藻时间(2.25 d)长,经过黑暗处理后的青岛大扁藻的最大日增长12.16×104 cells/mL,也较未经过黑暗处理的青岛大扁藻(14.63×104 cells/mL)低约17%(表 2)。
|
表 2 初始密度为3×104 cells/mL青岛大扁藻的逻辑斯谛方程及种群生长参数比较 Tab.2 Comparison of logistic equation and population growth parameters of Platymonas helgdandica with an initial density of 3×104 cells/mL |
在压载舱中,浮游植物必须面对一个黑暗的不利条件,浮游植物在黑暗环境中的适应使其通过船舶压载水在世界范围内的传播成为了可能[8]。王洪超[24]研究表明, 初始密度是影响微藻在黑暗中存活的重要因素,对于不同初始密度的藻液,藻细胞浓度趋于0的时间是不同的。本研究范围内,黑暗处理前3天内的细胞生长抑制率平均处于较高的水平,即前3天浮游植物密度减少最为剧烈,之后的细胞生长抑制率处于波动并整体降低的状态,实验结果与HALLEGRAEFF及RIGBY等在航行过程中对压载水的浮游植物跟踪研究结果吻合,大量的浮游植物在被压载后的1~3 d大量死亡[25-26]。在无光条件下,藻细胞无法进行光合作用,导致死亡。另外,藻液中代谢中间产物的积累,进一步引起微藻生存条件的恶化,将导致微藻的大量死亡[27]。然而,在黑暗3天以后,藻细胞起始密度越大,其存活率越高。造成这一原因可能是为了应对外界黑暗胁迫环境, 部分绿藻采用的代谢策略可能是通过保持较高代谢活性来应对不良环境[28],对于起始密度越高的青岛大扁藻,藻间的竞争越激烈,通过保持较高的代谢活性更有利于细胞的存活。黑暗初期,初始密度为5 cells/mL的纯种青岛大扁藻,在处理的第10天密度降为零,而其他初始密度处理直到第14天仍然有存活的青岛大扁藻。青岛大扁藻在10天内仍能存活,这对于中短期航线来说,排放后仍可能带来物种入侵风险。
研究发现,对经黑暗处理后的青岛大扁藻进行光恢复,其仍然具有种群恢复能力。经过黑暗处理的青岛大扁藻相较于未经黑暗处理的更晚进入生长拐点,当浮游植物暴露于极限条件时,经常采用保持内稳态的策略来度过不良环境,以降低生长为代价,保持细胞成分、蛋白和脂含量、细胞结构和功能均稳定[29]。因此经过黑暗处理的青岛大扁藻增值能力会比未经黑暗处理的稍低。2004年,在英国伦敦召开的OMP外交大会上,通过了《国际船舶压载水及沉积物管理与控制公约》,通过对压载水及沉积物的控制和管理,防止有害的水生物及病原体转移对环境、经济等带来的风险[30]。其中制定的压载水处理性能标准(即D-2排放标准),明确规定了经过处理的压载水中允许存活的生物(绝大多数为浮游植物,10 μm≤体长<50 μm)少于10个/m L[31]。关于公约的标准制定,其科学性仍然存在质疑。本研究中,模拟压载后光恢复的青岛大扁藻,初始密度为3个/mL时,两周内仍可达到较高的种群密度,当水源地和排放区域的沿海港口环境处在相似的纬度并有相似的环境时,物种被排放后成功生存的几率增加[32-33],而不同种类的浮游植物是否在低于D-2统一标准时,都能保证不再入侵,仍然值得深入研究。
对不同种类的浮游植物在航行及卸载后的种群变化规律进行更深入地探究,能进一步丰富人们对压载水中可存活生物的认识,获取更完备的物种信息,并为针对性地开展海洋生物入侵防治工作提供重要的依据。因此,有必要对船舶航行及卸载后的浮游植物的种群响应进行更加深入地研究。
| [1] |
IMO (International Marine Organization). Global ballast water management programme[EB/OL]. London: GloBallast Partnerships, 2008. http://globallast.Imo.org.
|
| [2] |
TAMELANDER J, RIDDERING L, HAAG F, et al. Guidelines for Development of a National Ballast Water Management Strategy[R]. London, IMO, 2010. http://www.researchgate.net/publication/242473360_Guidelines_for_Development_of_a_National_Ballast_Water_Management_Strategy
|
| [3] |
RUIZ G M, FOFONOFF P W, CARLTON J T, et al. Invasion of coastal marine communities in North America:apparent patterns, processes, and biases[J]. Annual Review of Ecology and Systematics, 2000, 31: 481-531. DOI:10.1146/annurev.ecolsys.31.1.481 |
| [4] |
COHEN A N, CARLTON J T. Biological study. Nonindigenous aquatic species in a United States Estuary: a case study of the biological invasions of the San Francisco Bay and Delta[R]. NTIS number PB96-166525. Virginia, USA: Spring, 1995: 273. http://agris.fao.org/agris-search/search/display.do?f=2013/US/US201301850000185.xml;US201300018592
|
| [5] |
COHEN A N. Ships' Ballast Water and the introduction of exotic organisms into the San Francisco estuary: current status of the problem and options for management[R]. Richmond: San Francisco Estuary Institute, 1998: 555-557. https://www.researchgate.net/publication/268347053_Ships'_Ballast_Water_and_the_Introduction_of_Exotic_Organisms_into_the_San_Francisco_Estuary_Current_Status_of_the_Problem_and_Options_for_Management_California_Urban_Water_Agencies
|
| [6] |
徐晓曼. 全球压载水管理项目风险评估活动情况介绍[J]. 交通环保, 2002, 23(4): 39-41. XU X M. Introduction of globallast risk assessment activity[J]. Environmental Protection in Transportation, 2002, 23(4): 39-41. |
| [7] |
RIGBY G, HALLEGRAEFF G M. Ballast water exchange trials and marine plankton distribution on the MV "Iron Whyalla"[R]. Canberra: Australian Government Publishing Service, 1993, 123: 445-449.
|
| [8] |
邢小丽. 船舶压舱水与沉积物中的微藻类及对厦门港浮游植物群落动态的潜在影响[D]. 厦门: 厦门大学, 2007: 33-39. XING X L. Investigation on the microalgae in the ballast water/sediment and its potential effect on phytoplankton community of Xiamen Harbor[D]. Xiamen: Xiamen University, 2007: 33-39. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1445469 |
| [9] |
KANG J H, HYUN B G, SHIN K. Phytoplankton viability in ballast water from international commercial ships berthed at ports in Korea[J]. Marine Pollution Bulletin, 2010, 60(2): 230-237. DOI:10.1016/j.marpolbul.2009.09.021 |
| [10] |
周名江, 于仁成. 有害赤潮的形成机制﹑危害效应与防治对策[J]. 自然杂志, 2007, 29(2): 72-77. ZHOU M J, YU R C. Mechanisms and impacts of harmful algal blooms and the countmeasures[J]. Chinese Journal of Nature, 2007, 29(2): 72-77. |
| [11] |
周淑辉, 吴俊, 孟庆松, 等. 上海港外来船舶压舱水中浮游植物的调查及风险分析[J]. 中国国境卫生检疫杂志, 2012, 35(2): 112-117, 125. ZHOU S H, WU J, MENG Q S, et al. Investigation and risk analysis of phytoplankton in ballast water of entry ships on Shanghai seaport[J]. Chinese Frontier Health and Quarantine, 2012, 35(2): 112-117, 125. |
| [12] |
白敏冬, 张芝涛, 白希尧. 海洋生物入侵性传播及绿色防治[M]. 北京: 科学出版社, 2005. BAI M D, ZHANG Z T, BAI X Y. Marine biological invasion and green prevention[M]. Beijing: Science Press, 2005. |
| [13] |
周君, 刘兵, 李春丽, 等. 宁波港压载水浮游植物多样性的研究[J]. 生物技术通报, 2012(9): 197-201. ZHOU J, LIU B, LI C L, et al. Study on diversity of phytoplanktonin ballast water from Ningbo Port[J]. Biotechnology Bulletin, 2012(9): 197-201. |
| [14] |
李炳乾, 陈长平, 杨清良, 等. 福建外来船舶压舱水中浮游植物种类组成与丰度及其影响因素的初步研究[J]. 台湾海峡, 2009, 28(2): 228-237. LI B Q, CHEN C P, YANG Q L, et al. Preliminary study on the species composition and abundance of phytoplankton and affecting factors in ballast water of ships from outside Fujian, China[J]. Journal of Oceanography in Taiwan Strait, 2009, 28(2): 228-237. |
| [15] |
宋丹. 船舶压载水的危害与处理方法[J]. 科技风, 2012(3): 117. SONG D. Harm and treatment of ship ballast water[J]. Technology Wind, 2012(3): 117. |
| [16] |
FLAGELLA M M, ANDREAKIS N, HIRAOKA M, et al. Identification of cryptic Ulva species (Chlorophyta, Ulvales) transported by ballast water[J]. Journal of Biological Research, 2010, 13: 47-57. |
| [17] |
PEиA A I, QUINTELA L A, HERRADÓN P G. Viability assessment of dog spermatozoa using flow cytometry[J]. Theriogenology, 1998, 50(8): 1211-1220. DOI:10.1016/S0093-691X(98)00221-0 |
| [18] |
ERICSSON S A, GARNER D L, REDELMAN D, et al. Assessment of the viability and fertilizing potential of cryopreserved bovine spermatozoa using dual fluorescent staining and two-flow cytometric systems[J]. Molecular Reproduction & Development, 1989, 22(4): 355-368. |
| [19] |
陈德辉, 刘永定, 袁峻峰, 等. 微囊藻和栅藻共培养实验及其竞争参数的计算[J]. 生态学报, 1999, 19(6): 908-913. CHEN D H, LIU Y D, YUAN J F, et al. Experiments of mixed culture and calculation of competitive parameters between Microcystis (Cyanobacteria) and Scenedesmus (Green algae)[J]. Acta Ecologica Sinica, 1999, 19(6): 908-913. |
| [20] |
GOLLASCH S, LENZ J, DAMMER M, et al. Survival of tropical ballast water organisms during a cruise from the Indian Ocean to the North Sea[J]. Journal of Plankton Research, 2000, 22(5): 923-937. DOI:10.1093/plankt/22.5.923 |
| [21] |
DICKMAN M, ZHANG F Z. Mid-ocean exchange of container vessel ballast water. 2:effects of vessel type in the transport of diatoms and dinoflagellates from Manzanillo, Mexico, to Hong Kong, China[J]. Marine Ecology Progress Series, 1999, 176: 253-262. DOI:10.3354/meps176253 |
| [22] |
CHOI K H, KIMMERER W, SMITH G, et al. Post-exchange zooplankton in ballast water of ships entering the San Francisco Estuary[J]. Journal of Plankton Research, 2005, 27(7): 707-714. DOI:10.1093/plankt/fbi044 |
| [23] |
YOO J K, SONG T Y, HONG H P, et al. Marine plankton in ballast water of ship entering Korea[J]. Ocean and Polar Research, 2006, 28(1): 57-65. DOI:10.4217/OPR.2006.28.1.057 |
| [24] |
王洪超, 严志宇. 船舶压载舱中环境因子对夜光藻生长的影响研究[J]. 中国环境管理干部学院学报, 2012, 22(1): 62-65. WANG H C, YAN Z Y. Environmental factors' effects of the ship's ballast tank on the growth of Noctiluca scientillans[J]. Journal of EMCC, 2012, 22(1): 62-65. |
| [25] |
HALLEGRAEFF G M, BOLCH C J. Transport of diatom and dinoflagellate resting spores in ships' ballast water:implications for plankton biogeography and aquaculture[J]. Journal of Plankton Research, 1992, 14(8): 1067-1084. DOI:10.1093/plankt/14.8.1067 |
| [26] |
RIGBY G, HALLEGRAEFF G, SUTTON C. Ballast water heating and sampling trials on the BHP Ship MV Iron Whyalla in Port Kembla and en-route to Port Headland[R]. Canberra: Australian Quarantine and Inspection Service, 1997. http://ecite.utas.edu.au/10654
|
| [27] |
朱明, 阎彬伦, 滕亚娟, 等. 中肋骨条藻的浓缩与长期保存技术的研究[J]. 水产科学, 2003, 22(6): 29-31. ZHU M, YAN B L, TENG Y J, et al. Long-term preservation and condensate of Skeleton coastum[J]. Fisheries Science, 2003, 22(6): 29-31. |
| [28] |
岳红, 李巧玉, 喻燚, 等. 铜绿微囊藻与小球藻对低温和黑暗的响应与恢复[J]. 水生生物学报, 2018, 42(1): 190-195. YUE H, LI Q Y, YU Y, et al. Responses and restoration of the waterbloom-forming cyanobacterium Micocystis and a green alga chlorella under darkness and low temperature[J]. Acta Hydrobiologica Sinica, 2018, 42(1): 190-195. DOI:10.7541/2018.024 |
| [29] |
MONTECHNIAROF, HIRSCHMUGLC J, RAVENJ, 等. 细胞在延长黑暗下的细胞组成的内稳态(英文)[J]. 植物﹑细胞和环境:英文版, 2006, 29: 2198-2204. MONTECHNIARO F, HIRSCHMUGL C J, RAVEN J, et al. Homeostasis of cells in the darkening of the cell[J]. Plants, Cells and Environment:English, 2006, 29: 2198-2204. |
| [30] |
李子田, 郝瑞彬, 沈方. 试论生物入侵的危害及防治措施[J]. 北方环境, 2004, 29(4): 40-42. LI Z T, HAO R B, SHEN F. The discussion on the harm and defense measure of biological invasion[J]. North Environment, 2004, 29(4): 40-42. |
| [31] |
郑启波. 压载水管理履约及我国应对措施研究[J]. 天津航海, 2009(2): 29-31. ZHENG Q B. The research on the performance of WB management and the measures to take by China[J]. Tianjin of Navigation, 2009(2): 29-31. |
| [32] |
ZAIKO A, MARTINEZ J L, SCHMIDT-PETERSEN J, et al. Metabarcoding approach for the ballast water surveillance-An advantageous solution or an awkward challenge?[J]. Marine Pollution Bulletin, 2015, 92(1/2): 25-34. |
| [33] |
BAEK S H, JUNG S W, SHIN K. Effects of temperature and salinity on growth of Thalassiosira pseudonana (Bacillariophyceae) isolated from ballast water[J]. Journal of Freshwater Ecology, 2011, 26(4): 547-552. |
2. Centre for Research on the Ecological Security of Ports and Shipping, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


