2. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306
凡纳滨对虾(Litopenaeus vannamei)属软甲纲(Malacostraca),十足目(Decapoda),对虾科(Penaeidae),滨对虾属(Litopenaeus)。因生长快,环境适应能力强,出肉率高等优点,现已成为全球三大优质养殖虾类之一[1]。温室养殖方式克服了传统方式受自然条件制约的缺陷,温室养殖不仅可以获取更多养殖时间,扩展养殖区域,还具有高密度,高产量与可控性强等特点,其现已发展成我国浙江以北地区凡纳滨对虾的主要养殖方式[2]。
放养密度是影响养殖与水环境的重要因素[3],提高密度代谢物与残饵必相应增加,从而易造成养殖中后期水质恶化、富营养化加剧,导致高发病率与倒塘率上升[4-5]。过高养殖密度不仅影响水质,而且影响养殖对象生长[6]、存活率和免疫力[7]。但提高养殖密度如能辅以有效的水质调控技术,也可获得良好的水质与养殖效果。有关报道显示生物包和蛋白分离器对青石斑鱼工厂化养殖系统水中氨氮、亚硝基氮和化学需氧量(CODMn)的去除率分别为40.1%、62.6%和51.9%[8]。也有在池水中加入微生物制剂,可有效降低池水中的pH,氨氮及亚硝氮[9]。换水以及使用增氧机增氧等简易水质调控措施均可使养殖水体主要水化指标得到一定的改善[10]。
以往有关温室养殖文献报道多为着重研究采用单一调控水质后的养殖效果,甚少见到虾类温室养殖中关于探讨合适密度同时结合主要水质调控措施效果的综合研究报道。为此实验于2015年在上海海洋大学养殖基地温室,以正交实验法设计不同密度开展凡纳滨对虾养殖实验,同时依据实验周期内水质变化规律、虾的养殖效果及消化酶比活力的改变,探讨生产中常见的充气增氧、换水、投放微生物制剂和消毒剂等简易水质调控措施对水质的改进效果,以期通过实践获得室内凡纳滨对虾养殖的适宜密度及相配套的有效的水质调控措施,为凡纳滨对虾室内高密度养殖提供可靠的实践依据。
1 材料与方法 1.1 实验材料实验池为底面积40.27 m2的水泥池(5.72 m×7.04 m),水深0.8 m。实验用虾为已淡化驯养至比重为1.005的凡纳滨对虾稚虾[L=(0.65±0.07) cm,W=(0.001 8±0.000 2) g]。实验用水为使用15 ×10-6强氯精消毒并经曝气沉淀以后的深井水,用浓缩海水将盐度调节至2。实验用饲料为“大川牌”凡纳滨对虾配合饲料(80012),微生物制剂为宝利来微生态制剂(山东宝利来生物工程有限公司,粉剂,主要成分:芽孢杆菌、枯草杆菌、沼泽红假单胞菌、硫化细菌等, 活菌总数>8×109个/g),实验使用消毒剂为北京渔经生物技术有限责任公司生产的“聚碘溶液”。
1.2 实验设计采用正交表L20(51×28)安排5种水平养殖密度(50、100、170、260、340个/m2),与增氧方式、是否换水、是否使用微生物制剂和消毒剂等4种常见水质改进措施开展正交实验,设2个重复,采用完全随机数字表确定所有实验池(表 1),每口池均布放8个具阀门散气石。
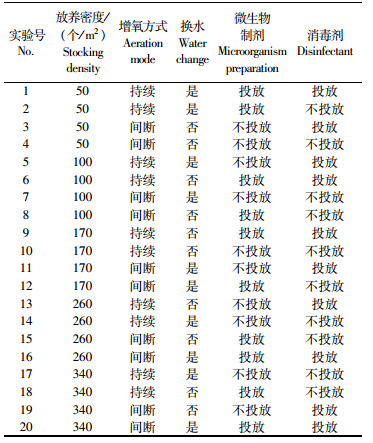
|
表 1 正交表L20(51×28)实验方案 Tab.1 Orthogonal table L20(51×28) experimental scheme |
增氧方式两种:连续充气增氧方式是指实验期间每日24 h沸腾状充气;间断充气增氧方式是指实验前60 d每日沸腾状充气12 h,不充气12 h(9:00-21:00),60~100 d每日充气16 h,不充气8 h(9:00-17:00),100~113 d每日24 h沸腾状充气。
不换水是指实验期间不换水,仅在80 d与100 d合计补充添加5 cm河水以补充因蒸发而减少的水量,换水是指养殖60、70、80 d时各换水10 cm,90、100、110 d时各换水20 cm。是否使用微生物制剂与消毒剂均为2个水平,实验全程不使用微生物制剂或消毒剂分别为各自不投放水平,微生物制剂投放水平方式是每15天按3 g/ m3全池泼洒微生物制剂,消毒剂投放水平方式是养殖60 d始每15天按0.2 g/m3全池泼洒稀释1 000倍的聚碘溶液。
1.3 养殖池日常管理按实验密度容量计数法投放实验用虾,初始水位80 cm,每日分别在08:00、12:00、18:00、23:00准确称量投喂配合饲料,据餐后观察饵料台残饵状况调节投饵量,分别以30 d前2 h时、30~60 d 1.5 h及60 d后1.0 h时无残饵视为适宜投饵量。113 d实验周期内,水温25~32 ℃,按实验设计进行各项水质调控措施。实验至80 d时,因部分实验池水pH已接近7.5,为确保实验成功,每隔5 d向每口实验池分别加入适量氢氧化钠溶液,以维持池水pH在7.5~8.1之间。实验期间每隔15 d及实验结束时各池随机采取30尾以上虾样测量体长和体质量。
1.4 实验池水质指标变化状况测定每15天定时、定点(距池边30 cm及池中央水面下10 cm处)采集水样混匀后测定各实验池主要水质指标,浊度、pH、溶解氧(DO)分别由Turbiquant 1100IR型浊度仪、pHB-4型酸度计、Multi-350i型水质分析仪现场测定。总氨氮(TAN)、亚硝基氮(NO2--N)、硝基氮(NO3--N)、化学需氧量(CODMn)、活性磷(PO43--P)分别用奈式比色法、重氮-偶氮比色法、锌镉还原-重氮偶氮法、碱性高锰酸钾法[11-12]、磷钼蓝分光光度法[13]测定,使用2216E培养基培养异养菌并测定总数,使用TCBS培养基培养弧菌并测定总数[14]。各指标在同一个取样地点均取两份样品测量,取平均值。
非离子氨氮(NH3-Nm)浓度通过下式计算求得[15]:
 (1)
(1)
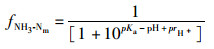 (2)
(2)
式中:fNH3-Nm是NH3-Nm与NH3-Nt之比,pKa是NH4+在水中水解电离反应平衡之后的浓度的负对数,prH+=-lgrH+表示为求氢离子活度系数的负对数。
1.5 消化酶活性的测定方法实验结束时随机采集60尾虾样,取出中肠腺研磨,离心后取上清液,测定消化酶活性。本实验采用南京建成生物试剂盒对胃蛋白酶、胰蛋白酶、脂肪酶、淀粉酶活性与蛋白含量进行测定。
酶的比活力(U/mg prot)为酶活力与蛋白质含量的比值。
1.6 数据处理采用R3.4.3进行正交实验资料的方差分析,Duncan氏法进行多重比较,P<0.05表示差异显著,P<0.01表示极差异显著。饵料系数(FCR)、肥满度(CF)和特定生长速率(SGR)分别用以下公式计算求出:
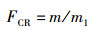 (4)
(4)
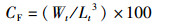 (5)
(5)
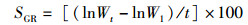 (6)
(6)
式中:FCR为饵料系数;CF为肥满度;SGR为特定生长速率;m为饲料投喂总干重(g);m1为虾体质量总增加量(g);W1和Wt分别是实验虾始末体质量(g);t为养殖时间(d),Lt为实验末虾体长(cm)。
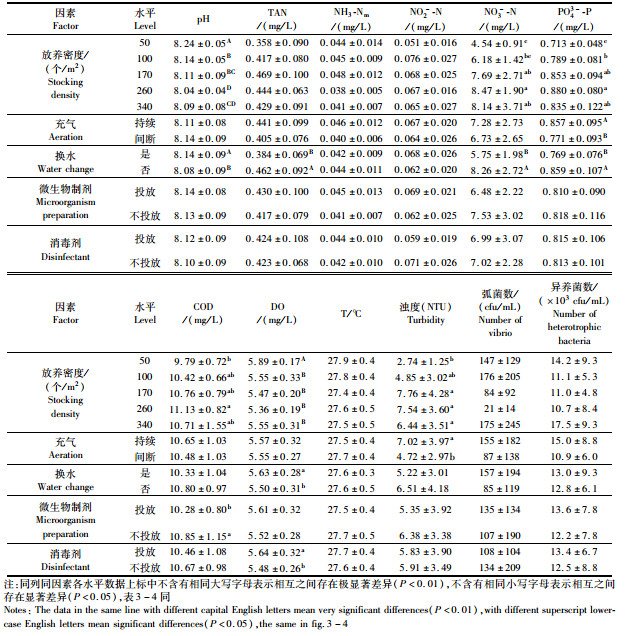
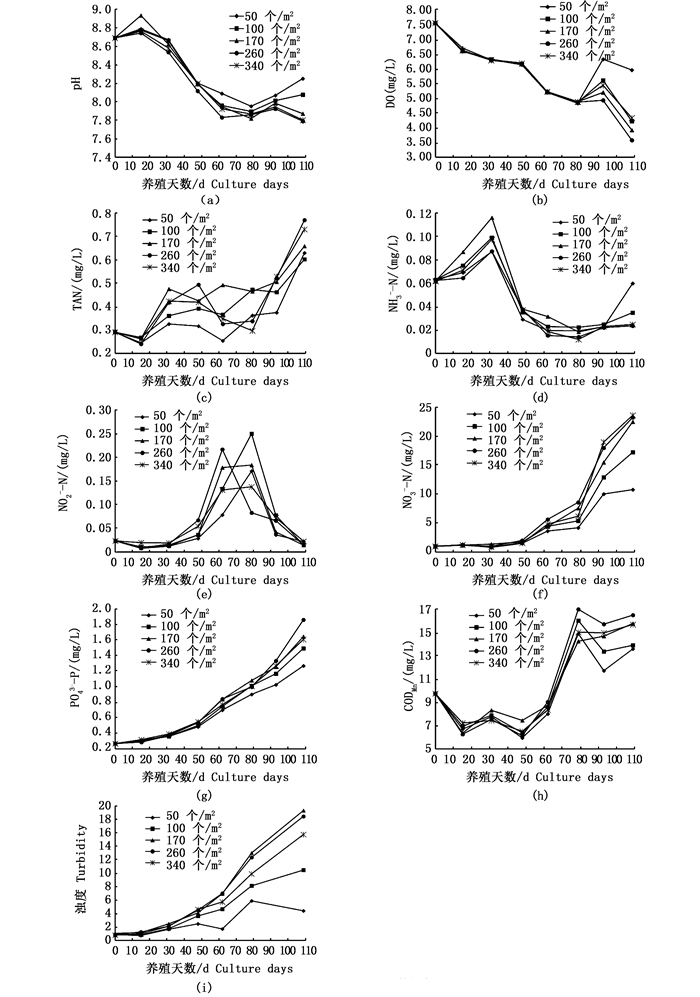
2 结果与分析 2.1 养殖周期内室内实验池水质演变状况表 2是实验全周期内,所测实验池主要水质指标平均值,图 1为养殖周期内不同密度水平三态氮(TAN、NO2--N、NO3--N)、PO43--P、DO、CODMn及pH、浊度、异养菌数随养殖时间的变化状况。
|
表 2 养殖周期内实验组水质指标平均值 Tab.2 The average water quality indexes of the experimental group during the culture period |
|
图 1 5种养殖密度实验组水质随养殖天数的变化
Fig. 1 Changes of water quality with the number of breeding days in 5 experimental groups
|
表 2与图 1表明,随着密度的增加,池水pH和DO呈波浪式递降,且50个/m2低密度组极显著高于其他试验组(P<0.01),260个/m2在高密度水平中(170~340个/m2)最低。图 1a显示,实验周期内各组pH随时间增减变化状况甚为相似,DO变化也具类同特点,且在80 d后两者均发生较大变化。池水日趋增多的残饵与代谢物等有机物不断氧化分解,导致pH与DO下降,故池水显示两指标随时间发生应有的相应变化趋势。由图 1a和1b可知,实验期内除170与260个/m2水平在110 d时的DO[(3.55±1.14)mg/L,(3.90±1.10) mg/L]偏低外,其余水平DO与pH均在凡纳滨对虾生长适宜范围[16-17],这也表明了实验适时添加碱液与适当充气增氧的良好效果。pH 15 d起始基本表现为各测定时段密度高pH则低的特征,而DO前80 d各密度水平间基本没有差异,80 d后DO随密度增高而降低,可见密度是影响温室池水pH、DO的重要因子。
2.1.2 不同密度组营养盐变化趋势图 1c显示,养殖周期内,各组TAN随时间呈波浪式递增变化,NH3-Nm则反之,但后者的各水平随时间的变化状况较为相似。表 2与图 1d显示,NH3-Nm(0.012~0.116 mg/L)均处于对虾生长安全范围[18],但NH3-Nm变化规律不同于TAN,养殖初期因池水pH下降幅度不大,随着TAN增加而增加。
表 2与图 1e显示,在养殖周期内各密度间NO2--N均无显著差异(P>0.05),各密度水平NO2--N随时间呈波浪式递增,初期波动很小,30~48 d期间逐步升高,后显著升高,各水平均在48~80 d间呈现急剧增加,其中100与260个/m2尤为突出,至60~80 d各水平先后达到最高值(0.138~0.249 mg/L),相继各水平在80 d后又剧烈递降,实验结束约降至初始值,80 d后相应地发生NO3--N急剧增加(图 1f)。此变化特点与虾塘中硝化菌量的增长与作用强度有关[19],此可能与池水中的活性污泥形成和变化有关[20]。
表 2与图 1f、图 1g显示,在养殖周期内,NO3--N与PO43--P随时间、密度和投饲量递增,各密度水平间NO3--N与PO43--P浓度间均有显著差异(P<0.05)。
2.1.3 不同密度水平化学需氧量、浊度、异养菌数的变化状况图 1h显示,养殖初期可能因池水中颗粒有机物絮凝沉降,CODMn浓度下降1倍左右,在15~62 d期间较缓慢波浪式递增,后随着虾生长,投饲量的快速增加而陡增,80 d后呈波浪式递减趋势,且随密度增高(P<0.05)。
图 1i显示,浊度随着养殖天数增加(P<0.05),初期波动很小,约在110 d达最高值。最高与最低浊度密度水平(170与50个/m2)至实验末浊度分别是初始时的19与5.5倍,浊度基本随密度呈增高趋势(P<0.05),此主要因高密度组残饵及代谢物量大所致。
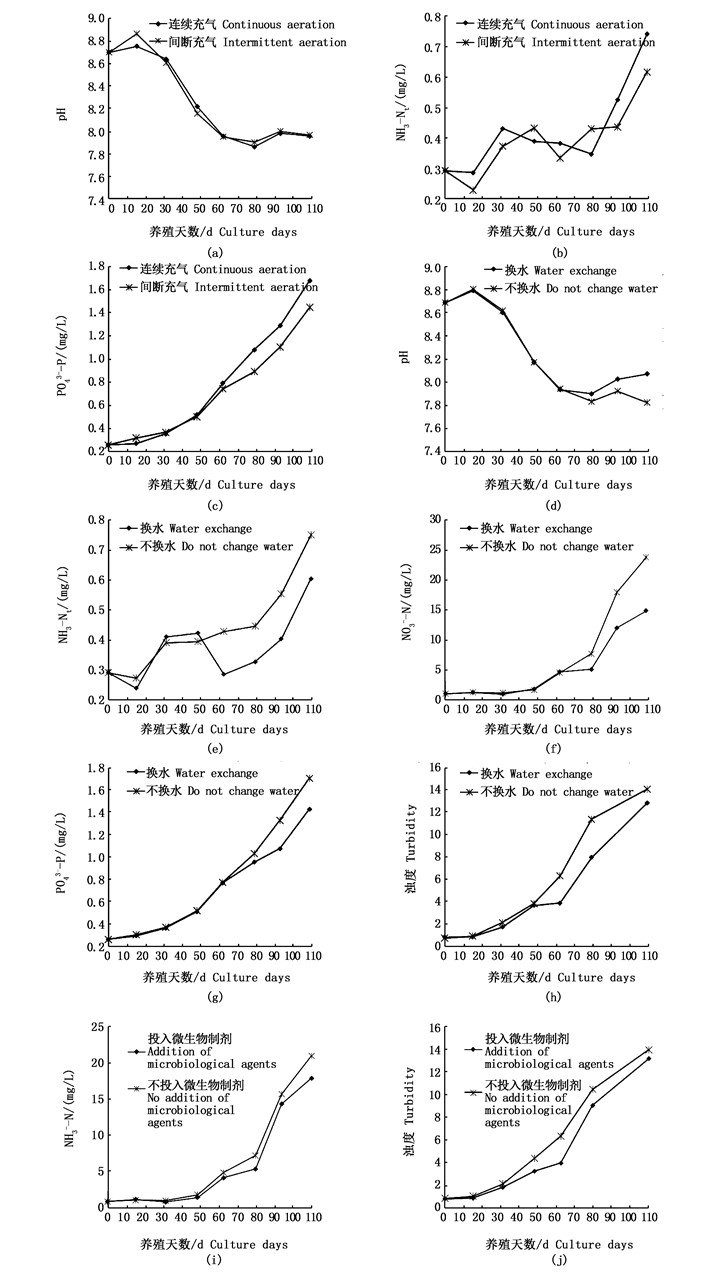
2.1.4 充气增氧与换水对池水的改善作用图 2是养殖周期内充气增氧方式与是否换水和投放微生物制剂各水平的TAN、NO3--N、PO43--P浓度及pH、浊度随养殖时间的变化状况。
|
图 2 调控措施实验池部分水质的变化
Fig. 2 Change of water quality in the experimental pool of control measures
|
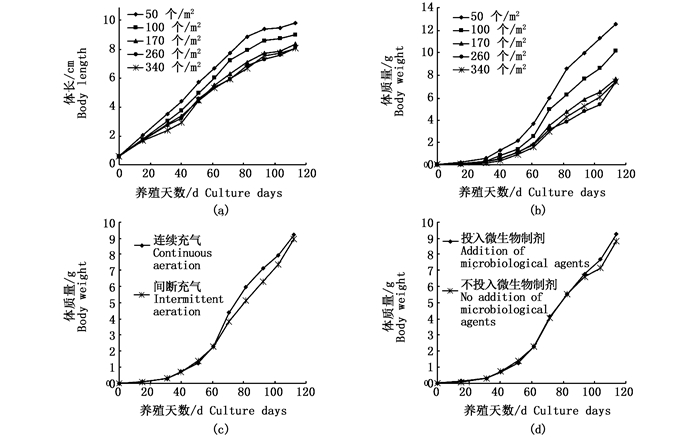
由表 2可知,实验周期内,除pH外,各水质指标值均是持续充气水平高于间断充气,经检验仅浊度与PO43--P存在显著差异(P<0.05),此可能是持续充气延缓了池水中颗粒有机物的沉降所致。
表 2与图 2d~h显示,60 d始,无论换水与否,各实验水平的水质指标变化趋势一致,但换水对TAN、NO3--N、PO43--P的改善显著(P<0.05),对浊度也有所改善。至实验末,此4个水质指标值换水较不换水分别降低24.1%、60.5%、19.4%、9.4%,而换水DO也显著高于不换水(P<0.05)。
2.1.5 投放微生物制剂与消毒剂对池水的改进作用表 2表明,投放微生物制剂可显著降低池水CODMn,改善NO3--N和浊度也较明显,其余水质指标间差异很小,两者间的变化趋势一致(图 2i、图 2j)。而投放消毒剂仅DO显著高于不投放(P<0.05),其余水质指标间无差异,变化趋势相同。
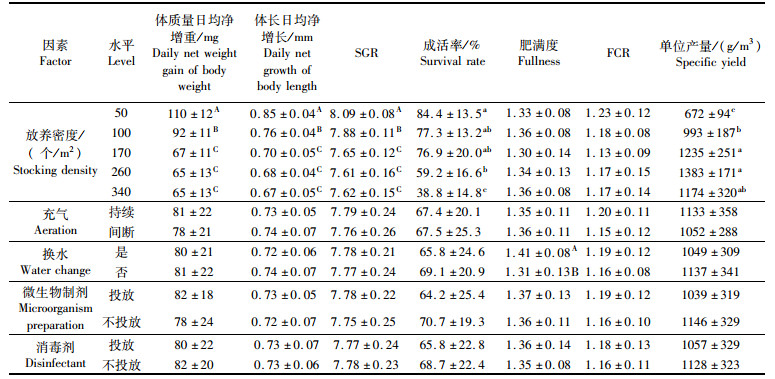
2.2 对虾养殖效果 2.2.1 不同密度养殖效果表 3表明,体质量与体长日增长值、SGR、成活率均随着放养密度的增加而降低,前3个指标,50个/m2组极显著高于其他水平(P<0.01),100个/m2次之,极显著高于其余水平(P<0.01),而高密度水平间无显著差异(P>0.05)。340个/m2的成活率最低仅为38.9%,是50个/m2的46%(P<0.05)。前4个密度的单位水体产量随密度上升而增加,260个/m2的产量显著高于50、100个/m2(P<0.05),与170、340个/m2无显著差异(P>0.05)。图 3a与图 3b显示,实验全周期内,对虾日均增重变化趋势为随密度提高增重幅度减小,生长速度变缓。
|
表 3 不同养殖条件下的养殖效果 Tab.3 The effect of culture under different culture conditions |
|
图 3 不同条件下对虾生长随养殖天数的变化状况
Fig. 3 The change of the growth of prawns with the number of days under different conditions
|
表 3表明,持续充气、换水、投放微生物制剂措施下的对虾体质量日均增加值、SGR、FCR分别略比间断充气、不换水与不投放微生物制剂措施高。不换水、不使用微生物制剂与消毒剂条件下的对虾成活率高于换水、使用微生物制剂与消毒剂措施。经检验,仅换水条件下对虾肥满度极显著高于不换水方式(P<0.01)。
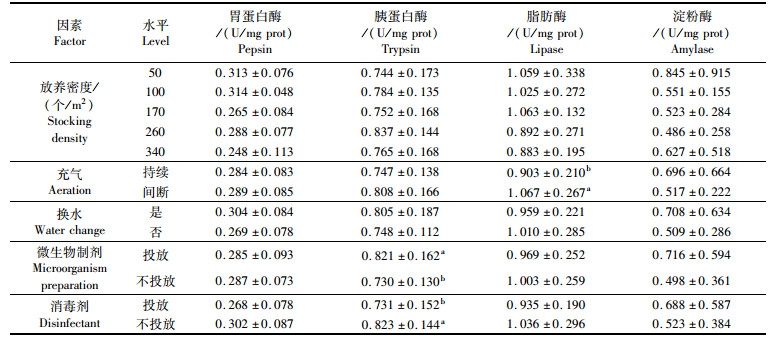
2.3 密度与水质调控技术对虾消化酶活性的影响表 4为各实验因素水平的4种消化酶活性。表 4表明,不同密度间除胰蛋白酶比活力未表现出明显变化趋势外,其余酶比活力基本随密度增加而下降,而胰蛋白酶最大比活力值出现在260个/m2水平,100个/m2次之。4种水质调控措施两水平间各消化酶比活力差异表现各异,持续充气下淀粉酶活力更高,但脂肪酶比活力显著小于间断充气措施(P<0.05);换水条件下除脂肪酶比活力略低外,其余酶比活力高于不换水;投放微生物制剂措施下胰蛋白酶比活力高(P<0.05),淀粉酶次之,剩余2个酶比活力基本一致;而投放消毒剂时,除淀粉酶外,对虾的胰蛋白酶(P<0.05)、胃蛋白酶、脂肪酶比活力均比不使用消毒剂小。可见,合理的水质调控措施利于较多种酶的活力,即较多种酶易于更佳水环境显示其强活性。
|
表 4 不同养殖条件下的消化酶活性 Tab.4 Digestive enzyme activity under different culture conditions |
高密度养殖会降低水中溶解氧与增加残饵、代谢物等含量,引起水质恶化,从而增加养殖风险[21]。水质指标与对虾疾病爆发的相关性研究常见于报道,JIMENEZ等[22]发现水质理化指标的变化与对虾的疾病之间很大程度上存在着相关性。王年斌等[23]指出氨氮、NO2--N、DO、pH等因子与虾病爆发相关性显著。说明良好的水质状况是减少养殖风险的重要条件,对养殖效果具有重要作用。实验结果表明,pH、NH3-Nm、DO随放养密度的增加而下降,NO3--N、PO43--P、浊度随密度增加而升高,COD随密度无明显变化趋势。王秋实等[24]得出的随养殖密度增加,水中TN、TP、NH3-Nm、NO3--N含量逐渐增加,COD无明显的变化规律,此与实验结基本一致,但本实验中NH3-Nm随放养密度的增加而降低与王秋实的实验结果不同,此可能是养殖池水pH较低原因,因此池水pH控制在可适范围的下限可降低NH3-Nm浓度及其毒性。50、100个/m2放养密度下池水的pH、DO高,而其余水化学指标均较低,可看出实验中50、100个/m2放养密度在养殖期间保持着较好的水质。
高放养密度虽可提高水体利用率,更好的发挥其生产力,但高密度养殖对虾的生长具明显抑制作用,加剧个体对空间和资源的竞争,从而增加活动耗能降低对生长能的利用[25-26]。实验显示,对虾体质量与体长日均增长值、SGR、成活率随着放养密度的增加而降低,低放养密度(50、100个/m2)显著高于高放养密度,且对虾规格更整齐,50个/m2的体质量与体长的变异系数为10.4%、10.0%,低于340个/m2的17.6%与17.8%。这与刘永士等对罗氏沼虾的研究结果一致[27]。
放养密度对凡纳滨对虾消化酶活性也存在影响,实验中,除胰蛋白酶外,胃蛋白酶、脂肪酶、淀粉酶随放养密度增加,呈下降趋势,此与肖鸣鹤等[28]报道的密度对克氏原螯虾幼虾消化酶活性影响的实验结果一致。综合实验结果表明50~100个/m2放养密度为实验条件下的温室水泥池最适放养密度。这与李倩等[29]报道的养殖密度为105~150万尾/hm2的小规模养殖模式效益最高的研究结果相似。
综合各实验密度下各实验组的水质演变规律、对虾消化活性、饵料系数、生长效果等实验结果,实验密度范围内,50与100个/m2是较为合适的养殖密度,在此密度下,换水、持续增氧等水质调控措施能更好的调控水质,对虾生长表现更佳,饵料利用率更高。
3.2 水质调控措施对水质与养殖效果的作用实验发现,持续充气条件下,除池水浊度和PO43--P显著高于间断充气措施(P<0.05),对虾脂肪酶比活力比间断充气措施低18%(P<0.05)外,其余水质指标、养殖效果、酶比活力均无差异,但池水中NO3--N含量比间断充气增高8.1%,对虾淀粉酶活力提高了35%,对虾体质量日均增长值高3.8%,单位水体产量提高了7.7%,说明持续充气有效延缓了颗粒有机物的沉降,有机物的有氧分解相对充分,对处于中间形态的水质指标值改善不明显,但水环境更适宜对虾生长,利于产量的提高。换水措施下池水水质指标中TAN、NO3--N、PO43--P均极显著低于不换水(P<0.01),pH极显著高于不换水(P<0.01),同时NH3-Nm、COD、浊度都低于不换水,仅NO2--N、弧菌数和异养菌数略高于不换水,且对虾肥满度极显著高于不换水组(P<0.01),消化酶比活力比不换水高,说明换水影响对虾消化酶活力和养殖效果,显示很好的改善水质效果。王光玉等[30]也发现,在换水率15%的养殖条件下, 可以保证水体水质稳定,刺参生长良好。定期投放微生态制剂可以改善水质,提高饲料利用率是目前对虾养殖重要的水质调控措施[31],实验发现,投放微生态制剂显著提高了胰蛋白酶活性(P<0.05),也有助于提高淀粉酶活性,有利于虾的生长,PAN等对鲤(Cyprinus carpio)[32]的研究中也有类似结果;投放微生态制剂除显著降低池水中COD外,对其他水质指标的影响不显著,改进不明显,此与黄建华等[33]研究结果相反,这可能是由于实验是在室内进行,光线等环境与室外池塘不同,也有可能是在充气状态下,养殖水体中较早生产了水质净化能力比较强的活性污泥有关[20],投放于池水中微生态制剂效果未能有效体现。投放消毒剂常用于对虾养殖池水的消毒杀菌[34]。实验结果表明,除DO外,投放消毒剂没有体现改善其他水质指标,提高养殖效果的作用,反而降低了对虾消化酶活性,不利于对虾摄食消化,有可能与实验是在室内水泥池内进行,池水中甚少有浮游动植物有关。建议温室养殖过程中谨慎使用消毒剂。
| [1] |
张伟权. 世界重要养殖品种——南美白对虾生物学简介[J]. 海洋科学, 1990, 14(3): 69-73. ZHANG W Q. A brief introduction to the biologic introduction of the world's important breed of Penaeus vannamei[J]. Marine Sciences, 1990, 14(3): 69-73. |
| [2] |
黄薇, 张根玉, 骆志强, 等. 南美白对虾池塘温室二茬养殖水质动态对比[J]. 水产科技情报, 2016, 43(1): 23-27. HUANG W, ZHANG G Y, LUO Z Q, et al. Dynamic comparison of water quality of two cropping in the greenhouse of Penaeus prawns[J]. Fisheries Science & Technology Information, 2016, 43(1): 23-27. |
| [3] |
陈亚坤, 郭冉, 夏辉, 等. 密度胁迫对凡纳滨对虾生长、水质因子及免疫力的影响[J]. 江苏农业科学, 2011, 39(3): 292-294. CHEN Y K, GUO R, XIA H, et al. Effects of density stress on growth, water quality and immunity of Litopenaeus vannamei[J]. Jiangsu Agricultural Sciences, 2011, 39(3): 292-294. DOI:10.3969/j.issn.1002-1302.2011.03.117 |
| [4] |
冯东岳, 钱冬. 2005~2009年凡纳滨对虾白斑综合征和桃拉综合征的流行情况分析[J]. 南方水产科学, 2011, 7(1): 78-83. FENG D Y, QIAN D. Prevalence study on Penaeus vannamei infected with WSD and TS during 2005-2009[J]. South China Fisheries Science, 2011, 7(1): 78-83. DOI:10.3969/j.issn.2095-0780.2011.01.013 |
| [5] |
马真.凡纳滨对虾集约化养殖水质管理决策支持系统的构建[D].青岛: 中国海洋大学, 2013. MA Z. The construction of DSS in water quality management of intensive Litopenaeus vannamei shrimp tanks[D]. Qingdao: Ocean University of China, 2013. |
| [6] |
戴习林, 周梦颖, 鞠波, 等. 养殖密度对罗氏沼虾生长、性别分化与性腺发育的影响[J]. 水产学报, 2016, 40(12): 1874-1882. DAI X L, ZHOU M Y, JU B, et al. Effects of stocking density on growth, sexual differentiation and gonad development of Macrobrachium rosenbergii[J]. Journal of Fisheries of China, 2016, 40(12): 1874-1882. |
| [7] |
曹阳, 李二超, 陈立侨, 等. 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J]. 水生生物学报, 2014, 38(5): 968-974. CAO Y, LI E C, CHEN L Q, et al. Effects of stocking density on growth, physiological and immune responses in juvenile Russian sturgeon[J]. Acta Hydrobiologica Sinica, 2014, 38(5): 968-974. |
| [8] |
穆珂馨, 赵振良, 马海军. 全封闭循环水工厂化养殖青石斑鱼水质效果研究[J]. 河北渔业, 2010(6): 4-7. MU K X, ZHAO Z L, MA H J. The study of water quality for breeding Epinephelus awoara with the industrial full-closed recirculating water system[J]. Hebei Fisheries, 2010(6): 4-7. |
| [9] |
朱学芝, 郑石轩, 潘庆军, 等. 微生态制剂对凡纳滨对虾生长及水质的影响[J]. 中山大学学报(自然科学版), 2008, 47(s1): 58-62. ZHU X Z, ZHENG S X, PAN Q J, et al. Effect of probiotics on growth performance and water quality for Litopenaeus vannamei[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2008, 47(s1): 58-62. |
| [10] |
刘军, 戴习林, 臧维玲. 凡纳滨对虾温棚高位池养殖密度及简易水质调控措施效果研究[J]. 上海海洋大学学报, 2016, 25(2): 189-197. LIU J, DAI X L, ZANG W L. Research of breeding density and water quality control measures in Litopenaeus vannamei greenhouse high-intensive ponds[J]. Journal of Shanghai Ocean University, 2016, 25(2): 189-197. |
| [11] |
陈佳荣. 水化学试验指导[M]. 北京: 中国农业出版社, 1996: 5-30. CHEN J R. Directing the hydrochemistry test[M]. Beijing: China Agriculture Press, 1996: 5-30. |
| [12] |
雷衍之. 养殖水环境化学[M]. 北京: 中国农业出版社, 2004: 45-78. LEI Y Z. Aquaculture environment hydrochemistry[M]. Beijing: China Agricultural Press, 2004: 45-78. |
| [13] |
国家质检总局. GB/T 17378.4-1998海洋监测规范第4部分: 海水分析[S].北京: 中国标准出版社, 1998, 6: 176-178. General Administration of Quality Supervision(SBTS). GB/T 17378.4-1998 The specification for marine monitoring part 4: seawater analysis[S]. Beijing: Standards Press of China, 1998, 6: 176-178. |
| [14] |
DI PINTO A, TERIO V, NOVELLO L, et al. Comparison between thiosulphate-citrate-bile salt sucrose (TCBS) agar and CHROMagar Vibrio for isolating Vibrio parahaemolyticus[J]. Food Control, 2011, 22(1): 124-127. DOI:10.1016/j.foodcont.2010.06.013 |
| [15] |
ALABASTER J S, LLOYD R. Water quality criteria for freshwater fish[M]. 2nd ed. London: Butterworth, 1982: 85-87.
|
| [16] |
SEIDMAN E R, LAWRENCE A L. Growth. Feed digestibility, and proximate body composition of juvenile Penaeus vannamei and Penaeus monodon grown at different dissolved oxygen levels[J]. Journal of the World Aquaculture Society, 1985, 16(1/4): 333-346. |
| [17] |
么宗利, 王慧, 周凯, 等. 碳酸盐碱度和pH值对凡纳滨对虾仔虾存活率的影响[J]. 生态学杂志, 2010, 29(5): 945-950. YAO Z L, WANG H, ZHOU K, et al. Effects of water carbonate alkalinity and pH on survival rate of post-larval Litopenaeus vannamei[J]. Chinese Journal of Ecology, 2010, 29(5): 945-950. |
| [18] |
JAFARI M T, KHAYAMIAN T. Direct determination of ammoniacal nitrogen in water samples using corona discharge ion mobility spectrometry[J]. Talanta, 2008, 76(5): 1189-1193. DOI:10.1016/j.talanta.2008.05.028 |
| [19] |
臧维玲, 张煜, 戴习林, 等. 人工湿地联合塘内设施调控生产性虾塘水环境的效果与技术[J]. 水产学报, 2012, 36(4): 568-575. ZANG W L, ZHANG Y, DAI X L, et al. The effect and application of treatment for wastewater of productive shrimp aquaculture by constructed wetlands combined with pond facilities[J]. Journal of Fisheries of China, 2012, 36(4): 568-575. |
| [20] |
方秀珍, 郭贤桢, 郁桐炳, 等. 鱼池淤泥中参与氮循环的细菌和淤泥活性[J]. 水产学报, 1993, 17(2): 137-145. FANG X Z, GUO X Z, YU T B, et al. Bacteria involved inncycle in fish pond sediment and sediment activity[J]. Journal of Fisheries of China, 1993, 17(2): 137-145. |
| [21] |
陈金玲, 赖秋明, 苏树叶, 等. 精养虾池主要生态因子变化特点与相关性分析[J]. 南方水产科学, 2012, 8(4): 49-56. CHEN J L, LAI Q M, SU S Y, et al. Study on variation characteristics and correlation analysis of major ecological factors in intensive shrimp ponds[J]. South China Fisheries Science, 2012, 8(4): 49-56. DOI:10.3969/j.issn.2095-0780.2012.04.008 |
| [22] |
JIMENEZ R, BARNIOL R, DE BARNIOL L, et al. Periodic occurrence of epithelial viral necrosis outbreaks in Penaeus vannamei in ecuador[J]. Diseases of Aquatic Organisms, 2000, 42(2): 91-99. |
| [23] |
王年斌, 韩家波, 周遵春, 等. 虾池水环境因子与虾病爆发的相关性分析[J]. 水产科学, 2004, 23(12): 5-8. WANG N B, HAN J B, ZHOU Z C, et al. Environmental factors in shrimp culture ponds related with diseases outbreaks[J]. Fisheries Science, 2004, 23(12): 5-8. DOI:10.3969/j.issn.1003-1111.2004.12.002 |
| [24] |
王秋实, 张镜群. 放养密度和微生态制剂对施氏鲟养殖水质的影响[J]. 水产学杂志, 2017, 30(5): 39-42. WANG Q S, ZHANG J Q. Effects of probiotics on water quality in Amur sturgeon Acipenser schrenckii culture exposures at different stocking densities[J]. Chinese Journal of Fisheries, 2017, 30(5): 39-42. DOI:10.3969/j.issn.1005-3832.2017.05.009 |
| [25] |
王兴强, 曹梅, 马繰, 等. 密度对凡纳滨对虾存活、生长和能量收支的影响[J]. 中国农学通报, 2005, 21(8): 409-412. WANG X Q, CAO M, MA S, et al. Effects of stocking densities on survival, growth and energy budget of juvenile Litopenaeus vannamei[J]. Chinese Agricultural Science Bulletin, 2005, 21(8): 409-412. DOI:10.3969/j.issn.1000-6850.2005.08.115 |
| [26] |
严维辉, 唐建清, 史克荣, 等. 不同放养密度下龙虾残杀情况的试验性研究[J]. 齐鲁渔业, 2008, 25(8): 28-29. YAN W H, TANG J Q, SHI K R, et al. Experimental research on the killing of lobster under different stocking densities[J]. Shandong Fisheries, 2008, 25(8): 28-29. |
| [27] |
刘永士, 臧维玲, 侯文杰, 等. 室内罗氏沼虾幼虾养殖密度对水质与生长的影响[J]. 上海海洋大学学报, 2010, 19(2): 184-189. LIU Y S, ZANG W L, HOU W J, et al. The effect of the stocking densities of indoor juvenile shrimps Macrobrachium rosenbergii culture on water quality and growth[J]. Journal of Shanghai Ocean University, 2010, 19(2): 184-189. |
| [28] |
肖鸣鹤, 肖英平, 吴志强, 等. 养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响[J]. 水产学报, 2012, 36(7): 1088-1093. XIAO M H, XIAO Y P, WU Z Q, et al. Effects of stocking density on growth, digestive enzyme activities and biochemical indices of juvenile Procambarus clarkii[J]. Journal of Fisheries of China, 2012, 36(7): 1088-1093. |
| [29] |
李倩, 周志明, 杭小英, 等. 南美白对虾不同养殖密度水质变化规律与养殖效益的分析[J]. 中国农学通报, 2014, 30(2): 100-104. LI Q, ZHOU Z M, HANG X Y, et al. Analysis of water quality changes under different breeding density and breeding benefit of Penaeus vannamei[J]. Chinese Agricultural Science Bulletin, 2014, 30(2): 100-104. |
| [30] |
王光玉, 姜佳惠, 祝楠, 等. 换水率和密度对刺参生长和水质的影响[J]. 渔业现代化, 2017, 44(6): 55-61. WANG G Y, JIANG J H, ZHU N, et al. Effects of water exchange rate and stocking density on growth of Apostichopus japonicus and water quality[J]. Fishery Modernization, 2017, 44(6): 55-61. DOI:10.3969/j.issn.1007-9580.2017.06.010 |
| [31] |
VERSCHUERE L, ROMBAUT G, SORGELOOS P, et al. Probiotic bacteria as biological control agents in aquaculture[J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671. DOI:10.1128/MMBR.64.4.655-671.2000 |
| [32] |
PAN K C, YANG H B. Progress in study of mechanism of bacillus[J]. Feed Industry, 1997, 18(9): 32-34. |
| [33] |
黄建华, 周发林, 马之明, 等. 微生物制剂对斑节对虾亲虾池异养细菌的影响[J]. 生态学杂志, 2007, 26(6): 826-830. HUANG J H, ZHOU F L, MA Z M, et al. Effects of microbial preparations on heterotrophic bacteria in Penaeus monodon Fabricius broodstock culturing tank[J]. Chinese Journal of Ecology, 2007, 26(6): 826-830. DOI:10.3321/j.issn:1000-4890.2007.06.010 |
| [34] |
DE OLIVEIRA T M L, REHFELD I S, GUEDES M I M C, et al. Susceptibility of vaccinia virus to chemical disinfectants[J]. American Journal of Tropical Medicine and Hygiene, 2011, 85(1): 152-157. DOI:10.4269/ajtmh.2011.11-0144 |
2. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27

