2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
盐酸氯苯胍(Robenidine Hydrochloride,ROBH)化学名称为1,3-双〔(对氯苯叉)氨基〕胍盐酸盐。ROBH是一种高效的抗球虫药,因其具有较好治疗效果,且毒性小,见效快,适口性好,在鸡、兔的急性、慢性球虫病治疗上使用较广泛。该药主要影响球虫ATP,从而干扰球虫蛋白质的代谢[1]。近些年来,随着集约化养殖规模加大,寄生虫感染致病越来越频繁,严重影响我国水产养殖产量[2]。黏孢子虫病(Myxosporidiosis)在大宗淡水鱼中的爆发属于其中一种[3]。光危害鲫(Carassius auratus)养殖的黏孢子虫(Myxobolus)就包括4种类型:引起鲫喉孢子虫病的洪湖碘泡虫(M.honghuensis)、引起鲫肤孢子虫病的武汉单极虫(Thelohanellus wuhanensis)、引起鲫鳃孢子虫病的汪氏单极虫(Thelohanellus wangi)和引起鲫腹孢子虫病的吴李碘泡虫(M.wuli)[4-6]。ROBH在20世纪80年代开发出来之后一直限于兽用[7],后来才渐渐用于水产上,主要拿来防治淡水鱼类的黏孢子虫病[8]。据报道,该药在临床上使用效果明显,给我国淡水养殖减小了不少损失[9-11]。临床上,盐酸氯苯胍常用作一种内服药,和一些外用药物(敌百虫和硫酸铜合剂、中药孢虫速杀等)配合用可以达到去除体表和鳃上的孢子虫囊,以及控制鱼体内孢子虫发育的目的[12]。
但目前关于ROBH在淡水鱼体内的药代动力学研究欠缺,只有关于药残监测方面的零星报道[8, 13-14],ROBH在国外的报道也只表现在检测方法方面[15-17]。异育银鲫(Carassius auratus gibelio)具有生长快、个体相对较大等特点,且肉质鲜美,已经成为我国重要的养殖品种,在我国从南到北都有养殖。本试验以异育银鲫为研究对象,利用具有简便、精密、准确的高效液相色谱法研究ROBH在该鱼体内的药代动力学,旨在为大宗淡水鱼类养殖中科学合理使用该药提供理论依据。
1 材料与方法 1.1 实验材料健康异育银鲫120尾,购于上海市浦东新区果园某养殖场,体质量(120±10)g,暂养于水族箱内,采用全天曝气水,溶氧充足。试验水温(25±1)℃。确认无药物使用情况用于实验,实验前停食一周。
1.2 实验试剂ROBH标准品:纯度≥99.0%,购自德国Dr公司;ROBH原料药由山西争跃化工有限公司提供,纯度≥98%;甲醇(色谱纯)、乙腈(色谱纯)、甲酸(分析纯)购自国药集团化学试剂有限公司;磷酸二氢钾(分析纯)购自阿拉丁;无水硫酸钠(分析纯)购自生工生物工程(上海)股份有限公司。
1.3 实验仪器LC-100高效液相色谱仪(带UV检测器):上海伍丰科学仪器有限公司;WH-861漩涡振荡器:太仓华利达设备有限公司;TDL-8M台式大容量冷冻离心机:上海卢湘仪器有限公司;低温保藏箱:Haier;超声波清洗机:广州邦洁电子产品有限公司;组织匀浆仪:Sigma;电子分析天平:上海海康仪器有限公司;氮吹仪:上海本昂科学仪器有限公司。
1.4 ROBH标准溶液的配制用分析天平准确称取0.01 g,用甲醇定溶于100 mL容量瓶中,配成10 μg/mL的ROBH标准溶液,保存于-20 ℃冰箱中备用。
1.5 标准曲线的建立准确量取10 μg/mL的ROBH标准溶液,用甲醇分别稀释成1、0.5、0.2、0.1、0.05 μg/mL的样品。将样品用0.22 μm的有机系微孔滤膜过滤,然后进行HPLC检测。以质量浓度为横轴(x轴),以峰面积为纵轴(y轴)作回归方程。
1.6 色谱条件ROBH的HPLC分析参考曾勇[18]的方法,并作适当调整。流动相:V(乙腈):V(0.05mol/L的磷酸二氢钾)=6:4;色谱柱:C18分析柱(150 mm×4.6 mm,5 μm);进样量:20 μL;波长:353 nm;柱温:室温;流速:1.0 mL/min。
1.7 给药及样品的采集与保存将120尾异育银鲫分成3组,将配制好的20、30、40 mg/kg鱼体质量剂量的ROBH口灌入异育银鲫前肠。口灌后将鱼体直立片刻,无回吐的鱼用于实验。在给药后0.25、0.5、1、2、3、4、6、8、10、12、24 h自鱼尾静脉取血,按照1:10的体积比例加入2%的草酸钾抗凝剂,混匀。并迅速采取鱼肾脏、肝脏和肌肉,将所取样品放置-80 ℃冰箱中保存。
1.8 样品前处理处理方法参照汤菊芬等[19]:血浆和各组织在室温下自然解冻,取血液1 mL,肌肉1.0 g、肝2.0 g,肾脏0.2 g,用组织匀浆仪捣碎,分别于15 mL离心管中,依次加入5 mL甲醇(含体积分数1%甲酸)、4 g无水硫酸钠,涡旋振荡至充分混匀,超声15 min,以4 000 r/min离心10 min,吸取上层清液后,残渣重复上述操作1次,合并上清液,在40 ℃水浴中用氮气吹干。用5 mL甲醇溶解残渣,涡旋振荡,超声15 min,以4 000 r/min离心10 min,上清液用0.22 μm有机系微孔滤膜过滤,滤液待上机检测。
1.9 回收率及精密度回收率:取空白鱼肌肉等组织0.9 g及血液0.9 mL,分别加入100 μg/mL、10 μg/mL、1 μg/mL的ROBH溶液100 μL,使其理论浓度达到10 μg/mL、1 μg/mL、0.1 μg/mL,按照1.8进行处理,每个浓度样品测3次,取其平均值为实测浓度。
精密度:同一样品在一天内不同时间测3次,连续测3 d,计算血液和各组织中ROBH的日内和日间平均变异系数,以判断该方法的精密度。
1.10 数据处理经HPLC测出的数据用Excel绘制出标准曲线及药物浓度与时间曲线,用Kinetic 4.4药代动力学软件计算药代动力学参数。
2 结果 2.1 ROBH标准工作曲线ROBH标准工作曲线回归方程为:y= 179.35x- 3.9238(R2=0.997),在0.05~1 μg/mL的范围内,ROBH的峰面积与其质量浓度呈较好的线性关系(图 1)。以2倍基线噪音的药量为最低检测限,得知在检测环境下,ROBH的最低检测限为20 ng/mL。
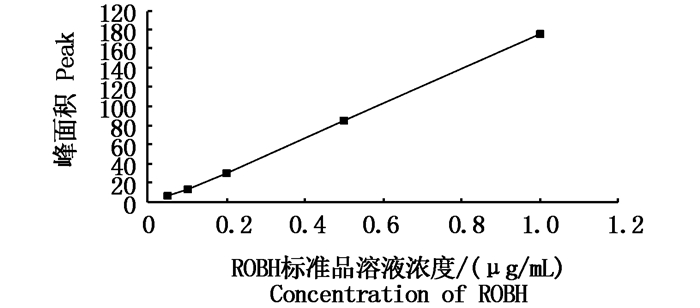
|
图 1 ROBH标准品工作曲线
Fig. 1 Standard curve of ROBH in HPLC assay
|
如表 1所示,在实验用鱼空白血液、肌肉、肾脏和肝脏中分别加入100 μg/mL、10 μg/mL、1 μg/mL的ROBH标准溶液时,肌肉中的加标回收率为89.31%~104.17%,血液中的加标回收率为92.43%~108.65%,肾脏中加标回收率为87.63%~91.89%,肝脏中加标回收率为89.51%~95.67%。血液、肌肉、肾脏和肝脏的日内变异系数分别为3.76%~4.61%、3.47%~4.38%、3.94%~4.61%和4.18%~4.57%,日间变异系数为2.73%~7.62%。表明用此方法处理样品可以得到较高的回收率,重复性良好。
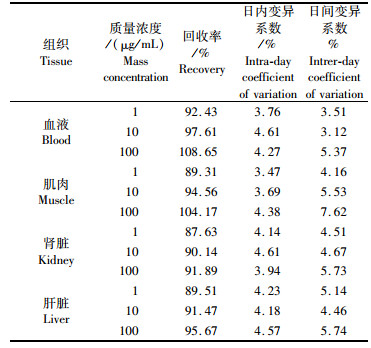
|
表 1 异育银鲫血液、肌肉、肾脏和肝脏中ROBH的回收率和变异系数 Tab.1 Recovery and Variation Coefficients of ROBH in blood, muscle, kidney and liver of Crucian Carp |
图 2显示,该药口灌异育银鲫后各组织中的药-时曲线均呈现双峰现象。其中,图 2a为ROBH在异育银鲫血液中的药-时曲线,双峰出现的时间和峰浓度分别是:20 mg/kg为2.3和10 h,其中Tmax=2.2 h,Cmax=0.554 mg/L,T10=0.436 mg/L;30 mg/kg为2.1和10 h,其中Tmax=2.1 h,Cmax= 0.734 mg/L,T10=0.510 mg/L;40 mg/kg为2.2和10 h,其中Tmax=2.2 h,Cmax= 1.172 mg/L,T10=0.739 mg/L。
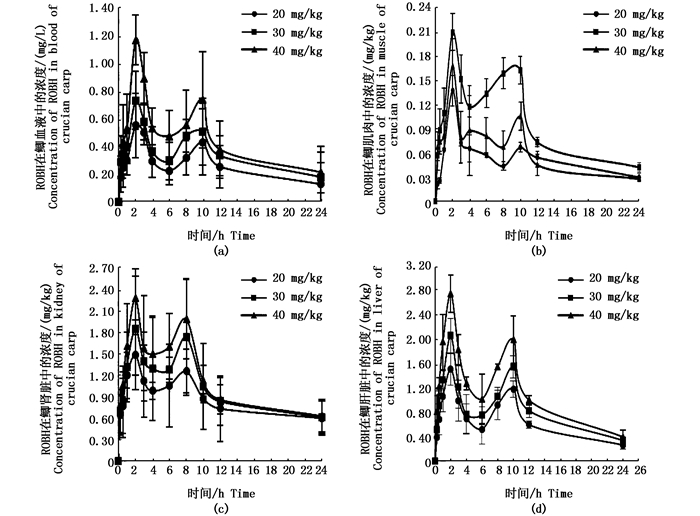
|
图 2 不同ROBH口灌剂量在异育银鲫各组织内的药-时曲线
Fig. 2 ROBH concentration-time curves in different tissues of crucian carp at different oral administration doses
|
图 2b为ROBH在异育银鲫肌肉中的药-时曲线。到达2 h左右出现第一个峰,其中20 mg/kg、30 mg/kg和40 mg/kg第一次出峰时间分别为2.0 h,1.9 h和2.0 h;相对应的峰浓度分别为Cmax=0.137 mg/kg、Cmax=0.168 mg/kg和Cmax=0.21 mg/kg。在第二次出峰的时间均为10 h,相对应的药量为20 mg/kg是0.067 mg/kg、30 mg/kg药量是0.105 mg/kg、40 mg/kg的药量是0.163 mg/kg。肌肉中的含量相对于其他组织而言明显偏低。
图 2c和图 2d是ROBH在异育银鲫肾脏和肝脏中的药时曲线。ROBH在此两种组织中也呈双峰现象。但在肾脏中,第二次出峰时间有所提前。其中,肾脏中各剂量出峰的时间和峰浓度分别是:20 mg/kg是2.0和8.0 h,Tmax=2.0 h, Cmax=1.489 mg/kg,30 mg/kg是2.1和8.0 h,Tmax=2.1 h,Cmax=1.849 mg/kg,40 mg/kg是2.1和8.0 h,Tmax=2.1 h,Cmax=2.283 mg/kg;肝脏中的含量有所增加,同时第二次出峰时间在10 h左右。其中各剂量出峰时间和峰浓度分别为20 mg/kg是1.5和10 h,Tmax=1.5 h,Cmax=1.509 mg/kg,30 mg/kg是1.5和10 h,Tmax=1.5 h,Cmax=2.016 mg/kg,40 mg/kg是1.4和10 h,Tmax=1.4 h,Cmax=2.750 mg/kg。
3 讨论 3.1 ROBH在异育银鲫体内的分布与吸收特征Tmax、Cmax是反映药物在体内吸收速率的重要指标。药物在生物体内的吸收、分布与各组织的血流量,亲和力以及其他因素有关。药物分布的初始阶段与血液的供应是否丰富有关,起始浓度可达很高,但随着时间的延长,药物在组织和器官的分布收到来自药物本身和组织亲和力的影响越来越大,从而形成药物的再分布过程[20]。经过再分布后,因肝、肾中血液供应非常丰富,所以在肝脏和肾脏中达峰时间较快、浓度高。这与本研究结果基本相符。在肝脏中,20、30和40 mg/kg 3种剂量的达峰时间分别是Tmax=1.5、1.5和1.4 h;此时的药量分别是Cmax=1.51、2.06和2.75 mg/kg;而肾脏中20 mg/kg、30 mg/kg和40 mg/kg 3种剂量的达峰时间为Tmax=2.0、2.1和2.1 h,对应的药物含量分别是Cmax=1.48、1.85和2.28 mg/kg,除了达峰时间与其他组织基本相似之外,最大药物含量却很高。这与彭晓章等[20]的报道类似,但与汤菊芬等[19]的研究中肝脏药物含量不一致,前者研究的是伊维菌素在鲫体内的药代动力学,而后者研究的是盐酸氯苯胍在眼斑拟石首鱼体内的药代动力学与残留规律,出现此情况的原因可能既与药物本身有关,也与所研究的对象有关。同时,图 2显示,3种剂量的ROBH在异育银鲫各组织中呈现双峰现象,这与汤菊芬等[19]的报道一致。据KROBOTH等[21]和PENTIKÄINEN等[22]的报道,目前口服药出现此现象的原因可能是由肝肠循环和非齐性吸收引起,而且双峰时间间隔在2~20 h之间。另外,FENG等[23]报道口服药进入人体后,要经过胃肠道两部分的吸收,而生物体中不同部位的通透性以及对同一种药物的吸收不同也会出现双峰现象,但由于鲫的胃分化不明显,不会因此产生ROBH吸收的双峰现象,可以排除。
肝脏和肾脏的药时曲线总体相似,但是这两种器官中该药的第二次出峰时间以及两个峰之间药物含量的变化不同。在肾脏中,第二次出峰时间与肝脏甚至其他组织均不同,Tmax=8 h。并在第一次出峰时间过后,到第二次出峰之间,3种剂量的ROBH在肾脏的药量变化没有肝脏中变化大。肾脏中3种剂量的ROBH药量是20 mg/kg,C3=1.119 mg/kg、C4=0.983 mg/kg、C6=1.059 mg/kg;30 mg/kg,C3=1.396 mg/kg、C4=1.292 mg/kg、C6=1.278 mg/kg;40 mg/kg,C3=1.582 mg/kg、C4=1.499 mg/kg、C6=1.604 mg/kg,以上变化均在0.1 mg/kg左右。肝脏中3种剂量的ROBH药量是20 mg/kg,C3=0.996 mg/kg、C4=0.701 mg/kg、C6=0.526 mg/kg、C8=0.925 mg/kg;30 mg/kg,C3=1.218 mg/kg、C4=0.772 mg/kg、C6=0.758 mg/kg、C8=1.065 mg/kg;40 mg/kg,C3=1.827 mg/kg、C4=1.277 mg/kg、C6=1.022 mg/kg、C8=1.552 mg/kg,以上变化均超过0.4 mg/kg,而40 mg/kg的变化却在0.8 mg/kg以上。此结果说明不同的器官和组织通透型不一样,故分布和吸收的规律也不一样。
口灌后20、30和40 mg/kg的肌肉药量达峰时间分别为Tmax=2.0、1.9和2.0 h,在血液中药量达峰时间分别为Tmax=2.3、2.1和2.2 h。图 2b显示,1 h前药量升高很快,在0.5 h左右稍微放缓,有所停顿,但是在1 h之后又开始快速升高,到达2 h左右出现第一个峰,这与血药含量规律很相似。同时,肌肉中药量在第一次出峰之后快速下降,此现象与血药含量变化较类似。但是30 mg/kg剂量的ROBH在3~4 h的过程中有所上升,而40 mg/kg剂量的ROBH在4 h到第二次出峰期间一直保持药量在上升的趋势,这与20 mg/kg剂量恰恰相反。血液中药量在第一次出峰时间结束后也是快速下降,而到第二次出峰期间药量变化不大,与肾脏中在相应期间的药量变化类似。到第二次出峰时,肌肉中20 mg/kg和30 mg/kg剂量的药量出峰时间为10 h,但是40 mg/kg的ROBH在第二次出峰时间有所提前。最后在10 h之后,3种剂量的药物含量均在下降,但是20 mg/kg剂量的下降较前两者缓慢,但最终20 mg/kg和30 mg/kg剂量的药物含量在经过下降出现逆差后在24 h达到相似的浓度,可能是由于药物在肌肉中分布速率较慢有关。血药含量在第二次达峰前到24 h未出现肌肉药量变化情况的类似现象。
AUC和Vd是衡量药物在体内吸收和分布的主要PK参数。AUC表现的是药时曲线下面积,反应了药物在各组织中的相对量。3种剂量按AUC(0-24)值由小到大排序均一样,都是肌肉<血液<肝脏<肾脏。所以由此得知,ROBH在异育银鲫各组织中的分布与给药剂量无关,可能跟血液供应量是否丰富和组织器官有关。Vd是表观分布容积,当体内药量一定时,该值与血药浓度成反比。其所体现的规律是,若Vd值小,则血药浓度高,说明该药大部分在血液中;若Vd值大,则血药浓度低,说明该药大部分在组织中。按照Vd值的大小排序,3种剂量均是血液>肝脏>肾脏>肌肉。所以推测药物的Vd值可能与药物的理化性质和组织器官有关。
3.2 ROBH在异育银鲫体内的清除及休药期CL表示的是总体清除率,MRT表示的是平均驻留时间,前者是反映药物在体内消除的主要参数之一,后者则与药物的吸收和消除速率有关。表 2中显示,3种剂量的ROBH在异育银鲫各组织中平均驻留时间肾脏>肝脏>血液>肌肉,表明该药在肾脏和肝脏中具有蓄积作用,这也证明了肝脏和肾脏是鱼类的主要解毒器官。清除数据显示,肌肉中清除最慢,这与汤菊芬等[19]和班付国等[24]的研究相符。
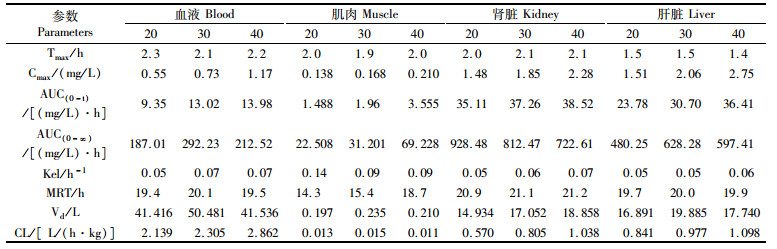
|
表 2 不同ROBH口灌剂量在异育银鲫各组织内的药代动力学参数 Tab.2 ROBH pharmacokinetic parameters in different tissues of crucian carp at different oral administration doses |
休药期的制定是为了保障食品的食用安全性。国家会规定某种药物的最大残留量(Maximum Residue Limits, MRT)标准和动物对药物的残留消除规律,休药期就是通过此标准和规律进行确定。2002年中国国家农业部颁布的235号公告[25]中规定ROBH在动物性食品中MRT为100 μg/kg,欧盟[26]和其他地区[27]也有此规定,但我国和欧盟均未规定ROBH在水产品中的MRT。本研究以MRT为100 μg/kg来确定休药期,以最大剂量40 mg/kg药物进行计算,24 h时该剂量在肌肉中对应的药量为42.383 μg/kg,低于100 μg/kg。而且ROBH是按照一级动力学消除的,消除后期符合指数消除:C=C0×e-kt。通过计算得出休药期最少为9天。同时考虑到养殖户投喂情况和天气原因,以及皮肤中未检测,休药期可适当延长。
| [1] |
李俊玲, 刘学江, 徐强, 等. 饲料中盐酸氯苯胍的测定[J]. 饲料广角, 2003(15): 20-23. LI J L, LIU X J, XU Q, et al. The determination of Robenidine HCI in feed[J]. Feed China, 2003(15): 20-23. DOI:10.3969/j.issn.1002-8358.2003.15.010 |
| [2] |
王玉堂, 陈昌福, 吕永辉. 水产养殖动物致病菌耐药性检测数据实际作用[J]. 中国水产, 2013(10): 57-61. WANG Y T, CHEN C F, LÜ Y H. The effect of antibiotic Resistance Test data of pathogenic bacteria in Aquaculture Animals[J]. China Fisheries, 2013(10): 57-61. DOI:10.3969/j.issn.1002-6681.2013.10.029 |
| [3] |
竹攸汀.异育银鲫皮肤粘孢子虫病的病原和组织病理研究[D].上海: 上海海洋大学, 2012. ZHU X T. Pathogen and histopathology studies of Myxosporean (Myxozoa: Myxosporea) infecting the skin of Allogynogenetic Crucian Carp (Carassius auratus gibelio)[D]. Shanghai: Shanghai Ocean University, 2012. |
| [4] |
佚名. 黏孢子虫病[J]. 中国水产, 2011(9): 52-53. ANON. Myxosporidiosis[J]. China Fisheries, 2011(9): 52-53. |
| [5] |
袁圣. 吴李碘泡虫病[J]. 海洋与渔业, 2015(10): 58-58. YUAN S. Myxobolus wuli[J]. Ocean and Fishery, 2015(10): 58-58. DOI:10.3969/j.issn.1672-4046.2015.10.036 |
| [6] |
汪氏单极虫--异育银鲫一粘孢子虫新种及其引发的鳃单极虫病[C]//中国动物学会原生动物学分会第十七次学术讨论会论文集, 2013. Thelohanellus Wang-The new species and the gill thelohanelliasis caused by the new species of Crucian Carp[C]//The 17th Academic Symposium of the Zoological Society of Chinese Society of Zoology, 2013. |
| [7] |
范本伦. 氯苯胍:一种新的高效球虫药[J]. 国外畜牧科技, 1979(3): 43-48. FAN B L. Robenidine:a new highly effective coccidia drug[J]. China Animal Husbandry & Veterinary Medicine, 1979(3): 43-48. |
| [8] |
吴仕辉, 陈昆慈, 戴晓欣, 等. 分散固相萃取/高效液相色谱法测定水产品中氯苯胍的残留量[J]. 分析测试学报, 2011, 30(12): 1356-1361. WU S H, WANG K C, DAI X X, et al. Determination of robenidine in fishery products by high performance liquid chromatography with dispersive solid phase extraction[J]. Journal of Instrumental Analysis, 2011, 30(12): 1356-1361. DOI:10.3969/j.issn.1004-4957.2011.12.005 |
| [9] |
刘山乔, 王高荣. 鲫鱼黏孢子虫病的诊断与防治[J]. 渔业致富指南, 2016(12): 52-53. LIU S Q, WANG G R. Diagnosis and control of Myxosporidiosis of Carassius[J]. Fishery Guide to be Rich, 2016(12): 52-53. |
| [10] |
王晓平, 陈秀丽, 董文, 等. 淡水鱼粘孢子虫病的病原分析及防治实例[J]. 齐鲁渔业, 2010, 27(2): 10-12. WANG X P, CHEN X L, DONG W, et al. The pathogenic characteristics and the treatment of the Myxosporidia Disease[J]. Shandong Fisheries, 2010, 27(2): 10-12. |
| [11] |
章明, 袁圣, 冯刚. 一例异育银鲫粘孢子虫的治疗案例[J]. 渔业致富指南, 2013(14): 61. ZHANG M, YUAN S, FENG G. A case of the treatment of Myxosporea in Crucian Carp[J]. Fishery Guide to be Rich, 2013(14): 61. |
| [12] |
俞小先, 戴俊, 窦天明, 等. 鲫鱼黏孢子虫病的主要特征、诊断方法与防治措施[J]. 水产养殖, 2009, 30(5): 35-36. YU X X, DAI J, DOU T M, et al. Diagnostic methods, prevention measures and main characteristics of Myxosporidiosis of Carassius[J]. Journal of Aquaculture, 2009, 30(5): 35-36. DOI:10.3969/j.issn.1004-2091.2009.05.023 |
| [13] |
汤菊芬, 蔡佳, 廖建萌, 等. HP LC-MS/MS法同时测定水产品中的诺氟沙星、盐酸小檗碱、盐酸氯苯胍残留[J]. 中国兽药杂志, 2014, 48(8): 55-60. TANG J F, CAI J, LIAO J M, et al. Determination of norfloxacin, berberine hydrochloride and robenidine hydrochloride residues in aquatic products by high performance chromatography-mass spectrometry (HPLC-MS/MS)[J]. Chinese Journal of Veterinary Drug, 2014, 48(8): 55-60. |
| [14] |
刘永涛, 董靖, 李乐, 等. 超高效液相色谱法同时测定水产品中的盐酸氯苯胍及其代谢产物[J]. 分析试验室, 2017, 36(9): 1058-1061. LIU Y T, DONG J, LI L, et al. Simultaneous determination of robenidine hydrochoride and its metabolites in aquatic products by UPLC[J]. Chinese Journal of Analysis Laboratory, 2017, 36(9): 1058-1061. |
| [15] |
YEOM H, YANG D H, SUH J H, et al. Determination of robenidine residues in chicken muscle by high performance liquid chromatography with ultraviolet detection[J]. Archives of Pharmacal Research, 2013, 36(3): 359-365. DOI:10.1007/s12272-013-0065-y |
| [16] |
DOWLING G, O'KEEFFE M, SMYTH M R. Determination of robenidine in eggs by liquid chromatography with UV spectrophotometric detection[J]. Analytica Chimica Acta, 2005, 539(1/2): 31-34. |
| [17] |
OLEJNIK M, SZPRENGIER-JUSZKIEWICZ T, JEDZINIAK P. Multi-residue confirmatory method for the determination of twelve coccidiostats in chicken liver using liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(46): 8141-8148. DOI:10.1016/j.chroma.2009.04.097 |
| [18] |
曾勇.动物性食品中氯苯胍和左旋咪唑残留检测方法研究[D].武汉: 华中农业大学, 2008. ZENG Y. Development of methods for determination of robenidine and levamisole residues in animal derive food[D]. Wuhan: Huazhong Agriculture University, 2008. |
| [19] |
汤菊芬, 蔡佳, 黄瑜, 等. 盐酸氯苯胍在红笛鲷体内的药代动力学及残留消除规律[J]. 广东海洋大学学报, 2016, 36(6): 33-37. TANG J F, CAI J, HUANG Y, et al. Pharmacokinetics and elimination regularity of robenidine hydrochloride residues in Luthjanus sanguineus[J]. Journal of Guangdong Ocean University, 2016, 36(6): 33-37. DOI:10.3969/j.issn.1673-9159.2016.06.006 |
| [20] |
彭章晓, 江敏, 吴昊, 等. 伊维菌素在鲫体内的药代动力学[J]. 水产学报, 2012, 36(3): 422-428. PENG Z X, JIANG M, WU H, et al. The pharmacokinetics of ivermectin in Carassius auratus[J]. Journal of Fisheries of China, 2012, 36(3): 422-428. |
| [21] |
KROBOTH P D, SMITH R B, RAULT R, et al. Effects of end-stage renal disease and aluminum hydroxide on temazepam kinetics[J]. Clinical Pharmacology and Therapeutics, 1985, 37(4): 453-459. DOI:10.1038/clpt.1985.70 |
| [22] |
PENTIKÄINEN P J, NEUVONEN P J, PENTTILÄ A. Pharmacokinetics and pharmacodynamics of glipizide in healthy volunteers[J]. International Journal of Clinical Pharmacology, Therapy, and Toxicology, 1983, 21(2): 98-107. |
| [23] |
FENG J, XU W, TAO X, et al. Simultaneous determination of baicalin, baicalein, wogonin, berberine, palmatine and jatrorrhizine in rat plasma by liquid chromatography-tandem mass spectrometry and application in pharmacokinetic studies after oral administration of traditional Chinese medicinal preparations containing scutellaria " coptis herb couple[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 53(3): 591-598. DOI:10.1016/j.jpba.2010.04.002 |
| [24] |
班付国, 吴宁鹏, 李慧素, 等. 氯苯胍在鸡组织中的残留消除规律研究[J]. 中国兽药杂志, 2012, 46(11): 24-26. BAN F G, WU N P, LI H S, et al. Depletion of robenidine residue in chicken tissues[J]. Chinese Journal of Veterinary Drug, 2012, 46(11): 24-26. |
| [25] |
中华人民共和国农业部.动物性食品中兽药最高残留限量[R].农业部公告235号.北京: 农业部, 2002. The ministry of agriculture of the People's Republic of China. Maximum residue limits of veterinary drugs in animal foods[R]. Announcement by the Ministry of Agriculture No. 235. Beijing: Ministry of Agriculture, 2002. |
| [26] |
EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP). Scientific Opinion on safety and efficacy of Cycostat® 66G (robenidine hydrochloride) for rabbits for breeding and fattening[J]. EFSA Journal, 2011, 9(3). DOI:10.2903/j.efsa.2011.2102 |
| [27] |
F AO. Assuring food safety and quality:guidelines for strengthening national food control systems[M]. Geneva: Joint FAO/WHO Publication, 2003.
|
2. Key Laboratory ofFreshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


