2. 洞头区水产科技推广站, 浙江 洞头 325700
海洋作为地球上最大的“碳库”,其固碳作用显著,潜力巨大。在全球气候变化的背景下,“蓝碳”受到国际社会的日益关注。“碳汇渔业”是指能够发挥碳汇功能,直接或间接降低大气CO2浓度效果的渔业生产过程、活动和机制[1]。其中,浅海贝、藻类养殖活动直接或间接地使用了大量的海洋碳,在“碳汇渔业”中具有重要地位[2-3]。
将贝类养殖活动列为碳汇渔业颇有疑义,能长期保存的贝壳碳来源如果是本身就能长期保存的泥沙,则其碳汇功能意义不大。在全球气候变化的研究中,稳定同位素分析被认为是三大现代技术之一[4]。应用稳定碳同位素技术,通过碳源分析来研究不同生物体食物来源,作为一种重要的研究手段被广泛应用于生态学领域研究中,已有研究表明对贝类软体组织的营养贡献较大的是底栖藻类与浮游植物[5-10]。而应用稳定碳同位素技术直接研究贝类碳源鲜见报道,本研究将DIC、DOC、悬浮物及沉积物全面纳入碳源范围,同时分析了贝壳与软体组织各自的碳源贡献率,将有助于深入剖析贝类碳汇的碳源特征,明确养殖贝类的碳汇功能。
1 材料与方法 1.1 样品采集2016年8月,3种贝类(毛蚶、泥蚶、文蛤)采集于温州市洞头区灵昆近海围塘养殖水域。用25号浮游生物网由水底至水表垂直拖网采样,未能采集到浮游生物。
贝类:捕捞后的样品放在装有养殖海水的容器里保存,保证样品成活。带至实验室内用过滤海水清洗干净,用刀刮除贝壳上的污损生物,放置于-20 ℃保存。每种贝类选取3个个体称总湿重,测量规格。解剖贝类将其分为软体组织、贝壳两部分,蒸馏水清洗后,60 ℃烘干36 h,烘干后称取软体组织、贝壳的干重,干燥后的样品用玛瑙研钵研磨成粉末状并混合均匀,用聚乙烯封口袋装好贮存在干燥器中,直至进行稳定碳同位素分析。
水样与悬浮物:养殖围塘内随机选取4处采样点,采样前用所采水样反复多次冲洗样品瓶,用采水器采集10 L水样。为了防止水体中微生物作用对δ13CDIC值的影响,向瓶中滴入两滴浓度为0.5%的HgCl2溶液,用封口胶密封后盖紧。带至无菌操作室内,用事先经470 ℃煅烧玻璃纤维滤膜(孔径0.45 μm)真空抽滤收集悬浮物(悬浮颗粒、浮游生物等)。过滤水样于4 ℃的条件下用50 mL的棕色玻璃瓶冷藏保存,以备δ13CDIC与δ13CDOC测定。将滤膜及其过滤物(即悬浮物)与贝壳一起进行烘干,放于干燥器以待分析。
表层沉积物:在每个水样采样点同时采集表层沉积物,混合装入塑料桶中,剔除贝壳、石头等杂质,混匀作为一个样品,带回实验室与贝壳一起进行烘干,研磨成粉,过200目网筛,放于干燥器以待分析。
1.2 测试分析碳同位素委托国家海洋局第三海洋研究所稳定同位素质谱实验室测定。贝壳、软体组织与沉积物的粉末样品,用4×6锡杯包样;悬浮物滤膜用不锈钢打孔器取固定面积的玻璃纤维膜样,用5×9锡杯包样;碳同位素分析测试用元素分析仪-稳定同位素质谱仪联机(Flash EA 1112 HT-Delta V Advantages,Thermo公司)。载气He流速90 mL/min,反应管温度960 ℃,色谱柱温度50 ℃。
DIC、DOC碳同位素分析测试用GasBenchⅡ:瑞士CTC Analytics公司CombiPAL自动进样器;美国Agilent公司Pora PlotQ色谱柱(30 m×0. 32 mm×20 μm);恒温样品盘;酸泵;Mat253检测器(美国Thermo Fisher公司)。
δ13C值以PDB国际标准作为参考标准,δ13C值按以下公式计算:
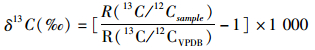
式中:R(13C/12CVPDB)为国际标准物PDB(Vienna Peedee Belemnite)的碳同位素丰度比值,δ13C值的分析精度为±0.1‰。
1.3 数据处理用IsoSource软件对贝壳、软体组织的4种碳源的贡献比率进行分析,用Excel 2003对文中数据进行计算,差异性分析用SPSS Statistics 17统计软件。
2 结果 2.1 样品规格采集的贝类中,文蛤规格较大,总湿质量平均达到22.07 g,壳高达34.37 mm。泥蚶的总湿质量最小,毛蚶次之,3种贝类具体规格详见表 1。

|
表 1 贝类规格 Tab.1 Bivalve specification |
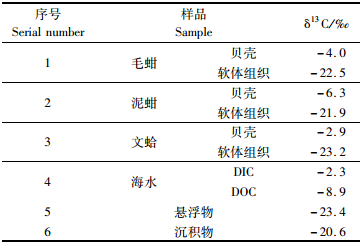
不同贝类的贝壳δ13C值变化幅度较大,文蛤δ13C值最富集, 为-2.9‰,泥蚶δ13C值最贫化为-6.3‰,毛蚶δ13C值居中, 为-4.0‰。不同贝类的软体组织δ13C值变化幅度较小,泥蚶δ13C值最富集, 为-21.9‰,文蛤δ13C值最贫化, 为-23.2‰,毛蚶δ13C值居中, 为-22.5‰(表 2)。
|
表 2 各样品的δ13C值 Tab.2 The δ13C value of each sample |
不同碳源的δ13C值变化幅度较大,水体溶解碳比悬浮物与沉积物更为富集。其中,DIC的δ13C值最富集, 为-2.3‰,其次为DOC的δ13C值达-8.9‰,沉积物δ13C值为-20.6‰,悬浮物δ13C值最贫化为-23.4‰。
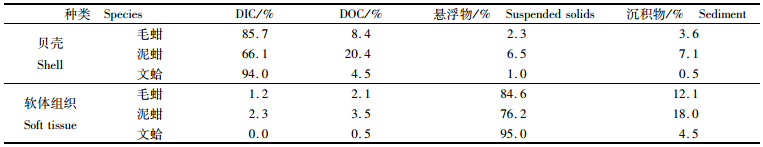
2.3 碳源分析3种贝类贝壳的主要碳源均为DIC,DIC对文蛤贝壳碳源贡献率高达94.0%,毛蚶达85.7%,最低的泥蚶也达66.1%。其次贡献率较高的碳源为DOC,DOC对泥蚶贝壳碳的贡献达20.4%,毛蚶为8.4%,文蛤为4.5%。DIC与DOC两种碳源合计贡献率在86%以上,文蛤高达98.5%,悬浮物与沉积物对贝壳碳贡献率较低(表 3)。
|
表 3 4种碳源对3种贝类的相对贡献率 Tab.3 Relative contributions of four carbon sources to three species of bivalves |
软体组织的碳源主要是悬浮物,悬浮物对文蛤软体组织碳的贡献率高达95.0%,对毛蚶贡献率达84.6%,对泥蚶贡献率达76.2%。其次贡献率较高的碳源为沉积物,沉积物对泥蚶软体组织碳的贡献达18.0%,毛蚶为12.1%,文蛤为4.5%。悬浮物与沉积物两种碳源对贝类软体组织合计贡献率在94%以上,文蛤高达99.5%,DIC与DOC对贝类软体组织碳的贡献率较低。
3 讨论 3.1 δ13C差异性分析影响稳定碳同位素积累的因素很多,不同区域的研究中稳定碳同位素值有很大的差异[9]。现有贝类食物来源研究主要通过软体组织的稳定碳同位素来分析,未考虑贝壳中稳定碳同位素来源,本文则对贝类的贝壳和软体组织同时进行了稳定碳同位素分析。本研究中泥蚶与文蛤软体组织δ13C值均比湛江港红树林生态系统的贝类软体组织δ13C值(泥蚶-19.7‰、文蛤-20.4‰)及山东刺参养殖塘中的贝类软体组织δ13C值(甲壳动物-16.92‰、文蛤-16.78‰、蛏-19.54‰)更为贫瘠[6, 9],这可能与不同养殖地区食性来源差异性有关。本文3种贝类的贝壳δ13C均比软体组织富集,文蛤贝壳表现为最富集。3种贝类软体组织δ13C越贫瘠,贝壳δ13C则越富集,贝壳与软体组织δ13C表现出负相关,这可能是由于贝壳较强的δ13C富集能力,削弱了软体组织对δ13C的竞争力。
海水中DIC是HCO3-、CO32-、H2CO3及CO2的总和[11],海水中DIC的稳定碳同位素δ13CDlC值(-1‰~2.2‰)明显高于大气中CO2的δ13C值(-8‰)[12],且其δ13C值组成十分恒定[13],本文测定的δ13CDlC低于上述研究结论。在近海,尤其有大河流输入的海域,由于陆源贫13C淡水输入的影响,δ13CDlC通常比大洋偏负,珠江口表层水δ13CDlC值变化范围在-10.66‰~-0.24‰[14]。本文δ13CDlC值偏负,位于珠江口δ13CDlC变化范围内,这可能与养殖围塘位于瓯江口近海水域有关。本研究悬浮物δ13C值为-23.4‰,与杭州湾人工湖浮游植物δ13C值-23.53‰[15]非常接近,但略显富集,比辽东半岛潮间带颗粒有机物δ13C值(-22.89‰~-20.61‰)[16]略显贫瘠。尽管采样时未单独采集到浮游生物,但在悬浮物里面包含了浮游植物与悬浮颗粒,故悬浮物δ13C值位于上述研究的浮游植物与颗粒有机物δ13C值之间属正常范围。山东刺参养殖塘中的表层沉积物δ13C值为-24.54‰[9],而本文表层沉积物δ13C值更为富集,不同地区的水体DIC及沉积物δ13C表现出了一定的差异性。
3.2 贝类不同组织碳源分析贝类作为一种滤食性动物,具有很强的滤水能力,可以从水体中滤取大量的浮游植物和有机颗粒,并将滤食的物质以组织生长、排泄物等形式重新分配。海水中DIC对浮游生物体内的碳同位素值影响较大[17],也是沉水植物碳同位素组成受影响的重要环境因素之一[18]。本研究3种贝类贝壳的主要碳源均为水体DIC,而贝类软体组织贡献率大的来源是悬浮物与沉积物,这表明3种贝类贝壳与软体组织的主要碳源截然不同,两部分组织各有其喜好的碳源选择,水体DIC对贝类的贝壳碳同位素组成有重要影响。颗粒有机物对菲律宾蛤仔软体组织的相对贡献率达74.2%[16],与本文3种贝类软体组织的主要碳源为悬浮物的结论相一致。
当选用n种同位素来确定n+1种食物来源对生物的贡献比例时,根据质量守恒原则用标准的线性混合模型来计算,可以得到确定的结果[6]。当选用n种同位素测定多于n+1种来源时,采用IsoSource程序对不同来源的贡献比例只能进行范围定量分析。本研究用单一的稳定碳同位素来分析4个碳源时,IsoSource软件计算出的结果就不能非常精准地反映不同碳源贡献,今后可增加稳定碳同位素种类,以得到更准确的结果。
3.3 贝类碳汇功能贝类通过强大的滤水能力摄食同化海水中各形态的碳,形成了碳酸钙躯壳(贝壳)实现碳的固定,起到了间接减少海水CO2分压的作用[19-20]。同时,伴随着养殖贝类的收获,大量的贝壳碳从海水中被直接移出成为能够持久存在的碳汇,形成了“可移出碳汇”,这对养殖海域以及邻近海域的碳循环具有重要的影响[21-22]。
外界对贝壳生长具有碳汇功能的质疑主要在于,如果贝类贝壳碳的主要来源是沉积物中的泥沙,则贝壳的固碳功能就没多大意义,因为泥沙的碳本身也能够长期稳定保存。本研究结果表明,沉积物即泥沙不是贝壳碳的主要来源。转化成贝壳的碳绝大多数来自于水体,特别是水体中的DIC。贝壳的生长利用了水体中的DIC,降低水体中DIC的浓度,可以促进大气中CO2向水体转移,起到了间接固碳的作用,具有明显的渔业碳汇功能。
| [1] |
唐启升. 碳汇渔业与又好又快发展现代渔业[J]. 江西水产科技, 2011(2): 5-7. TANG Q S. Carbon sink fisheries and good and fast development of modern fisheries[J]. Jiangxi Fishery Sciences and Technology, 2011(2): 5-7. |
| [2] |
宋金明. 中国近海生态系统碳循环与生物固碳[J]. 中国水产科学, 2011, 18(3): 703-711. SONG J M. Carbon cycling processes and carbon fixed by organisms in China marginal seas[J]. Journal of Fishery Sciences of China, 2011, 18(3): 703-711. |
| [3] |
宋金明, 李学刚, 袁华茂, 等. 中国近海生物固碳强度与潜力[J]. 生态学报, 2008, 28(2): 551-558. SONG J M, LI X G, YUAN H M, et al. Carbon fixed by phytoplankton and cultured algae in China coastal seas[J]. Acta Ecologica Sinica, 2008, 28(2): 551-558. |
| [4] |
韩兴国, 严昌荣, 陈灵芝, 等. 暖温带地区几种木本植物碳稳定同位素的特点[J]. 应用生态学报, 2000, 11(4): 497-500. HAN X G, YAN C R, CHEN L Z, et al. Stable carbon isotope characteristics of some woody plants in warm temperate zone[J]. Chinese Journal of Applied Ecology, 2000, 11(4): 497-500. |
| [5] |
刘雨蒙, 章守宇, 周曦杰, 等. 枸杞岛海藻场大型海藻凋落物碳氮稳定同位素分析[J]. 上海海洋大学学报, 2016, 25(3): 438-444. LIU Y M, ZHANG S Y, ZHOU X J, et al. C/N stable isotope analysis of macro algae litters in kelp bed in Gouqi Island[J]. Journal of Shanghai Ocean University, 2016, 25(3): 438-444. DOI:10.12024/jsou.20160101633 |
| [6] |
易志全. 湛江港红树林生态系统有机碳源对渔业资源的贡献率研究[D]. 湛江: 广东海洋大学, 2010. YI Z Q. Study on contribution of organic carbon sources to fishes in mangrove ecosystem in Zhanjiang harbor[D]. Zhanjiang: Guangdong Ocean University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10566-2010268376.htm |
| [7] |
白富进. 湛江港近江牡蛎中碳氮同位素时空分布及其对无机氮响应的初步研究[D]. 湛江: 广东海洋大学, 2010. BAI F J. Preliminary study the spatial and temporal distribution of carbon and nitrogen isotope in Ostrea rivularis Gould and the response to inorganic nitrogen, Zhanjiang Harbor[D]. Zhanjiang: Guangdong Ocean University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10566-2010268343.htm |
| [8] |
李由明, 黄翔鹄, 刘楚吾. 碳氮稳定同位素技术在动物食性分析中的应用[J]. 广东海洋大学学报, 2007, 27(4): 99-103. LI Y M, HUANG X M, LIU C H. The application of carbon nitrogen stable isotope technology in animal feeding analysis[J]. Journal of Guangdong Ocean University, 2007, 27(4): 99-103. |
| [9] |
GUO K, ZHAO W, WANG S, et al. Study of food web structure and trophic level in the sea ponds of an optimized culture model (jellyfish-shellfish-fish-prawn)[J]. Aquaculture International, 2014, 22(6): 1783-1791. DOI:10.1007/s10499-014-9782-6 |
| [10] |
XU Q, GAO F, YANG H S. Importance of kelp-derived organic carbon to the scallop Chlamys farreri in an integrated multi-trophic aquaculture system[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(2): 322-329. DOI:10.1007/s00343-015-4332-2 |
| [11] |
刘启明, 林锦美, 张金丽, 等. 海气CO2通量的溶解无机碳δ13C值示踪研究进展[J]. 海洋湖沼通报, 2008(3): 53-60. LIU Q M, LIN J M, ZHANG J L, et al. Progress in air-sea fluxes of carbon dioxide traced by dissolved inorganic carbon stable[J]. Transactions of Oceanology and Limnology, 2008(3): 53-60. |
| [12] |
BROECKER W S, PENG T H. Evaluation of the 13C constraint on the uptake of fossil fuel CO2 by the Ocean[J]. Global Biogeochemical Cycles, 1993, 7(3): 619-626. DOI:10.1029/93GB01445 |
| [13] |
杨涛, 蒋少涌, 赖鸣远, 等. 海洋沉积物孔隙水中溶解无机碳(DIC)的碳同位素分析方法[J]. 地球学报, 2005, 26(s1): 51-52. YANG T, JIANG S Y, LAI M Y, et al. An analytical method for carbon isotopic composition of dissolved inorganic carbon (DIC) in pore waters from marine sediments[J]. Acta Geoscientica Sinica, 2005, 26(s1): 51-52. |
| [14] |
刘启明. 南海北部及珠江口溶解无机碳的稳定同位素地球化学特征[D]. 厦门: 厦门大学, 2005. LIU Q M. The geochemical characteristics of the δ13C of dissolved inorganic carbon in the Northern South China Sea and the adjacent Pearl River Estuary[D]. Xiamen: Xiamen University, 2005. |
| [15] |
QUAN W M, SHI L Y, CHEN Y Q. Stable isotopes in aquatic food web of an artificial lagoon in the Hangzhou Bay, China[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(3): 489-497. DOI:10.1007/s00343-010-9037-y |
| [16] |
ZHAO L Q, YAN X W, YANG F. Food sources of the Manila clam Ruditapes philippinarum in intertidal areas:evidence from stable isotope analysis[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(4): 782-788. DOI:10.1007/s00343-013-2191-2 |
| [17] |
THIMDEE W, DEEIN G, SANGRUNGRUANG C, et al. Analysis of primary food sources and trophic relationships of aquatic animals in a mangrove-fringed estuary, Khung Krabaen Bay (Thailand) using dual stable isotope techniques[J]. Wetlands Ecology and Management, 2004, 12(2): 135-144. DOI:10.1023/B:WETL.0000021674.76171.69 |
| [18] |
林清. 温度和无机碳浓度对龙须眼子菜(Potamogeton pectinatus)碳同位素分馏的影响[J]. 生态学报, 2007, 28(2): 570-576. LIN Q. Effects of temperature and dissolved inorganic carbon concentration on the carbon isotopic fractionation of Potamogeton pectinatus[J]. Acta Ecologica Sinica, 2007, 28(2): 570-576. |
| [19] |
NAVARRO J M, THOMPSON R J. Biodeposition by the horse mussel Modiolus modiolus (Dillwyn) during the spring diatom bloom[J]. Journal of Experimental Marine Biology and Ecology, 1997, 209(1/3): 1-13. |
| [20] |
CHAUVAUD L, THOMPSON K J, CLOERN J E, et al. Clams as CO2 generators:The Potamocorbula amurensis example in San Francisco Bay[J]. Limnology Oceanography, 2003, 48(6): 2086-2092. DOI:10.4319/lo.2003.48.6.2086 |
| [21] |
权伟, 应苗苗, 康华靖, 等. 浙江近海贝类养殖及其碳汇强度研究[J]. 渔业现代化, 2014, 41(5): 35-38. QUAN W, YING M M, KANG H J, et al. The study of shellfish mariculture and carbon sink capacity in the coastal areas of Zhejiang province[J]. Fishery Modernization, 2014, 41(5): 35-38. |
| [22] |
ZHOU Y, YANG H S, ZHANG T, et al. Influence of filtering and biodeposition by the cultured scallop Chlamys farreri on benthic-pelagic coupling in a eutrophic bay in China[J]. Marine Ecology Progress Series, 2006, 317: 127-141. DOI:10.3354/meps317127 |
2. Dongtou Fisheries Science and Technology Extension Service, Dongtou 325700, Zhejiang, China
 2018,
Vol. 27
2018,
Vol. 27


