2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 海洋生物科学国际联合研究中心, 中国科技部, 上海 201306;
4. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306
从18世纪的工业革命之后,受化石燃料的燃烧和人类活动的影响,大气中CO2浓度不断增加。2013年环境中CO2浓度已经比工业革命时期增加约40%[1],当前海洋溶解的CO2浓度为480×10-6左右。若大气中的CO2浓度继续按照目前趋势发展(420×10-6 /世纪),到2100年其浓度将升高至800×10-6~1 000×10-6,到2300年大气中CO2的浓度将升高至2 000 ×10-6 [2]。排放到大气中的CO2有24%~35%被海洋以每天2 500多万吨的速度吸收[3],这缓解了大气中CO2浓度的增长,但却改变了海水酸碱度和碳酸盐平衡,使得表层海水的碱性下降,引起海洋酸化[4-5]。
目前,海洋中的HCO3-占溶解无机碳的90%以上,CO32-浓度占9%左右,CO2占1%以下。随着海洋中溶解较多的CO2,海水化学平衡发生了改变,导致海洋中溶解CO2、HCO3-和H+浓度增加,而CO32-浓度和CaCO3饱和度下降[6]。海洋生物也受到影响,研究发现随着CO2浓度升高,马氏珠母贝(Saccostrea glomerata)的受精率显著降低,并且降低其胚胎生长速度,增加胚胎畸形率[7]。在胚胎发育时期进行酸化处理,会影响大部分鱼类早期发育过程。淡水青鳉(Oryzias latipes)受精卵孵化的水体中CO2的分压为0.12 kpa和0.42 kpa时,发育到2~5天的胚胎出现发育延迟,可能与糖代谢和电子传递链过程受酸化影响有关[8]。睛斑扁隆头鱼(Symphodus ocellatus)的受精卵在CO2浓度为800 ~1 000微大气压(μatm)时出现代谢速率加快,而且孵出仔鱼个体较小,严重影响其生存率[9]。
2007年HATTORI等[10]发现温度升高会使淡水青鳉(Oryzias latipes)出现基因型XX雄性,并且在外界温度达到34 ℃时,孵化出膜的幼鱼全部表现为雄性个体。大气中CO2浓度的升高,对海洋的影响既包括海水升温,又包括海水酸化。目前,关于温度升高对鱼类性别分化的研究很多[10-11]。pH对隐带丽鱼属(Apistogramma)和柔耙丽鱼属(Pelvicachromis)性别比例的影响也有报道,高pH降低雄性在种群中的比例,在这些研究中是利用磷酸钠、碳酸氢钠和腐殖酸等调节实验水体的pH[12]。而海洋酸化是由于空气中CO2被海洋吸收,改变了海水碳酸盐体系,H+浓度增加,这与以往pH调控方式不同,但是海洋酸化对海洋鱼类性别分化的影响却未见报道。海水青鳉(Oryzia melastigma)个体较小,雌鱼产卵量大且每日产卵,鱼卵颜色透明且不易破损,胚胎发育各阶段变化明显,世代周期短,便于进行各种实验观察和操作,因此已逐渐成为海洋毒理学研究的模式生物[13-14]。并且,青鳉成鱼的第二性征明显,其性别决定系统为XX/XY,性别决定基因为Y染色体上的DMY基因[15]。2010年杨明等[16]成功克隆出青鳉性别决定特异基因——DMY,并将此技术应用到鉴定青鳉个体的遗传性别。因此本文采用海水青鳉作为研究对象,通过形态学第二性征观察、组织学性腺观察和性别决定DMY基因,研究海洋酸化对海洋青鳉受精卵发育过程中性别分化的影响,为进一步研究环境改变导致鱼类性别分化的机制奠定基础。
1 材料与方法 1.1 实验鱼养殖海水青鳉最初从厦门大学引进实验室。实验用海水青鳉是三、四月龄的性成熟成鱼,体长为2.5~3.0 cm。养殖用海水是由曝过气的自来水添加红海盐(红海水族,香港)配制而成的,在海水盐度为31时,pH 8.24±0.02,碱度为6.8~7.2°dKH。实验鱼每日早、中和晚投喂卤虫无节幼体,实验温度为(25±1)℃,光照周期为光:暗=14 h:10 h,每天下午4:00—5:00吸去残饵和粪便,更换1/3新鲜配制的海水。
1.2 实验设计实验共设3组,分别为对照组(当前空气中CO2浓度约为480×10-6),低浓度酸化组(CO2浓度约为1 000×10-6,模拟21世纪末海水中CO2浓度),高浓度酸化组(CO2浓度约为2 000×10-6,模拟2300年海水中CO2浓度),每个实验组设3个平行组。对照组泵入的空气以及处理组泵入不同CO2浓度都是通过CO2加富器(CE-100-5,武汉瑞华)控制。受精卵孵化的设置如下:采用10对性成熟并且产过卵的海水青鳉成鱼,放置于一个25 cm×10 cm×35 cm(长×宽×高)鱼缸中。早上投喂饵料1 h后收集鱼缸中新产出鱼卵,清洗后平均分配到3个孵化网中,每个孵化网中分配70颗,连续收取3 d,重复以上操作。统计数量后1 h内,平均分配到3个实验组的共9个小孵化网中,再将孵化网放入孵化缸中,缸中加入2 L海水用于实验(图 1)。以上操作过程均在青鳉卵产出2 h内完成,经显微镜观察,此时青鳉卵处于5 ~ 6发育阶段。每日记录鱼卵情况,包括相同批次鱼卵的发育情况、出膜日期、出膜数量,每天下午6:00换水,每次换鱼缸中水量的三分之一。实验过程中用pH计(Seven EASY, METTLER TOLEDO)每日测量实验海水pH,用盐度折射计测定实验用水的盐度值,用滴定法测定实验用水的总碱度值。
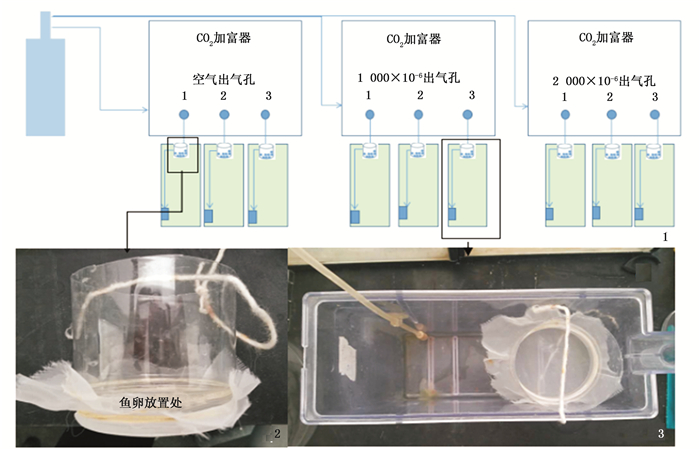
|
图 1 实验设计示意图及装置照片
Fig. 1 Schematic diagram of experimental design and photos of experimental device
1.实验设计示意图; 2.孵化鱼卵的孵化筐照片; 3.单个实验缸的照片 1. Schematic diagram of experimental design; 2. The photo of the hatching basket for the eggs; 3. The photo of a hatching tank |
待鱼卵出膜后用吸管将其从孵化水环境中取出,饲养于与亲鱼相同水环境中(见2.1)直到性成熟,在培养期间水的温度、盐度、碱度等水质指标保持一致。仔鱼饲养至性成熟后,首先,通过第二性征判断雌雄,取性腺所在的躯干部位用于组织切片和HE染色,对性腺组织进行组织学分析。然后,取尾鳍提取DNA,用于分子水平鉴定性别。躯干部和尾鳍取样部位如图 2所示。
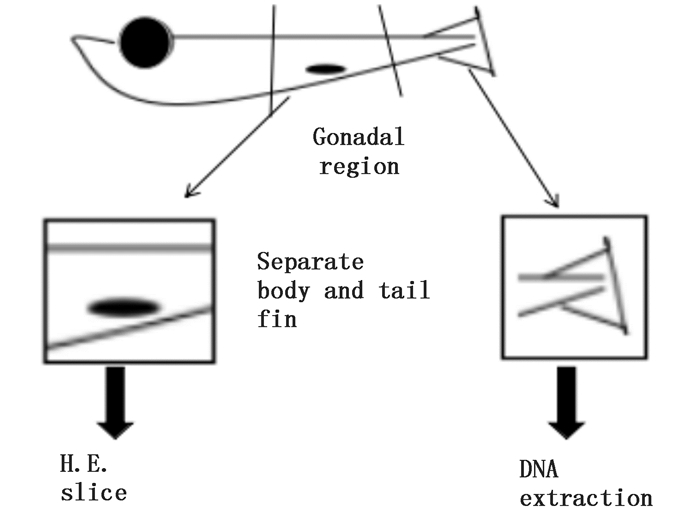
|
图 2 海水青鳉取样部位示意图
Fig. 2 Schematic diagram of sampling areas in the marine medaka
|
实验结束后,取性成熟的实验鱼进行遗传性别鉴定。冰上麻醉青鳉,剪取青鳉尾鳍,移入1.5 mL的EP管中,用解剖剪剪碎,加入100 μL组织裂解液浸没组织,加入20 μL蛋白酶K。55 ℃水浴过夜,期间每隔3 h将组织液颠倒混匀一次。离心,12 000 r/min,20 ℃,5 min,取上清液100 μL。添加提前冷藏过的异丙醇,混匀后,在振动混合机上充分混合。离心,12 000 r/min,4 ℃,5 min,弃上清。加入100 μL 75%的乙醇,混匀后离心12 000 r/min,1 min。弃上清,加100 μL TE或双蒸水后保存备用。
参考MATSUDA等[17]进行引物设计,上下游引物为5′-LCCCACCAGATCCTATACA AGTGAC-3′/5′-LGTAAACACGGGCCGCAGCCGA TGGGC-3′。PCR扩增体系为20 μL,即Tap mix Buffer (2×) 10 μL,上、下游引物各1 μL,MgCl2为1 μL,DNA为1 μL,ddH2O为6 μL。反应程序:96 ℃预变性5 min,96 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃延伸5 min;4 ℃保存。PCR产物用1%的琼脂糖凝胶进行电泳,110 V电压电泳30 min,以1 kb DNA Marker为标尺,凝胶成像系统拍照。青鳉的遗传性别均可以根据电泳结果准确判断,雌性个体中无Y染色体,因此无片段扩增出来,雄性个体中含有Y染色体,可以扩增出700 bp的片段(图 3)。
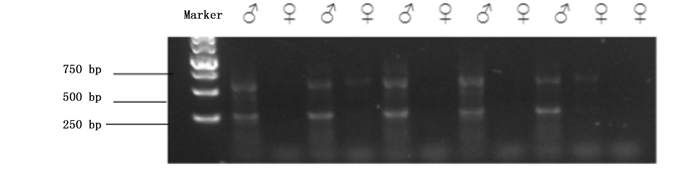
|
图 3 海水青鳉性成熟个体遗传性别鉴定
Fig. 3 Genetic sexual identification of adult marine medaka
|
性腺组织用波恩氏液固定24 h后,保存于70%的乙醇中。组织脱水及HE染色步骤参考HATTORI等[10],并进行修改。基本流程如下:石蜡切片——组织固定——组织脱水——组织透明——组织透蜡——包埋——组织切片——贴片和烤片——切片染色——脱水——透明——封片——观察和拍照。
1.5 数据统计所有数据均采用平均值±标准差表示,使用SPSS 19.0对实验数据进行统计分析。采用单因素方法分析(one-way ANOVA)和Duncan氏多重比较对不同酸化处理组中受精卵的孵化率及不同组的雄雌比例进行差异显著性分析,以P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 实验水体系统水质参数测定结果实验期间,每天对实验水体的常规水质参数进行测量,整个鱼卵孵化过程水环境参数值和仔鱼孵化出膜后至成鱼的实验水体的各种水质参数值见表 1。

|
表 1 整个实验过程中各实验组的水质参数值 Tab.1 Water parameters of different groups during the experiment |
将发育阶段处于5 ~ 6期的受精卵放于不同CO2浓度的酸化组水体中,受精卵经15~25 d孵化出膜。空气对照组的平均孵化率为78%,低浓度酸化处理组的平均孵化率为87%,高浓度酸化处理组的平均孵化率为72%。经统计分析,2个酸化处理组的孵化率和对照组均无显著差异(P>0.05,图 4)。
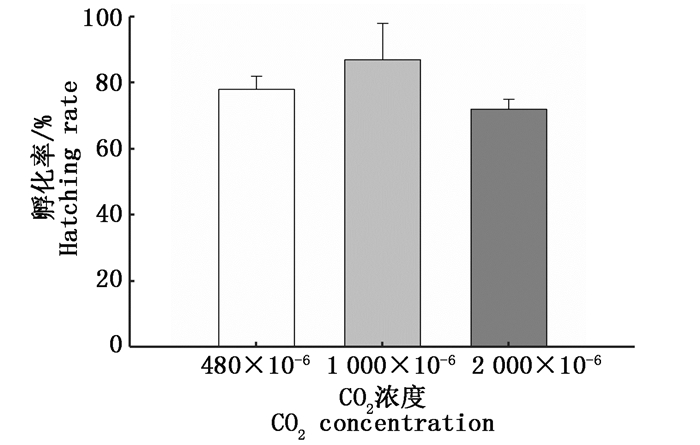
|
图 4 海水酸化对海水青鳉受精卵孵化率的影响
Fig. 4 The effect of ocean acidification on the hatching rate of marine medaka fertilized eggs
|
分别通过形态学、组织学、遗传学的方式,判断海水青鳉的性别。首先,通过观察成鱼臀鳍形态判断雌雄,雄性臀鳍要比雌性大,鳍条也较长。在显微镜下,观察青鳉的泄殖器,青鳉的肛乳头突向外延长形成管状凸起,雌性肛乳头后部外周包裹着一层脂肪层(图版-1),但雄性个体的肛乳头部位没有脂肪层(图版-2)。通过第二性征判断雌雄性别后,再将同一条鱼取其性腺所在的躯干部位用于组织切片,HE染色后进行观察,同时从实验鱼的尾鳍提取DNA,用于基因型的性别判定。雌鱼性腺位于体腔上皮与肠道之间的体腔中,雌鱼性腺中可以观察到双线期卵母细胞和卵巢腔(图版-4),雄鱼性腺切片中观察到精母细胞和精子(图版-5)。经遗传学方法进行性别判断后发现,酸化组的一部分实验鱼基因型为XX,但形态学上,臀鳍鳍条长是雄性的个体,对这些雄鱼的性腺切片发现有精原细胞和精子(图版-3,6),这些个体被称为性逆转雄性[sex-reversed (XX) male]。

|
图版 海水青鳉性别鉴定 Plate1 Sexual identification of marine medaka 1.成年雌鱼;2.成年雄鱼;3.性逆转的成年雄鱼;4.雌鱼性腺组织切片;5.雄鱼性腺组织切片;6.性逆转的雄性性腺切片; cl.泄殖器; af.臀鳍; od.双线期卵母细胞; oc.卵巢腔; sp.精子; sc.精母细胞 1. adult female; 2. adult male; 3. sex-reversed male; 4. female gonadal tissue slices; 5. male gonadal tissue slices; 6. gonadal slice of sex-reversed male; cl. cloacal; af.anal fin; od. diplotene oocyte; oc. ovarian cavity; sp. sperm; sc. spermatocyte |
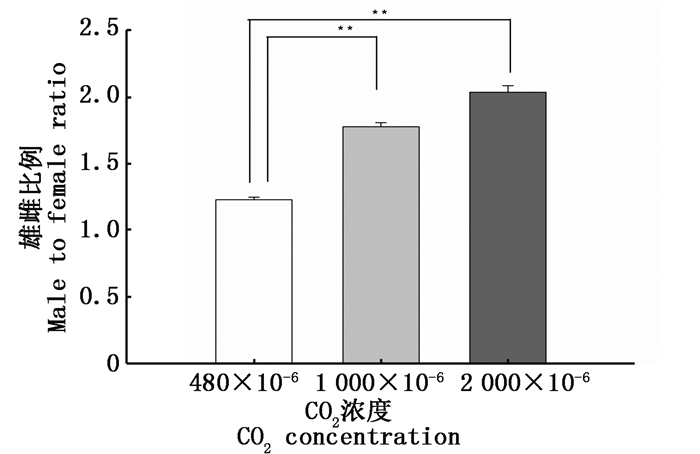
将各个实验组中孵化出膜的仔鱼,放置到正常组的水体中,养殖约3个月,实验鱼发育至性成熟,通过形态学判断每个实验组中雌雄鱼的比例。由图 5可知,对照组中雌雄比例接近1:1。在CO2浓度为1 000×10-6浓度酸化处理组中,雄性个体数增加,雄雌比例升高至雄:雌=1.78:1,在CO2浓度为2 000×10-6浓度酸化处理组中,雄:雌=2.04:1,此时雄性个体数远远多于雌性个体数。经统计分析,2个酸化组与对照组之间均存在极显著差异(P < 0.01,图 5)。
|
图 5 海水酸化对海水青鳉雄雌比例的影响
Fig. 5 The effect of ocean acidification on the male to female ratio in marine medaka
|
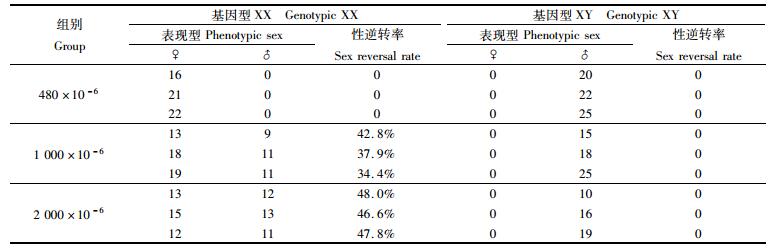
通过形态学、组织学和遗传学对实验组中达到性成熟的青鳉进行性别判断,由表 2可知,在正常条件下生长的青鳉从孵化到性成熟的个体中并未出现基因型和表现型不相同的个体。而在低浓度酸化组中,共出现31尾青鳉基因型和表现型不同。在高浓度酸化组中,出现较多的雄性个体,经验证共计36尾鱼基因型和表现型是不相同的。在CO2浓度为1 000×10-6的实验组中,同一批次受精卵中有较多的雄性个体,其中有基因型为XX的雌鱼会发生性别逆转表现型为雄性的个体,平均性逆转率为38.4%;在CO2浓度为2 000×10-6的实验组中,同一批次受精卵中有更多的雄性个体,平均性逆转率为47.5%。
|
表 2 海水酸化对青鳉性别分化的影响 Tab.2 The effect of ocean acidification on sexual differentiation of marine medaka |
目前,大气中CO2浓度已经上升为480×10-6左右,全球气候变化效应中心预计2100年大气中CO2浓度将上升至1 000×10-6左右,2300年CO2浓度将为2 000×10-6左右[2]。本文主要通过模拟21世纪末和2300年大气中CO2的浓度,研究海洋酸化对海洋青鳉早期发育过程中性别分化的影响,研究发现海水酸化处理受精卵后,显著提高雄雌比例,并且在酸化组中有约40%的实验鱼是基因型XX的雄性个体。
本实验中发现通入1 000×10-6、2 000×10-6的CO2的酸化海水对海洋青鳉受精卵孵化率影响不显著。在以往的研究报道中,800~1 200 μatm pCO2的酸化水体对小丑鱼(Amphiprion percula)[18]、大西洋鲱(Clupea harengus)[19]和狭鳕(Theragra chalcogramma)[20]的胚胎发育过程及仔鱼大小均没有显著影响。但是高CO2浓度酸化海水可能导致鱼类延迟出膜、早期发育迟缓以及出膜仔鱼RNA/DNA降低[8, 19, 21]。
绝大多数鱼类,在正常水体环境中,性别是由基因决定的。然而,有些鱼类,性别分化受到环境因素的影响[22-23]。据统计,温度能够影响7个属54种鱼类的性别分化[24]。淡水青鳉,是XX/XY性别决定系统,DMY基因位于Y染色体上,是主要的性别决定基因。并且,利用性激素处理青鳉仔鱼或者胚胎,可以诱导产生性逆转,XX雄性或者XY雌性[11]。这些研究表明青鳉具有两性发育潜能,并且其遗传性别决定受到环境因素的影响。在大气中人为排放CO2的增加,不仅带来全球气温上升,同时带来海洋酸化。本文研究发现海水酸化处理发育早期的海水青鳉受精卵,也会影响其性腺分化过程,导致雄性个体增多,而这其中包括基因型XX,而表现型为雄性的个体。
性别分化是在神经内分泌系统控制下发生的,外界环境的变化可能影响神经内分泌系统中蛋白质、激素以及其他化学物质的结构和活性,进而影响鱼类的性别分化。在对鲤鱼(Cyprinus carpio)的研究中发现,环境温度变化范围超过5 ℃,其体内雌二醇分泌量的差别达20倍以上[25];高温也能诱使尼罗罗非鱼(Oreochromis niloticus)的芳香酶表达量降低,并且降低雌激素分泌水平[26],用芳香酶抑制剂可以有效地抑制高温诱导而产生的雄性化[27]。目前,已有大量研究表明海洋酸化通过影响鱼类脑部γ-氨基丁酸A(GABAA)受体的功能从而对鱼类的嗅觉、听觉、视觉等感觉和行为造成影响[28]。因此,应继续研究海洋酸化是否通过影响鱼类脑部神经内分泌活动,进而影响其早期发育的性别分化。
SATO等在升高水温对青鳉性别分化影响的研究中发现,处理组的基因型XX的雄性个体经形态学和组织学判断,与正常的基因型XY的雄性没有差别。且XX雄性可以与雌鱼交配,受精卵能够正常发育和孵化出膜,仔鱼正常发育至性成熟的雌鱼[11]。与SATO等实验结果一致,在本研究中,酸化处理组中,经形态学和组织学判断,与正常的基因型XY的雄性没有差别。虽然本研究目前没有继续研究基因型XX雄性的繁殖情况,但如果与升温导致的XX雄性相似,那么在全球升温和海洋酸化的共同作用下,可能会导致海洋鱼类种群中Y染色体的减少。因此,应继续研究海洋酸化和升温双重胁迫对海洋鱼类性别分化的影响。
| [1] | CONWAY T J, TANS P P, WATERMAN L S, et al. Evidence for interannual variability of the carbon cycle from the National Oceanic and Atmospheric Administration/Climate Monitoring and Diagnostics Laboratory Global Air Sampling Network[J]. Journal of Geophysical Research:Atmospheres, 1994, 99(D11): 22831–22855. DOI:10.1029/94JD01951 |
| [2] | HOEGH-GULDBERG O, MUMBY P J, HOOTEN A J, et al. Coral reefs under rapid climate change and ocean acidification[J]. Science, 2007, 318(5857): 1737–1742. DOI:10.1126/science.1152509 |
| [3] | SABINE C L, FEELY R A, GRUBER N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004, 305(5682): 367–371. DOI:10.1126/science.1097403 |
| [4] | CALDEIRA K, WICKETT M E. Oceanography:anthropo-genic carbon and ocean pH[J]. Nature, 2003, 425(6956): 365. DOI:10.1038/425365a |
| [5] | ORR J C, FABRY V J, AUMONT O, et al. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms[J]. Nature, 2005, 437(7059): 681–686. DOI:10.1038/nature04095 |
| [6] | CAI W J, HU X P, HUANG W J, et al. Acidification of subsurface coastal waters enhanced by eutrophication[J]. Nature Geoscience, 2011, 4(11): 766–770. DOI:10.1038/ngeo1297 |
| [7] | PARKER L M, ROSS P M, O'CONNOR W A. The effect of ocean acidification and temperature on the fertilization and embryonic development of the Sydney rock oyster Saccostrea glomerata(Gould 1850)[J]. Global Change Biology, 2009, 15(9): 2123–2136. DOI:10.1111/gcb.2009.15.issue-9 |
| [8] | TSENG Y C, HU M Y, STUMPP M, et al. CO2-driven seawater acidification differentially affects development and molecular plasticity along life history of fish (Oryzias latipes)[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2013, 165(2): 119–130. |
| [9] | CATTANO C, GIOMI F, MILAZZO M. Effects of ocean acidification on embryonic respiration and development of a temperate wrasse living along a natural CO2 gradient[J]. Conservation Physiology, 2016, 4(1): cov073. DOI:10.1093/conphys/cov073 |
| [10] | HATTORI R S, GOULD R J, FUJIOKA T, et al. Temperature-dependent sex determination in Hd-rR medaka Oryzias latipes:gender sensitivity, thermal threshold, critical period, and DMRT1 expression profile[J]. Sexual Development, 2007, 1(2): 138–146. DOI:10.1159/000100035 |
| [11] | SATO T, ENDO T, YAMAHIRA K, et al. Induction of female-to-male sex reversal by high temperature treatment in medaka, Oryzias latipes[J]. Zoological Science, 2005, 22(9): 985–988. DOI:10.2108/zsj.22.985 |
| [12] | SANDRA G E, NORMA M M. Sexual determination and differentiation in teleost fish[J]. Reviews in Fish Biology and Fisheries, 2010, 20(1): 101–121. DOI:10.1007/s11160-009-9123-4 |
| [13] |
陈漪, 王晓杰, 冉皓宇, 等. 海水模式种青鳉鱼(Oryzias melastigma)的胚胎发育观察[J].
海洋与湖沼, 2016, 47(1): 71–82.
CHEN Y, WANG X J, RAN H Y, et al. Developmental stages of a marine model fish-medaka Oryzias melastigma[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 71–82. |
| [14] | KIM B M, KIM J, CHOI I Y, et al. Omics of the marine medaka (Oryzias melastigma) and its relevance to marine environmental research[J]. Marine Environmental Research, 2016, 113: 141–152. DOI:10.1016/j.marenvres.2015.12.004 |
| [15] | NANDA I, KONDO M, HORNUNG U, et al. A duplicated copy of DMRT1 in the sex-determining region of the Y chromosome of the medaka, Oryzias latipes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(18): 11778–11783. DOI:10.1073/pnas.182314699 |
| [16] |
杨明, 王昆鹏, 张玉颖, 等. 青鳉DMY基因的克隆及其在性别鉴定中的应用[J].
上海大学学报(自然科学版), 2010, 16(6): 562–566.
YANG M, WANG K P, ZHANG Y Y, et al. Gene cloning and application of DMY gene for sex identification in Oryzias latipes[J]. Journal of Shanghai University (Natural Science), 2010, 16(6): 562–566. |
| [17] | MATSUDA M, NAGAHAMA Y, SHINOMIYA A, et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J]. Nature, 2002, 417(6888): 559–563. DOI:10.1038/nature751 |
| [18] | MUNDAY P L, DONELSON J M, DIXSON D L, et al. Effects of ocean acidification on the early life history of a tropical marine fish[J]. Proceedings of the Royal Society B, 2009, 276(1671): 3275–3283. DOI:10.1098/rspb.2009.0784 |
| [19] | FRANKE A, CLEMMESEN C. Effect of ocean acidification on early life stages of Atlantic herring (Clupea harengus L.)[J]. Biogeosciences, 2011, 8(12): 3697–3707. DOI:10.5194/bg-8-3697-2011 |
| [20] | HURST T P, FERNANDEZ E R, MATHIS J T. Effects of ocean acidification on hatch size and larval growth of walleye pollock (Theragra chalcogramma)[J]. ICES Journal of Marine Science, 2013, 70(4): 812–822. DOI:10.1093/icesjms/fst053 |
| [21] | FROMMEL A Y, MANEJA R, LOWE D, et al. Severe tissue damage in Atlantic cod larvae under increasing ocean acidification[J]. Nature Climate Change, 2012, 2(1): 42–46. |
| [22] | CRAIG J K, FOOTE C J, WOOD C C. Evidence for temperature-dependent sex determination in sockeye salmon (Oncorhynchus nerka)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1996, 53(1): 141–147. DOI:10.1139/f95-152 |
| [23] | YAMAMOTO E. Studies on sex-manipulation and production of cloned populations in hirame, Paralichthys olivaceus (Temminck et Schlegel)[J]. Aquaculture, 1999, 173(1/4): 235–246. |
| [24] | CONOVER D. TSD in fishes[M]//VALENZUELA N, LANCE V A. Temperature-dependent sex determination in vertebrates[M]. Washington: Smithsonian Books, 2004: 11-20. |
| [25] | MANNING N J, KIME D E. Temperature regulation of ovarian steroid production in the common carp, Cyprinus carpio L., in vivo and in vitro[J]. General and Comparative Endocrinology, 1984, 56(3): 376–388. DOI:10.1016/0016-6480(84)90080-7 |
| [26] | KWON J Y, HAGHPANAH V, KOGSON-HURTADO L M, et al. Masculinization of genetic female Nile tilapia (Oreochromis niloticus) by dietary administration of an aromatase inhibitor during sexual differentiation[J]. The Journal of Experimental Zoology, 2000, 287(1): 46–53. DOI:10.1002/(ISSN)1097-010X |
| [27] | D'COTTA H, FOSTIER A, GUIGUEN Y, et al. Aromatase plays a key role during normal and temperature-induced sex differentiation of tilapia Oreochromis niloticus[J]. Molecular Reproduction & Development, 2001, 59(3): 265–276. |
| [28] |
王晓杰, 宋佳坤, 范纯新, 等. 海洋酸化对鱼类感觉和行为影响的研究进展[J].
生态毒理学报, 2015, 10(6): 13–20.
WANG X J, SONG J K, FAN C X, et al. Impacts of ocean acidification on sensory system and behavior in marine fish[J]. Asian Journal of Ecotoxicology, 2015, 10(6): 13–20. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. International Research Center for Marine Biosciences at Shanghai Ocean University, Ministry of Science and Technology, Shanghai 201306, China;
4. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


