2. 上海海洋大学 水产与生命学院, 上海 201306
机体受病原刺激后,将启动免疫应答防御病原入侵,减轻病原对机体的损伤,免疫应答的激活、维持及效应机制均离不开各类免疫相关功能基因的表达及调控[1]。一般情况下,免疫基因在机体中的表达处于较低水平,当病原刺激时免疫基因的表达将发生显著变化,CyHV-3病毒入侵显著上调鲤白细胞介素IL-1β基因的表达[2],Ⅰ型干扰素(Ⅰ-IFN)通过诱导GIG-1蛋白、泛素样蛋白(ISG15) 的表达,在脾脏中发挥抑制病毒复制的作用[3]。髓样细胞分化蛋白(MyD88)、白细胞介素(IL-1β)、肿瘤坏死因子受体相关因子6(TRAF-6)、TLR-7等被证明可能与CyHV-3的病毒免疫有关[4-5]。研究发现,免疫基因的表达能从分子水平更直观地反映机体在病原入侵时的免疫应答水平,免疫基因表达水平越高,机体启动的免疫应答水平越高,对病原的抑制能力越强,说明机体抗病能力越强[6],例如中国明对虾(Fenneropenaeus chinensis)的TLR基因表达被抑制时抗病毒能力有所下降[7]。目前,从免疫基因表达水平研究水产动物抗病能力的报道较多[8-9],因此,从免疫基因表达水平对抗病选育世代进行抗病能力评估具有一定可行性。
锦鲤疱疹病毒病(Kio herpesvirus disease,KHVD)由鲤疱疹病毒3型(Cyprinid herpesvirus 3,CyHV-3) 引起[10],锦鲤[11]、镜鲤[12]等鲤及其变种对其易感。该病已经在全球大部分地区发现并导致巨大经济损失,锦鲤及其他鲤产品全球性贸易流动是该病广泛爆发的重要原因之一。2002年,我国首次在进口的锦鲤中检出该病,至今已在东北[13]、海南[14]等地区发现。研究发现,鲤感染CyHV-3后在全身多个器官组织中均能检测到该病毒,但主要是在鳃、脾、肾组织中[15]。而脾、肾组织是鲤重要的免疫器官,因此本实验主要研究了脾、肾组织中CyHV-3病毒载量及免疫基因表达情况,以期更准确有效地反映鲤的抗病毒免疫水平。
近几年,在北方地区镜鲤(Cyprinus carpio L. mirror)养殖中由于爆发锦鲤疱疹病毒病导致大规模死亡,损失严重。研究发现镜鲤感染该病的死亡个体和成活个体在基因水平及遗传物质上存在差异[12],为此黑龙江水产所通过筛选抗病毒相关分子标记的辅助育种手段,开展了镜鲤抗疱疹病毒(CyHV-3) 新品种的选育工作,目前已经选育到F3,且选育世代间抗病成活率存在显著差异。本研究拟在免疫基因表达水平及病毒载量两个方面结合抗病成活率结果综合全面评估3个选育世代的抗病能力,从而科学指导下一代选育,并丰富鱼类抗性育种理论。
1 材料与方法 1.1 实验鱼实验鱼为黑龙江水产所通过筛选抗病毒相关分子标记的辅助育种手段选育的镜鲤抗疱疹病毒(CyHV-3) 选育世代F1、F2、F3。2016年度抗病选育世代F1、F2、F3的抗病成活率分别为61.1%、88.6%、92.5%(养殖密度为60尾/m3,于发病后统计)。
1.2 实验设计攻毒实验方法借鉴了ØDEGÅRD等[16]将健康鱼与患病鱼混养方式进行攻毒试验的方法。辽宁丹东某镜鲤养殖场中锦鲤疱疹病毒病存在连续多年固定爆发的情况,因此选择该养殖场进行本次研究。采集夏花规格的F1、F2、F3为夏花组,检测夏花组是否感染CyHV-3。并在该养殖场暴发锦鲤疱疹病毒病时采集F1、F2、F3为感染组,比较F1、F2、F3间免疫基因表达及CyHV-3病毒载量情况。
1.3 实验样品采集夏花组采样:分别采集F1、F2、F3的全鱼样本,规格:2~3 cm左右,每个选育世代均随机采集3尾,且每个选育世代设两组平行,受夏花鱼规格限制无法区分脾和肾,因此仅在夏花鱼同一部位采集样品用于总RNA和基因组DNA提取。
感染组采样:分别采集无发病症状的F1、F2、F3,规格:8~12 cm,每个选育世代均随机采集3尾,且每个选育世代设两组平行,每尾分别采集脾和肾。所有样本均液氮保存后转移至实验室-80 ℃超低温冰箱中保存备用。
1.4 实验方法 1.4.1 夏花组感染CyHV-3检测利用MagPureTissue DNA KF Kit提取基因组DNA,用OIE推荐的TK引物和sph引物[17]检测夏花组是否感染CyHV-3。PCR体系20μL:DNA模板1 μL,2×Es Taq Master Mix酶10 μL,上、下游引物各0.5 μL,最终体积由灭菌超纯水补足,PCR程序:预变性95 ℃ 5 min;94 ℃变性30 s,56 ℃/63 ℃退火30 s,72 ℃延伸30 s,30~35个循环;72 ℃后延伸5 min,4 ℃终止反应。PCR扩增产物经1%琼脂糖凝胶电泳检测。
1.4.2 CyHV-3病毒载量及免疫基因表达将F1设为对照组,CyHV-3的衣壳蛋白ORF72(Capsid triplex protein ORF72)[18]、胸腺嘧啶核苷激酶TK(Thymidine kinase)[19]和免疫基因[20]TLR7a、TRAF6、MyD88a、IL-1β及Ⅰ-IFN为目的基因,比较3个选育世代的CyHV-3病毒载量及免疫基因表达情况。
1.4.3 实时荧光定量PCR所有引物均由生工生物工程(上海)有限公司提供,引物信息见表 1,实时荧光定量PCR反应体系为25 μL,2×UItra SYBR Mixture(high ROX) 12.5 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L) 0.5 μL,基因组DNA 1 μL/cDNA 0.5 μL,ddH2O补足25 μL。上机程序(1) 循环数1,预变性,95 ℃ 1 min;(2) 循环数40,变性:95 ℃ 30 s,退火:58~60 ℃ 1 min,溶解曲线:95 ℃ 1 min,55 ℃ 30 s,95 ℃ 1 min。所有样本均进行了3次重复,每个样品的Ct值为3次重复的均值,病毒载量研究中以ddH2O为空白对照,去除假阳性可能。
|
表 1 荧光定量PCR引物 Tab.1 Primers used in quantitative real-time PCR |
使用2-ΔΔCt法[21]处理荧光定量实验数据计算出相对表达量。使用SPSS 17.0软件单因子方差分析(one-way ANOVA)进行显著性差异分析,P < 0.05为存在显著性差异。Excel 2010作图。
2 结果与分析 2.1 基因组DNA、总RNA提取、cDNA合成微量分光光度计检测提取总RNA的A260/A280在1.8~2.0之间,组织DNA的A260/A280约为1.8。提取总RNA、组织DNA及反转的cDNA经琼脂糖凝胶电泳检测结果见图 1。符合进行实时荧光定量PCR、常规PCR的条件。
|
图 1 RNA、cDNA及DNA琼脂糖凝胶电泳检测结果
Fig. 1 Agarose gel electrophoresis detection result of RNA, cDNA and DNA
|
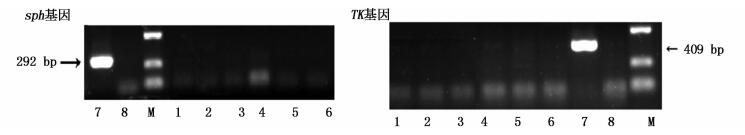
本研究夏花组F1、F2、F3利用TK基因和sph基因进行常规PCR检查,在1%琼脂糖凝胶电泳结果显示:阳性模板均出现目的条带,空白对照及夏花组F1、F2、F3均无目的条带,这一结果说明夏花组F1、F2、F3未感染CyHV-3(图 2)。
|
图 2 夏花组CyHV-3检测结果
Fig. 2 CyHV-3 test results of summerlings groups
1、2为F1样品;3、4为F2样品;5、6为F3样品;7为阳性对照;8为空白对照 1 and 2 : the F1 samples; 3 and 4: the F2 samples; 5 and 6 : the F3 samples; 7: the positive; 8:the negative control |
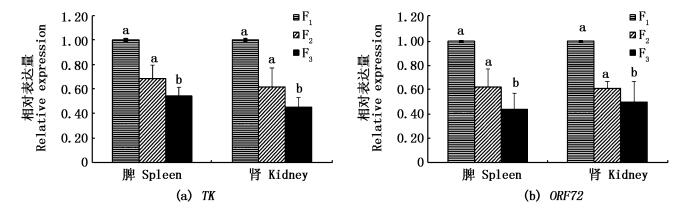
如图 3所示,TK和ORF72基因扩增结果一致,表明本实验通过实时荧光定量PCR对F1、F2、F3中CyHV-3病毒载量进行相对定量的研究方法具有可行性。CyHV-3病毒载量在3个选育世代中呈下降趋势,在脾、肾组织变化趋势一致,F3脾、肾中CyHV-3病毒载量显著低于F1、F2(P < 0.05),F2脾、肾的CyHV-3病毒载量高于F1但二者间无显著性差异(P>0.05),说明3个选育世代抑制CyHV-3增殖能力逐代增强。
|
图 3 F1、F2、F3中CyHV-3病毒增殖情况
Fig. 3 CyHV-3 virus proliferation in the three breeding generations F1, F2, F3
标记字母不同表示组内存在显著性差异(P < 0.05),图 4, 5同此 Different letters indicate the presence of significant difference within the two groups(P < 0.05), the same in fig. 4-5 |
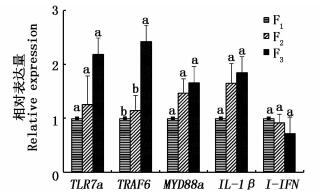
|
图 4 夏花组F1、F2、F3中免疫基因的表达
Fig. 4 Expression of immune genes in Summerlings F1, F2, F3
|
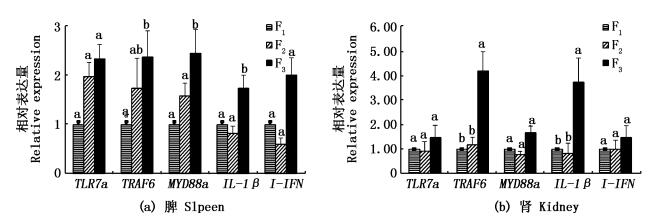
|
图 5 感染组F1、F2、F3中免疫基因在脾、肾中的表达
Fig. 5 The expression of immune genes in spleen and kidney of the infection groups F1, F2, F3
|
如图 4所示,在夏花组F1、F2、F3中,Ⅰ-IFN的相对表达量呈现下降趋势,TRAF6、TLR7a、MyD88a及IL-1β的相对表达量呈现上升趋势,仅TRAF6基因在F3的表达显著高于F1、F2(P < 0.05),其余均差异不显著(P>0.05),结果说明在选育世代间,除TRAF6基因表达较高外,其他基因未受选育影响。
2.5 感染组F1、F2、F3中免疫基因的表达如图 5所示,在脾中,F3的TLR7a、TRAF6、MyD88a、IL-1β及Ⅰ-IFN的相对表达量均最高,其中,TRAF6基因在F3的表达显著高于F1 (P < 0.05),MyD88a、IL-1β基因在F3的表达显著高于F1和F2(P < 0.05),在F2中,TLR7a、TRAF6、MyD88a基因的相对表达量高于F1,IL-1β及Ⅰ-IFN基因的相对表达量低于F1,但F2与F1间免疫基因表达均差异不显著(P>0.05)。在肾中,F3的TLR7a、TRAF6、MyD88a、IL-1β及Ⅰ-IFN的相对表达量均为最高值,其中,TRAF6、IL-1β基因在F3中的表达显著高于在F1、F2 (P < 0.05) 中,TLR7a、MyD88a、IL-1β在F2中的相对表达量低于F1,TRAF6、Ⅰ-IFN在F2中的相对表达量高于F1,但F2与F1之间差异均不显著(P>0.05)。以上结果说明感染组F3与F1、F2间免疫基因表达水平存在显著差异,F2与F1间无显著差异,其中F2的免疫基因表达水平与其表现出的抗病成活率水平不一致,但与CyHV-3病毒载量研究结果一致。
3 讨论 3.1 夏花组CyHV-3检测目前,通过常规PCR检测CyHV-3时,PCR产物一般通过1%琼脂糖凝胶电泳方法检测,本研究利用OIE推荐检测引物TK和sph引物进行常规PCR检测,结果显示:待检样品在1%琼脂糖凝胶电泳中未出现目的条带,说明本研究中夏花组F1、F2、F3均未感染CyHV-3。
3.2 免疫基因差异表达研究发现,CyHV-3与细菌[22]均能上调IL-1β基因的表达,感染CyHV-3的鱼对由真菌、细菌、寄生虫等引发疾病更易感,从而导致该病更高的死亡率。IL-1β基因表达量的增加能增强鱼类抗病能力[23]。本研究中,IL-1β基因在夏花组和感染组的F3中高表达,说明F3抗病毒、病菌及抗感染的能力强于F1、F2,这可能是F3具有显著高成活率的重要原因之一。
Toll样受体(Toll-like receptor, TLR)能直接与MyD88配体结合,并结合IL-1受体相关激酶(IRAKs)向下激活下游接头分子TRAF6,而TRAF6可以激活下游因子IKKs从而分别诱导NF-κB、IRF7和其他炎性因子的表达[24-25]。本研究感染组中TRAF6、MyD88a及IL-1β基因的表达量在具有高成活率的F3中显著高表达,由以上推测,镜鲤可能通过上述TLRs信号通路诱导IL-1β基因的表达。TRAF6、MyD88作为TLRs信号通路的关键因子,在F3中的显著高表达情况推测可能是因为在CyHV-3感染后,机体启动多种TRAF6、MyD88参与的TLRs信号通路发挥抗病毒作用,但这一推测还有待进一步研究。
3.3 抗病力评估随抗病成活率的增加,在感染组F1、F2、F3中,CyHV-3病毒载量呈下降趋势,F3显著高于F1、F2 (P < 0.05),而F2高于F1但二者间无显著性差异(P>0.05),机体抑制病毒增殖能力能反映其抗病毒能力,推断F3抗病能力显著高于F1、F2。
不同选育世代间免疫基因的显著差异表达可以反映选育评估效果。夏花组未感染CyHV-3,3个选育世代中仅TRAF6基因在F3的表达量显著高于F1、F2(P < 0.05),说明在选育世代间,除TRAF6基因表达较高外,其他基因未受选育影响。在感染组的脾中,F3的IL-1β、MyD88a基因表达显著高于F1、F2(P < 0.05)、TRAF6基因表达显著高于F1 (P < 0.05),而肾中F3的IL-1β、TRAF6基因表达显著高于F1、F2(P < 0.05),从3个选育世代免疫基因表达的显著性差异来看,F1与F2间均差异不显著,而F3与F1、F2均存在显著差异表达的基因,由此说明F3抗病能力显著高于F1、F2,而F2的抗病力与F1无显著差异。
病毒载量及免疫基因表达的结果均表明F3抗病能力显著高于F1、F2,F3的成活率也显著高于F1,由此推断,F3的抗病力高且趋于稳定。F2的成活率显著高于F1,F2抑制CyHV-3能力高于F1,但免疫基因表达水平无显著差异,推测F2的抗病力还不稳定。总之,通过病毒载量、免疫基因表达及抗病成活率3个方面综合评估抗病选育世代的抗病力比单纯由抗病成活率情况反映的评估结果更完善更准确,也说明本研究的评估方法是进行鱼类抗病毒新品种选育世代评估的行之有效的方法。
| [1] | SECOMBES C J, HARDIE L J, DANIELS G. Cytokines in fish:an update[J]. Fish & Shellfish Immunology, 1996, 6(4): 291–304. |
| [2] | ADANEK M, STEINHAGEN D, IRNAZAROW I, et al. Biology and host response to Cyprinid herpesvirus 3 infection in common carp[J]. Developmental & Comparative Immunology, 2014, 43(2): 151–159. |
| [3] | RAKUS K Ł, IRNAZAROW I, ADAMEK M, et al. Gene expression analysis of common carp (Cyprinus carpio L.) lines during Cyprinid herpesvirus 3 infection yields insights into differential immune responses[J]. Developmental & Comparative Immunology, 2012, 37(1): 65–76. |
| [4] | KONGCHUM P, PALTI Y, HALLERMAN E M, et al. SNP discovery and development of genetic markers for mapping innate immune response genes in common carp (Cyprinus carpio)[J]. Fish & Shellfish Immunology, 2010, 29(2): 356–361. |
| [5] | KONGCHUM P, HALLERMAN E M, HULATA G, et al. Molecular cloning, characterization and expression analysis of TLR9, MyD88 and TRAF6 genes in common carp (Cyprinus carpio)[J]. Fish & Shellfish Immunology, 2011, 30(1): 361–371. |
| [6] |
杨华, 杨永林. 基于主成分分析法建立绵羊一般抗病力的评估模型[J].
中国草食动物科学, 2015, 35(3): 1–5.
YANG H, YANG Y L. Assessment model of general disease resistance with principal component analysis in sheeps[J]. China Herbivore Science, 2015, 35(3): 1–5. |
| [7] |
梁忠秀, 李健, 谭志军, 等. 塔玛亚历山大藻对中国明对虾肝胰腺和鳃SOD、GST和MDA的影响[J].
水产学报, 2013, 37(8): 1192–1197.
LIANG Z X, LI J, TAN Z J, et al. Effects of the toxic dinoflagellate Alexandrium tamarense on MDA, SOD and GST in hepatopancreas and gill of Fenneropenaeus chinensis[J]. Journal of Fisheries of China, 2013, 37(8): 1192–1197. |
| [8] | SHIN G W, WHITE S L, DAHMS H U, et al. Disease resistance and immune-relevant gene expression in golden mandarin fish, Siniperca scherzeri Steindachner, infected with infectious spleen and kidney necrosis virus-like agent[J]. Journal of Fish Diseases, 2014, 37(12): 1041–1054. DOI:10.1111/jfd.2014.37.issue-12 |
| [9] | AHMADI P Y, FARAHMAND H, MIANDARE H K, et al. The effects of dietary Immunogen® on innate immune response, immune related genes expression and disease resistance of rainbow trout (Oncorhynchus mykiss)[J]. Fish & Shellfish Immunology, 2014, 37(2): 209–214. |
| [10] |
李俊超, 马杰, 曾令兵, 等. 抗锦鲤疱疹病毒的植物药物筛选及其效果比较[J].
淡水渔业, 2014, 44(3): 62–67.
LI J C, MA J, ZENG L B, et al. Studies on the screening and efficacy evaluation of herbal drugs in inhibiting Koi herpesvirus replication in vitro[J]. Freshwater Fisheries, 2014, 44(3): 62–67. |
| [11] |
袁海延, 于慧, 王好, 等. 锦鲤疱疹病毒病的研究进展[J].
中国兽药杂志, 2015, 49(5): 62–65.
YUAN H Y, YU H, WANG H, et al. Research progress of koi herpesvirus disease[J]. Chinese Journal of Veterinary Drug, 2015, 49(5): 62–65. |
| [12] |
贾智英, 池喜峰, 李池陶, 等. 德国镜鲤养殖群体中抗病与死亡个体遗传结构比较研究[J].
上海海洋大学学报, 2010, 19(1): 7–11.
JIA Z Y, CHI X F, LI C T, et al. Analysis of genetic structure between the death and survival individuals of German mirror carp in cultivated stocks[J]. Journal of Shanghai Ocean University, 2010, 19(1): 7–11. |
| [13] |
朱霞, 李新伟, 王好, 等. 一株锦鲤疱疹病毒的分离与鉴定[J].
中国预防兽医学报, 2011, 33(5): 340–343.
ZHU X, LI X W, WANG H, et al. Isolation and identification of Koi herpesvirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2011, 33(5): 340–343. |
| [14] |
周永灿, 袁军法, 任武泽, 等. 锦鲤疱疹病毒的检测与人工感染试验[J].
武汉大学学报(理学版), 2005, 51(s2): 249–252.
ZHOU Y C, YUAN J F, REN W Z, et al. Detection and experimental infection of Koi herpesvirus[J]. Journal of Wuhan University (Natural Science Edition), 2005, 51(s2): 249–252. |
| [15] |
包卫空, 沈锦玉. 锦鲤疱疹病毒的鉴定及预防[J].
水产养殖, 2015, 36(4): 45–48.
BAO W K, SHEN J Y. Identification and prevention of Koi herpes virus disease[J]. Journal of Aquaculture, 2015, 36(4): 45–48. |
| [16] | ØDEGÅRD J, OLESEN I, DIXON P, et al. Genetic analysis of common carp (Cyprinus carpio) strains. Ⅱ:Resistance to koi herpesvirus and Aeromonas hydrophila and their relationship with pond surviva[J]. Aquaculture, 2010, 304(1/4): 7–13. |
| [17] |
张圆圆, 王先科, 贾滔. 锦鲤疱疹病毒(KHV)的检测技术概述[J].
河南水产, 2016: 1–6.
ZHANG Y Y, WANG X K, JIA T. Overview of detection methods of koi herpesvirus (KHV)[J]. Henan Shuichan, 2016: 1–6. |
| [18] | ADAMEK M, SYAKURI H, HARRIS S, et al. Cyprinid herpesvirus 3 infection disrupts the skin barrier of common carp (Cyprinus carpio L.)[J]. Veterinary Microbiology, 2013, 162(2/4): 456–470. |
| [19] |
张艳, 孟庆峰, 钱爱东, 等. 锦鲤疱疹病毒荧光定量PCR检测方法的建立[J].
吉林畜牧兽医, 2010, 31(4): 11–14.
ZHANG Y, MENG Q F, QIAN A D, et al. Establishment of a flurogenic quantitative polymerase chain reaction assay for detection of Koi hepesvirus[J]. Jilin Animal Husbandry and Veterinary Medicine, 2010, 31(4): 11–14. |
| [20] |
葛会争. 德国镜鲤与黑龙江野鲤杂交组合的亲子鉴定及鲤鱼免疫功能基因SNP位点研究[D]. 上海: 上海海洋大学, 2012.
GE H Z. Parentage identification of Heilongjiang wild carp and the German mirror carp cross combinations on microsatellite DNA markers and carp immune function gene SNP research[D]. Shanghai:Shanghai Ocean University, 2012. |
| [21] | LIVAL K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and themethod[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [22] | XU Q Q, XU P, ZHOU J W, et al. Cloning and expression analysis of two pro-inflammatory cytokines, IL-1β and its receptor, IL-1R2, in the Asian swamp eel Monopterus albus[J]. Molecular Biology, 2016, 50(5): 671–683. DOI:10.1134/S0026893316030122 |
| [23] |
刘佳佳, 吴志新, 石焱, 等. 甘露寡糖对草鱼感染嗜水气单胞菌后细胞因子表达的调节[J].
淡水渔业, 2013, 43(5): 31–36.
LIU J J, WU Z X, SHI Y, et al. Regulation of MOS on cytokines gene expression in grass carp infected with Aeromonas hydrophila[J]. Freshwater Fisheries, 2013, 43(5): 31–36. |
| [24] | VEKSLER-LUBLINSKY I, SHEMER-AVNI Y, MEIRI E, et al. Finding quasi-modules of human and viral miRNAs:a case study of human cytomegalovirus (HCMV)[J]. BMC Bioinformatics, 2012, 13: 322. DOI:10.1186/1471-2105-13-322 |
| [25] | JENKINS K A, MANSELL A. TIR-containing adaptors in Toll-like receptor signalling[J]. Cytokine, 2010, 49(3): 237–244. DOI:10.1016/j.cyto.2009.01.009 |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


