2. 镇江天和生物技术公司, 江苏 镇江 212200;
3. 中国科学院植物研究所, 北京 100093
蓝藻是新兴的基因工程宿主,在很多方面具有优势:(1)光能转化效率高;(2)具有多种代谢途径,有能力合成丰富的化合物,避免了高成本的有机化合物原料给工业生产带来的经济问题;(3)适应能力强,分布广泛;(4)作为原核生物,蓝藻结构简单,基因操作技术成熟,已表达了几十个外源基因。通常在实验室条件下转基因藻的纯化比较容易实现,藻种污染的机会较少,因此并不注重转基因藻种纯化的问题。
转基因蓝藻正作为一个良好的平台来开发成针对虾白斑综合征病毒(WSSV)的口服剂。规模化生产转基因蓝藻由于涉及人员多,生产环节复杂,往往也增加了藻种受杂藻污染的机会。藻种不纯往往会造成不利影响, 如:(1)受到杂藻的稀释,目的产物含量降低将严重影响产品的质量和数量;(2)不纯的藻液杂质、杂藻影响产品的加工,使工艺更复杂繁琐;(3)含杂菌、杂藻的产品降低药效还会产生毒副作用。然而迄今为止尚未见转基因藻种纯化的研究报道。
转基因藻种在形态上难以与野生藻区分,在生理生化上又难以和含转空载体的品系区分,所以需要从生理、生化和分子3个层面来分离3种亚品系。过去报道的研究通常是从混杂的物种中分离出野生的藻种[1-2],尚未见从相同形态的藻类群体中分离出转基因藻和野生藻种的报道,也未见有转基因品系和转空载体品系及纯化的报道。
本研究中,以转WSSV病毒vp-28基因鱼腥藻7120(Anabaena sp. PCC 7120)为例,探讨转基因蓝藻纯化的方法。传统的划板/涂布法用于获得单藻落,荧光定量PCR、电泳、Western Blot等分子生物学技术用于鉴定转基因藻和野生藻,鉴定后对各亚品系藻株培养以供实验生产。本研究的纯化方法为转基因产品生产提供了一个可行的参考标准,作为生产中各种质量体系建立的依据,同时也是对现阶段转基因产品生产流程的补充。
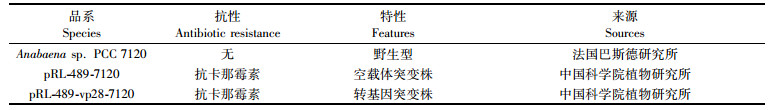
1 材料与方法 1.1 藻种和培养基本研究中所涉及的所有藻株均由表 1所列来源提供。
|
表 1 蓝藻品系特性及其来源 Tab.1 Species, features and sources of test subjects |
液体培养[3-4]:三角瓶(250 mL)培养,液体体积约150 mL,接种后吸光度OD750约为0.1。
固体培养[3-4]:培养基浇灌厚度在培养皿的三分之二最佳,冷却后划线或用移液枪吸取藻液200 μL涂布。
培养条件[3-4]: (30±1)℃、24 h连续光照[100 μmol/(m2·s)], 液体摇床培养(振荡频率140 r/min),固体培养基倒置培养。
液体培养基:选用不含有硝酸钠的BG-11[简称BG-11(-N)]培养液[2]。
固体培养基:在BG-11(-N)培养液中加入1.5%琼脂培养基灭菌后使用。
1.3 筛选方法培养中对于杂菌杂藻以及野生型藻种的筛选主要依靠抗生素筛选和平板划线分离法。其中抗生素筛选分为平板筛选和液体筛选,用不同浓度梯度的培养液和平板来筛选藻种,得出转基因藻的最适生长浓度。平板划线分离法主要操作为:在筛选出的培养基中加入1.5%的琼脂,制成固体培养基,倒平板。将接种环置于酒精灯火焰消毒并冷却后沾取藻细胞,在平板上划线,(30± 1) ℃、24 h连续光照[100 μmol/(m2·s)]倒置培养[4-5],待10 d左右长出藻群落后挑取藻体继续划线,培养。
1.4 植板率定义植板率的定义是:每个平板接种细胞总数中形成细胞团的百分率[6]。计算植板率的方法是:
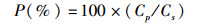 (1)
(1)
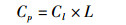 (2)
(2)
式中:P(%)为植板率;CP为每平板形成的细胞团数;Cs为每平板接种的细胞总数;Cl为每毫升培养液中的细胞数目;L为该平板细胞培养液的毫升数。
1.5 分子生物学筛选进一步分离纯化过程中主要运用到以下几种分子生物学方法:质粒的提取,常规PCR检测,RT-qPCR检测,Western Blot以及核酸电泳等。
文中对蓝藻质粒的提取主要参考童艳等[7]的方法通过浓缩十倍的藻细胞液来提取蓝藻质粒。过程中需要注意提取时藻种的生长状态,在对数生长期提取质粒最佳。文中涉及到的常规PCR检测主要是在提取蓝藻总DNA或者提取质粒后,用vp-28基因作为引物扩增目的基因并电泳对比条带。引物序列为上游P1:5′GGGGTACCCCAGAGCGTCATGGATCTTTCTTT 3′;下游P2:5′CCCTCGAGGGACGATTTATTTACTCGGTCTC 3′。
RT-qPCR检测方法中取对数生长期的藻细胞液(OD750=0.5)。使用总RNA提取试剂盒(天根生化科技培养细胞/细菌总RNA提取试剂盒DP430)提取样品的总RNA,并使用反转录试剂盒将提取后的总RNA反转录成cDNA,得到的cDNA样品即可作为RT-qPCR方法定量检测蓝藻中vp-28基因的模板[8]。RT-qPCR实验完成后,需要对RT-qPCR实验的产物进行电泳条带检测,来确定目的基因是否正常扩增。
Western Blot检测蛋白的操作中注意取样的细胞须处于对数生长后期,其藻细胞液浓度OD750应大于等于0.5, 多次冻融后离心去上清液。冻融后先用Bradford方法检测每个样品的总蛋白浓度,根据每个样品的总蛋白浓度计算每个泳道的上样量以保证每个泳道的蛋白总含量为10 μg,蛋白质电泳后转膜,封闭[8]。保证封闭时间后孵育单克隆抗体。
1.6 藻种保存方法藻种纯化后需要选择适当的保存方式来保证藻种的正常使用。本研究主要涉及到以下几种保存方式,(1)液体保藏:常规BG-11培养液保存,可保存2~4周,需要定期更换培养液。(2)固体保藏:通过平板划线或者涂布的方法将藻种保存在BG-11固体培养基上,可保存3~6个月左右,活化后可以继续使用。(3)甘油保藏:纯化的藻种与保种甘油按照一定比例混合后贮存于-80 ℃中,可保存一年以上,活化后可继续使用[9]。
2 结果 2.1 培养液筛选选用BG-11(-N)和含氮培养基[简称BG-11(+N)]培养液[2]是本纯化法的第一步。在该培养液中鱼腥藻细胞可分化出固定空气中氮的异形胞而绝大部分杂菌和杂藻无法生长;如果杂菌、杂藻污染较严重可先用液体培养液反复冲洗藻液数次后静止半小时左右,再去除含有单细胞杂藻、杂菌的上清液。
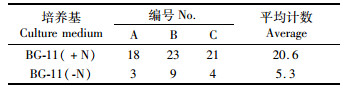
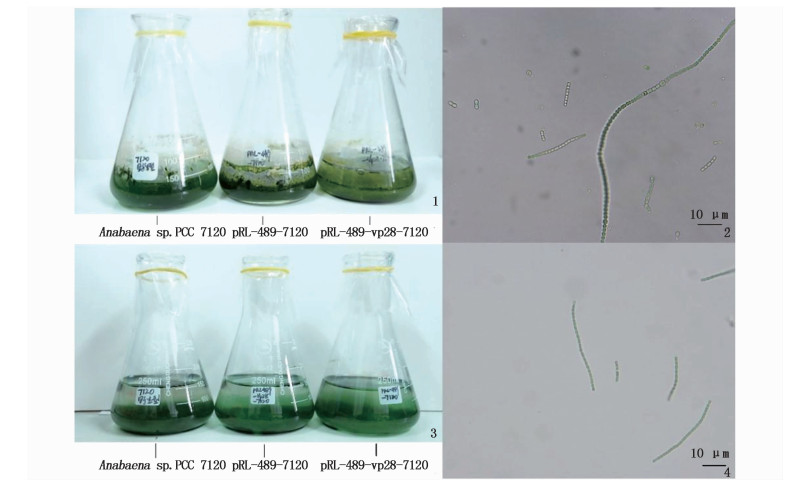
根据表 2, BG-11(-N)培养基中杂藻的显微计数比BG-11(+N)少74.3%,另根据显微境观察不含氮源的BG-11(-N)培养基中生长的鱼腥藻异形胞更明显,且每条丝状体上含有不止一个异形胞。由于氮源的耗尽等原因,在含有氮源的BG-11(+N)培养基中也发现含有异形胞的鱼腥藻丝状体。图版Ⅰ的对比更明显直观得表现出了不含氮源培养的优势,图版中含有氮源的培养液在培养至20 d后含有更多的杂藻(另存在很多单细胞藻类以及杂菌在培养瓶贴壁)。
|
表 2 鱼腥藻7120在两种BG-11培养基培养20 d后杂藻的计数 Tab.2 Counts of other algae than Anabaena sp. PCC 7120 in BG-11(-N) and BG-11(+N) |
|
图版 Ⅰ 鱼腥藻7120各品系在两种BG-11培养液培养20 d的培养瓶及光学显微镜400倍图片 Plate Ⅰ Pictures of Anabaena sp.pcc 7120, pRL-489-7120 and pRL-489-vp28-7120 cultured 20 days in GB-11 and micrograph zoomed in 400 times 1.鱼腥藻7120各品系在BG-11(+N)培养液中培养20 d培养瓶照片;2.鱼腥藻7120在BG-11(+N)培养液中培养20 d光学显微镜400倍下图片;3.鱼腥藻7120各品系在BG-11(-N)培养液中培养20 d培养瓶照片;4.鱼腥藻7120在BG-11(-N)培养液中培养20 d光学显微镜400倍下图片 1. Picture of Anabaena sp.7120, pRL-489-7120 and pRL-489-vp28-7120 cultured 20 days in GB-11(+N); 2. Picture of Anabaena sp.pcc 7120 cultured 20 days in GB-11(+N)zoomed in 400 times; 3. Picture of Anabaena sp.7120, pRL-489-7120 and pRL-489-vp28-7120 cultured 20 days in GB-11(-N); 4. Picture of Anabaena sp.pcc 7120 cultured 20 days in GB-11(-N)zoomed in 400 times |
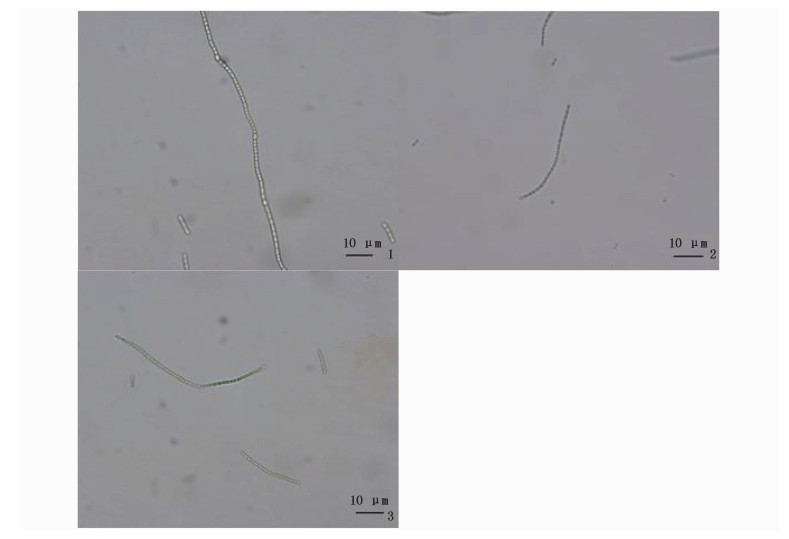
经过简单的培养液筛选后,虽然不能固氮的杂藻杂菌已经基本筛除,但是同为鱼腥藻生理、形态结构基本相似的野生型鱼腥藻和含有空载体的突变株以及转基因突变株混合后难以区分。本纯化的第二步是选择平板划线以及抗生素筛选(图版Ⅱ、Ⅲ)。划平板后,取单藻落悬浮滴于玻片上,通过形态学鉴定可以区分杂藻与鱼腥藻,用抗生素筛选藻种能最有效地将野生型鱼腥藻杀死,可实现两种突变株的分离。
|
图版 Ⅱ 鱼腥藻(Anabaena sp.PCC 7120)各品系显微镜400倍下图片 Plate Ⅱ Micrography of Anabaena sp.PCC 7120, pRL-489-7120 and pRL-489-vp28-7120 zoomed in 400 times 1.鱼腥藻(Anabaena sp.PCC 7120)野生型400倍显微图片;2.鱼腥藻(Anabaena sp.PCC 7120)转空载体型400倍显微图片;3.鱼腥藻(Anabaena sp.PCC 7120)转目的基因型400倍显微图片 1.Micrography of Anabaena sp.PCC 7120 zoomed in 400 times; 2.Micrography of pRL-489-7120 zoomed in 400 times; 3.Micrography of pRL-489-vp28-7120 zoomed in 400 times |
|
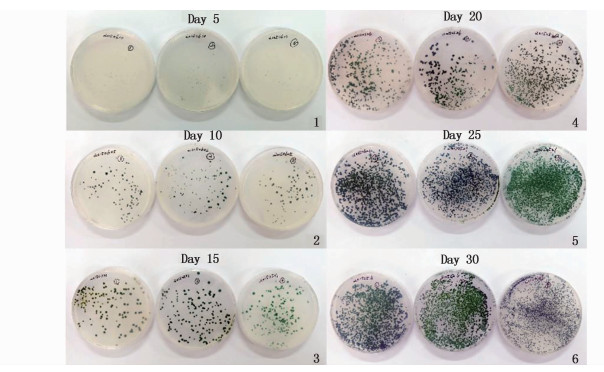
图版 Ⅲ 鱼腥藻7120野生型涂布5~30 d平板变化 Plate Ⅲ Pictures of Anabaena sp. PCC 7120 in culture dishes from day5 to day30 1.涂布第5天野生型藻种平板;2.涂布第10天野生型藻种平板;3.涂布第15天野生型藻种平板;4.涂布第20天野生型藻种平板;5.涂布第25天野生型藻种平板;6.涂布第30天野生型藻种平板 1.Picture of Anabaena sp. PCC 7120 in culture dishes in Day5; 2.Picture of Anabaena sp. PCC 7120 in culture dishes in Day10; 3.Picture of Anabaena sp. PCC 7120 in culture dishes in Day15; 4.Picture of Anabaena sp. PCC 7120 in culture dishes in Day20; 5.Picture of Anabaena sp. PCC 7120 in culture dishes in Day25; 6.Picture of Anabaena sp. PCC 7120 in culture dishes in Day30 |
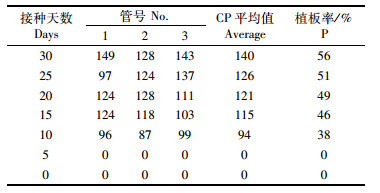
表 3可以看出从接种10 d开始植板率开始上升,但是逐渐趋于平稳,藻落的大小在逐渐变大但是数量并无明显变化。
|
表 3 野生型植板藻落数与植板率变化 Tab.3 Changes in P(%) and Cp of Anabaena sp. PCC 7120 |
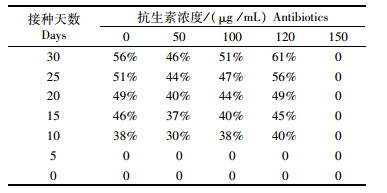
植板率反映了野生型鱼腥藻7120在除去杂藻和杂菌后促进了生长(图 1,表 3和4)。表 4中抗生素浓度为0的是选取到的野生型作为对比,其他藻种均为未经纯化的藻种,涂布中转基因藻和野生藻混杂。可以看出150 μg /mL的卡那霉素浓度为藻种的最高耐受浓度,经验证120 μg /mL浓度下生长出的藻落都为转基因藻种,也说明该转基因藻种抗生素的最适浓度为120 μg /mL。
|
表 4 不同抗生素浓度下植板率变化 Tab.4 Changes in P(%) cultured in different Antibiotics concentrations |
|
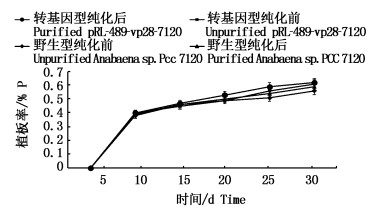
图 1 野生型和转基因品系纯化前后植板率对比
Fig. 1 Changes between purified and unpurified Anabaena sp. PCC 7120, pRL-489-vp28-7120 in 30days
|
综上,在抗生素筛选后,发现经纯化的转基因突变株和野生型藻株在去除同类竞争后植板率上升(5%和4%),即生长速率得到了提升,说明纯化有利藻的生长。
2.3 提取总DNA或质粒进行常规PCR检测由于从蓝藻提取质粒难度较高且数量较少,可以将提取的质粒DNA进行PCR扩增后再电泳,效果更佳。
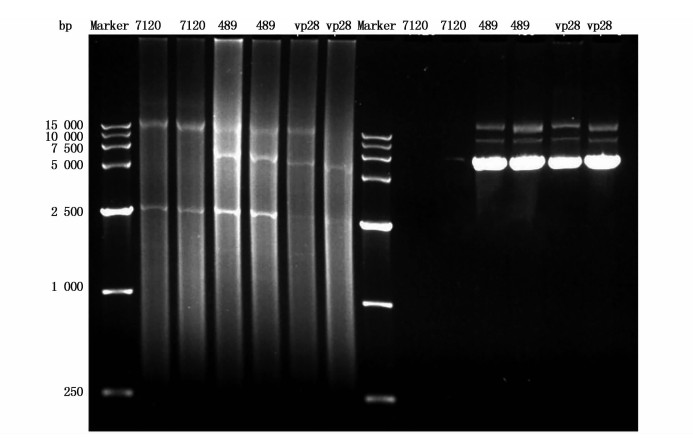
图 2中图左侧是藻液直接提取质粒的电泳图,图右侧是用提取物转入大肠杆菌后再次提取的质粒电泳图,可明显看出野生藻种不含质粒。可见用提取质粒的方法可以鉴别是否为野生藻种。抗生素筛选仅能将不含质粒的野生型藻种进行筛除,均含质粒的空载体突变株和转目的基因的突变株区分需要通过PCR验证基因表达来区别,这是本分离的第三步。
|
图 2 从转基因鱼腥藻7120提取质粒验证
Fig. 2 Plasmid extracts of Anabaena sp. PCC 7120, pRL-489-7120, pRL-489-vp28-7120 in electrophoretogram
|
为了检测纯化对3种鱼腥藻7120亚品系影响,用RT-qPCR技术分析了纯化前后3种鱼腥藻亚品系vp-28基因的表达率(图 5), 用Western blot检测了vp-28蛋白的含量(图 6)。
|
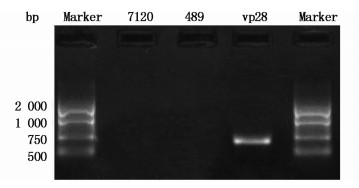
图 3 PCR验证基因表达
Fig. 3 PCR products of Anabaena sp. PCC 7120, pRL-489-7120, pRL-489-vp28-7120 in electrophoretogram
|
|
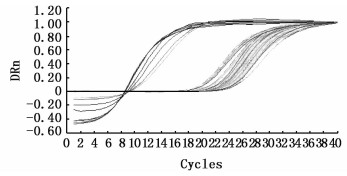
图 4 RT-qPCR测定中vp-28基因的扩增曲线
Fig. 4 vp-28 amplification curve of Anabaena sp. PCC 7120, pRL-489-7120, pRL-489-vp28-7120
|
|
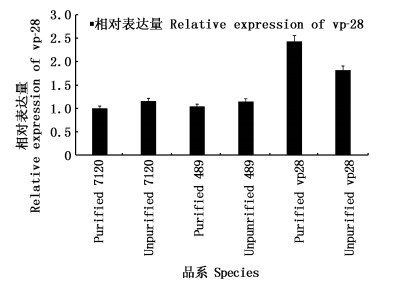
图 5 3种鱼腥藻7120亚品系细胞中vp-28基因的相对表达量
Fig. 5 Relative expression of vp-28 gene in Anabaena sp. PCC 7120, pRL-489-7120, pRL-489-vp28-7120
|

|
图 6 纯化藻种和未纯化藻种细胞中vp-28蛋白的蛋白印迹Western blot
Fig. 6 Analysis of relative expression of vp28 gene by Western blot in Anabaena sp. PCC 7120, pRL-489-7120, pRL-489-vp28-7120
|
以纯化后的野生藻种作为参照,可以看出纯化后的含空载体的藻种由于不含有目的基因,其相对表达量和纯化的野生藻种相近,而纯化后的含目的片段的藻种由于筛选后除去了野生藻和空载体的影响表达量最高。
2.5 Western Blot检测图 6可以明显看出纯化后野生和含有空载体的转基因藻株都没有蛋白表达,而纯化后的转目的片段突变株条带最明显,表达量大。
3 讨论 3.1 分离纯化方法的讨论早在1988年法国巴斯德研究所的RIPPKA就对蓝藻的纯化和分类进化有相关的研究[10],当时纯化藻种是为了更好地研究各种蓝藻的最适生长条件等生理指标。最初的纯化只是把野生型蓝藻细胞混杂的悬浮液接种在简单的固体培养基上来做分离,而当下先进的流式细胞仪已经可以做到,主要根据细胞的大小及色素差异对一些特定种群进行识别与计数[11-12]。
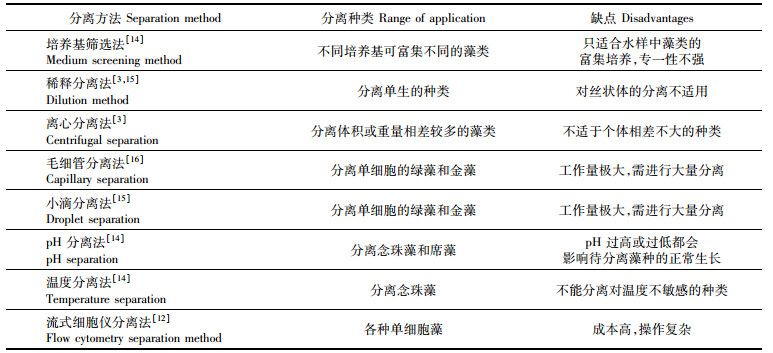
分离纯化藻种的关键是得到单藻落,通过观察单藻落的悬浮液中藻细胞的大小和形态可以筛选所需的藻种。所以平板划线的方法对于分离藻种还是实用的。相对于流式细胞仪复杂的染色检测[13],平板划线具有操作简单,容易上手和实验成本低的特点。本文从微生物分类的研究中总结归纳了一些常用的方法列于表 5中。
|
表 5 微藻的常见分离方法归纳 Tab.5 Traditional methods of Separation and purification for microalgae |
虽然野生型微藻(包括蓝藻)的纯化已引起广泛的重视,有了许多文献阐述,但针对转基因微藻纯化的研究却未见报道。从本研究看,转基因微藻纯化主要涉及3方面的分离:(1)杂藻杂菌和目的藻种的分离;(2)目的藻种野生型和同源的转基因品系分离;(3)转基因型中空载体和转目的片段藻种的分离。
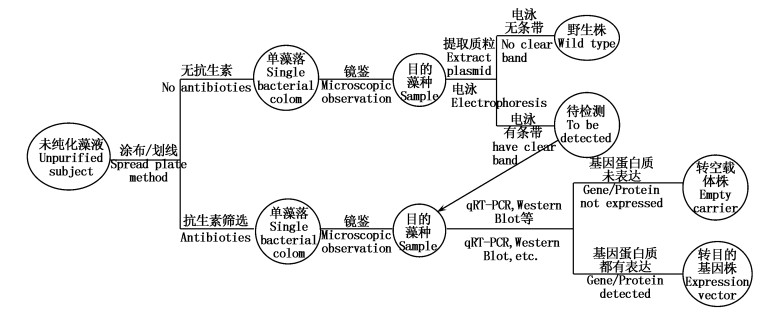
本研究中尝试了对鱼腥藻7120野生型(Anabaena sp. PCC 7120)、转基因突变种(Anabaena sp. PCC 7120 pRL-489-vp28)和转空载体突变种(Anabaena sp. PCC 7120 pRL-489)3个亚品系的分离。转基因蓝藻在培养的过程中有部分细胞由于无性繁殖会丢失质粒而逐渐丧失转基因获得的特性,因此需要抗生素的筛选去除培养液中丢失质粒的细胞。而野生型藻株以及转空载体藻株在日常培养过程中由于操作失误等原因也会混杂着转基因藻种,但是光凭抗生素筛选和涂布法不能将三者进行区分。基于研究可总结为以下技术路线来分别获得转基因及相关亚品系的藻株(图 7)。
|
图 7 转基因蓝藻及其亚品系纯化技术路线
Fig. 7 Technical route of separation and purification for transgenic cyanobacteria and its subspecies
|
具有异形胞的鱼腥藻可以在不含氮源的培养液和平板中生长,这一特点使得许多需要氮源的菌类以及杂藻都无法生长,这也是一种纯化手段。本研究中利用了鱼腥藻能固氮的特点, 通过控制培养基氮源将绝大多数杂藻甚至杂菌隔离在培养液外。之后对于不同藻种纯化培养的过程中也可根据藻种的特点调节培养基的组份来隔绝污染源。
3.1.2 目的藻种野生型和同源的转基因品系分离本研究中使用抗生素筛选和划线法结合的方式将野生藻种和两种转基因突变株进行了区分。据推断,纯化对于藻种有一定促进作用。但研究中也发现抗生素筛选和镜检并不能对空载体突变株和转目的基因突变株进行很好地区分,这也是一般传统方法的局限性所在。
3.1.3 转基因型中空载体和转目的片段藻种的分离扩大培养后的突变株可以通过普通PCR,荧光定量PCR以及Western Blot分别检测基因水平和蛋白水平的表达以确定是否含有目的片段,从而鉴别是否为转目的基因品系。
实验结果表明相对于传统方法而言,本研究所给出的纯化方法能准确区分野生型藻种、转目的基因突变株以及转空载体突变株。本研究还发现纯化后的藻种在生长速率和蛋白表达方面都比未经纯化的藻种有更明显的优势。
传统的藻种分离方法比较简单,但仅可针对野生藻种纯化而无法分离转基因空载体藻和转基因工程藻;先进的流式细胞仪分离法虽然能准确地分离藻种,但需要作荧光标记和检测,设备和试剂又较为昂贵,考虑到使用代价较高以及操作的便利性,本文的方法从形态学将目的藻种和其他物种区分,然后利用抗生素区分野生型和转基因型,最后用分子的手段区分不同转基因藻种,做到了从形态学到生理学再到分子生物层面的逐层分离,最终在亚品系的水平将野生型和转空载体以及转目的基因的3种品系藻进行了区分。
其中杂藻杂菌和目的藻种的分离过程中需要注意的是配置培养液的pH以及营养盐的质量,劣质的营养盐很可能含有氮源混入而导致杂藻杂菌滋生,而不适的pH则会对鱼腥藻的生长不利。野生型和同源的转基因品系分离的过程中需要注意随着抗生素浓度的提高,藻种对光照的敏感度也越来越高,勿将平板置于高过150 μmol/(m2·s)的环境。最后在转基因型中空载体和转目的藻种的分离过程中则需要根据目的基因设计好对应的引物和抗体,这对于目的基因以及蛋白的检测都是至关重要的。
现有的分离方法仅注重于不同属种间藻种的分离,而如今转基因藻种的分离则需要针对同一物种不同突变株的不同特性进行针对性的分离。相对于根据形态鉴别不同藻类的传统纯化,本文的方法利用培养基的性质去除了大量的杂藻和杂菌,为形态学鉴别减少了大量的工作量;利用抗生素将野生型从混合的藻种中纯化出来也是从未报道过的;而利用分子的手段将转基因鱼腥藻的不同亚品系区分进而分离,则是本研究对于传统纯化的一个突破。
3.2 纯化对生产的意义在转基因产品产业日益壮大的今天,从复杂而耗时的实验室纯化系统中简化,从而建立一套完整的分离纯化检测体系,为市场提供了一个可以参考的标准,也为日后其他产品的生产做准备。如前述,欧美国家对转基因产品的监管体系和力度在多年发展中都日益成熟,国内对转基因产品的生产和销售还没有一个完善的体系。这套方法的建立目的在于作为市场的参照,使得国内生产转基因藻类甚至其他转基因产品的企业有良好的品质保证和环境意识,增强国际竞争力。
转基因纯化方法的建立有助于用光反应器大规模培养转基因微藻的优化生产,做到了(1)能在生产过程中检测藻种纯度;(2)精确区分出转基因藻种,空载体藻种和野生藻种;(3)快速方便,可行性高。生产藻种不纯会导致产量下滑、产品质量降低从而影响产品等级的评定,最终导致产品价值下降影响生产利润。藻种纯化可以使目的藻种生长不受杂藻杂菌限制从而增加目的藻种生物量提高产量。由于除去了杂藻杂菌以及同源野生藻的影响,生产的产品纯度提升使得产品的质量得到了保证。最终纯化后生产的产品为企业创造的利润会大幅增长。
转基因工程藻由于其光合自养,且转化简单成熟(无需诱导,天然感受态),生长速度较快等特点逐渐成为科研以及生产炙手可热的研究对象。其他原核生物(如大肠杆菌)和真核生物(如酵母)等传统发酵生产的工艺已相当成熟,转基因藻类纯化体系的建立为转基因藻类生产铺平了道路,势必会对传统的工艺发起挑战。但是转基因藻类由于其多拷贝的特性还存在稳定性的问题,且对于转基因藻种操作的人员培养也是转基因藻类生产的一大关键问题。只有将转基因藻类遗传稳定性的问题解决并且加强人员培养和管理,转基因藻类产业才会有更长远的发展。
3.3 总结与展望本文中转基因藻的纯化方法分3个步骤先后从种群层面、细胞层面以及分子层面纯化分离了藻种。荧光定量PCR对基因表达率的检测很好地说明了纯化后表达率的提升;生产中产率得到的提升正是纯化藻种的意义最好的体现。
本文中所实施的方法和讨论虽然对鱼腥藻这种丝状体有显著的纯化效果,但遇到单细胞藻时又因为单细胞藻不能固氮且不易于收集仍难以有效地进行纯化。藻种的纯化仅仅是藻种问题出现后对于这一现象的补救方法,希望在日后的研究中可以通过增加荧光标记的方法来简化纯化的操作,进一步从源头上解决藻种混杂的问题。
| [1] |
宋东辉, 施定基, 宋海燕, 等.一种共生蓝藻分离纯化及培养优化的方法: 中国, ZL200710059345.4[P]. 2011-11-16. SONG D H, SHI D J, SONG H Y, et al. A method for optimal culture, separation and purification of the symbiotic cyanobacteria: CN, ZL200710059345.4[P]. 2011-11-16. |
| [2] |
CASTENHOLZ R W. Culturing methods for cyanobacteria[J]. Methods in Enzymology, 1988, 167: 68-93. DOI:10.1016/0076-6879(88)67006-6 |
| [3] |
华汝成. 单细胞藻类的培养与利用[M]. 北京: 农业出版社, 1986: 272-356. HUA R C. Culturing and utilization of unicellular algae[M]. Beijing: China Agriculture Press, 1986: 272-356. |
| [4] |
华汝成, 张道南. 海水单细胞藻类的培养与保种[J]. 集美大学学报(自然科学版), 1981(1): 100-111. HUA R C, ZHANG D N. Study on the culture and the maintenance of the marine unicellurlar algae[J]. Journal of Jimei University (Natural Science), 1981(1): 100-111. |
| [5] |
朱浩然. 植物制片技术学[M]. 北京: 人民教育出版社, 1960: 50-76. ZHU H R. Mounting technology for plant sample[M]. Beijing: People's Education Press, 1960: 50-76. |
| [6] |
魏娟, 赵良侠, 唐欣昀, 等. 鱼汤提取物对杜氏盐藻植板率的影响[J]. 安徽农学通报, 2007, 13(11): 48-49. WEI J, ZHAO L X, TANG X Y, et al. Effect of Dashi extract on the plating efficiency of Dunaliella salina[J]. Anhui Agricultural Science Bulletin, 2007, 13(11): 48-49. DOI:10.3969/j.issn.1007-7731.2007.11.022 |
| [7] |
童艳, 施定基, 冉亮, 等. 蓝藻质粒DNA提取方法的改进[J]. 植物生理学通讯, 2006, 42(2): 281-284. TONG Y, SHI D J, RAN L, et al. A improving method for the plasmid DNA isolation from cyanobacteria[J]. Plant Physiology Communications, 2006, 42(2): 281-284. |
| [8] |
JIA X H, ZHANG C L, SHI D J, et al. Oral administration of Anabaena-expressed VP28 for both drug and food against white spot syndrome virus in shrimp[J]. Journal of Applied Phycology, 2016, 28(2): 1001-1009. DOI:10.1007/s10811-015-0607-4 |
| [9] |
WOLK C P. Purification and storage of nitrogen-fixing filamentous cyanobacteria[J]. Methods in Enzymology, 1988, 167: 93-95. DOI:10.1016/0076-6879(88)67007-8 |
| [10] |
RIPPKA R. Isolation and purification of cyanobacteria[J]. Methods in Enzymology, 1988, 167: 3-27. DOI:10.1016/0076-6879(88)67004-2 |
| [11] |
VELDHUIS M J W, KRAAY G W. Application of flow cytometry in marine phytoplankton research:current applications and future perspectives[J]. Scientia Marina, 2000, 64(2): 121-134. DOI:10.3989/scimar.2000.64n2 |
| [12] |
CZECHOWSKA K, JOHNSON D R, VAN DER MEER J R. Use of flow cytometric methods for single-cell analysis in environmental microbiology[J]. Current Opinion in Microbiology, 2008, 11(3): 205-212. DOI:10.1016/j.mib.2008.04.006 |
| [13] |
谢薇薇, 龚伊, 王志伟, 等. 利用流式细胞仪分选技术研究湖泊真核超微藻的遗传多样性[J]. 环境科学, 2013, 34(4): 1485-1491. XIE W W, GONG Y, WANG Z W, et al. Use of flow cytometric sorting to assess the diversity of eukaryotic picophytoplankton of lakes[J]. Environmental Science, 2013, 34(4): 1485-1491. |
| [14] |
王梅梅, 阚振荣, 郭春雨, 等. 饮水中藻类在不同培养基中的生长状况[J]. 河北大学学报(自然科学版), 2005, 25(2): 185-188, 193. WANG M M, KAN Z R, GUO C Y. Algae growth state of drinking water in different culture media[J]. Journal of Hebei University (Natural Science Edition), 2005, 25(2): 185-188, 193. DOI:10.3969/j.issn.1000-1565.2005.02.015 |
| [15] |
湛江水产学校. 海洋饵料生物培养[M]. 北京: 农业出版社, 1980: 63-65. Zhanjiang College of Fishery. Culturing of marine bait organism[M]. Beijing: China Agriculture Press, 1980: 63-65. |
| [16] |
陈碧华.杜塘水库浮游藻类群落特征及微囊藻的分离培养[D].福州: 福建师范大学, 2009. CHEN B H. Study on dynamics of phytoplankton community characteristics and isolation & culture of microcystis in Dutang reservoir[D]. Fuzhou: Fujian Normal University, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10394-2010034512.htm |
2. Tianhe Biotec. Ltd. Zhenjiang 212200, Jiangsu, China;
3. Institute of Botany, Chinese Academy of Sciences, Beijing 100093, China
 2018,
Vol. 27
2018,
Vol. 27


