2. 浙江永兴水产种业有限公司, 浙江 温州 325000;
3. 浙江省近岸水域生物资源开发与保护重点实验室, 浙江 温州 325005;
4. 桐庐县江南镇人民政府农办, 浙江 杭州 311507
凡纳滨对虾(Litopenaeous vannemei)属节肢动物门(Arthropoda),对虾科(Penaeidae),对虾属(Penaeous)。该虾具有个体大、适盐范围广、耐高温、生长快、抗逆性强、饲料蛋白需求量低和易于集约化养殖等优良特点,在全球范围内被大规模养殖。近些年来我国沿海一带掀起了凡纳滨对虾的养殖热潮,至2014年海水养殖产量达87.547万吨,占全国对虾养殖产量的83.6%,成为我国对虾养殖的绝对优势种类[1]。
氨态氮和亚硝态氮是水产养殖环境中重要的胁迫因子,其对虾的伤害是多方面的,较高的浓度会影响虾体的生理功能、酶活性,使其代谢失衡,生长受到抑制,抗病力下降[2]。凡纳滨对虾的酚氧化酶活性(phenoloxidase activity)在低氨态氮组(1.10 mg/L)和对照组下培养7 d后无显著变化,但当氨态氮浓度达到5.24 mg/L时其1 d后则显著下降[3]。克氏原螯虾(Procambarus clarkii)的肝胰脏血清溶菌酶(LSZ)、超氧化物歧化酶(SOD),肌肉LSZ、酚氧化酶活性以及血细胞总数在高氨态氮浓度下随着时间的延长逐渐下降[4]。日本沼虾(Macrobrachium nipponense)的SOD、过氧化氢酶和谷胱甘肽过氧化物酶的活性均因亚硝态氮的增加而降低[5]。而该影响同时受到温度、盐度和pH等环境因子的调控。氨态氮中非离子氨态氮浓度随着pH和温度的升高而升高,使对虾会受到更强的毒害作用[6]。盐度对于亚硝态氮的毒性影响十分显著,盐度越高,虾类对亚硝态氮的耐受能力就越强[7-9]。在水环境中,亚硝态氮以亚硝酸根离子(NO2-)和亚硝酸(HNO2)两种形式存在,后者能自由扩散并通过鳃进入机体,毒性较大。当水体中pH下降时,以HNO2形式存在的亚硝态氮的比例上升,因此在低pH条件下,亚硝态氮的毒性较强[10]。
对虾的摄食是获取营养物质和维持机体内环境稳定的一种重要生命活动,既受到中枢神经系统等内部因素的控制,同时也受到各种外部环境因子的影响。为了更好地进行健康养殖和提升养殖经济效益,必须更深入了解环境因子变化所带来的影响。而目前国内就环境因子对于凡纳滨对虾摄食影响的研究并不多,因此有必要研究氨态氮、亚硝态氮及其他因子耦合对于凡纳滨对虾的生长和摄食关系的影响,探讨其作用机制,寻求消除或缓解环境胁迫影响的途径或方法。
1 方法和材料 1.1 实验材料实验在浙江永兴水产种业有限公司(120.848687°E, 27.89073°N, 浙江省温州市)进行,所用凡纳滨对虾(Litopenaeous vannemei)均来自浙江省海洋水产养殖研究所清江养殖基地(121.108733°E, 28.280329°N, 浙江省温州市)繁育的浙桂1号。对虾在除菌海水中暂养饥饿24 h后,挑选体长,体质量相近的对虾用于后续实验。
1.2 实验方法实验一共设计了3组双因子耦合实验(表 1)。氨态氮浓度和亚硝态氮浓度依照孙国铭等研究而定[11],实验浓度高于安全浓度且低于96 h的致死浓度。亚硝态氮和氨态氮耦合实验中,亚硝态氮和氨态氮浓度均为0 mg/L, 5 mg/L, 10 mg/L(pH 8.2,盐度15);氨态氮与pH耦合实验中,氨态氮浓度为0 mg/L, 5 mg/L, 10 mg/L,pH的梯度为7.6、8.2和8.8(亚硝态氮浓度为0 mg/L,盐度15);盐度与亚硝态氮耦合实验中,亚硝态氮浓度为0, 5, 10 mg/L,盐度为5、15和25(氨态氮浓度为0 mg/L,pH 8.2)。实验海水经沉降,生物吸收,消毒等步骤,其盐度为15,pH 8.2,氨态氮和亚硝态氮浓度均低于0.01 mg/L。
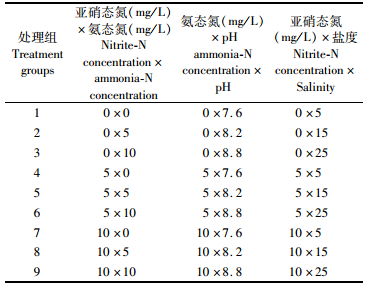
|
表 1 实验设计 Tab.1 Experimental design |
每个培养玻璃箱(养殖水体为90 L)放养对虾10尾,每个处理设3个重复,初始体总质量(湿重)为(4.50±0.50)g。用比色法测定氨态氮和亚硝态氮,以分析纯的NH4Cl和NaNO3配成试验液,对养殖水体的氨态氮和亚硝态氮浓度进行调整。每两小时用电极式水质检测仪器测定水体中的pH,用NaOH和HCl溶液进行调整。盐度的调节通过添加NaCl或蒸馏水进行。
实验所用饲料为宁波正大对虾饲料(水分10.1%,蛋白质43.1%,脂肪5.1%和灰分10.7%)。每日投喂3次饲料(7:00, 12:00, 18:00),过量投喂,投饵2 h后吸污,收集的饲料在60℃烘干后称重。每日换1/2水量,养殖水体溶氧维持在6.0 mg/L以上,光周期16 L:8 D,水温(32.0±1.0)℃。实验周期维持7 d,实验结束后用纱布吸去虾体表面水分,用电子天平称量对虾体质量,精确至0.001 g。
1.3 数据分析特定生长率(SGR, %/d)、摄食率(FId, %,每日体质量百分数)和饲料转化效率(FCEd, %)分别按下列公式计算:

式中:对虾体质量为湿重(W, g),W1、W2分别为实验开始及结束时对虾的湿重;F为摄食总量(干重, g);T为实验持续时间(d)。
采用SPSS 16.0对实验数据进行单因素和双因素方差分析,Duncan氏多重比较,以P < 0.05作为差异显著水平,描述性统计值采用平均值±标准差(Mean ± SD)表示。采用Excel 2013对实验数据进行回归拟合。
2 结果 2.1 氨态氮和亚硝态氮耦合对凡纳滨对虾生长与摄食率的影响如表 2所示,在实验设计的亚硝态氮和氨态氮分别为0,5,10 mg/L的3组浓度下,实验对虾的特定生长率,摄食率和饲料转化率均随着氮浓度的增加而下降(P < 0.05)。氨态氮和亚硝态氮的浓度从0升至5或10 mg/L时,对虾的特定生长率、摄食率和饲料转化率均显著下降(P < 0.05)。亚硝态氮和氨态氮双因子交互作用对于各个参数差异显著(P < 0.001)。特定生长率与氨态氮(A)和亚硝态氮(N)符合二元二次方程,其回归方程为:RSG(%/d)= -3.198 -0.291 4A-0.202N+ 0.009A×N + 0.011A2+0.005N2(R2=0.97, P < 0.05)。
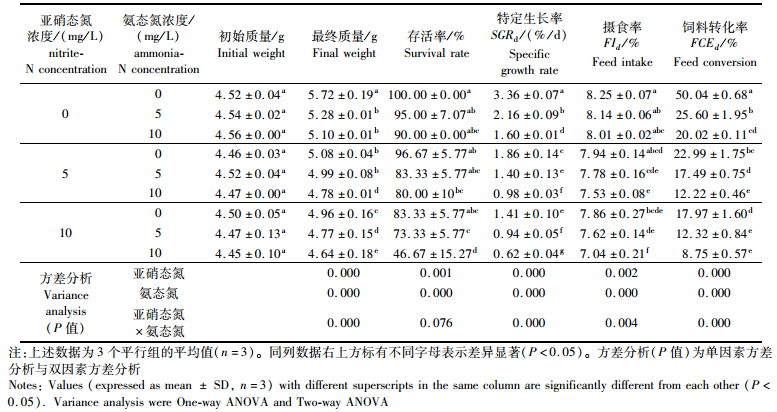
|
表 2 亚硝态氮和氨态氮对凡纳滨对虾特定生长率、存活率、摄食率及饲料转化率的影响 Tab.2 The effect of nitrite-N and ammonia-N on specific growth rate, survival rate, feed intake and feed conversion rate of L. vannamei |
如表 3所示,氨态氮水平的提高导致对虾的特定生长率,摄食率和饲料转化率下降(P < 0.05)。pH水平的改变同时影响对虾的特定生长率、摄食率和饲料转化率。pH为8.2时对虾的特定生长率,摄食率和饲料转化率最高(P < 0.05)。pH为8.8时各参数处于最低水平,且氨态氮水平为5 mg/L时,特定生长率和饲料转化率为负值,氨态氮为10 mg/L时,对虾在第3天时已全部死亡。统计结果表明,氨态氮水平和pH对对虾的特定生长率、摄食率和饲料转化率的影响差异显著(P < 0.05)。双因子耦合对于各个参数影响差异显著(P < 0.001)。对不同浓度氨态氮(A)和不同水平pH(H)下的特定生长率进行回归处理,其回归方程为:
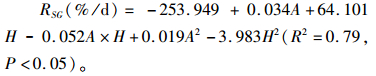
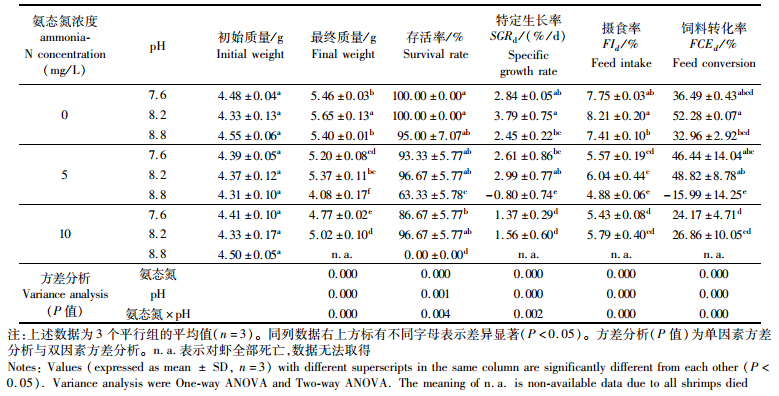
|
表 3 pH和氨态氮对凡纳滨对虾特定生长率、存活率、摄食率及饲料转化率的影响 Tab.3 The effect of pH and ammonia-N on specific growth rate, survival rate, feed intake and feed conversion rate of L. vannamei |
不同盐度下对虾的特定生长率和饲料转化率呈单谷模型(表 4),在5~15盐度范围内,特定生长率和饲料转化率随着盐度的升高而上升(P < 0.05),之后随着盐度上升而降低(P < 0.05),而对虾的摄食率在5~25范围内受到盐度的影响不显著(P≥0.05)。方差分析显示,盐度对对虾的特定生长率和饲料转化率影响差异显著(P < 0.001),但对摄食率影响不显著(P≥0.05)。亚硝态氮水平对对虾的各项参数的影响差异显著(P < 0.001)。亚硝态氮和盐度双因子交互作用对特定生长率、摄食率影响差异显著(P < 0.05),对饲料转化率影响差异不显著(P≥0.05)。不同亚硝态氮(N)和盐度(S)下的特定生长率的回归方程为:RSG(%/d)= 1.488-0.121N +0.1825 + 0.003N×S-0.001N2-0.006S2(R2=0.84, P < 0.05)。
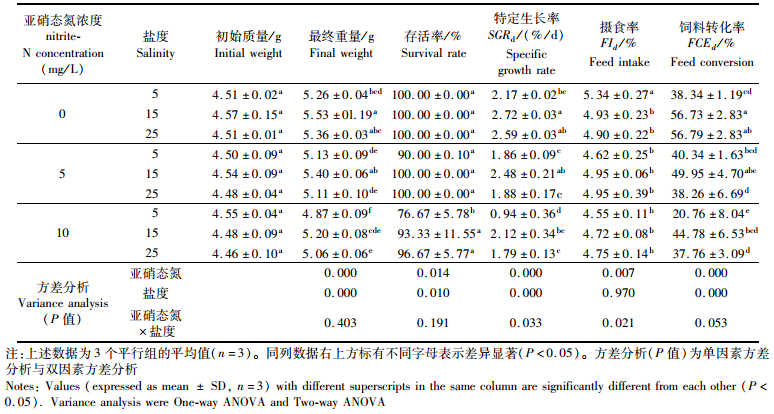
|
表 4 亚硝态氮和盐度对凡纳滨对虾特定生长率、存活率、摄食率及饲料转化率的影响 Tab.4 The effect of nitrite-N and salinity on specific growth rate, survival rate, feed intake and feed conversion rate of L. vannamei |
氨态氮和亚硝态氮是对虾养殖环境中最主要的胁迫因子,较高浓度时会影响整个虾体的生理功能、酶活性,使其代谢失衡,生长受到抑制。亚硝态氮为强氧化剂,可以使甲壳动物血液中血蓝蛋白发生类似血红蛋白的反应,从而引起缺氧和青紫症[12]。以上二者的来源与作用机制有着相辅相成之势,水体中的亚硝态氮主要来自于硝态氨,通过亚硝酸单胞菌(Nitrosom onas)的硝化作用,被氧化为亚硝态氮。氨态氮能通过甲壳动物的鳃组织并进入血液,非离子氨的急剧增加对生物体内的硝酸杆菌产生很大的抑制作用,从而抑制硝酸盐的生成,导致亚硝态氮大量积累,对生物体造成损害[2]。基于氨态氮会导致亚硝态氮的大量积累,有文献表明水体中的亚硝态氮比氨态氮更直接地影响机体的生理功能,毒性更大[12]。胡义波等研究表明,在较低浓度(1 mg/L)的氨态氮和亚硝态氮条件下,亚硝态氮下的罗氏沼虾(Macrobrachium rosenbergii)的血细胞数量要远低于氨态氮[13]。本研究实验结果表明,氨态氮和亚硝态氮水平升高,对于对虾的特定生长率、摄食率和饲料转化量产生严重的负面作用。相关研究表明,克氏原螯虾随着氨态氮和亚硝态氮浓度增高,螯虾的摄食时间、摄食频次和活动总体呈现下降趋势,寻食时间呈现逐渐上升的变化趋势,进而导致摄食率下降[14]。对日本对虾和凡纳滨对虾的研究均表明,水体中氨态氮浓度的升高使血淋巴和血蓝蛋白浓度下降,并且使对虾的耗氧量升高[15-16]。可见氨态氮和亚硝态氮的升高不仅对对虾的外源性摄食造成影响,而且使对虾在生理上耗费大量的能量抵御该种改变,因此饲料的转化率大幅下降,二者共同受到的抑制最终体现为特定生长率的降低。
3.2 氨态氮和pH耦合对凡纳滨对虾的影响同时,氨态氮和亚硝态氮对对虾的影响受到pH的调控。氨态氮对于对虾的主要毒性在于非离子氨态氮,因为非离子氨态氮具有相当高的脂溶性,能够穿透细胞膜毒害细胞组织。而pH的上升会导致离子氨态氮向非离子氨态氮形态转变,使得水体中非离子氨态氮的浓度升高,pH每升高一个单位,非离子氨态氮浓度大约升高10倍[17]。在4 h内,pH在7.0~8.5的范围内,中国对虾(Fenneropenaeus chinensis)幼虾的耗氧率随pH突变值的增加而升高[18]。pH升高为8.8 ~9.5时, 罗氏沼虾对肠球菌的感染率急剧增大[19]。在表 3中同样表现出随着pH的升高对虾的生长指标显著下降的结果。pH可以影响非离子氨态氮浓度来进一步毒害对虾,所以pH的跃迁(如光合作用增强,水体中的重碳酸根被迅速消耗导致pH上升)对于处于氨污染状态下的对虾而言危害极大。
3.3 亚硝态氮和盐度耦合对凡纳滨对虾的影响盐度对虾体的生长影响主要体现在影响虾体的渗透压调节和摄食方面。盐度变化可促使对虾进行渗透调节,导致其代谢能量消耗,由于代谢能在多数甲壳动物的能量分配中占较大的比例,因此代谢能的变化决定了生长能的积累。研究认为凡纳滨对虾在接近等渗点(24.7)或略低于等渗点的盐度环境中生长较快[20]。总体而言,一般认为凡纳滨对虾的最适生长盐度为20左右[21]。本实验中盐度15的生长要高于盐度25,这结果与申玉春的结果相一致[22]。在表 4中能观察到对虾在高盐度(盐度为15和25)情况下比低盐度(盐度为5)具有更小的抑制率。低盐度情况下(盐度为5)凡纳滨对虾抵抗低氧情况能力显著下降,在盐度15~25的环境下抗菌和溶菌活力最高[23]。盐度对亚硝态氮的调节主要是由于氯离子和亚硝态氮离子在对虾的鳃部竞争相同吸收位点[24-25],所以高盐度虽然对摄食并无明显影响,但能够在生理代谢上一定程度缓解亚硝态氮的负面作用。
4 结论综上所述,氨态氮和亚硝态氮耦合对凡纳滨对虾的生长和摄食抑制存在叠加效应,氨态氮的负面作用随着pH的升高而加剧,但亚硝态氮对对虾的抑制作用可被高盐度一定程度地缓解。在养殖过程中,控制氨态氮和亚硝态氮的浓度,选择适宜的pH和盐度是获得高产量和饲料转化率的有效途径。
| [1] |
赵兴武, 崔利锋, 李书民, 等. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2015: 32-33. ZHAO X W, CUI L F, LI S M, et al. China fishery statistics yearbook[M]. Peking: China Agriculture Publisher, 2015: 32-33. |
| [2] |
聂月美, 邵庆均. 氨氮对虾的免疫影响及其预防措施[J]. 中国饲料, 2006(10): 28-31. NIE Y M, SHAO Q J. Effects of ammonia-nitrogen on the immunity of shrimps and precaution measures[J]. China Feed, 2006(10): 28-31. DOI:10.3969/j.issn.1004-3314.2006.10.011 |
| [3] |
LIU C H, CHEN J C. Effect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus[J]. Fish & Shellfish Immunology, 2004, 16(3): 321-334. |
| [4] |
朱毅菲. 不同浓度氨氮、不同低pH突变对克氏原螯虾免疫功能的影响[D]. 武汉: 华中农业大学, 2006. ZHU Y F. Effects of ammonia-N with different concentrations and different low pH values on immune functions of Procambarus clarkia[D]. Wuhan: Huazhong Agricultural University, 2006. http://cdmd.cnki.com.cn/article/cdmd-10504-2006190437.htm |
| [5] |
WANG W N, WANG A L, ZHANG Y J, et al. Effects of nitrite on lethal and immune response of Macrobrachium nipponense[J]. Aquaculture, 2004, 232(1/4): 679-686. |
| [6] |
CHEN J C, KOU Y Z. Effects of ammonia on growth and molting of Penaeus japonicus juveniles[J]. Aquaculture, 1992, 104(3/4): 249-260. |
| [7] |
胡贤德, 孙成波, 王平, 等. 不同盐度条件下亚硝酸氮对斑节对虾的毒性影响[J]. 沈阳农业大学学报, 2009, 40(1): 103-106. HU X D, SUN C B, WANG P, et al. Toxicity of nitrite nitrogen to Penaeus monodon under the different salinities conditions[J]. Journal of Shenyang Agricultural University, 2009, 40(1): 103-106. |
| [8] |
LIN Y C, CHEN J C. Acute toxicity of nitrite on Litopenaeus vannamei (Boone) juveniles at different salinity levels[J]. Aquaculture, 2003, 224(1/4): 193-201. |
| [9] |
CHEN J C, LIN C Y. Lethal effects of ammonia and nitrite on Penaeus penicillatus juveniles at two salinity levels[J]. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 1991, 100(3): 477-482. DOI:10.1016/0742-8413(91)90026-P |
| [10] |
寇红岩, 冼健安, 郭惠, 等. 亚硝酸盐对虾类毒性影响的研究进展[J]. 海洋科学, 2014, 38(2): 107-115. KOU H Y, XIAN J A, GUO H, et al. Research progress of toxic effects of nitrite on shrimp[J]. Marine Sciences, 2014, 38(2): 107-115. |
| [11] |
孙国铭, 汤建华, 仲霞铭. 氨氮和亚硝酸氮对南美白对虾的毒性研究[J]. 水产养殖, 2002(1): 22-24. SUN G M, TANG J H, ZHONG X M. Toxicity research of ammonia nitrogen and nitrite nitrogen to Penaeus vannamei[J]. Journal of Aquaculture, 2002(1): 22-24. |
| [12] |
李志华, 王维娜. 几种常见污染物对虾的危害[J]. 中国水产, 2004(2): 71-74. LI Z H, WANG W N. The damage of several common contaminations to the shrimp[J]. China Fisheries, 2004(2): 71-74. |
| [13] |
胡义波, 王玥, 姜乃澄. 氨态氮、亚硝态氮对罗氏沼虾血细胞及超微结构的影响[J]. 浙江大学学报(理学版), 2005, 32(6): 691-697. HU Y B, WANG Y, JIANG N C. Effects of ammonia-N and nitrite-N on the Hemocyte count and ultrastructure of Macrobrachium rosenbergii[J]. Journal of Zhejiang University (Science Edition), 2005, 32(6): 691-697. |
| [14] |
芦光宇. 氨氮和亚硝酸氮对克氏原螯虾摄食行为和抗氧化功能的影响[D]. 扬州: 扬州大学, 2012. LU G Y. Effect of the ammonia nitrogen and nitrite on feeding behavior and the function of antioxidant system in red swamp crayfish (Procambarus clarkii)[D]. Yangzhou: Yangzhou University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-11117-1013181166.htm |
| [15] |
CHEN J C, CHENG S Y, CHEN C T. Changes of haemocyanin, protein and free amino acid levels in the haemolymph of Penaeus japonicus exposed to ambient ammonia[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1994, 109(2): 339-347. DOI:10.1016/0300-9629(94)90137-6 |
| [16] |
RACOTTA I S, HERNáÁNDEZ-HERRERA R. Metabolic responses of the white shrimp, Penaeus vannamei, to ambient ammonia[J]. Comparative Biochemistry and Physiology Part A:Physiology, 2000, 125(4): 437-443. DOI:10.1016/S1095-6433(00)00171-9 |
| [17] |
孙成波, 李婷, 李义军, 等. 多因子对斑节对虾氮磷代谢的影响[J]. 浙江海洋学院学报(自然科学版), 2011, 30(2): 132-136, 154. SUN C B, LI T, LI Y J, et al. Effects of several factors on nitrogen and phosphorus metabolism in Penaeus monodon[J]. Journal of Zhejiang Ocean University (Nature Science), 2011, 30(2): 132-136, 154. |
| [18] |
CHEN J C, LIN C Y. Responses of oxygen consumption, Ammonia-N excretion and Urea-N excretion of Penaeus chinensis exposed to ambient ammonia at different salinity and pH levels[J]. Aquaculture, 1995, 136(3/4): 243-255. |
| [19] |
CHENG W, CHEN J C. Enterococcus-like infections in Macrobrachium rosenbergii are exacerbated by high pH and temperature but reduced by low salinity[J]. Diseases of Aquatic Organisms, 1998, 34(2): 103-108. |
| [20] |
王兴强, 马甡, 董双林. 盐度和蛋白质水平对凡纳滨对虾存活、生长和能量转换的影响[J]. 中国海洋大学学报, 2005, 35(1): 33-37. WANG X Q, MA S, DONG S L. Effects of salinity and dietary protein levels on survival, growth and energy conversion of juvenile Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2005, 35(1): 33-37. |
| [21] |
HUANG H J. Factors affecting the successful culture of Penaeus stylirostris and Penaeus vannamei at an estuarine power plant site: temperature, salinity, inherent growth variability, damselfly nymph predation, population density and distribution, and polyculture[D]. Texas: Texas A & M University, 1983.
|
| [22] |
申玉春, 陈作洲, 刘丽, 等. 盐度和营养对凡纳滨对虾蜕壳和生长的影响[J]. 水产学报, 2012, 36(2): 290-299. SHEN Y C, CHEN Z Z, LIU L, et al. The effects of salinity and nutrition on molt and growth of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2012, 36(2): 290-299. |
| [23] |
沈丽琼, 陈政强, 陈昌生, 等. 盐度对凡纳滨对虾生长与免疫功能的影响[J]. 集美大学学报(自然科学版), 2007, 12(2): 108-113. SHEN L Q, CHEN Z Q, CHEN C S, et al. Growth and Immunities of the shrimp, Litopenaeus vannamei (Boone) Exposed to different salinity levels[J]. Journal of Jimei University (Natural Science), 2007, 12(2): 108-113. |
| [24] |
YILDIZ H Y, BENLI A C K. Nitrite toxicity to crayfish, Astacus leptodactylus, the effects of sublethal nitrite exposure on hemolymph nitrite, total hemocyte counts, and hemolymph glucose[J]. Ecotoxicology and Environmental Safety, 2004, 59(3): 370-375. DOI:10.1016/j.ecoenv.2003.07.007 |
| [25] |
KOZÁK P, MÁCHOVÁ J, POLICAR T. The effect of chloride content in water on the toxicity of sodium nitrite for spiny-cheek crayfish (Orconectes limosus RAF.)[J]. Bulletin Francais de la Pêche et de la Pisciculture, 2005, 376-377: 705-714. |
2. Zhejiang Yongxing Aquatic Seeds, Wenzhou 325000, China;
3. Zhejiang Key Lab of Exploitation and Preservation of Coastal Bio-Resource, Wenzhou 325005, China;
4. Agricultural technical extension center of Tonglu, Hangzhou 311507, China
 2018,
Vol. 27
2018,
Vol. 27


