罗红霉素(Roxithromycin),化学名为9E-[O-[(2-甲氧基乙氧基)-甲基肟]红霉素,分子式为C41H74N2O15,分子量837.03[1],是红霉素的衍生物,是新一代14元大环内酯类抗生素[2]。主要是与细菌50s核糖体亚基结合, 通过阻断转肽作用和mRNA移位而抑制细菌蛋白质的合成, 从而起抗菌作用[3]。抗生素(Antibiotics)能干扰或抑制致病微生物的生存,广泛地应用于人类及动物的疾病治疗、农业生产、畜牧及水产养殖等领域。据统计,全世界每年抗生素的消费量可达10~20万吨,我国是抗生素的最大生产国和消费国。抗生素的大量使用必然会导致过多的残留物随生活污水进入到水环境中,进而在沉积物中积累,目前抗生素产生的环境危害愈发突出。中国圆田螺属软体动物门, 腹足纲, 前鳃亚纲, 中腹足目, 田螺科,圆田螺属,是水生底栖生物,可以用来监测水体沉积物的环境污染。目前抗生素对水体的污染日益严重,有研究表明中国圆田螺对水体中重金属污染有指示作用[4]。化学物质在生物体内代谢过程包括Ⅰ相代谢和Ⅱ相代谢两种[5]。抗生素在Ⅰ相代谢组被还原氧化或者分解。催化Ⅰ相代谢的酶主要是P450酶系。红霉素-N-脱甲基酶(ERND)是P450家族中CYP3A标志酶,对药物进行氧化还原或者水解[6]。国内有关水产动物组织微粒体药酶的研究不多,如黎雯等[7]用鱼肝EROD酶活力诱导作为二噁英的水生态毒理学指标;陈大健等[8]研究了氟苯尼考对鲫CYP2E1活性的影响。本文探究沉积物中罗红霉素对中国圆田螺不同组织中ERND酶活性的影响,并对其变化原因进行分析,进而为中国圆田螺对水体中抗生素指示作用研究奠定基础,也为水产养殖提供参考。
1 材料与方法 1.1 材料方法中国圆田螺(Cipangopaludina chinensis , Gray)为典型的底栖动物,采于河北白洋淀,非繁殖期,其质量为(3.07±0.97) g,壳高为(23.65±3.45) mm,壳宽为(15.41±1.71) mm。实验室养殖水体水质的主要参数为:温度24~26 ℃,pH 7.5~7.8,溶解氧10.1~10.3 mg/L。罗红霉素(分析纯), 购自加拿大多伦多研究化学品公司;红霉素-N-脱甲基酶(ERND)ELISA检测试剂盒, 购自南京建成科技有限公司。
1.2 设计方法实验室暂养10 d后随机分为12组,即空白对照组、实验组Ⅰ(250倍环境剂量罗红霉素组15 μg/g)、实验组Ⅱ(500倍环境剂量罗红霉素组30 μg/g)、实验组Ⅲ(750倍环境剂量罗红霉素组45 μg/g),空白和各实验组均设3个平行组,每组60只,饲养于容积为5 L的缸内,每个缸内放500 g沙子,将罗红霉素和沙子混匀,加水500 mL,之后每天都加水补充至开始的量,实验周期为5天,每天取样进行测定,实验期间不投喂。据报道,罗红霉素在中国主要水域水体中的含量约在2~3 000 ng/L范围内,沉积物中约在2~60 ng/g范围内[9],本文以60 ng/g为参考环境浓度[10],研究沉积物中罗红霉素对水生生物尤其是底栖生物的影响。测量了中国圆田螺胃、肝脏、肾脏和卵巢肌肉组织中ERND的活性。
1.3 取样方法在对照组和3个实验组中每组随机取3 ×3只大小重量相同的田螺,作为3个平行取平均值,分别在田螺肝脏、肾脏、胃和卵巢肌肉部分切取约0.01 g组织,放入冷冻的研钵中,加0.99 mL双蒸水研磨,制成匀浆液,4 ℃,3 000 r/min离心10 min,取上清液进行测定,测定ERND的ELISA检测试剂测定ERND活力,依据试剂盒说明书上的计算方法计算酶活性。
1.4 数据处理方法组织中ERND活力计算:在Excel工作表中,以标准品浓度作为横坐标,对应的450 nm波长处的OD值作为纵坐标,绘制出标准品线性回归曲线,按照曲线方程计算各样本浓度值。依据算出的回归方程,测出不同浓度和时间梯度下各个组织的ERND的活性,实验结果均为3个平行样测定值的平均值,数据误差线为标准误差,采用SPSS 13.0进行单因素方差分析(one-way ANOVA),独立样本t 检验分析差异显著性。其中,P<0.05表示实验组与对照组差异显著。
2 结果 2.1 ERND标准曲线测量了0 ng、5 ng、10 ng、20 ng、40 ng和80 ng浓度的标准品在450 nm波长处的OD值,依此做出标准曲线。绘制出了标准曲线方程,如下图。
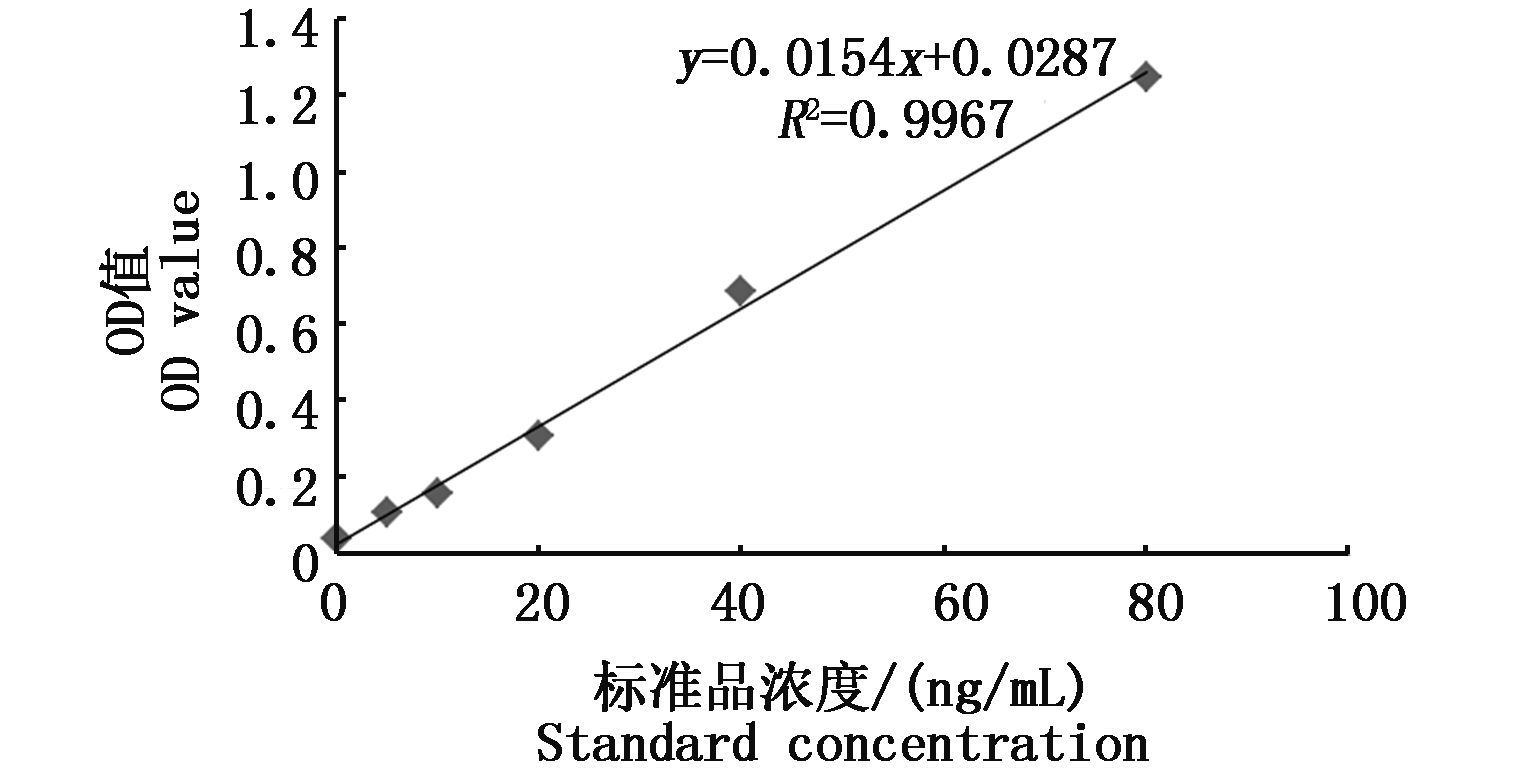
|
图 1 ERND标准曲线
Fig. 1 ERND standard curve
|
中国圆田螺肝脏中红霉素-N-脱甲基酶(ERND)活性变化如图 2所示。左图是以浓度作图,图中除45 μg/g罗红霉素剂量组第2天和第3天外其他组与对照组比较均表现为显著差异。前3天时,对照组和3个实验组都呈现升高趋势,而到第4天时又都有明显的降低,即对照组和3个实验组的ERND活性均表现为先上升后下降。前3天ERND活性明显升高,提高了肝脏清除罗红霉素的能力。但第4天实验组酶活相比对照组ERND活性显著下降,表明肝脏抗氧化能力下降。
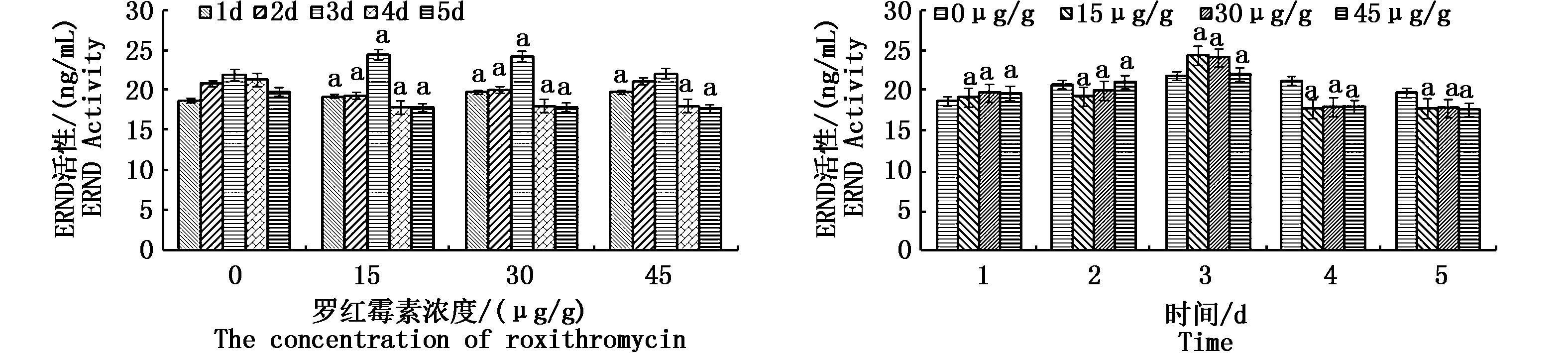
|
图 2 中国圆田螺肝脏中ERND活性变化情况
Fig. 2 The activities of ERND in liver of C. chinensis
柱上方含有小写字母的表示同一实验组不同时间的差异显著,下同 Lowercase letters indicate there are significant differences among the different sampling period |
右图是以时间作图,而在时间图中可以看到前2天酶活性随着罗红霉素浓度提高而显著提高,后3天则是酶活性随着罗红霉素浓度升高而显著降低。
2.3 中国圆田螺肾脏中ERND酶活性的测定结果中国圆田螺肾脏中红霉素-N-脱甲基酶(ERND)活性变化如图 3所示。浓度图 3个实验组与对照组相比均表现为显著差异。第1天时实验组相对对照组酶活性下降明显。第2天则是先升高后降低,最高点在15 μg/g。第3天也是先升高后降低,但最高点在30 μg/g出现。后2天都是随着浓度升高酶活降低。

|
图 3 中国圆田螺肾脏中ERND活性变化情况
Fig. 3 The activities of ERND in kidney of C. chinensis
|
而在时间图中第1天酶活随着浓度升高而降低,第2天、第3天随着浓度升高而呈现先升高后降低的情况,并且分别在15和30 μg/g的位置出现最高点。后两天酶活性则是随着浓度升高而明显降低。
2.4 中国圆田螺胃中ERND酶活性的测定结果中国圆田螺胃中红霉素-N-脱甲基酶(ERND)活性变化如图 4所示。浓度图中除15 μg/g罗红霉素剂量组第1天外,其他实验组与对照组相比均表现为显著差异。除30 μg/g罗红霉素剂量组外,其他3个组在前2天时均表现为上升并达到最大值,在后3天则持续下降,而30 μg/g罗红霉素剂量组前2天几乎没有变化,而是在第3天的时候表现出明显的升高,然后降低,即4个组的ERND活性均呈现先升高后降低的趋势。四组随着罗红霉素浓度的升高,呈现不变-降低-升高的趋势。
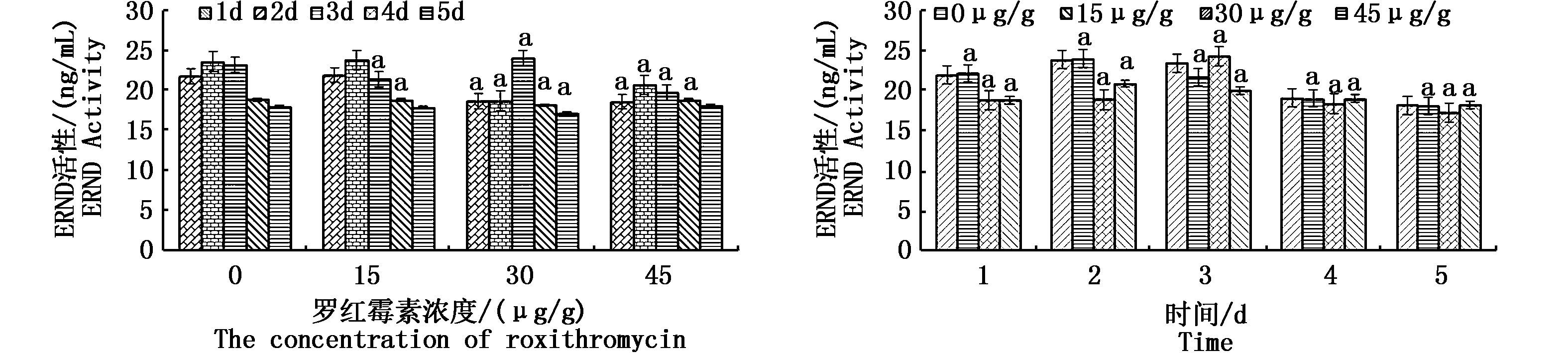
|
图 4 中国圆田螺胃中ERND活性变化情况
Fig. 4 The activities of ERND in stomach of C. chinensis
|
时间图中随着暴露时间的延长,酶活性基本上是呈现随着罗红霉素浓度升高而降低的现象。实验组和对照组出现显著差异。
2.5 中国圆田螺卵巢中ERND酶活性的测定结果中国圆田螺卵巢中红霉素-N-脱甲基酶(ERND)活性变化如图 5所示。浓度图中实验组与对照组相比均表现为显著差异。

|
图 5 中国圆田螺卵巢中ERND活性变化情况
Fig. 5 The activities of ERND in stomach of C. chinensis
|
而时间图中第1天随着浓度的升高酶活先升高后降低,但总体和对照组没有太明显的差异。第2天时实验组和对照组有了显著差异,升高后降低并且在30 μg/g时到达最高的。第3天时随着浓度升高酶活性有明显的下降。第4天则是先下降后升高。第5天没有显著差异。
3 讨论研究了罗红霉素对中国圆田螺肝脏、肾脏、胃和卵巢中红霉素-N-脱甲基酶(ERND)活性的影响,结果表明,ERND在中国圆田螺肝脏、肾脏、胃和卵巢中均有分布,含量没有显著差异。罗红霉素对不同组织中ERND的活性的影响趋势大致相同,总体来说,都是先促进后抑制,在卵巢中,ERND活性变化较小,可能是由于卵巢中ERND对罗红霉素不敏感,不同浓度的罗红霉素对中国圆田螺各组织中的ERND活性影响不是很大。肾脏和胃最大酶活是在第2天出现,而肝脏和卵巢则是在第3天出现。这可能和肝脏作为免疫器官有关,在暴露于罗红霉素后肝脏合成的ERND大量转运到其他器官,而后才是肝脏自己开始氧化外来化学物质。
化学物质在生物体内代谢过程包括Ⅰ相代谢和Ⅱ相代谢两种。抗生素在Ⅰ相代谢组被还原氧化或者分解。催化Ⅰ相代谢的酶主要是P450酶系。红霉素-N-脱甲基酶(ERND)是P450家族中CYP3A标志酶,对药物进行氧化还原或者水解[11]。实验中不同组织酶活性对罗红霉素的反应都是先上升再下降,推测最初一两天酶活性升高的原因是摄入罗红霉素后中华圆田螺开始大量合成ERND酶,但随着酶的大量合成,其中间产物的积累反过来抑制了酶的合成,酶活性因此下降。酶活性下降的原因也有可能是罗红霉素抑制了酶蛋白的合成,或者是阻断了电子传递链,也可能通过影响酶合成的其他途径实现。
随着暴露时间的延长,前2天酶活性都是随着罗红霉素浓度升高而呈现先升高后降低的趋势,可能是在这段时间在大量合成ERND,但合成能力有限(ATP供应不足、氨基酸数量不够等),所以才酶活先升高后降低。而后三天基本上酶活性都是随着浓度升高而下降,或者没有明显的差异,可能此时已经完成了体内罗红霉素的氧化清除工作。
本实验所使用的250倍环境浓度、500倍环境浓度以及750倍环境浓度,已经对田螺各组织中ERND活性产生明显的影响,考虑到水生生物的富集作用以及耐药性[12],以及不同环境下抗生素的作用[13],应对水体中罗红霉素等抗生素引起足够的重视。
| [1] |
李新莉, 吴犬畅, 张翠丽, 等. 罗红霉素对BALB/c小鼠肠道菌群的影响[J].
中国抗生素杂志, 2012, 37(3): 4–7.
LI X L, WU Q C, ZHANG C L, et al. Effect of roxithromycin on BALB/c mice intestinal flora[J]. Chinese Journal of antibiotics, 2012, 37(3): 4–7. |
| [2] | JOE-ANTHONY R, DAVID M. Concomitant roxithromycin use among elderly patients taking warfarin resulting in significant over-anti-coagulation.[J]. Journal of Pharmacy Practice & Research, 2015, 45(2): 182–185. |
| [3] |
李常磊. 浅谈罗红霉素的药理作用及临床应用[J].
世界最新医学信息文摘, 2015, 15(5): 34–34.
LI C L. Pharmacological action and clinical application of roxithromycin in the world[J]. The latest Medical information abstract, 2015, 15(5): 34–34. |
| [4] |
端正花, 李莹莹, 陈静, 等. 中国圆田螺壳在镉污染中的指示作用[J].
农业环境科学学报, 2014, 33(11): 2131–2135.
DOI:10.11654/jaes.2014.11.009 DUAN Z H, LI Y Y, CHEN J, et al. The indication of Chinese Garden Spider shell in Cadmium pollution[J]. Journal of Agro Environment Science, 2014, 33(11): 2131–2135. DOI:10.11654/jaes.2014.11.009 |
| [5] |
刘佳, 黄宇虹, 王保和, 等. 姜黄素类化合物体内代谢途径及其代谢产物的研究进展[J].
现代药物与临床, 2015, 30(12): 1553–1557.
LIU J, HUANG Y H, WANG B H, et al. Advances in metabolic pathways and their metabolites in curcuminoids[J]. Drugs & Clinic, 2015, 30(12): 1553–1557. |
| [6] |
张沂, 于春令, 邸秀珍, 等. 氟喹诺酮类药物对大鼠肝微粒体细胞色素P450酶系的影响[J].
解放军医学杂志, 2012, 37(11): 1059–1063.
ZHANG Y, YU C L, DI X Z, et al. Effects of fluoroquinolones on cytochrome P450 enzyme system in rat liver microsomes[J]. Medical Journal of Chinese People's Liberation Army, 2012, 37(11): 1059–1063. |
| [7] |
黎雯, 徐盈, 吴文忠. 鱼肝EROD酶活力诱导作为二噁英的水生态毒理学指标[J].
水生生物学报, 2000, 24(3): 201–207.
LI W, XU Y, WU W Z. EROD enzyme activity induced by fish liver as an indicator of dioxin[J]. Acta Hydrobiologica Sinica, 2000, 24(3): 201–207. |
| [8] |
陈大健, 王加才, 张萍, 等. 氟苯尼考对鲫鱼CYP2E1活性影响的药代动力学评价[J].
中国兽医科学, 2007, 37(3): 269–273.
CHEN D J, WANG J C, ZHANG P, et al. Pharmacokinetic study on the effect of florfenicol on CYP2E1 activity in Carassius auratus[J]. Veterinary Science in China, 2007, 37(3): 269–273. |
| [9] |
章强, 辛琦, 朱静敏, 等. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J].
环境化学, 2014, 33(7): 1075–1083.
DOI:10.7524/j.issn.0254-6108.2014.07.001 ZHANG Q, XIN Q, ZHU J M, et al. Research progress on current situation of antibiotic pollution and its eco-environmental effects in main water areas in China[J]. Environmental Chemistry, 2014, 33(7): 1075–1083. DOI:10.7524/j.issn.0254-6108.2014.07.001 |
| [10] | WANG H W, YANG L K, ZHANG J, et al. Effect of Roxithromycin on the morphology of tissues in the liver of Cipangopaludina chinensis[J]. Applied Mechanics and Materials, 2014: 67–70. |
| [11] |
周凡, 林玲, 何丰, 等. 恩诺沙星注射对中华鳖肝脏Ⅰ相、Ⅱ相酶活性的影响[J].
浙江农业学报, 2013, 25(6): 1228–1233.
ZHOU F, LIN L, HE F, et al. Effect of enrofloxacin injection on turtle liver phase Ⅰ, phase Ⅱ enzyme activity[J]. Acta Agriculturae Zhejiangensis, 2013, 25(6): 1228–1233. |
| [12] |
王瑞君, 熊筱娟. 胸蛙烂皮病奇异变形杆菌的分离、鉴定及对药物敏感性研究[J].
淡水渔业, 2012, 42(4): 31–34.
WANG R J, XIONG X J. Isolation, identification and drug sensitivity of Proteus mirabilis isolated from the skin of Rana spinosa[J]. Freshwater Fishing, 2012, 42(4): 31–34. |
| [13] |
周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染[J].
生态毒理学报, 2007, 2(3): 243–251.
ZHOU Q X, LUO Y, WANG M E. Antibiotic environmental residues, ecotoxicity and resistance gene contamination[J]. Asian Journal of Ecotoxicology, 2007, 2(3): 243–251. |
 2017,
Vol. 26
2017,
Vol. 26

