2. 上海城投原水有限公司青草沙水库管理分公司, 上海 201913
青草沙饮用水源地位于长兴岛北侧、长江口南北港分流口下方,属上海崇明县管辖,而长江口属于海洋、淡水生物栖息地间的生态交错区域,其水域具有特殊的生态环境。该水源地的开发项目于2007年6月正式开工,2010年12月开始试运行,到了2011年6月项目即全面投入运行,总面积约达67.2 km2,相当于10个西湖的水域面积,其拥有的7.19×106 m3/d供水规模,弥补了上海市原水供应缺口,使得超过1 100万人口受益,为上海市开创了原水水源供给的新格局。青草沙水库拥有丰富的水量以及优良的水质,因此是上海市难得的优良水源地和城市供水的战略储备地[1],也是国内最大的蓄淡避咸的河口江心水库,同时还是目前世界上最大的边滩水库[2]。
浮游藻类的优势种能有效地适应水体环境变化,并能抵制该变化造成的干扰,从而维持不同水域环境下浮游藻类群落的稳定和演替[3]。某些特定浮游藻类的演替可体现水体的营养水平[4],而环境条件的改变也会影响到浮游藻类优势种的变化[5]。为了控制污染、保护生物多样性及保持生态平衡,浮游藻类优势种的研究等前期工作就显得尤为必要。国内外已有大量文献报道过不同水域中浮游藻类群落结构的特征及其与水环境的关系[6-8],也有学者在青草沙水库运行初期进行过相关的调查研究[9-11],但针对浮游藻类优势种的组成、变化及其与环境因子的关系鲜有报道。本文研究浮游藻类优势种的组成及其变化,探讨优势种演替规律,分析重要优势种的分布特征,并将优势种种类与环境因子作RDA分析,探讨诱发青草沙水库优势种演替的环境因子,以期为水生生物群落的后续演替研究提供理论依据和参考,为青草沙水体营养状况的判定及富营养化防治提供重要依据。
1 材料与方法 1.1 站点布设和采样频率本调查组于2014—2015年每月下旬在青草沙水库进行浮游藻类调查。根据青草沙水库的自然形态、水文规划状况等特点[12],在水库上、中、下游和3个闸门等处共布设11个采样站点(表 1、图 1)。生物学物候上一般以3—5月为春季,6—8月为夏季,9—11月为秋季,12月、1—2月为冬季。

|
表 1 青草沙水库采样站点的经纬度 Tab.1 The latitude and longitude of sampling sites in Qingcaosha Reservoir |

|
图 1 青草沙水库调查站点图
Fig. 1 Map of sampling sites in Qingcaosha Reservoir
|
采用YSI 6600EDS现场测定水温(WT)、溶氧(DO)、酸碱度(pH),用塞氏盘测定透明度(SD),用日本BPL8-PS7FL回声测深仪测定水深(D),用HANNA HI9811-5便携式测定仪测定电导率(EC),对带回实验室的样品分析总氮(TN)、总磷(TP),采用国标(GB/T 11892—1989)的方法测定高锰酸盐指数(CODMn)。
1.3 浮游藻类样品处理与实验方法采用2.5 L柱状采水器于水面下0.5 m处的浅表水层采集10 L水样,经过充分混匀后取1 L体积的水,立即加入10 mL鲁哥氏碘液及5 mL左右的中性甲醛溶液固定,带回实验室后,置于分液漏斗中静置沉淀48 h,将样品浓缩定容至50 mL血清瓶中,用光学显微镜Olympus CX21对藻类进行鉴别和细胞计数[13],重复计数两次并取平均值后换算成1 L样品中浮游藻类的总细胞数。浮游藻类的鉴定主要参考齐雨藻、胡鸿钧和王全喜等的文献[14-16]。
1.4 数据处理和分析种类优势度(Y)的计算公式为:
 (1)
(1)
式中:Ni为群落中第i个物种的个体数量,N为群落中所有个体数量,fi为群落中第i种的出现频率。当Y>0.02时即为优势种[17]。
种类更替率(R)的计算公式为[18]:R(%) =[
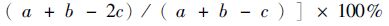 (2)
(2)
式中:a为2014年的种类数,b为2015年的种类数,c为两年共有的种类数。
作图采用Origin 9软件完成,利用SPSS 19.0软件和CANOCO of Windows 4.5软件对数据进行统计分析。
2 结果与分析 2.1 青草沙水库的理化因子2015年青草沙水库的理化数据与2014年的相比,水深有所增加,水温、溶解氧年均值有所上升,pH呈弱碱性,透明度、溶解氧范围变大,电导率明显下降,TN浓度、TP浓度、CODMn两年间差异不大(表 2)。
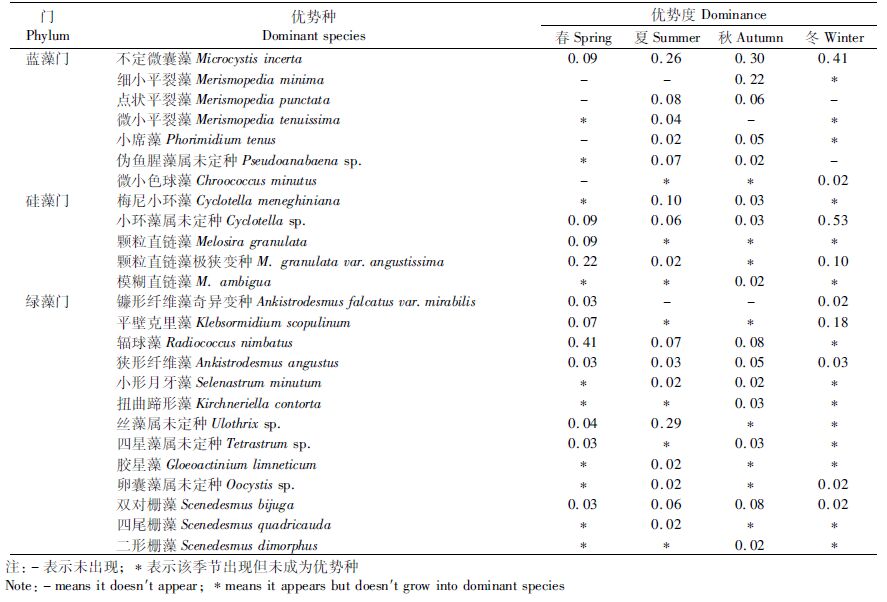
2.2 浮游藻类优势种的组成2014年共发现优势种25种,隶属于4门17属。优势种以蓝藻和绿藻居多,其中蓝藻门7种,占28.00%;硅藻门5种,占20.00%;绿藻门13种,占52.00%。优势度排前4位的优势种依次为不定微囊藻(Microcystis incerta)、细小平裂藻(Merismopedia minima)、丝藻属未定种(Ulothrix sp.)和辐球藻(Radiococcus nimbatus)。
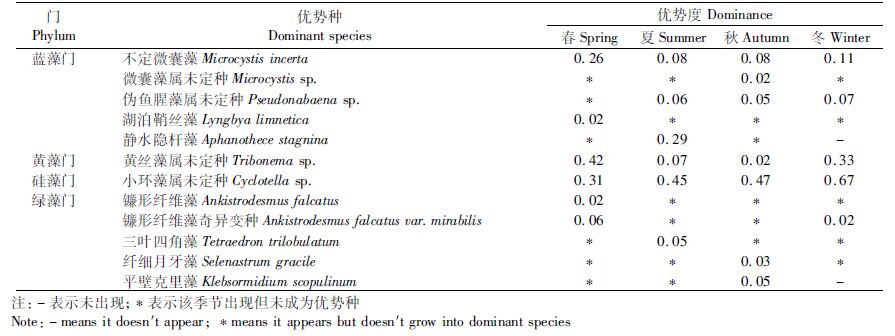
2015年共发现优势种12种,隶属于4门10属。优势种以蓝藻和绿藻居多,其中蓝藻门和绿藻门均为5种,各占41.67%;硅藻门和黄藻门均为1种,各占8.33%。优势度排前4位的优势种依次为小环藻属未定种(Cyclotella sp.)、静水隐杆藻(Aphanothece stagnina)、黄丝藻属未定种(Tribonema sp.)和不定微囊藻。

|
表 2 青草沙水库的主要理化因子的年均值及其范围 Tab.2 Annual average and the range of main physicochemical factors in Qingcaosha Reservoir |
青草沙水库优势种在这两年间既有延续又有更替,两年皆出现的优势种为:不定微囊藻、伪鱼腥藻属未定种(Pseudoanabaena sp.)、小环藻属未定种、镰形纤维藻奇异变种(Ankistrodesmus falcatus var.mirabilis)和平壁克里藻(Klebsormidium scopulinum)。浮游藻类优势种物种更替率为84.38%,表明两年间青草沙水库浮游藻类优势种物种的更替变化较为明显,2015年较前一年优势种种类数减少将近一半,并出现优势度较大的新的优势种:黄丝藻属未定种。
2.3 浮游藻类优势种的季节变化2014—2015年青草沙水库浮游藻类优势种存在较为明显的季节变化(表 3,4),并且两年的优势种种类数季节变化趋势上并不一致。2014年浮游藻类优势种种类数的季节变化表现为:夏季(16种)>秋季(15种)>春季(11种)>冬季(9种),浮游藻类优势种在4个季度中多以蓝藻和绿藻为主,尤其以绿藻居多。2015年出现的浮游藻类优势种种类数4季相差不大,秋季(7种)>春季、夏季(均为6种)>冬季(5种),同样以蓝藻和绿藻为主。
|
表 3 青草沙水库浮游藻类优势种及优势度(2014年) Tab.3 The dominance of dominant species of planktonic algae in Qingcaosha Reservoir(2014) |
|
表 4 青草沙水库浮游藻类优势种及优势度(2015年) Tab.4 The dominance of dominant species of planktonic algae in Qingcaosha Reservoir(2015) |
2014—2015各个季节共有的优势种均为3种,冬春季分别为不定微囊藻、小环藻属未定种和镰形纤维藻奇异变种;夏秋季分别为不定微囊藻、伪鱼腥藻属未定种和小环藻属未定种。2014年小席藻(Phorimidium tenus)、微小平裂藻(Merismopedia tenuissima)、点状平裂藻(Merismopedia punctata)、细小平裂藻是夏秋季的蓝藻优势种,但2015年这些蓝藻优势种演替为湖泊鞘丝藻(Lyngbya limnetica)、静水隐杆藻和微囊藻属未定种(Microcystis sp.)占优势。总的来说,2014—2015年间浮游藻类的优势种数量呈现夏秋季多、冬春少的特点,所属门类主要为蓝藻门、硅藻门、绿藻和黄藻门,具有夏秋季蓝藻占优势,春夏季绿藻占优势,冬春季硅藻、黄藻占优势的特征(图 2)。

|
图 2 青草沙水库优势种种类数的季节变化
Fig. 2 Seasonal variation in the number of dominant species in Qingcaosha Reservoir
|
因为2014年和2015年优势度最大的优势种分别为不定微囊藻和小环藻属未定种,且两种藻类又是两年的共同优势种,黄丝藻属未定种为2015年新出现的优势种,且优势度较大,所以将这3种藻类作为青草沙水库的重要优势种,对其进行生物密度周年变化的研究。
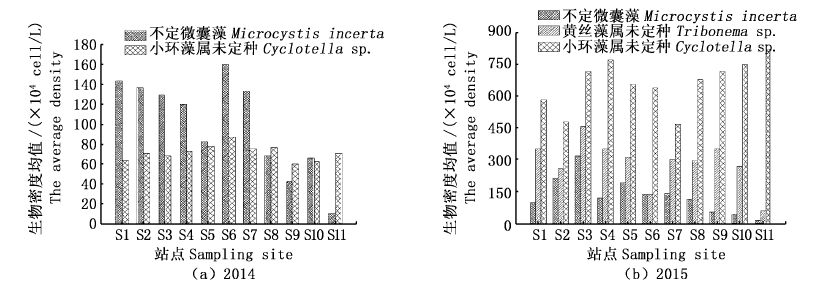
不定微囊藻2014年的生物密度年均值为(97.99±124.58)×104 cells/L,占总藻类年平均生物密度的19.62%,单因素方差分析(one-way ANOVA)可得:各月间的生物密度有极显著变化(F=24.083,P<0.01),各站点间无显著差异(F=1.112,P>0.05,图 5a);2015年的生物密度年均值为(130.25±156.10)×104 cells/L,占总藻类各站点年平均生物密度的8.97%,各月间的生物密度有极显著变化(F=13.911,P<0.01),各站点间有显著差异(F=2.235,P<0.05,图 5b)。不定微囊藻出现于两年的所有月份中且均有较大的优势度,两年间的生物密度变化趋势总体上一致,但2015年其对总生物密度的贡献率有所降低(图 3a)。

|
图 3 青草沙水库不定微囊藻和小环藻属未定种生物密度的周年变化(2014—2015)
Fig. 3 Annual variation of density of Microcystis incerta and Cyclotella sp.in Qingcaosha Reservoir(2014—2015)
|
|
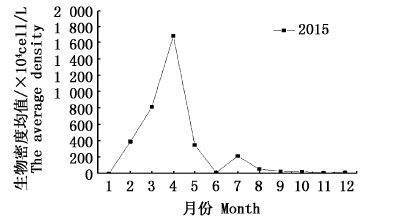
图 4 青草沙水库黄丝藻属未定种生物密度的周年变化
Fig. 4 Annual variation of density of Tribonema sp.in Qingcaosha Reservoir
|
小环藻属未定种2014年的生物密度年均值为70.73×104 cells/L,占总藻类各站点年平均生物密度的14.16%,各月间的生物密度有极显著变化(F=26.001,P<0.01),各站点间无显著差异(F=0.833,P>0.05,图 5a);2015年的生物密度年均值为664.50×104 cells/L,占总藻类各站点年平均生物密度的45.79%,各月间的生物密度亦有极显著变化(F=1.997,P<0.05),各站点间亦无显著差异(F=1.158,P>0.05,图 5b)。小环藻属未定种出现于两年的所有月份中,且在2015年成为全年优势种,无论从优势度还是对总生物密度的贡献率来说,2015年相对2014年均有明显提升(图 3b)。
|
图 5 青草沙水库重要优势种密度的空间分布
Fig. 5 Spatial distribution of the important dominant species density in Qingcaosha Reservoir
|
黄丝藻属未定种2014年未成为优势种;2015年生物密度年均值为298.26×104 cells/L,占总藻类年平均生物密度的20.55%,各月间的生物密度存在极显著的变化(F=34.084,P<0.01),但各站点间无显著差异(F=0.988,P>0.05,图 5b)。2015年3、4月黄丝藻迅猛增长,生物密度急剧升高,均值分别达到813.42×104 cells/L和1 685.65×104 cells/L,占当月总生物密度的49.46%和61.73%,夏季之后黄丝藻数量呈现明显的下降趋势(图 4)。
2.5 浮游藻类优势种与环境因子的关系为了使藻类密度的数据呈现正态分布,首先对其进行lg(x+1)转换处理[19-21],之后对2014和2015年的优势种进行去趋势对应分析(DCA)[22-23],从所得的各特征值中看出,4个排序轴中梯度最大的值分别是2.384、1.688(均小于3),故选择线性模型RDA较合适。对2014年的浮游藻类优势种及环境因子数据的分析显示,前两个排序轴的特征值依次为0.239和0.068,物种与环境相关性轴1特征值为0.826,轴2为0.732。对2015年的浮游藻类优势种及环境因子数据的分析显示,前两个排序轴的特征值依次为0.160和0.138,物种与环境相关性轴1特征值为0.796,轴2为0.733,RDA说明了两年度的两个排序轴均能较好地反映青草沙水库浮游藻类优势种与各环境因子之间的相互关系。环境因子缩写和优势种代码见表 2和表 5。图 6a显示:2014年大多数优势种类与水温、电导率、TN、TP呈正相关关系,与pH、溶解氧呈负相关关系;图 6b显示:2015年各优势种与水温的关系不尽相同,大多数优势种类与TN、TP呈正相关关系,与溶解氧呈负相关关系。水温是两年间3种重要优势种的主要影响因子,不定微囊藻密度与水温呈正相关关系;黄丝藻属未定种和小环藻属未定种与水温呈负相关关系。

|
表 5 两年间青草沙水库RDA中的优势种代码 Tab.5 The dominant species during two years in Qingcaosha Reservoir and the codes of species in RDA |

|
图 6 青草沙水库浮游藻类物种与环境因子的RDA排序图
Fig. 6 RDA ordination diagram between planktonic algae species and environmental factors in Qingcaosha Reservoir
|
2015年与2014年相比,青草沙水库优势种种类数有下降的趋势,主要减少了绿藻门的种类,优势种的种类依然以蓝藻、绿藻为主,它们大多是耐污性比较强的种类,这与亚热带地区其他水库中的优势种类群特征类似[24-25]。由于黄丝藻属未定种的出现和小环藻属未定种优势度的提高,两者在2015年占据绝对优势地位,比2014年明显增加的原因可能与长江来水中这两种藻的生物密度的增加有密切关系,取代了蓝藻门和绿藻门的许多优势种,从而使2015年优势种种类数大量减少且没有明显的季节变化,同时也是两年共同优势种较少的一个原因。对比2014年和2012年[10],优势种的季节性变化特征相似,种类数均表现出夏秋季多、冬春季少的特征,优势种所属门类均属绿藻最多,并呈现夏秋季蓝藻多、冬春季硅藻多的特点。总体上,2012、2014、2015年各个季节的优势种种类数呈现下降趋势。
本调查期间青草沙水库已运行了4、5年,一般于冬季关闭下游闸门进行蓄水,其余季节进行换水,可能由于这种运行方式改变了水库的理化环境,致使两年间浮游藻类优势种更替变化明显。2015年优势度较大的黄丝藻在长江口亦大量出现并成为优势种[26],青草沙水库地处长江口,水体容易受到长江口流域来水水质的影响,因此对长江口水域的监测至关重要,今后应加大对长江口来水中浮游藻类动态变化的关注力度。
3.2 青草沙水库浮游藻类优势种对环境因子的响应水温是影响青草沙水库藻类生长最基本的生态因子,这与国内外一些学者的研究中提出的水温是影响浮游藻类生长的最直接因素这一结论相一致[7, 27]。水温对藻类的数量分布和生长速率的影响很大,不同藻类生长的最适温度不同,库区水温对优势种类群的影响十分明显,冬春季温度低,适合黄藻、硅藻的增殖;夏季水温逐渐升高,促使蓝藻和绿藻大量繁殖;秋季之后入冬,又是黄藻和硅藻生长旺盛之际。优势种类群的演替存在明显的季节规律,优势种的生物密度、生物量会随季节的更替而改变,一般会随水温的上升而增多,因此大多数优势种与水温呈正相关关系。这也与路娜、陈立婧等对水温与藻类关系的分析相一致[17, 28]。
蓝藻对高温和强光适应性强,具有极好的抗紫外能力,能在低光条件下获得优势,生理代谢水平低[29],因此青草沙水库蓝藻门的种类也容易在温度较高的夏季(平均水温28.3 ℃)和秋季(平均水温20.5 ℃)占优势,与RDA分析中大多数蓝藻尤其是不定微囊藻与水温呈较好正相关的结果相符。黄丝藻属生长旺盛季节为春季,黄丝藻属未定种在2015年冬春季有较大优势度,余涛对巢湖的研究结果[30]也表明小型黄丝藻只在冬春成为优势种。硅藻数量暖季少冷季多[31],因为温带硅藻都是在比较低的温度时生长,而不适宜在高温环境中生存,小环藻属未定种两年均在冬季优势度最大,适宜的水温可能是其优势度和密度升高的较大因素,这与大多硅藻门种类尤其是小环藻属未定种与水温呈负相关的结果相吻合。
营养盐是影响浮游藻类群落结构分布和数量的重要因素,能直接影响其动态变化。2015年优势种生物密度与总氮、总磷呈正相关关系。一般情况下,水体中氮磷浓度的增加会引起浮游藻类密度的剧增,在合适的氮磷比值范围内,浮游藻类的增殖速度与水体氮磷含量呈正相关关系,许多研究也表明营养盐能促进藻类的增殖,与浮游藻类密度有正相关性[32-33]。
pH过低或过高会抑制藻细胞体内某些酶类的活性,影响藻类代谢,导致其生长繁殖速率下降[34],碱性系统易于捕获大气中的CO2,更利于藻类光合作用,因此较高的生产力通常出现于碱性水环境中[35],有研究表明pH 8.5时水体碳酸系统稳定性较高,此时藻类生长最好[36]。水库两年的pH均值为8.4、8.5,弱碱性的环境适宜藻类的生长繁殖。除此以外,青草沙水库处于亚热带季风气候区,全年降雨量相对较多,而降雨的季节性变化又是影响营养盐浓度和水动力学过程的关键因素,从而会间接影响浮游藻类优势种的生态特征。浮游藻类优势种的变化较为迅速,加上群落结构的演替也较复杂,仍需进行长期且深入的调查。
总之,水库在保持水质清澈的同时需要更好地利用生态湿地资源,加强调控来提高水库的生物多样性。在水库今后的管理调控中,应做好实时监测和应急响应工作,在可能暴发藻类的区域、季节采取相应的防控预警措施,防止水源地水质的进一步恶化,以保证居民饮用水的安全。
| [1] | 蒋增辉.青草沙水库浮游藻类的调查及控制[J]. 净水技术, 2012, 31(5): 9–14. JIANG Z H.Investigation and control of phytoplankton in Qingcaosha reservoir[J]. Water Purification Technology, 2012, 31(5): 9–14. |
| [2] | 孙陆宇, 温晓蔓, 禹娜, 等.上海青草沙水库后生浮游动物群落结构[J]. 复旦学报(自然科学版), 2013, 52(1): 119–128. SUN L Y, WEN X M, YU N, et al.Community structure of metazoan zooplankton in Qingcaosha reservoir, Shanghai[J]. Journal of Fudan University (Natural Science), 2013, 52(1): 119–128. |
| [3] | 王铭玮. 上海城市水源地蓝藻暴发的影响因素及控制管理体系研究[D]. 上海: 华东师范大学, 2011. WANG M W. Research on factors, control and management system of cyanobacteria blooming in water source in Shanghai[D]. Shanghai: East China Normal University, 2011. |
| [4] | MARCHETTO A, PADEDD B M, MARIANI M A, et al.A numerical index for evaluating phytoplankton response to changes in nutrient levels in deep Mediterranean reservoirs[J]. Journal of Limnology, 2009, 68(1): 106–121. DOI:10.4081/jlimnol.2009.106 |
| [5] | KAMENIR Y, DUBINSKY Z, ZOHARY T.Phytoplankton size structure stability in a meso-eutrophic subtropical lake[J]. Hydrobiologia, 2004, 520(1/3): 89–104. |
| [6] | WETZEL R G. Limnology[M]. New York: Saunders College Publishing, 1983: 342-407. |
| [7] | REYNOLDS C S. The ecology of freshwater phytoplankton[M]. Cambridge: Cambridge University Press, 1984: 1-5. |
| [8] | LUNGAYIA H B O, M’HARZI A, TACKX M, et al.Phytoplankton community structure and environment in the Kenyan waters of Lake Victoria[J]. Freshwater Biology, 2000, 43(4): 529–543. DOI:10.1046/j.1365-2427.2000.t01-1-00525.x |
| [9] | 刘歆璞, 张玮, 王丽卿, 等.青草沙水库浮游植物群落结构及其与环境因子的关系[J]. 上海海洋大学学报, 2015, 24(4): 532–543. LIU X P, ZHANG W, WANG L Q, et al.Structure of phytoplankton community and its relationship with environmental factors in Qingcaosha Reservoir[J]. Journal of Shanghai Ocean University, 2015, 24(4): 532–543. |
| [10] | 周莉莉. 河口水库浮游植物变化特征及环境管理体系探讨[D]. 上海: 华东师范大学, 2014. ZHOU L L. Research on phytoplankton and enviromental management system of estuarine reservoir[D]. Shanghai: East China Normal University, 2014. |
| [11] | 赵冉, 孙振中, 张玉平, 等.青草沙邻近水域网采浮游植物群落结构特征[J]. 渔业科学进展, 2014, 35(3): 9–18. ZHAO R, SUN Z Z, ZHANG Y P, et al.The netz-phytoplankton assemblage structure of Qingcaosha Reservoir adjacent waters[J]. Progress in Fishery Sciences, 2014, 35(3): 9–18. |
| [12] | 陈伟民, 黄祥飞, 周万平, 等. 湖泊生态系统观测方法[M]. 北京: 中国环境科学出版社, 2005: 41-47. CHEN W M, HUANG X F, ZHOU W P, et al. Lake ecosystem observation method[M]. Beijing: China Environmental Science Press, 2005: 41-47. |
| [13] | 黄祥飞. 湖泊生态调查观测与分析[M]. 北京: 中国标准出版社, 2000: 72-79. HUANG X F. Survey, observation and analysis of lake ecology[M]. Beijing: China Standard Press, 2000: 72-79. |
| [14] | 齐雨藻. 中国淡水藻志: 第四卷: 硅藻门, 中心纲[M]. 北京: 科学出版社, 1995: 13-17. QI Y Z. Flora algarum sinicarum aquae dulcis (tomus IV) bacillariophyta, centreae[M]. Beijing: Science Press, 1995: 13-17. |
| [15] | 胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态[M]. 北京: 科学出版社, 2006: 23-903. HU H J, WEI Y X. The freshwater algae of China: systematics, taxonomy and ecology[M]. Beijing: Science Press, 2006: 23-903. |
| [16] | 王全喜. 中国淡水藻志: 第十一卷: 黄藻门[M]. 北京: 科学出版社, 2007: 43-57. WANG Q X. Flora algarum sinicarum aquae dulcis: tomus XI: Xanthophyta[M]. Beijing: Science Press, 2007: 43-57. |
| [17] | 陈立婧, 吴竹臣, 胡忠军, 等.上海崇明岛明珠湖浮游植物群落结构[J]. 应用生态学报, 2011, 22(6): 1599–1605. CHEN L J, WU Z C, HU Z J, et al.Phytoplankton community structure in Mingzhu Lake of Chongming Island, Shanghai[J]. Chinese Journal of Applied Ecology, 2011, 22(6): 1599–1605. |
| [18] | 连光山, 林玉辉, 蔡秉及. 大亚湾浮游动物群落的特征[C]//大亚湾海洋生态文集. 北京: 海洋出版社, 1990: 274-281. LIAN G S, LIN Y H, CAI B J. Characteritics community of zooplankton in Daya Bay[C]//Collections of Papers on Marine Ecology in the Daya Bay. Beijing: Ocean Press, 1990: 274-281. |
| [19] | 路学堂. 东平湖浮游植物群落结构与驱动因子及蓝藻水华可能性研究[D]. 济南: 山东大学, 2013. LU X T. The research on phytoplankton community, driving environmental factors and the possibility of cyanobacterial bloom in Dongping Lake, China[D]. Ji'nan: Shandong University, 2013. |
| [20] | 邱小琮, 赵红雪, 孙晓雪.宁夏沙湖浮游植物与水环境因子关系的研究[J]. 环境科学, 2012, 33(7): 2265–2271. QIU X C, ZHAO H X, SUN X X.Studies on relationship of phytoplankton and water environmental factors in Shahu Lake[J]. Environmental Science, 2012, 33(7): 2265–2271. |
| [21] | 万莉. 四明湖水库浮游生物群落结构及其动态[D]. 宁波: 宁波大学, 2014. WAN L. The community structure and dynamics of plankton in Siminghu reservoir[D]. Ningbo: Ningbo University, 2014. |
| [22] | 蒋荣根. 厦门湾及其邻近海域富营养化特征分析与评价[D]. 厦门: 国家海洋局第三海洋研究所, 2014. JIANG R G. Analysis and assessment on the characteristics of eutrophication in the Xiamen bay and its adjacent coastal waters[D]. Xiamen: Third Institute of Oceanography, State Oceanic Administration, 2014. |
| [23] | 陶晶晶. 滴水湖及其外围水体浮游植物群落结构与水质评价[D]. 上海: 上海师范大学, 2013. TAO J J. Study on the change structure of phytoplankton community and water quality evaluation in Dishui Lake and its surrounding waters[D]. Shanghai: Shanghai Normal University, 2013. |
| [24] | 胡韧. 珠海水库富营养化现状、浮游植物群落特征与蓝藻水华风险分析[D]. 广州: 暨南大学, 2009. HU R. Eutrophication, phytoplankton assemblage and blue-green algal blooms in Zhuhai reservoirs[D]. Guangzhou: Ji'nan University, 2009. |
| [25] | 胡韧, 熊江霞, 韩博平.具有短水力滞留的小型富营养化水库浮游植物群落结构与动态[J]. 生态环境, 2008, 17(4): 1319–1326. HU R, XIONG J X, HAN B P.Structure and dynamics of phytoplankton assemblage in a small eutrophic reservoir with a short residence time[J]. Ecology and Environment, 2008, 17(4): 1319–1326. |
| [26] | 刘笑. 长江口浮游植物与轮虫群落生态研究[D]. 上海: 上海海洋大学, 2015. LIU X. The characteristics of community structure of phytoplankton and the rotifer in Yangtze River Estuary[D]. Shanghai: Shanghai Ocean University, 2015. |
| [27] | 路娜, 尹洪斌, 邓建才, 等.巢湖流域春季浮游植物群落结构特征及其与环境因子的关系[J]. 湖泊科学, 2010, 22(6): 950–956. LU N, YIN H B, DENG J C, et al.Spring community structure of phytoplankton from Lake Chaohu and its relationship to environmental factors[J]. Journal of Lake Sciences, 2010, 22(6): 950–956. |
| [28] | 张丽霞. 南湾水库水质与藻类变化关系和不同光强对铜绿微囊藻的影响[D]. 信阳: 信阳师范学院, 2009. ZHANG L X. The relationship of the algae and Nanwan reservoir and the impact of different light on the Microcystic Aeruginosa[D]. Xinyang: Xinyang Normal University, 2009. |
| [29] | 余涛. 巢湖浮游植物群落结构研究[D]. 合肥: 安徽大学, 2010. YU T. Phytoplankton community structure in Chaohu Lake[D]. Hefei: Anhui University, 2010. |
| [30] | 郭沛涌, 林育真, 李玉仙.东平湖浮游植物与水质评价[J]. 海洋湖沼通报, 1997: 37–42. GUO P Y, LIN Y Z, LI Y X.Study on phytoplankton and evaluation of water quality in Dongping Lake[J]. Transactions of Oceanology and Limnology, 1997: 37–42. |
| [31] | 景钰湘. 上海滴水湖浮游藻类群落结构特征及水质评价[D]. 上海: 上海海洋大学, 2012. JING Y X. The characteristics of community structure of planktonic algae and water quality assessment in Dishui Lake, Shanghai[D]. Shanghai: Shanghai Ocean University, 2012. |
| [32] | 梁晓霞. 晋阳湖浮游藻类群落结构与水体生态修复研究[D]. 太原: 山西大学, 2009. LIANG X X. Studies on community structures of plankton and ecological restoration of water in Jinyang Lake[D]. Taiyuan: Shanxi University, 2009. |
| [33] | 王镜岩, 朱圣庚, 徐长法. 生物化学(上)[M]. (3版). 北京: 高等教育出版社, 2002: 397-398. WANG J Y, ZHU S G, XU C F. Biological chemistry (volume one)[M]. (3版). Beijing: Higher Education Press, 2002: 397-398. |
| [34] | MELACK J M.Photosynthetic activity of phytoplankton in tropical African soda lakes[J]. Hydrobiologia, 1981, 81/82(1): 71–85. DOI:10.1007/BF00048707 |
| [35] | 刘春光, 金相灿, 孙凌, 等.pH值对淡水藻类生长和种类变化的影响[J]. 农业环境科学学报, 2005, 24(2): 294–298. LIU C G, JIN X C, SUN L, et al.Effects of pH on growth and species changes of algae in freshwater[J]. Journal of Agro-environment Science, 2005, 24(2): 294–298. |
2. Qingcaosha Reservoir Management Branch, Shanghai Smi Raw Water Co. Ltd, Shanghai 201913, China
 2017,
Vol. 26
2017,
Vol. 26


