2. 中国水产科学研究院无公害渔药创制中心, 北京 102488;
3. 北京鑫洋水产高新技术有限公司, 北京 102488;
4. 全国水产技术推广总站, 北京 100125
目前,微生态制剂已成为水产动物疾病防治的重要手段之一,具有广阔的应用前景[1]。其中,枯草芽孢杆菌和地衣芽孢杆菌等益生菌的生产和应用已较为成熟[2-5]。新的益生菌的分离鉴定、功能研究和发酵条件的摸索将会进一步推动微生态制剂领域的发展。
鲍鱼希瓦氏菌最初由KIM等[6] 2007年在鲍鱼肠道菌群中分离鉴定。研究发现,该菌能够促进对虾生长,增强对虾免疫力和抗病害能力[7-8];此外,有研究表明该菌能有效降解石油,有望用于海水石油污染的治理[9]。而且,在安全性实验中,未发现该菌对实验动物有明显的致病作用[10]。
综上所述,鲍鱼希瓦氏菌在水产养殖和海水污染治理中具有一定的应用前景,但尚未见其发酵条件探索的相关报道。本研究通过单因素实验和正交实验对鲍鱼希瓦氏菌的发酵条件进行优化,以期为工业生产提供实验数据支持。
1 材料与方法 1.1 菌株鲍鱼希瓦氏菌斜面菌种由本实验室分离保存[7],并提交到中国普通微生物菌种保藏管理中心,保藏号CGMCC No. 9138。
1.2 主要仪器摇床 (DSHZ-300A,苏州培英实验设备有限公司);生化培养箱 (LRH-250,上海一恒科技有限公司);70 L发酵罐 (GUJS-70,镇江东方生物工程设备技术有限责任公司);超净工作台 (SW-CJ-ICU,苏州安泰空气技术有限公司)。
1.3 培养基平板培养基:蛋白胨1%,牛肉膏0.3%,氯化钠0.5%,琼脂1.5%,pH 7.0。
基础液体培养基:蛋白胨1%,牛肉膏0.3%,氯化钠0.5%,pH 7.0。
1.4 实验方法 1.4.1 摇瓶种子培养挑取斜面培养基上的菌种,接种于基础液体培养基培养过夜,取母瓶培养物接种至子瓶,按基础培养条件 (接种量6%,温度30 ℃,转速230 r/min,装液量100 mL/500 mL) 培养18 h作为摇瓶种子。
1.4.2 单因素实验在基础培养基和培养条件下,采用单因素实验对摇瓶发酵的温度、转速、装液量、初始pH、碳源、氮源和无机盐进行优化。
1.4.3 正交实验采用三因素三水平的正交实验对碳源、氮源和无机盐的配比进行优化。
1.4.4 生长曲线绘制以最优培养基和培养条件在摇床上进行发酵,每隔4 h取样1次测定菌体生物量,直至32 h。
1.4.5 发酵罐扩大培养采用最优培养基和培养条件,在70 L发酵罐上进行扩大培养。
1.4.6 菌体生物量测定采用平板计数法,3个重复,用Excel 2007进行数据分析,数据以均数±标准误表示。
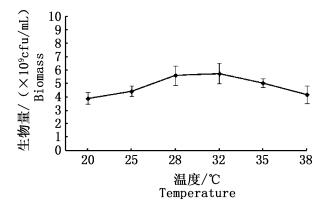
2 结果与讨论 2.1 培养条件优化 2.1.1 培养温度优化将培养温度设置为20、25、28、32、35和38 ℃,培养24 h后,取样测定菌体生物量见图 1。
|
图 1 培养温度对鲍鱼希瓦氏菌生长的影响
Fig. 1 Effect of temperature on growth of Shewanella haliotis
|
微生物的繁殖可以看作是一系列的酶促反应,而繁殖最适温度反映着相应酶促反应系统的最适温度。图 1数据显示,在20~32 ℃培养条件下菌体生物量随温度升高而增加,选取30 ℃作为最优发酵温度。温度大于32 ℃时,菌体生物量下降,有可能是温度超过了细菌繁殖的最适温度,也有可能是由于实际最适温度大于32 ℃,细菌生长过早进入衰退期所致。需要绘制生长曲线以进一步明确。
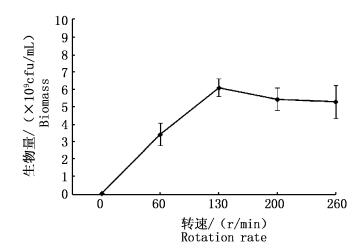
2.1.2 转速优化将摇床转速分别设置为0、60、130、200和260 r/min。培养24 h后,取样测定菌体生物量见图 2。
|
图 2 摇床转速对鲍鱼希瓦氏菌生长的影响
Fig. 2 Effect of rotation rate on growth of Shewanella haliotis
|
摇瓶转动可以增加溶解氧,分散营养物质和代谢产物。图 2数据显示,在0~130 r/min范围内,菌体生物量随转速的增加而增加。在130~260 r/min范围内,菌体生物量随转速的增加而减少,但减少不明显。因此,最优摇床转速为130 r/min。
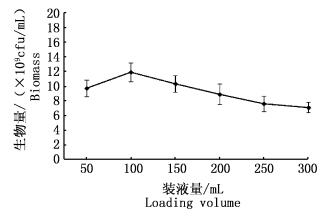
|
图 3 装液量对鲍鱼希瓦氏菌生长的影响
Fig. 3 Effect of loading volume on growth of Shewanella haliotis
|
将500 mL三角瓶装液量设置为50、100、150、200、250和300 mL。培养24 h后,取样测定菌体生物量见图 3。
摇床培养条件下,装液量与溶氧密切相关。图 3数据显示,装液量为100 mL时菌体生物量最高。
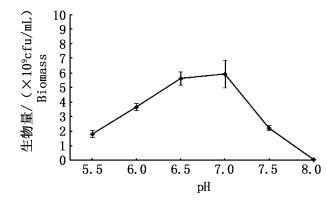
2.2 培养基优化 2.2.1 初始pH优化在最优培养条件下,将培养基的初始pH分别设定为5.5、6.0、6.5、7.0、7.5和8.0。培养24 h,测定菌体生物量见图 4。
|
图 4 初始pH对鲍鱼希瓦氏菌生长的影响
Fig. 4 Effect of initial pH on growth of Shewanella haliotis
|
图 4数据显示,当初始pH在5.5~7.0范围内,菌体生物量随pH升高而升高,pH 7.0时最高。随着pH的进一步增大,菌体生物量逐渐降低。由此可见,适合该菌繁殖的pH范围为6.5~7。因此,最优初始pH设置为6.8。
2.2.2 碳源优化在最优培养条件下,比较蔗糖、葡萄糖、可溶性淀粉、玉米淀粉和土豆淀粉这5种碳源,添加量均为6%。培养24 h后,取样测定菌体生物量见图 5。
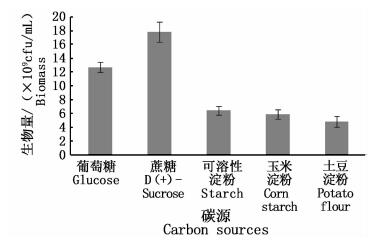
|
图 5 碳源对鲍鱼希瓦氏菌生长的影响
Fig. 5 Effect of carbon sources on growth of Shewanella haliotis
|
微生物能够利用复杂的大分子是由于其能够分泌多种多样的水解酶,将细胞外的大分子降解后进而吸收利用。图 5数据显示,蔗糖的菌体生物量最大,其次是葡萄糖,而淀粉类多糖的生物量较低,这可能是由于该菌分泌淀粉酶类的能力较弱。但如果有实验能够证实该菌可以分泌一定量的淀粉水解相关酶类,那么将速效碳源蔗糖和迟效碳源淀粉搭配使用可能更有利于细菌生长并减少发酵成本[11]。此外,研究表明鲍鱼希瓦氏菌能够降解石油[9]。所以,也有可能使用石油产品作为其发酵的碳源。目前,选择蔗糖作为最优碳源。
2.2.3 氮源优化在最优培养条件下,选择酵母膏、蛋白胨、牛肉膏、混合氮源 (蛋白胨:牛肉膏:酵母膏=5:1:1 w/w)、NH4Cl和 (NH4)2SO4替换基础培养基中的氮源,添加量均为3.5%。培养24 h后,取样测定菌体生物量见图 6。
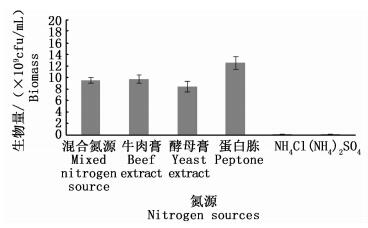
|
图 6 氮源对鲍鱼希瓦氏菌生长的影响
Fig. 6 Effect of nitrogen sources on growth of Shewanella haliotis
|
天然培养基营养丰富,不仅能作为碳源氮源,还能为微生物的生长提供微量元素和维生素类物质。图 6数据显示,有机氮源更有利于细菌的生长繁殖,其中以单独使用蛋白胨效果最好。考虑到培养基配方以简单为佳,选择单用蛋白胨作为最优氮源。
2.2.4 无机盐优化在最优培养条件下,比较NaCl、K2HPO4、NaH2PO4+Na2HPO4(1:1 w/w)、NaH2PO4+K2HPO4(1:1 w/w)、MgSO4和CaCO3这6种无机盐或无机盐组合,添加量均为0.5%。培养24 h后,取样测定菌体生物量见图 7。
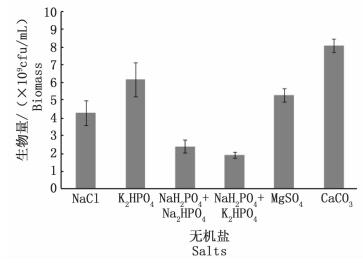
|
图 7 无机盐对鲍鱼希瓦氏菌生长的影响
Fig. 7 Effect of inorganic salts on growth of Shewanella haliotis
|
天然培养基如蛋白胨已含有满足微生物生长繁殖基本要求的无机盐,但由于微生物生理特性不同,其对无机盐的需求量也有差别。钙离子是构成细胞的重要组分,也是多种生物酶的辅因子。研究显示,碳酸钙可以促进微生物生长[12-13],还可以通过缓冲培养基pH的作用促进发酵产物的积累[14]。图 7数据显示,培养基中添加碳酸钙后的菌体生物量最大,一方面可能是因为鲍鱼希瓦氏菌对钙离子的需求量较大,而溶解度小的碳酸钙不仅能够持续提供钙离子,还能避免钙离子水平过高;另一方面可能是碳酸钙能缓冲细菌代谢过程中产生的酸,起到稳定pH的作用。所以,选择碳酸钙作为最优无机盐。
2.2.5 正交实验优化培养基配比通过单因素实验选定了碳源、氮源和无机盐,共3个因素,每个因素取3个水平。采用L9(3)4正交设计优化培养基配比 (表 1)。
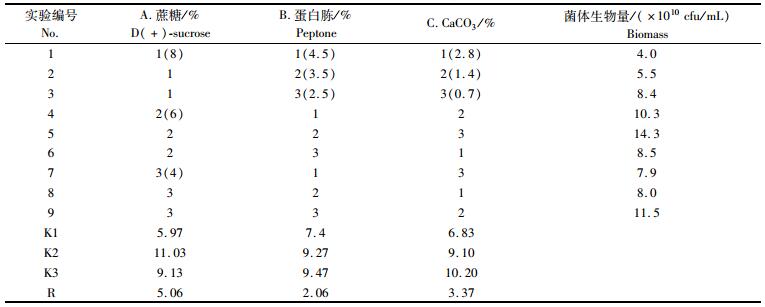
|
表 1 鲍鱼希瓦氏菌发酵培养基优化的正交实验 Tab.1 Orthogonal design for fermentation medium optimization of Shewanella haliotis |
由表 1直观分析结果可知,各因素影响大小的顺序为碳源 > 无机盐 > 氮源,表明碳源对鲍鱼希瓦氏菌生长影响最大,其次是无机盐,最后是氮源。该菌最优培养基配比为A2B3C3,即蔗糖6%、蛋白胨2.5%和碳酸钙0.7%。同时,从表 1中可见如果能进一步降低蛋白胨和碳酸钙的浓度,就有可能继续提高菌体生物量。
2.3 摇瓶发酵生长曲线的测定在最优培养基和培养条件下进行摇床发酵实验:温度30 ℃,转速130 r/min,装液量100 mL/500 mL,接种量6%,蔗糖6%,蛋白胨2.5%,碳酸钙0.7%,初始pH 6.8。绘制生长曲线以选择最优种龄和收获时间 (图 8)。
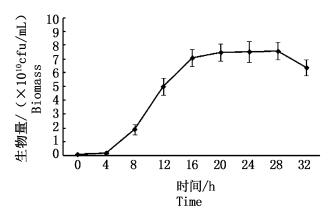
|
图 8 鲍鱼希瓦氏菌生长曲线
Fig. 8 The growth curve of Shewanella haliotis
|
由图 8可知,0~4 h生物量较低 (延滞期),4~20 h生物量快速增长 (对数期),20~28 h生物量趋于稳定 (稳定期),28 h时生物量开始下降 (衰退期)。处于对数生长晚期的种子增殖能力强、菌体量大,是接种的最佳时机。因此,鲍鱼希瓦氏菌最优种龄是18 h,最优收获时间为24 h。
2.4 发酵罐扩大培养使用70 L发酵罐扩大培养进行验证,在最优培养基配比下,设置发酵条件:装填系数0.6,罐压0.05 MPa,温度30 ℃,接种量6%,搅拌速度260 r/min。发酵24 h后,测定生物量达到 (1.14±0.14)×1011 cfu/mL,可以满足工业生产的需求。和分批发酵相比,补料发酵可以解除底物抑制、产物反馈抑制和分解产物阻遏,更有利于菌体生长和发酵产物的积累[15]。但本实验菌体生物量已较为满意,而补料会增加操作及污染风险,故未采用。
3 结论鲍鱼希瓦氏菌在水产养殖和海水污染治理中具有一定的应用前景。本实验对鲍鱼希瓦氏菌的发酵培养基和摇瓶发酵条件进行了优化。最优培养基为蔗糖6%,蛋白胨2.5%,碳酸钙0.7%,初始pH 6.8。最优摇瓶培养条件为温度30 ℃,转速130 r/min,装液量100 mL/500 mL,接种量6%,收获时间24 h。在70 L发酵罐进行验证,生物量达到1.14×1011 cfu/mL,为其工业生产提供了实验数据支持。
| [1] |
张连水, 张慧霞, 孟会贤, 等. 微生态制剂的研究现状及前景[J].
河北渔业, 2016: 56–59.
ZHANG L S, ZHANG H X, MENG H X, et al. The progress and future developing trend on microecological agents[J]. Hebei Fisheies, 2016: 56–59. |
| [2] |
汤保贵, 徐中文, 张金燕, 等. 枯草芽孢杆菌的培养条件及对水质的净化作用[J].
淡水渔业, 2007, 37(3): 45–48.
TANG B G, XU Z W, ZHANG J Y, et al. Cultivation conditions and application in water purification effect of Bacillus subtilis[J]. Freshwater Fisheries, 2007, 37(3): 45–48. |
| [3] | LIU K F, CHIU C H, SHIU Y L, et al. Effects of the pro-biotic, Bacillus subtilis E20, on the survival, development, stress tolerance, and immune status of white shrimp, Litopenaeus vannamei larvae[J]. Fish &Shellfish Immunology, 2010, 28(5/6): 837–844. |
| [4] |
杨莺莺, 李卓佳, 陈永青, 等. 益生菌D-1液体发酵工艺的研究[J].
南方水产, 2005, 1(6): 44–49.
YANG Y Y, LI Z J, CHEN Y Q, et al. Fermentation technology of probiotic strain D-1[J]. South China Fisheries Science, 2005, 1(6): 44–49. |
| [5] | BURBANK D R, SHAH D H, LAPATRA S E, et al. Enhanced resistance to coldwater disease following feeding of probiotic bacterial strains to rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2011, 321(3/4): 185–190. |
| [6] | KIM D, BAIK K S, KIM M S, et al. Shewanella haliotis sp. nov., isolated from the gut microflora of abalone, Haliotis discushannai[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(12): 2926–2931. DOI:10.1099/ijs.0.65257-0 |
| [7] | HAO K, LIU J Y, LING F, et al. Effects of dietary admini-stration of Shewanellahaliotis D4, Bacilluscereus D7 and Aeromonasbivalvium D15, single or combined, on the growth, innate immunity and disease resistance of shrimp, Litopenaeus vannamei[J]. Aquaculture, 2014, 428-429: 141–149. DOI:10.1016/j.aquaculture.2014.03.016 |
| [8] |
夏磊, 赵明军, 张洪玉, 等. 不同比例复合益生菌对凡纳滨对虾生长、免疫及抗氨氮能力的影响[J].
中国水产科学, 2015, 22(6): 1299–1307.
XIA L, ZHAO M J, ZHANG H Y, et al. Effects of different proportions of a group of compound bacteria on growth, innate immunity, and ammonia nitrogen resistance in Pacific white shrimp, Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2015, 22(6): 1299–1307. |
| [9] | BAYAT Z, HASSANSHAHIAN M, HESNI M A. Enrichment and isolation of crude oil degrading bacteria from some mussels collected from the Persian Gulf[J]. Marine Pollution Bulletin, 2015, 101(1): 85–91. DOI:10.1016/j.marpolbul.2015.11.021 |
| [10] | LI S F, ZHANG J D, QIU D Q, et al. Biological characteristics and pathogenicities of Shewanella algae and Shewanella abalone from babylonia[J]. Agricultural Science & Technology, 2015, 16(9): 1845–1850. |
| [11] |
刘惠知, 孔利华, 周映华, 等. 益生菌枯草芽孢杆菌发酵培养基及条件的优化[J].
饲料研究, 2009: 32–34.
LIU H Z, KONG L H, ZHOU Y H, et al. Fermentation medium and conditions optimizing of probiotic Baccilus subtilis[J]. Feed Research, 2009: 32–34. |
| [12] |
刘立明, 李寅, 堵国成, 等. 碳酸钙促进丙酮酸发酵过程中α-酮戊二酸的形成[J].
生物工程学报, 2003, 19(6): 745–749.
LIU L M, LI Y, DU G C, et al. CaCO3 stimulatesα-ketoglutarate accumulation during pyruvate fermentation by Torulopsis glabrata[J]. Chinese Journal of Biotechnology, 2003, 19(6): 745–749. |
| [13] | YI J S, KIM M, KIM S J, et al. Effects of sucrose, phosphate, and calcium carbonate on the production of pikromycin from Streptomyces venezuelae[J]. Journal of Microbiology and Biotechnology, 2015, 25(4): 496–502. DOI:10.4014/jmb.1409.09009 |
| [14] | ZOU M Y, GUO F F, LI X Z, et al. Enhancing production of alkaline polygalacturonate lyase from Bacillus subtilis by fed-batch fermentation[J]. PLoS One, 2014, 9(3): e90392. DOI:10.1371/journal.pone.0090392 |
| [15] |
王剑, 蒋霞云, 卢梦琪, 等. 浅玫瑰色链霉菌壳聚糖酶罐发酵工艺及其优化[J].
上海海洋大学学报, 2015, 24(6): 952–959.
WANG J, JIANG X Y, LU M Q, et al. Optimization of chitosanase production from Streptomyces roseolus by fermentation process[J]. Journal of Shanghai Ocean University, 2015, 24(6): 952–959. |
2. Research & Creation Center of Green Fishery Medicine of Chinese Academy of Fishery Sciences, Beijing 102488, China;
3. Beijing Seasun Fishery Co. Ltd, Beijing 102488, China;
4. National Fisheries Technical Extension Center, Beijing 100125, China
 2017,
Vol. 26
2017,
Vol. 26


