2. 上海水产品加工及贮藏工程技术研究中心农业部, 上海 201306;
3. 水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
4. 美国USDA-ARS研究中心, 美国加利福尼亚州 94710;
5. 上海建桥学院, 上海 201306
单核细胞增生李斯特菌 (Listeria monocytogenes) 是一种典型的兼性胞内寄生的革兰氏阳性致病菌[1],临床上该病的病死率高达20%~30%[2]。单增李斯特菌通常以生物被膜的形式存在,成熟的生物被膜更是对理化因子、杀菌剂、抗生素等具有较强抵抗力[3]。KADAM等[4]发现营养较低的培养基能促进单增李斯特菌生物被膜的形成;LEE等[5]发现0.5%的过氧乙酸并未对生物被膜态的单增李斯特菌产生影响。单增李斯特菌由于生物被膜的存在,使其抵御外界不良环境的能力增强,以致细菌难以去除。
超高压 (Ultra-high pressure,UHP) 杀菌技术是在常温或指定温度下,将食品置于压力系统中,以水或其他液体作为传压介质,经过100 MPa以上压力处理而达到杀菌、灭酶并改善食品功能特性等效果的食品加工技术[6]。虽然超高压处理能较好保留食品原有品质,但却无法彻底灭活食品中所有的微生物,而残留的微生物,尤其是细菌孢子和亚致死后恢复活性的营养体对食品的安全性构成隐患[7]。LINTON等[8]在对含单增李斯特菌的乳制品进行超高压处理研究中发现,500 MPa、10 min、20 ℃处理虽能够降低单增李斯特菌的活菌量,但仍有细菌存活并繁殖;PATTERSON等[9]将有单增李斯特菌的鸡肉进行600 MPa、2 min、20 ℃处理后也发现了活菌的存在。在适宜条件下,存活的单增李斯特菌能继续繁殖,并形成生物被膜增加了食品的食用危害。
已有研究报道超高压处理不能将单增李斯特菌全部灭活,但超高压处理对单增李斯特菌生物被膜形成能力的影响尚未有研究,因此本研究选取了两株4b血清型单增李斯特菌进行超高压处理并比较超高压处理对单增李斯特菌生物被膜形成能力的影响。
1 材料与方法 1.1 材料 1.1.1 菌种与试剂单增李斯特菌ATCC13932(血清型4b) 购自上海疾控中心、单增李斯特菌WaX12为本实验室从牛奶中分离的菌株 (血清型4b);PALCAM培养基、脑心浸出液 (BHI)、胰蛋白胨大豆琼脂TSA培养基均购自陆桥生物有限公司;乙醇、甲醇、磷酸缓冲液 (PBS) 均购自北京国药集团化学试剂有限公司;结晶紫购自生工生物技术有限公司;SYBR Green Ⅰ购自索莱宝生物技术有限公司。
1.1.2 主要仪器HPP.L2-600/2超高压设备购自华泰森淼有限公司;24孔板 (corning) 购自生工生物技术有限公司;Bio-Tek酶标仪SynergyTM Mx购自基因有限公司;荧光显微镜Axiovert A1购自卡尔·蔡司股份公司;S-3400NSEM扫描电镜购自日立公司。
1.2 菌悬液的制备无菌挑取冻存于-80 ℃的单增李斯特菌,用三线法划线接种于PALCAM培养基上37 ℃培养活化24 h获得单菌落,挑取一个菌落于5 mL脑心浸出液BHI培养基中,37 ℃、200 r/min过夜培养,以1%的接种量接入5 mL BHI培养基中,37 ℃、200 r/min过夜培养再次活化,离心 (6 000 r/min、4 ℃、15 min),弃上清液后用0.85%生理盐水悬浮沉淀,调整菌液浓度,活菌数达到约109 cfu/mL。
1.3 超高压处理将制备好的单增李斯特菌菌悬液分装于无菌的冻存管,每管约3 mL。将冻存管置于超高压加压釜中,分别采用100、200、300、400和500 MPa处理15 min,升压时间不超过5 min,泄压时间不超过1 min,处理温度为20 ℃。以未经高压处理的菌悬液为对照组,每个处理做3次平行。
1.4 微生物计数采用平板涂布法进行菌落总数的测定。用0.85%无菌生理盐水梯度稀释经超高压处理组和对照组,取100 μL菌悬液涂布于胰蛋白胨大豆琼脂TSA培养基上。37 ℃恒温倒置培养24 h后,进行菌落计数,计算单增李斯特菌存活量。
1.5 生物被膜的制备对照组和经超高压处理后的菌液以1:50转接到新鲜BHI培养基中,取1 mL该培养液转入24孔板中,为便于荧光显微镜及扫描电镜的观察,事先将无菌圆形盖玻片 (20 mm×20 mm) 置于24孔板中。每个样品设置12个平行。将24孔板置于37 ℃中静置培养,分别培养24 h、48 h和72 h。吸走各孔中的培养液,用1×PBS缓冲液清洗3次,室温干燥后待用。
为了排除初始接菌量对生物被膜形成量造成的影响,本实验中为每个压力处理组设置了对照组。对照组的初始接菌量与相对应的超高压处理组的活菌数相同。
1.6 结晶紫法测定生物被膜的形成在经干燥处理的24孔板中加入1 mL浓度为0.1%的结晶紫溶液进行染色。室温染色30 min后,弃去染色液,用1×PBS缓冲液洗涤3次,干燥后,向每个孔中加入1 mL浓度为95%的乙醇溶液,脱色30 min,使结晶紫染色液脱色充分。酶标仪测定其OD595的光吸收值,结果采用Graphpad Prism 5和SPSS 20进行统计分析。
1.7 荧光显微镜观察生物被膜内细菌分布在室温干燥后的圆形盖玻片中加入2 mL 2.5%戊二醛固定2 h,再用1×PBS缓冲液清洗3次。室温干燥后,用SYBR Green Ⅰ对粘附在盖玻片上的菌体进行染色30 min,用1×PBS清洗3次后将圆形盖玻片取出放于载玻片上,并在荧光显微镜下进行观察被膜情况。
1.8 扫描电镜观察被膜形态的细菌在干燥后的圆形盖玻片中加入4 ℃预冷的1.5 mL 2.5%戊二醛进行固定,置于4 ℃固定10 h以上。用1×PBS缓冲液清洗3次,室温干燥后,用梯度浓度 (依次加入30%、50%、70%、90% 4个浓度) 的乙醇溶液对样品进行脱水,各脱水1次,时间为15 min。加入100%乙醇溶液,脱水2次,时间15 min。室温干燥后,将圆形盖玻片取出,喷金处理,用扫描电镜观察。
2 结果 2.1 超高压处理对单增李斯特菌存活量的影响单增李斯特菌经100~500 MPa、20 ℃、15 min处理后,测定其菌落总数,计算经超高压处理后单增李斯特菌的存活率,以未经高压处理的单增李斯特菌为对照 (图 1)。由图 1可见,WaX12和ATCC13932两个株菌经小于200 MPa超高压处理后菌落总数无明显减少。而大于200 MPa超高压处理后菌落总数均有明显下降,并且WaX12菌株的存活率明显高于ATCC13932菌株。由此推断超高压处理较难完全杀灭单增李斯特菌株,并且WaX12菌株对压力的耐受能力强于ATCC13932菌株。
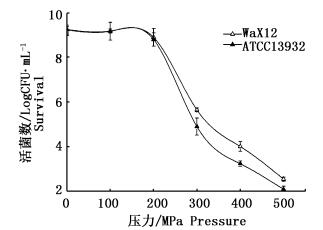
|
图 1 超高压处理对单增李斯特菌WaX12和ATCC13932存活率的影响
Fig. 1 Effect of ultra high pressure on the survival number of Listeria monocytogenes WaX12 and ATCC13932
|
结晶紫能与单增李斯特菌的生物被膜结合,因此其吸光值的高低即可反映生物被膜量的多少。将经100~500 MPa压力处理组和对照组的菌液以1:50转接到新鲜BHI培养基中于37 ℃静置培养24 h、48 h和72 h,对其形成的生物被膜进行检测。
2.2.1 不同压力处理对单增李斯特菌生物被膜形成量的影响WaX12经大于200 MPa的压力处理后,在3个时间点的生物被膜量均低于对照组和100 MPa压力处理组,并随处理压力增大WaX12的被膜量减少。37 ℃下WaX12经过48 h培养,被膜形成量最多 (图 2a)。为排除初始接菌量不同对被膜量造成的影响,实验中对每个压力处理组均设置了相同接菌量的对照组,100 MPa实验组的被膜量显著高于对照组 (P < 0.05),与对照组相比其被膜形成量提升了28.8%;而其他各压力处理组与对照组均无显著差异。结果说明,100 MPa的超高压处理增强了WaX12的生物被膜形成能力;较高的压力未改变WaX12的被膜形成能力,只是由于菌量的减少使生物被膜量也降低 (图 2b)。

|
图 2 超高压处理后单增李斯特菌WaX12生物被膜形成能力的比较
Fig. 2 The comparison of the biofilm formation of Listeria monocytogenes WaX12 after the ultra-high pressure processing by crystal staining assay
a, b, c, d说明各组有显著差异 (P < 0.05)
a, b, c, d indicates there was a significant difference between the groups |
37 ℃下ATCC13932经过72 h培养,被膜形成量最多 (图 3a);200 MPa处理后,ATCC13932的被膜形成量比对照组显著提升了20.9%(P < 0.05),而其他各压力处理组与对照组均无显著差异 (图 3b)。结果说明,200 MPa超高压处理增强了ATCC13932的生物被膜形成能力。
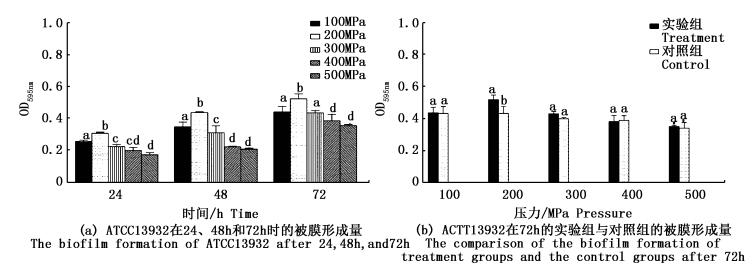
|
图 3 超高压处理后单增李斯特菌ATCC13932生物被膜形成能力的比较
Fig. 3 The comparison of the biofilm formation of Listeria monocytogenes ATCC13932 after the ultra-high pressure processing by crystal staining assay
a, b, c, d说明各组有显著差异 (P < 0.05)
a, b, c, d indicates there was a significant difference between the groups |
为便于比较WaX12和ATCC13932两株菌生物被膜形成能力的差异,均选取了这两株菌的最大被膜形成量,即WaX12在48 h,ATCC13932在72 h的被膜形成量进行比较 (图 4)。

|
图 4 单增李斯特菌WaX12和ATCC13932最大被膜形成量
Fig. 4 Maximum amount of biofilm formation ofListeria monocytogenes WaX12 and ATCC13932
a, b说明两组有显著差异 (P < 0.05)
a, b indicates there was a significant difference between two groups |
WaX12的最大被膜量与ATCC13932相比增加了44.7%。两株菌被膜形成量最少的组均为500 MPa压力处理组,WaX12的最小被膜量比ATCC13932高36.4%。WaX12达到最高被膜形成量所需的时间比ATCC13932短,且WaX12的被膜形成量高于ATCC13932。由此推断,WaX12形成生物被膜的能力大于ATCC13932。
2.3 荧光显微镜观察结果为直接观察单增李斯特菌经不同压力处理后生物被膜形成情况,本实验选择成膜量最多和最少的组,即WaX12在100、500 MPa处理后,ATCC13932在200、500 MPa处理后,及各自的对照组,采用荧光显微镜观察被膜形成情况 (图版Ⅰ)。

|
图版Ⅰ 单增李斯特菌WaX12(A) 和ATCC13932(B) 在不同压力及未经高压处理后被膜形成情况的荧光显微镜结果 (×400)。标尺为20.0 μm Plate1 Microscopical analysis of biofilms formed by Listeria monocytogenes WaX12(A) and ATCC13932 (B) after different pressures (×400). Scale bar=20.0 μm |
由图版Ⅰa可以观察到WaX12经过100 MPa处理后48 h形成的生物被膜最致密,菌体之间交联度高,染色部分最稀疏的是500 MPa处理后24 h形成的生物被膜,荧光部分最少,且几乎不交联。由图版Ⅰb观察到ATCC13932经200 MPa处理后72 h形成的生物被膜荧光染色部分最多且交联度较高,染色部分最少最稀疏的是经500 MPa处理后24 h形成的生物被膜。
两株菌相比,WaX12菌体之间交联更明显更致密,ATCC13932的交联度均较低,分布稀疏,结合结晶紫染色的结果可知WaX12较ATCC13932形成生物被膜的能力高。
2.4 扫描电镜观察结果进一步采用扫描电镜观察单增李斯特菌被膜形成情况,并选取WaX12和ATCC13932最大和最小被膜形成量时的生物被膜形态 (图版Ⅱ)。结果显示,WaX12经100 MPa处理后48 h形成的生物被膜较其他组别生物被膜更加稠密,且在单个菌之间有明显的细丝相连。这一现象与SHIRTLIFF等[10]的研究结果一致,说明单增李斯特菌WaX12被膜形成能力明显强于ATCC13932。

|
图版Ⅱ 单增李斯特菌生物被膜扫描电镜结果 (×5 000)(1) WaX12最大被膜形成量,(2) WaX12最小被膜形成量,(3) ATCC13932最大被膜形成量,(4) ATCC13932最小被膜形成量。标尺为10.0 μm Plate2 Scanning electron microscopy of biofilms formed by Listeria monocytogenes(×5 000) (1) The maximum of the biofilm formation of WaX12; (2) The minimum of the biofilm formation of WaX12; (3) The maximum of the biofilm formation of ATCC13932; (4) The minimum of the biofilm formation of ATCC13932. Scale bar=10.0 μm |
细菌的被膜形成受到较多因素的影响,如粘附表面的材质、营养物质、pH及温度等[11]。本研究结果显示,超高压对单增李斯特菌生物被膜形成能力有影响;不同菌株被膜形成能力不同。
3.1 超高压对单增李斯特菌生物被膜形成能力的影响KADAM等[4]发现在营养贫瘠的培养基中,单增李斯特菌的被膜形成能力强于营养丰富的培养基;付娇娇等[12]发现,不同培养条件下,单增李斯特菌形成的被膜量不同,其中温度对单增李斯特菌的被膜形成影响较大。细菌形成被膜的能力易受到环境的影响。本实验中,经过较小的压力 (100~200 MPa) 处理后,单增李斯特菌的被膜形成能力提升;而使用大于200 MPa压力处理后,由于高压处理后菌量的减少使得单增李斯特菌的生物被膜量也减少,但是生物被膜形成能力没有变化。由此推测,经过较小的压力处理后,单增李斯特菌通过形成更多生物被膜来抵抗外界压力刺激;而经过较大的压力处理后,由于单增李斯特菌的活菌数显著减少,因此其生物被膜形成量也减少。
3.2 不同菌株被膜形成能力不同王少辉等[13]对上海市动物源性食品中单增李斯特菌的污染状况的报告中表明:相同血清型不同来源的单增李斯特菌的被膜形成能力不同。在本实验中,经过超高压处理后,ATCC13932的活菌率低于WaX12,这一结果表明单增李斯特菌对超高压处理有一定的耐受能力,且这两株菌的耐受能力不同,WaX12比ATCC13932更耐高压。同时,两株菌生物被膜形成能力也不同,ATCC13932的生物被膜量显著少于WaX12。荧光显微镜观察的结果表明,ATCC13932形成的生物被膜比WaX12更稀疏,被膜内细菌的交联更疏松,而且孔径也更大;扫描电镜的观察结果表明,WaX12形成的生物被膜中菌体之间互联的细丝更多,表明它的被膜形成能力较高。这两株菌之间被膜形成能力的差异表明单增李斯特菌被膜形成能力受到自身基因的调控,这一结果与NILSSON等[14]的研究一致,他们发现不同来源的单增李斯特菌的被膜形成能力有差异;KAZMIERCZAK等[15]的研究也发现,单增李斯特菌被膜形成受到sigB,prfA等基因的共同调控。
单增李斯特菌生物被膜的形成受到外界环境以及基因的调控等因素影响,因此避免由于环境改变造成生物被膜增加而造成的危害对食品加工很重要,所以阐明影响单增李斯特菌生物被膜形成的因素和机制是今后研究的重点。
| [1] | GOUIN E, QUEREDA J J, COSSART P. Intracellular bacteria find the right motion[J]. Cell, 2015, 161(2): 199–200. DOI:10.1016/j.cell.2015.03.035 |
| [2] |
蒋原. 食源性病原微生物检测指南[M]. 北京: 中国标准出版社, 2010.
JIANG Y. Guide for the detection of foodborne pathogens[M]. Beijing: China Standards Press, 2010. |
| [3] |
柯春林, 方维焕. 单增李斯特菌生物膜及其形成机制的研究进展[J].
中国微生态学杂志, 2011, 23(6): 574–577.
KE C L, FANG W H. Research on the biofilm and its mechanism of Listeria monocytogenes[J]. Chinese Journal of Microecology, 2011, 23(6): 574–577. |
| [4] | KADAM S R, DEN BESTEN H M W, VAN DER VEEN S, et al. Diversity assessment of Listeria monocytogenes biofilm formation:impact of growth condition, serotype and strain origin[J]. International Journal of Food Microbiology, 2013, 165(3): 259–264. DOI:10.1016/j.ijfoodmicro.2013.05.025 |
| [5] | LEE S H I, CAPPATO L P, CORASSIN C H, et al. Effect of peracetic acid on biofilms formed by Staphylococcus aureus and Listeria monocytogenes isolated from dairy plants[J]. Journal of Dairy Science, 2016, 99(3): 2384–2390. DOI:10.3168/jds.2015-10007 |
| [6] | KOVAČ K, DIEZ-VALCARCE MHERNANDEZ M, et al. High hydrostatic pressure as emergent technology for the elimination of foodborne viruses[J]. Trends in Food Science & Technology, 2010, 21(11): 558–568. |
| [7] |
姜雪, 于鹏, 肖杨, 等. 天然抑菌剂与超高压协同作用的研究进展[J].
食品科技, 2016, 41(2): 296–299.
JIANG X, YU P, XIAO Y, et al. Development and application of synergistic effect between HPP and natural antibacterial agents[J]. Food Science and Technology, 2016, 41(2): 296–299. |
| [8] | LINTON M, MACKLE A B, UPADHYAY V K, et al. The fate of Listeria monocytogenes during the manufacture of Camembert-type cheese:a comparison between raw milk and milk treated with high hydrostatic pressure[J]. Innovative Food Science & Emerging Technologies, 2008, 9(4): 423–428. |
| [9] | PATTERSON M F, MACKLE A, LINTON M. Effect of high pressure, in combination with antilisterial agents, on the growth of Listeriamono cytogenes during extended storage of cooked chicken[J]. Food Microbiology, 2011, 28(8): 1505–1508. DOI:10.1016/j.fm.2011.08.006 |
| [10] | SHIRTLIFFM E, MADER J T, CAMPER A K. Molecular inter-actions in biofilms[J]. Chemistry & Biology, 2002, 9(8): 859–871. |
| [11] | DONLAN R M. Biofilms:microbial life on surfaces[J]. Emerging Infectious Diseases, 2002, 8(9): 881–890. DOI:10.3201/eid0809.020063 |
| [12] |
付娇娇, 王旭, 刘海泉, 等. 不同培养条件下sigB对单增李斯特菌生物被膜形成的影响[J].
上海海洋大学学报, 2016, 25(4): 634–640.
FU J J, WANG X, LIU H Q, et al. Effects of sigB on biofilm formation by Listeria monocytogenes under various culture conditions[J]. Journal of Shanghai Ocean University, 2016, 25(4): 634–640. |
| [13] |
王少辉, 刘萍萍, 魏建超, 等. 上海市动物源性食品中单增李斯特菌的流行病学及生物被膜形成能力研究[J].
中国动物传染病学报, 2015, 23(4): 31–36.
WANG S H, LIU P P, WEI J C, et al. Epidemiology and biofilm-formation capacity of Listeria monocytogenes from animal origin food in Shanghai[J]. Chinese Journal of Animal Infectious Diseases, 2015, 23(4): 31–36. |
| [14] | NILSSON R E, ROSS T, BOWMAN J P. Variability in biofilm production by Listeria monocytogenes correlated to strain origin and growth conditions[J]. International Journal of Food Microbiology, 2011, 150(1): 14–24. DOI:10.1016/j.ijfoodmicro.2011.07.012 |
| [15] | KAZMIERCZAK M J, WIEDMANN M, BOORK J. Contri-butions of Listeria monocytogenes sigmaB and PrfA to expression of virulence and stress response genes during extra-and intracellular growth[J]. Microbiology, 2006, 152(6): 1827–1838. DOI:10.1099/mic.0.28758-0 |
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation (Shanghai), Ministry of Agriculture, Shanghai 201306, China;
4. Produce Safety and Microbiology Research Unit, USDA-ARS, CA 94710, USA;
5. Shanghai Jianqiao University, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


