2. 上海登瀛水产养殖专业合作社, 上海 202164;
3. 上海光明特种水产有限公司, 上海 202178;
4. 上海海洋大学 上海市教委水产动物遗传育种协同创新中心, 上海 201306
中华绒螯蟹 (Eriocheir sinensis, 以下简称河蟹) 是我国最重要的养殖蟹类,2014年全国成蟹养殖产量高达79.65万吨,总产值达500亿元左右,在我国淡水渔业中占有极其重要的地位[1]。目前,尽管河蟹养殖已经遍及我国绝大部分地区,但长江流域仍是河蟹养殖最集中的区域,产量占全国的80%以上。池塘养殖是我国河蟹养殖的主要方式,通常为雌雄混养[2]。先前研究表明,池塘养殖条件下雌雄河蟹的生殖蜕壳时间和性腺发育速度均有较大差异[3-4],因此雌雄成蟹上市时间也有所不同。长江流域雌蟹适宜上市时间通常为10月中下旬—12月,雄蟹上市时间 (11月中旬—12月) 略晚于雌蟹[5],此外,由于河蟹雌雄个体的生殖蜕壳时间不同,而蜕壳后的软壳蟹通常容易受到硬壳蟹的攻击而导致成活率降低,因此河蟹雌雄单性化养殖是值得研究和探讨的实用技术问题[6]。
尽管雌雄单性化分养有利于河蟹养殖管理和捕捞上市,如:根据河蟹雌雄不同的营养需求,研发和投喂相应的饲料,根据雌雄不同的性腺发育情况分别捕捞上市等[3],但是,目前尚不清楚河蟹单性化养殖对其性腺发育是否存在影响,这不利于河蟹单性化养殖和育肥技术的提高。有研究表明,河蟹雌雄混养时雌雄性别间可能存在一定的社群行为,从而影响其性腺发育[7]。因此,探明雌雄单性化养殖对河蟹生长和性腺发育的影响,是开展其单性化养殖技术研发和应用的重要前提。鉴于此,本研究初步比较了群体养殖条件下雌雄单性别分养和雌雄混养对河蟹亚成体生殖蜕壳率、成活率、增重率、性腺指数和肝胰腺指数的影响,以期为河蟹养殖技术的提高提供基础资料和实践依据。
1 材料与方法 1.1 实验用蟹及实验设计实验用蟹为2015年8月底取自上海海洋大学崇明河蟹养殖基地的室外池塘,均未完成生殖蜕壳。从中选取规格整齐、体表无外伤、肢体健全的雌雄个体各60只转入基地养殖实验室进行暂养,暂养于6只体积为500 L的PE水槽 (直径为1.08 m,高度为1 m),暂养3~4 d后开始正式实验。养殖实验分为3组:单性雌体养殖组 (简称单性雌体组)、单性雄体养殖组 (简称单性雄体组) 和雌雄混合养殖组 (简称混养组),每组各重复3只PE水槽,共9只实验水槽。在单性别养殖组中,每只水槽中放入10只雌体或雄体,雌雄混合组水槽中分别放入雌雄个体各5只,为便于比较单性养殖和混养条件下的养殖性能和性腺发育情况,数据统计和分析时,将混养组的雌雄性别分开统计养殖性能和性腺发育情况,因此数据统计时,实验分为4组,即单性雌体组、混养雌体组、单性雄体组和混养雄体组。实验用雌雄个体初始平均体质量分别为 (56.62±9.27) g和 (83.89±11.25) g,正式养殖实验共进行45 d。
1.2 养殖管理养殖实验期间,每日18:00左右投喂配合饲料,投喂量为蟹体质量的1%~3%,次日上午8:00左右清除残饵和粪便,并根据残饵、水温和摄食情况适当调整投饵量。每6小时左右观察和记录河蟹蜕壳、同类相残和死亡情况,以便于统计蜕壳时间和死亡率变化情况;每天中午 (12:00) 和晚上 (22:00) 测量水温,每3天测量一次水体氨氮、亚硝酸盐和pH。实验期间pH为7.0~8.5,溶解氧>4 mg/L,氨氮 < 0.5 mg/L,亚硝酸盐 < 0.15 mg/L,均控制在河蟹养殖的安全水质指标范围内[8]。实验水槽为循环水养殖系统,盐度为5,24 h连续充氧,自然光照,实验期间自然水温为18.9~30.5 ℃。
1.3 数据采集和实验采样 1.3.1 生殖蜕壳率和死亡率的变化实验过程中, 每日检查和记录完成生殖蜕壳和死亡个体的数量, 实验结束后按照每5天的蜕壳和死亡情况, 统计实验过程中生殖蜕壳率和死亡率的变化情况, 并对单性雌体组和混养雌体组、单性雄体组和混养雄体组的生殖蜕壳率和死亡率进行两两比较。
1.3.2 最终成活率和增重率实验第30天所有个体均完成生殖蜕壳,继续养殖15 d,使得刚完成生殖蜕壳的河蟹能够壳硬化和继续进行性腺发育,第45天结束实验。实验结束时,统计每只水槽中存活个体数量,并逐尾称重,称重前用干毛巾轻轻擦去体表水分,然后采用电子天平精确称重 (精确到0.01 g),采用游标卡尺精确测量甲壳长和甲壳宽 (精确到1 μm),计算总成活率 (%) 和增重率 (WGR,%)。
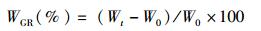 (1)
(1)
式中:WGR为增重率;Wt为实验结束时的河蟹质量;W0为实验开始时的河蟹质量。
1.3.3 性腺指数和肝胰腺指数实验结束时,每个实验组随机挑选8只生殖蜕壳后25~40 d的雌体或雄体,进行活体解剖,取出每只蟹的全部肝胰腺和性腺,用电子天平精确称重 (精确到0.001 g) 后计算肝胰腺指数 (HSI, %) 和性腺指数 (GSI, %)。计算公式如下:
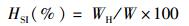 (2)
(2)
 (3)
(3)
式中:WH指肝胰腺质量 (g);WG指性腺质量 (g);W指体质量 (g)。
1.4 数据处理所有数据采用平均值±标准误表示。采用SPSS 17.0软件对实验数据进行统计分析, 用Levene法进行方差齐性检验,当数据不满足齐性方差时对百分比数据进行反正弦或者平方根处理,采用单因子ANOVA对实验结果进行方差分析, 采用Tukey s-b (K) 法进行多重比较;当数据转换后仍不满足齐性方差时,采用Games-Howell非参数检验进行多重比较。取P < 0.05为差异显著, 在Excel和Sigmaplot软件上绘制相关图表。
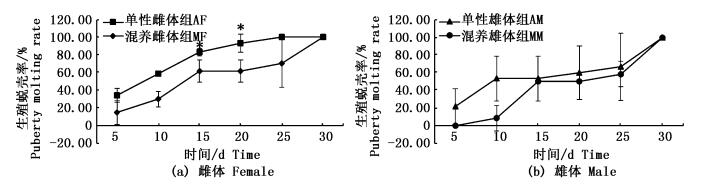
2 结果与分析 2.1 生殖蜕壳率和死亡率的变化随着时间的推移,各组成蟹生殖蜕壳率均呈上升趋势,实验第30天所有成活个体均完成生殖蜕壳。就雌体而言,单性雌体组生殖蜕壳率均高于混养雌体组,其中实验第15和20天时,差异显著 (P<0.05);就雄体而言,单性雄体组的生殖蜕壳率也略高于混养雄体组,但是两组间差异均不显著 (P>0.05),实验15~30 d内两组雌体的生殖蜕壳率比较接近 (图 1)。
|
图 1 河蟹雌雄分养对其生殖蜕壳率变化的影响
Fig. 1 The effects of mono-sex culture on the puberty molting rate of sub-adult E. sinensis
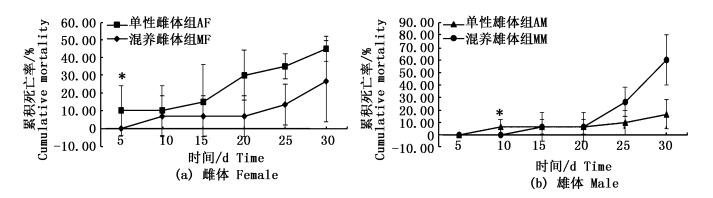
*表示两群体间差异显著 (P<0.05),图 2、3同 *indicates significant differences between two populations, the same as Fig. 2 and Fig. 3 |
|
图 2 河蟹雌雄分养对其死亡率变化的影响
Fig. 2 The effects of mono-sex culture on the mortality of sub-adult E. sinensis
|
|
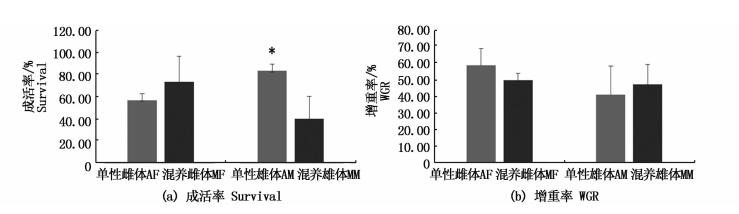
图 3 河蟹雌雄分养对其成活率和增重率的影响
Fig. 3 The effects of mono-sex culture on survival and WGR of sub-adult E. sinensis
|
雌体的死亡主要发生在实验第15~30天,雄体死亡主要发生在实验第20~30天,均略迟于其生殖蜕壳高峰期。就两组雌体而言,单性雌体组的累计死亡率一直高于混养雌体组,其中实验第5天时两组雌体死亡率的差异显著 (P<0.05);就雄体而言,实验第5~20天内两组死亡率均较低,此后单性雄体组的累计死亡率一直低于混养雄体组 (图 2)。
2.2 成活率和增重率就成活率而言,单性雌体组的成活率略低于混养雌体组,但两者之间差异不显著,而单性雄体组的成活率显著高于混养雄体组;就增重率而言,单性雌体组略高于混养雌体组,而单性雄体组略低于混养雄体组,差异均不显著。
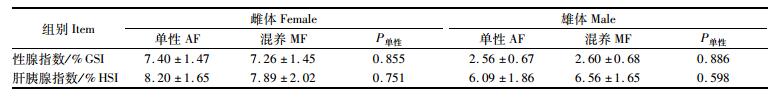
2.3 性腺指数和肝胰腺指数的变化无论雌蟹还是雄蟹,单性养殖和雌雄混养组的性腺指数和肝胰腺指数均无显著差异。整体上,生殖蜕壳后25~40天,雌蟹性腺指数为5.1%~9.8%,雄蟹性腺指数为1.7%~3.8%,无论雌蟹还是雄体,不同个体的性腺指数相差较大 (表 1)。
|
表 1 河蟹雌雄分养对其性腺指数和肝胰腺指数的影响 Tab.1 The effects of mono-sex culture on GSI and HSI of sub-adult E. sinensis |
生殖蜕壳是河蟹养殖过程中最后一次蜕壳,这次蜕壳后通常性腺开始快速发育,但是池塘养殖条件下雌雄生殖蜕壳时间并不同步,通常雌体生殖蜕壳时间早于雄体[4-5]。本研究结果表明,无论单性化养殖还是雌雄混合养殖,雌体生殖蜕壳时间略早于雄体,且单性雌体养殖条件下15~20 d的雌体生殖蜕壳率显著高于雌雄混养中雌体,这可能是因为纯雌体养殖条件下,没有雄体抢食和干扰,雌体生殖蜕壳时间得以提前。本试验中混养组的成活率雌雄是分开统计的,虽然同一性别中单性组和混养组蟹的数量不同,但每个桶内蟹的总数以及它们所处的环境是相同的,这样可以充分体现单性养殖组和混合养殖组的成活率差异。结果表明,单性雄体组的成活率显著高于混养雄体组,可能是因为雌雄混养组雌体提前完成生殖蜕壳,当雄体蜕壳时,已经完成蜕壳的雌体残杀正在蜕壳的雄体或蜕壳后的软壳雄体,故导致混养雄体的成活率较低,实验中多次观察到正在蜕壳个体被其他硬壳个体残杀死亡。本实验中雌雄分养组和混合养殖组的成活率均较低 (雌雄分养组平均为70.0%;雌雄混养组平均为56.7%),这可能是因为室内养殖条件下养殖密度 (8~10只/m2) 远高于池塘养殖密度 (1~2只/ m2)[5],且室内养殖条件下无水草作为隐蔽物,故室内养殖条件下成活率相对较低。河蟹单性化养殖对其生殖蜕壳后的增重率无显著影响,雌雄河蟹生殖蜕壳后的平均增重率均在50%左右,但是不同个体间的差异较大,本研究中雌体生殖蜕壳后的增重率为44%~81%,雄体增重率为35%~72%,这与先前报道的长江水系池塘养殖河蟹的增重率接近[9]。饵料营养、活动空间大小和水体矿物质离子含量等因素均会影响甲壳动物蜕壳后的增重率[10-13],如何通过养殖技术优化提高成蟹蜕壳后的增重率,是今后需要深入研究的重要问题。
3.2 雌雄分养对雌雄性腺发育的影响性腺、肝胰腺和肌肉是河蟹主要的可食部位[14],性腺发育的优劣直接关系到其食用价值和经济价值[15-16],因此,雌雄分养对河蟹性腺发育有无影响是河蟹单性化养殖需要考虑的重要问题之一。本研究结果表明,河蟹雌雄单性化养殖对其性腺发育基本没有影响,这为今后生产上推广雌雄分养和强化育肥提供了理论依据。生殖蜕壳是河蟹性腺快速发育的起点,雌体生殖蜕壳后卵巢开始快速发育[4],雄体生殖蜕壳后主要是附性腺体积迅速增长,但雌雄河蟹的生殖蜕壳时间有所不同[5]。雌雄河蟹性腺发育期间营养需求可能有所不同,因此通过雌雄分养可以给雌雄河蟹投喂不同的饲料进行育肥,进一步研究需要根据雌雄河蟹性腺快速发育期的营养需求研发雌雄专用的育肥饲料[15, 17]。此外,由于雌雄成蟹的生殖蜕壳时间和性腺发育速度不同,通常雌蟹上市时间早于雄蟹,因此雌雄分养有利于商品河蟹捕捞上市,无需在捕捞成蟹中剔除雄蟹或雌蟹。本研究结果表明,雌雄成蟹生殖蜕壳后25~40 d,性腺指数分别达到7.3%和2.5%左右,均已经达到膏蟹上市的标准雌体性腺指数≥6.5%,雄体性腺指数≥2.2%[18]。在特定养殖条件下,河蟹性腺指数和生殖蜕壳后天数的相互关系和预报方程尚未见报道,这不利于河蟹性腺指数和膏蟹捕捞时间的预报,今后需要在此方面加强研究,提高河蟹养殖的管理水平。
综上所述,河蟹雌雄分养可以提高雌体或雄体群体养殖下的蜕壳同步性,提高雄体单养条件下的成活率,且雌雄分养对成蟹生殖蜕壳后的增重率和性腺发育无负面影响。今后,需要进一步研究河蟹雌雄分养条件下的营养需求、专用饲料和关键养殖技术,促进河蟹养殖技术水平的提高。
| [1] |
农业部渔业渔政管理局. 2015年中国渔业统计年鉴[R]. 北京: 中国农业出版社, 2015: 28-36.
Bureau of Fisheries, Ministry of Agriculture, PRC. 2015 China fishery statistical yearbook[R]. Beijing:China Agriculture Press, 2015:28-36. |
| [2] |
王武, 王成辉, 马旭洲. 河蟹生态养殖[M]. 2版. 北京: 中国农业出版社, 2014: 59-84.
WANG W, WANG C H, MA X Z. Ecological culture of Chinese mitten carb aquaculture[M]. 2nd ed. Beijing: Chinese Agricultural Press, 2014: 59-84. |
| [3] | HE J, WU X G, LI J Y, et al. Comparison of the culture performance and profitability of wild-caught and captive pond-reared Chinese mitten crab (Eriocheir sinensis) juveniles reared in grow-out ponds:implications for seed selection and genetic selection programs[J]. Aquaculture, 2014, 434: 48–56. DOI:10.1016/j.aquaculture.2014.07.022 |
| [4] |
倪国彬, 何杰, 赵恒亮, 等. 池塘养殖中华绒螯蟹二龄雌体生长规律和生殖蜕壳时间的研究[J].
浙江海洋学院学报 (自然科学版), 2015, 34(2): 125–131.
NI G B, HE J, ZHAO H L, et al. The study of growth pattern and puberty molting time of pond-reared female Chinese mitten crab during the second year culture[J]. Journal of Zhejiang Ocean University (Natural Science), 2015, 34(2): 125–131. |
| [5] |
何杰, 吴旭干, 龙晓文, 等. 长江水系中华绒螯蟹野生和养殖群体选育子一代养殖性能和性腺发育的比较[J].
海洋与湖沼, 2015, 46(4): 808–818.
HE J, WU X G, LONG X W, et al. Culture performance and gonadal development of the first generation of selectively-bred Chinese mitten crabs from wild and cultured populations[J]. Oceanologia et Limnologia Sinica, 2015, 46(4): 808–818. |
| [6] |
沈竑. 几种河蟹精养模式的比较试验 (下)[J].
科学养鱼, 2008: 36–37.
SHEN H. A comparative research on several aquiculture patterns of Chinese mitten crab Eriocheir sinensis (second volume)[J]. Scientific Fish Farming, 2008: 36–37. |
| [7] | HERBORG L M, BENTLEY M G, CLARE A S, et al. Mating behaviour and chemical communication in the invasive Chinese mitten crab Eriocheir sinensis[J]. Journal of Experimental Marine Biology and Ecology, 2006, 329(1): 1–10. DOI:10.1016/j.jembe.2005.08.001 |
| [8] |
张列士, 李军. 河蟹增养殖技术[M]. 北京: 金盾出版社, 2002: 248-334.
ZHANG L S, LI J. Aquaculture technology of Chinese mitten crab[M]. Beijing: Jindun Publishing House, 2002: 248-334. |
| [9] |
何杰. 中华绒螯蟹池塘生态养殖群体生长特征研究[J].
水利渔业, 2005, 25(6): 10–11.
HE J. Population growth characteristics of the mitten crab in Ecological aquaculture Ponds[J]. Reservoir Fisheries, 2005, 25(6): 10–11. |
| [10] | MANOR R, SEGEV R, LEIBOVITZ M P, et al. Intensification of redclaw crayfish Cherax quadricarinatus culture:Ⅱ. Growout in a separate cell system[J]. Aquacultural Engineering, 2002, 26(4): 263–276. DOI:10.1016/S0144-8609(02)00035-3 |
| [11] | JONES C M. Evaluation of six diets fed to redlaw, Cherax quadricarinatus (von Martens), held in pond enclosures[J]. Freshwater Crayfish, 1995, 10: 469–479. |
| [12] |
魏薇, 魏华. 水环境中的Ca2+浓度对中华绒螯蟹早熟和存活的影响[J].
淡水渔业, 2005, 35(3): 10–12.
WEI H. The effects of Ca2+ concentration in aquatic environment on the precocity and survival of Chines mitten crab (Eriocheir sinensis)[J]. Freshwater Fisheries, 2005, 35(3): 10–12. |
| [13] |
魏薇, 吴嘉敏, 魏华. 盐度对中华绒螯蟹性早熟生理机制的影响[J].
中国水产科学, 2007, 14(2): 275–280.
WEI W, WU J M, WEI H. Physiological mechanism of precociousness influenced by salinity in juvenile Eriocheir sinensis[J]. Journal of Fishery Sciences of China, 2007, 14(2): 275–280. |
| [14] | SHAO L C, WANG C, HE J, et al. Hepatopancreas and gonad quality of Chinese mitten crabs fattened with natural and formulated diets[J]. Journal of Food Quality, 2013, 36(3): 217–227. DOI:10.1111/jfq.2013.36.issue-3 |
| [15] | WU X G, CHENG Y X, SUI L Y, et al. Effect of dietary supplementation of phospholipids and highly unsaturated fatty acids on reproductive performance and offspring quality of the Chinese mitten crab, Eriocheir sinensis (H. Milne-Edwards), female broodstock[J]. Aquaculture, 2007, 273(4): 602–613. DOI:10.1016/j.aquaculture.2007.09.030 |
| [16] |
吴旭干, 龙晓文, 刘乃更, 等. 中华绒螯蟹、日本绒螯蟹及其杂交种性腺发育和生化组成的比较研究[J].
淡水渔业, 2015, 45(3): 3–8.
WU X G, LONG X W, LIU N G, et al. Comparative study on gonadal development and biochemical composition among Eriocheir sinensis, E. japonica and their hybrids[J]. Freshwater Fisheries, 2015, 45(3): 3–8. |
| [17] | WU X G, CHANG G L, CHENG Y X, et al. Effects of dietary phospholipid and highly unsaturated fatty acids on the gonadal development, tissue proximate composition, lipid class and fatty acid composition of precocious Chinese mitten crab, Eriocheir sinensis[J]. Aquaculture Nutrition, 2010, 16(1): 25–36. DOI:10.1111/anu.2009.16.issue-1 |
| [18] |
国家标准化管理委员会. GB/T 19957-2005地理标志产品阳澄湖大闸蟹[S]. 北京: 中国标准出版社, 2006.
National Standardization Management Committee. GB/T 19957-2005 Product of geographical indication:Yangcheng Lake Chinese mitten crab[S]. Beijing:China Standards Press, 2006. |
2. Shanghai Dengying Aquaculture Cooperatives, Shanghai 202164, China;
3. Shanghai Bright Special Aquaculture Limited Company, Shanghai 202178, China;
4. Collaborative Innovation Center of Aquatic Animal Breeding Center Certificated by Shanghai Municipal Education Commission, Shanghai Ocean University, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


