2. 上海海洋大学 水产与生命学院, 上海 201306
Hg2+是一种有毒且难以生物降解的环境污染物。Hg2+污染主要来自氯碱、塑料、电池、电子等工业排放的废水,而排向大气和土壤的Hg2+也将随着水循环回归入水体[1-3]。水生生物摄入Hg2+将其转化为毒性更高的有机汞,并通过食物链不断富集,危害人类健康[4-8]。因此,建立简便快速、高灵敏、高选择性的Hg2+检测方法对于汞污染预防和治理具有重要的意义。
目前测定Hg2+的方法主要有冷原子吸收法[9-11]、电感耦合等离子体质谱 (ICP-MS)[12-14]及荧光探针法[15-17]等。它们具有准确度高、选择性好、干扰少等优点,但是一般需要复杂的样品前处理和大型仪器,不适用于快速现场检测。电化学生物传感器因其成本低、简单快速及便携等优点,成为非常有应用前景的重金属检测方法[18-19]。
DNA不仅是遗传信息的载体,也可以电荷转移,呈现出导体的电学性质。2004年,One小组发现Hg2+能与双链DNA中胸腺嘧啶 (T-T) 错配通过T-Hg2+-T配位作用形成稳定的双螺旋结构,并且T-T碱基错配对Hg2+具有高度特异识别和选择性[20]。基于此种特异性识别,国内外学者利用T-Hg2+-T配位化学构建了一系列的Hg2+荧光、比色及电化学生物传感器[21-24]。2007年,JOSEPH等发现T-T会阻断DNA双链电荷转移,而T-Hg2+-T配合物形成后恢复了DNA双链电荷转移功能[25]。在此原理基础上,本文以含有胸腺嘧啶的Hg2+特异性DNA链为识别元件,以亚甲基蓝和铁氰化钾催化体系为信号放大系统,结合计时电量法,构建了一种高灵敏、高选择性和非标记的Hg2+电化学生物传感器。
1 材料与方法 1.1 试剂与仪器DNA序列:5′-HS-(CH2)6-ACTACAGTCAT CGCG-3′和5′-CGCGATGTCTGTACT-3′由上海生工生物技术有限公司合成与纯化。Hg2+标准贮液购自德国默克公司,亚甲基蓝 (Methylene Blue,MB)、氯化钾、氯化钠、三羟甲基氨基甲烷 (Tris)、三 (2-甲酰乙基) 膦 (TCEP, 纯度99%) 购自Sigma-Aldrich。乙醇、硫酸、氢氧化钠、亚铁氰化钾、铁氰化钾、MgCl2购自上海国药集团化学试剂有限公司,均为分析纯。实验用水为MilliQ超纯水 (比电阻为18.2 MΩ,美国密理博有限公司)。
CHI 832电化学工作站 (上海辰华仪器有限公司);三电极系统:金盘电极 (购自上海辰华仪器有限公司,直径为2 mm) 为工作电极、Ag/AgCl (饱和KCl) 电极为参比电极、铂丝电极为对电极;QC50型超声波清洗仪 (上海必能信超声波有限公司);85-1A磁力搅拌器 (上海辰华仪器有限公司)。
1.2 实验方法 1.2.1 电极预处理将金电极用Pirahna洗液 (98% H2SO4与30% H2O2的体积比7:3) 浸泡5 min, 再依次使用1.0、0.3、0.05 μm Al2O3粉末抛光, 并用无水乙醇和超纯水超声清洗各3 min, 使金电极表面呈光滑镜面。再将电极置于1.0 mol/L NaOH溶液和0.5 mol/L H2SO4溶液中分别进行电化学处理, 至金电极达到稳定的伏安图。超纯水冲洗,高纯氮气吹干电极表面。
1.2.2 DNA在金电极表面的自组装固定巯基修饰的100 μmol/L DNA与其同等浓度的完全互补链在50 mmol/L Tris-HAc (0.5 mol/L NaCl,pH 8.2) 缓冲液中,60 ℃水浴杂交10 min,自然冷却至室温。然后预杂交的DNA双链与10 μmol/L TCEP在50 mmol/L Tris-HAc (0.5 mol/L NaCl,pH 7.4) 缓冲溶液中孵育30 min,将双硫键切断。将处理的金电极浸入上述溶液中,同时在溶液中加入100 mmol/L MgCl2,使溶液中DNA形成更稳定的双链结构,于4 ℃冰箱中避光自组装16 h。分别用缓冲溶液和超纯水冲洗3次,以除去非特异性吸附在电极表面的双链DNA,氮气迅速吹干电极表面备用。
1.2.3 Hg2+的电化学测定DNA修饰电极与不同浓度的Hg2+溶液室温孵育15 min,然后分别用10 mmol/L Tris-HAc (0.5 mol/L NaCl,pH 7.4) 和超纯水反复洗涤电极表面,以除去未结合的Hg2+,然后用计时电量法测定。计时电量法实验条件:DNA修饰电极为工作电极,Ag-AgCl为参比电极,铂丝为对电极;扫描电位范围:0~380 mV;电解质溶液为含有2.0 μmol/L MB的2 mmol/L [Fe (CN)6]3-溶液,支持电解质为0.1 mol/L KCl溶液。
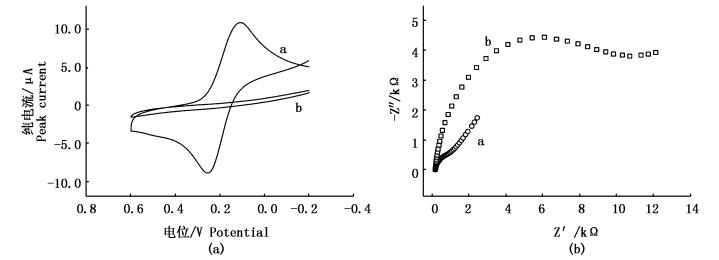
2 结果与讨论 2.1 DNA双链修饰电极电化学表征循环伏安法和电化学阻抗是表征生物分子修饰电极界面结构的有力工具。我们以[Fe (CN)6](3-/4-)为电化学探针,考察了金电极在DNA双链修饰前后的循环伏安行为和界面阻抗性质。如图 1a所示,裸金电极 (曲线a) 在-0.2~0.6 V范围内有一对稳定且可逆性良好的氧化还原峰;将含有T-T错配的双链DNA修饰在金电极,在金电极表面形成一层致密带负电荷的DNA组装层,在氧化还原过程中,DNA探针磷酸盐骨架的负电荷阻止[Fe (CN)6](3-/4-)接近电极表面,导致其循环伏安曲线 (曲线b) 没有出现氧化还原峰。图 1b为金电极在DNA双链修饰前后交流阻抗的Nyquist图。裸金电极的阻抗值较小 (约420 Ω,曲线a),DNA修饰后,电极界面阻抗显著增加 (约12 000 Ω,曲线b),这与循环伏安法的结果一致。以上结果表明,双链DNA成功自组装在金电极表面。
|
图 1 金电极 (曲线a) 和DNA修饰电极 (曲线b) 在2 mmol/L [Fe (CN)6](3-/4-) (0.1 mol/L KCl, pH7.4) 溶液中的循环伏安曲线 (a) 和电化学交流阻抗图 (b)
Fig. 1 (a) Cyclic voltammograms and (b) Nyquist plots of bare gold electrode (curve a) and DNA-modifiedelectrode (curve b) in 2 mmol/L[Fe (CN)6](3-/4-) (0.1 mol/L KCl, pH 7.4)
|
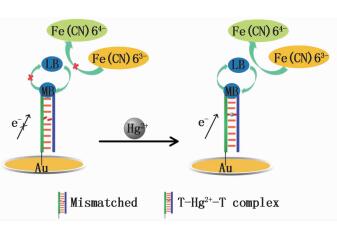
基于DNA双链电荷转移的Hg2+生物传感器的工作原理 (图 2),含有1个T-T错配的DNA双链探针致密的自组装在金电极表面。MB吸附在DNA双链层表面,在0~-380 mV范围扫描,电子从电极表面经DNA双链转移到MB,MB被还原为无色亚甲基蓝 (Leucomethylene Blue,LB),LB再被溶液中的[Fe (CN)6]3-氧化为MB,持续循环还原-氧化产生可检测的计时电量信号。T-T错配因阻碍DNA双链内部电子转移,使计时电量信号较小;当溶液中存在Hg2+时,其与T-T错配通过配位作用形成T-Hg2+-T配合物,恢复了DNA完全互补双链的碱基堆积状态,使得计时电量信号显著增加。利用计时电量信号的改变即可实现对Hg2+的检测。
|
图 2 基于DNA电子传递的电化学生物传感器检测Hg2+的原理图
Fig. 2 Schematic illustration of electrochemical biosensor based on charge transport of DNA for the detection of Hg2+
|
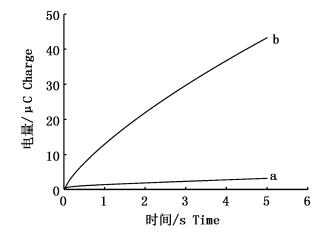
为验证上述Hg2+生物传感器的可行性 (图 3),我们采用计时电量法来考察DNA修饰电极与Hg2+识别前后的计时电量。计时电量实验结果如图 3所示,曲线a为金电极修饰了含有T-T错配DNA双链后的计时电量曲线;由曲线b可以看出,识别Hg2+后计时电量信号明显增强,这是由于T-T错配与Hg2+配位形成T-Hg2+-T配合物,恢复DNA双链内部电子转移所致。实验结果证明上述Hg2+生物传感器的可行性。
|
图 3 DNA双链修饰电极与10 μmol/L Hg2+识别
Fig. 3 Chronocoulometry at-380 mV of 2.0 mmol/L [Fe (CN)6]3- plus 2 μmol/L MB (pH 7) at a gold electrode modified with DNA duplexs containing T-T mismatches before (curve a) and after the recognition with 10 μmol/L Hg2+(curve b)
|
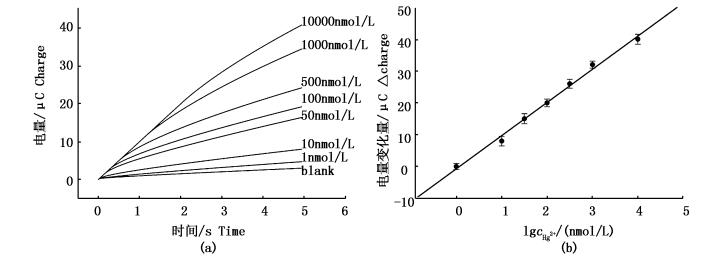
将DNA双链修饰电极与不同浓度的Hg2+孵育15 min,充分洗涤后,检测修饰电极的计时电量 (5 s) 变化,如图 4所示。Hg2+在1.0~104 nmol/L浓度范围内都有电化学信号的变化,计时电量 (5 s) 随着Hg2+浓度的增加相应地增大。以计时电量的变化量ΔC=C-C0(C0为无Hg2+时的计时电量,而C为识别Hg2+后的计时电量) 对Hg2+浓度对数作图,ΔC与lgcHg2+在该浓度范围内呈良好的线性关系 (图 4b),线性相关系数为0.997,线性相关方程为:ΔC=10.23X-0.047(X为Hg2+浓度对数),该Hg2+生物传感器对Hg2+的检测限为0.5 nmol/L (S/N=3)。
|
图 4 Hg2+生物传感器对不同浓度Hg2+的测定 (a) 计时电量曲线;(b) 计时电量变化量与Hg2+浓度对数之间的线性关系图
Fig. 4 The detection of different concentrations of Hg2+ (a) Chronoloulometric curves; (b) The relationship between the logarithmic of Hg2+ concentrations and ΔC
|
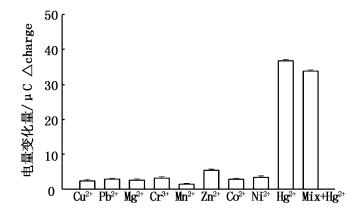
为考察该传感器对Hg2+的特异性,分别选取Cu2+、Pb2+、Mg2+、Cr3+、Mn2+、Zn2+、Co2+和Ni2+作为干扰离子在同等条件下进行计时电量测定。由图 5可见,各种干扰离子计时电量变化量远小于Hg2+,说明电极表面修饰DNA中T-T与Hg2+的结合具有较高的特异性。即使这些金属离子与Hg2+共存时,对Hg2+的检测几乎没有影响,因此,该生物传感器对Hg2+具有很好的选择性。
|
图 5 电化学生物传感器检测Hg2+的特异性和选择性
Fig. 5 specificity and selectivity of electrochemical biosensor for the detection of Hg2+
|
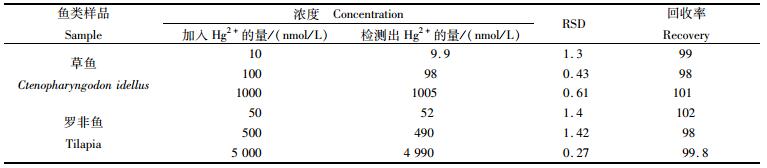
本文研究的Hg2+生物传感器希望应用到多种领域,然而当今的食品污染存在多种问题,因此我们做了鱼样中贡离子含量检测。将样品鱼预处理后,通过湿消解法得到样品液,采用加标回收法,用本实验方法检测Hg2+浓度,结果如表 1所示。
|
表 1 生物传感器对实际样品中Hg2+的检测 Tab.1 The determination of Hg2+ ions in real samples by using the proposed method |
本文基于T-T与Hg2+的特异性识别,结合亚甲基蓝和铁氰化钾的催化放大检测信号,构建了灵敏度高、选择性好的可用于检测Hg2+的电化学生物传感器, 该生物传感器简单快速、检测线性范围宽,有望应用于食品、水体中Hg2+的快速检测。
| [1] |
冯新斌, 仇广乐, 付学吾, 等. 环境汞污染[J].
化学进展, 2009, 21(2/3): 436–457.
FENG X B, QIU G L, FU X W, et al. Mercury pollution in the environment[J]. Progress in Chemistry, 2009, 21(2/3): 436–457. |
| [2] | DRISCOLL C T, HAN Y J, CHEN C Y, et al. Mercury contamination in forest and freshwater ecosystems in the Northeastern United States[J]. Bioscience, 2007, 57(1): 17–28. DOI:10.1641/B570106 |
| [3] | ZHANG L, WONG M H. Environmental mercury contamination in China:sources and impacts[J]. Environment International, 2007, 33(1): 108–121. DOI:10.1016/j.envint.2006.06.022 |
| [4] | PATTERSON B, RYAN J, DICKEY J H. The toxicology of mercury[J]. The New England Journal of Medicine, 2004, 350(9): 945–947. DOI:10.1056/NEJM200402263500919 |
| [5] | LLIĆ L, BOGDANOVIĆ D, ŽIVKOVIĆ D, et al. Optimization of heavy metals total emission, case study:Bor (Serbia)[J]. Atmospheric Research, 2011, 101(1/2): 450–459. |
| [6] | GROBE D, MANORE M M, STILL E. Trading off fish health and safety:female decision-making processes toward the risk of methylmercury in fish[J]. Journal of Consumer Affairs, 2007, 41(2): 250–264. DOI:10.1111/j.1745-6606.2007.00080.x |
| [7] | HALL B D, BODALY R A, FUDGE R J P, et al. Food as the dominant pathway of methylmercury uptake by fish[J]. Water, Air, and Soil Pollution, 1997, 100(1/2): 13–24. |
| [8] | STEWART A R, SAIKI M K, KUWABARA J S, et al. Influence of plankton mercury dynamics and trophic pathways on mercury concentrations of top predator fish of a mining-impacted reservoir[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2008, 65(11): 2351–2366. DOI:10.1139/F08-140 |
| [9] | LEMOS V A, SANTOS L O D. A new method for preconcentration and determination of mercury in fish, shellfish and saliva by cold vapour atomic absorption spectrometry[J]. Food Chemistry, 2014, 149: 203–207. DOI:10.1016/j.foodchem.2013.10.109 |
| [10] | SHAH A Q, KAZI T G, BAIG J A, et al. Simultaneously determination of methyl and inorganic mercury in fish species by cold vapour generation atomic absorption spectrometry[J]. Food Chemistry, 2012, 134(4): 2345–2349. DOI:10.1016/j.foodchem.2012.03.109 |
| [11] | TONG S L. Stationary cold-vapor atomic absorption spectrometric method for mercury determination[J]. Analytical Chemistry, 1978, 50(3): 412–414. DOI:10.1021/ac50025a014 |
| [12] | ARMSTRONG H E L, CORNS W T, STOCKWELL P B, et al. Comparison of AFS and ICP-MS detection coupled with gas chromatography for the determination of methylmercury in marine samples[J]. Analytica Chimica Acta, 1999, 390(1/3): 245–253. |
| [13] | BATISTA B L, RODRIGUES J L, SOUZA S S D, et al. Mercury speciation in seafood samples by LC-ICP-MS with a rapid ultrasound-assisted extraction procedure:application to the determination of mercury in Brazilian seafood samples[J]. Food Chemistry, 2011, 126(4): 2000–2004. DOI:10.1016/j.foodchem.2010.12.068 |
| [14] | JACKSON B, TAYLOR V, BAKER R A, et al. Low-level mercury speciation in freshwaters by isotope dilution GC-ICP-MS[J]. Environmental Science & Technology, 2009, 43(7): 2463–2469. |
| [15] | LEE S, RAO B A, SON Y A. Colorimetric and "turn-on" fluorescent determination of Hg2+ ions based on a rhodamine-pyridine derivative[J]. Sensors and Actuators B:Chemical, 2014, 196: 388–397. DOI:10.1016/j.snb.2014.02.025 |
| [16] | KUMAR K S, RAMAKRISHNAPPA T, BALAKRISHNA R G, et al. A Fluorescent chemodosimeter for Hg2+ based on a spirolactam ring-opening strategy and its application towards mercury determination in aqueous and cellular media[J]. Journal of Fluorescence, 2014, 24(1): 67–74. DOI:10.1007/s10895-013-1271-1 |
| [17] | SHAFAWI A, EBDON L, FOULKES M, et al. Determination of total mercury in hydrocarbons and natural gas condensate by atomic fluorescence spectrometry[J]. Analyst, 1999, 124(2): 185–189. DOI:10.1039/a809679a |
| [18] | BERCHMANS S, ARIVUKKODI S, YEGNARAMAN V. Self-assembled monolayers of 2-mercaptobenzimidazole on gold:stripping voltammetric determination of Hg (Ⅱ)[J]. Electrochemistry Communications, 2000, 2(4): 226–229. DOI:10.1016/S1388-2481(00)00002-3 |
| [19] | GUSTAVSSON I. Determination of mercury in sea water by stripping voltammetry[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1986, 214(1/2): 31–36. |
| [20] | ONO A, TOGASHI H. Highly selective oligonucleotide-based sensor for mercury (Ⅱ) in aqueous solutions[J]. Angewandte Chemie International Edition, 2004, 43(33): 4300–4302. DOI:10.1002/(ISSN)1521-3773 |
| [21] |
吴继魁. 基于新型分子信标和胸腺嘧啶-汞 (Ⅱ) 配位作用的DNA和Hg2+检测技术研究[D]. 上海: 华东师范大学, 2010.
WU J K. Studies on the detection of DNA and Hg2+ based on novel molecular beacon and thymine-mercury (Ⅱ) coordination[D]. Shanghai:East China Normal University, 2010. |
| [22] |
李兰英, 吴继魁, 崔静, 等. 利用多胸腺嘧啶DNA修饰金电极伏安法测定水溶液中的Hg2+[J].
分析化学, 2009, 37(6): S1–36.
LI L Y, WU J K, CUI J, et al. Determination of Hg2+ in aqueous solution by using voltammetry of gold electrode modified thymine DNA[J]. Chinese Journal of Analytical Chemistry, 2009, 37(6): S1–36. |
| [23] |
吴继魁, 卫碧文, 林莉, 等. 一种基于汞特异性DNA和SYBR GREENⅠ荧光检测Hg2+方法的建立[J].
生物技术通报, 2013: 221–224.
WU J K, WEI B W, LIN L, et al. Highly sensitive and selective detection of Hg2+ in aqueous solution with mercury-specific DNA and SYBR GREEN I[J]. Biotechnology Bulletin, 2013: 221–224. |
| [24] | SHENG Z H, HAN J H, ZHANG J P, et al. Method for detection of Hg2+ based on the specific thymine-Hg2+-thymine interaction in the DNA hybridization on the surface of quartz crystal microbalance[J]. Colloids and Surfaces B:Biointerfaces, 2011, 87(2): 289–292. DOI:10.1016/j.colsurfb.2011.05.031 |
| [25] | JOSEPH J, SCHUSTER G B. Long-distance radical cation hopping in DNA:the effect of thymine-Hg (Ⅱ)-thymine base pairs[J]. Organic Letters, 2007, 9(10): 1843–1846. DOI:10.1021/ol070135a |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2017,
Vol. 26
2017,
Vol. 26


