2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 水产动物遗传育种中心上海市协同创新中心, 上海 201306
微藻是自然界中重要的初级生产者,具有种类多、繁殖快、含有多种生物活性物质等特点,极具开发潜力[1]。将微藻用于废水处理是当今研究的热点,ABOU-SHANAB等[2]研究了6种微藻在处理猪场废水及耦合生物柴油生产的效果,发现墨西哥衣藻(Chlamydomonas mexicana)可获得的生物量干重最大,为(0.56±0.35) dwt/L,对氮磷的去除效率也最高,分别为62%和28%,ZHU等[3]发现小球藻(Chlorella zofingiensis)在稀释后COD浓度为1 900 mg/ L的猪场废水中生长最好,此时对污水中养分的去除率、生物量、油脂含量和生物柴油产量均达到最大,邱昌恩等[4]得出一株绿球藻正常生长的氮浓度范围为0.015~0.150 g/L,且可耐受高氮环境,有望用于对氮、磷污水的处理。温度是影响藻类生长和生化组成的重要因子,一般认为温度变化主要影响与光合作用有关酶的活性及光合作用过程,微藻对温度的适应范围较宽,但不同微藻对温度的耐受能力不同[5-6]。华雪铭等[7]发现绿色巴夫藻(Pavlova viridis)适宜的生长温度为30 ℃,此时总脂含量也最大,但35 ℃则不能生长。潘瑾等[8]得出在10~30 ℃范围内,随温度的升高,三角褐指藻(Phaeodactylum tricornutum)的藻细胞密度和C16∶0含量呈先上升后下降的趋势,均在20 ℃时最高。本实验研究了温度对一株从猪场沼液中新分离的耐高氨氮绿球藻生长和油脂特性的影响,为后续该株绿球藻用于猪场沼液净化及藻细胞开发利用奠定了基础。
1 材料与方法 1.1 藻株的来源实验藻株分离自浙江嘉兴余新镇敦好农牧科技有限公司沼液发酵池,并在实验室进行纯化,分离时沼液的氨氮浓度为305 mg/L,经显微镜鉴定为绿球藻属(Chlorococcum sp.)。
1.2 适宜培养温度的筛选实验设5个温度梯度,分别为20、25、30、35和40 ℃,采用1 000 mL三角烧瓶作为培养容器。采用补充了有机氮源(复合氨基酸,350mg/L)的f/2淡水培养液作为培养基,经121 ℃高压灭菌20 min后用于实验。取处于指数增长期的绿球藻藻种,4 ℃离心(6 000 r/min)10 min,去上清,藻泥用蒸馏水溶解后再次离心去上清,将藻泥接种到培养基中,初始接种密度为300×104 cells/mL。每温度设3个平行。实验在三温区光照培养箱中进行。光周期为24 L∶0 D,光照强度为2 500 lx,每天定时摇瓶3次,试验进行7 d。
1.3 藻细胞密度和生物量的测定 1.3.1 藻细胞密度的测定培养过程中采用血球计数板计数法每天检测藻细胞密度,每个样数3块板,取平均值,并求算比生长率(K)。
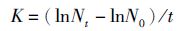 (1)
(1)
式中:N0为培养初始藻细胞密度(cells/mL);Nt为经过t时间后培养液中的藻细胞密度(cells/mL);t为培养时间(d)。
1.3.2 生物量的测定培养结束后,每组取100 mL藻液经预先恒重过的0.45 μm微孔滤膜抽滤,置于鼓风干燥箱中105 ℃烘至恒重,计算生物量干重(B)。
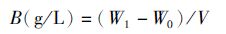 (2)
(2)
式中:W0为预恒重过的0.45 μm微孔滤膜的重量;W1为恒重过后0.45 μm微孔滤膜的藻泥的总重量;V为抽滤的藻液体积。
1.4 总脂和脂肪酸组成的测定 1.4.1 总脂的测定培养结束时,取足量藻液离心,再用蒸馏水清洗离心,收集的藻泥于-46 ℃下冷冻干燥,得到的藻粉用于测定总脂含量。
总脂含量的测定采用氯仿-甲醇法[9]。精确称取藻粉0.1~0.2 g(W0)至50 mL的锥形瓶内。加30 mL含0.01% BHT的氯仿-甲醇混合液[V(氯仿)∶V(甲醇)=2∶1],在4 ℃冰箱中浸提24 h,期间用超声波破碎仪在冰浴中破碎两次,每次30 min。然后将浸提液过滤至预恒重的50 mL的锥形瓶(W1)中,加10 mL 0.88% KCl溶液后立即充分震荡混合,静置30 min以待分层,用吸管吸去上层液(无色略呈白色乳状);然后沿壁缓慢加入10 mL 50%甲醇,弃上层液,下层氯仿层(绿色)即含脂层。将锥形瓶置于真空干燥箱中,40 ℃真空干燥后恒重(W2)。计算总脂含量和总脂产量。
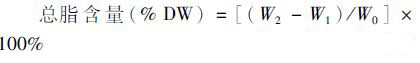 (3)
(3)
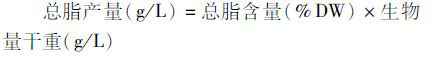 (4)
(4)
参照GRIFFITHS等方法[10],脂肪酸组成测定采用直接甲酯化法。采收一定体积藻液4 ℃离心(5 000 r/min,3 min)获得藻泥(约50~100 mg),将藻泥转入带硅胶衬里螺旋帽的15 mL棕色螺纹口顶空瓶中,加入500 μL十九烷酸-甲苯溶液(浓度0.2 mg/mL),漩涡混匀后,加2 mL 甲醇钠(NaOMe,0.5 mol/L),置超声波清洗机中80 ℃水浴混匀20 min,冷却至室温后,加2 mL BF3-甲醇溶液(Sigma),再置超声波清洗机中80 ℃水浴混匀20 min,冷却至室温后,加800 μL 去离子水和1 200 μL正己烷,漩涡混匀后,4 000 r/min离心3 min,将上层含有脂肪酸甲酯的正己烷-甲苯层经0.22 μm针头式过滤器过滤至2 mL广口样瓶中,于气相-质谱联用仪上参照黄旭雄等[11]检测脂肪酸含量。利用峰面积归一化法确定各脂肪酸的相对百分含量。某一种脂肪酸甲酯相对含量为某一种脂肪酸甲酯的峰面积与总脂肪酸甲酯的峰面积的比值。
1.5 生物柴油品质的测算通过前人建立的脂肪酸甲酯分子结构和组成与生物柴油品质指标(运动粘度、碘值、十六烷值和冷滤点)的关系模型,预测并评价该株绿球藻生物柴油是否可以作为柴油的替代燃料。具体参数定义及预测模型公式如下:
预测模型的3个参数定义:
相对链长[12](Relative chain length)L=∑Ni×Pi
皂化值[13](Saponification value,mgKOH/g)SN=∑(560×Pi)/MWi
长碳链饱和指数[14](Long chain saturated factor)LCSF=0.1×Pc16:0+0.5×Pc18:0+1.5×Pc22:0+2×Pc24:0
3个指标的预测模型公式:
运动粘度[12](Viscosity,mm2/s)Vis=-1.729 95+0.312 47×L+0.042 28×Pc22:1
碘值[13](Iodine value,gI2/100 g)IV=∑(254×m×Pi)/MWi
十六烷值[15](Cetane number)CN=46.3+5458/SN-0.225×IV
式中:i表示某种脂肪酸甲酯;N表示脂肪酸甲酯的碳链数;m表示脂肪酸甲酯的双键数;P表示脂肪酸甲酯的相对百分含量(%总脂肪酸甲酯);MW表示脂肪酸甲酯的分子量。
1.6 数据处理与分析每组样品的所有指标均平行测定3次,测定结果以平均值±标准差(Mean±SD)表示。试验数据用PASW.Statistics18.0软件进行ANOVA单因子方差分析,若P<0.05,则作Duncan’s多重比较。
2 结果 2.1 温度对绿球藻细胞密度和生物量的影响绿球藻在20~40 ℃均能正常生长,随着温度的升高绿球藻的细胞密度和生物量先上升后下降,均在35 ℃达到最高,分别为3 604×104 cells/mL和0.915 g/L。培养至第7天,20、25、30、35和40 ℃组相对生长率分别为0.29、0.31、0.34、0.35和0.32,35 ℃组相对生长率显著高于其他组(P< 0.05),且35 ℃组较其他组提前进入静止期,第5天以后该组藻细胞密度保持不变。40 ℃组与25 ℃组相对生长率无显著性差异(P>0.05),但生物量40 ℃组显著高于25 ℃组(P< 0.05)。对不同培养温度下的藻细胞密度回归分析,得y=-7.605x2+497.42x-4 721.3(R2=0.879 3),由回归方程得该株绿球藻的最适生长温度为32.7 ℃(图 1-2)。
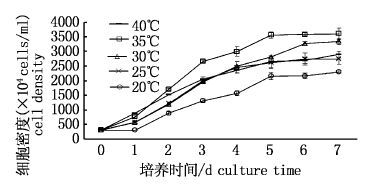
|
图 1 不同温度下绿球藻的细胞密度变化
Fig. 1 Variation of cell density of Chlorococcum sp.cultured at different temperature
|
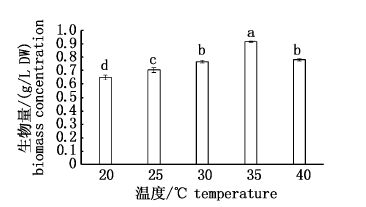
|
图 2 不同温度下绿球藻的生物量
Fig. 2 Biomass concentrations of Chlorococcum sp.at different temperature
不同小写字母表示生物量差异显著(P< 0.05)。 Different small letters mean significant differences among the treatments(P< 0.05). |
随着温度的升高绿球藻总脂含量和总脂产量均先上升后下降,30 ℃组和35 ℃组的总脂含量分别为22.68%和23.67%,二者无显著性差异(P>0.05),但均显著高于其他各试验组(P< 0.05)。各试验组的总脂产量差异显著(P< 0.05),35 ℃组总脂产量最高,为21.65 mg/L,各试验组按总脂产量高低排序:35 ℃>30 ℃>40 ℃>25 ℃>20 ℃。对不同培养温度下的总脂含量回归分析,得y=-0.037 6x2+2.505 3x-19.065(R2=0.850 4),由回归方程获得最高总脂含量的培养温度为33.3 ℃。对不同培养温度下的总脂产量进行回归分析,得y=-0.045 3x2+3.090 5x-33.959(R2=0.769 6),由回归方程获得最高总脂产量的培养温度为34.11 ℃(图 3)。
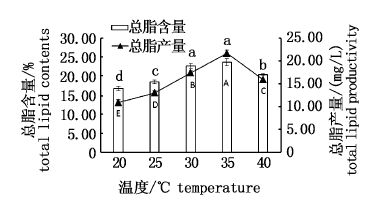
|
图 3 不同温度下绿球藻的总脂含量和总脂产量
Fig. 3 Total lipid contents and total lipid yield of
Chlorococcum sp. at different temperature
不同小写字母表示总脂含量差异显著(P< 0.05),不同大写字母表示总脂产量差异显著(P< 0.05) Different small letters for total lipid contents and different capital letters for total lipid yield mean significant differences among the treatments(P< 0.05),respectively. |
C16和C18系列脂肪酸是该株绿球藻的主要脂肪酸,二者总和占整个脂肪酸的85.56%~92.32%,以棕榈酸(C16:0)和亚油酸(C18:2n6)含量最多。随温度的升高,C16:0的含量先上升后下降,在35 ℃时最高,为28.37%;C18:3n3(亚麻酸)含量则不断降低,由20.02%降为4.30%;饱和脂肪酸(SFA)的含量先上升后下降,35 ℃时SFA含量最高,为41.90%;单不饱和脂肪酸(MUFA)呈波浪式变化,在40 ℃时最高,为19.26%;多不饱和脂肪酸(PUFA)含量不断下降,从60.93%降为44.85%(表 1)。
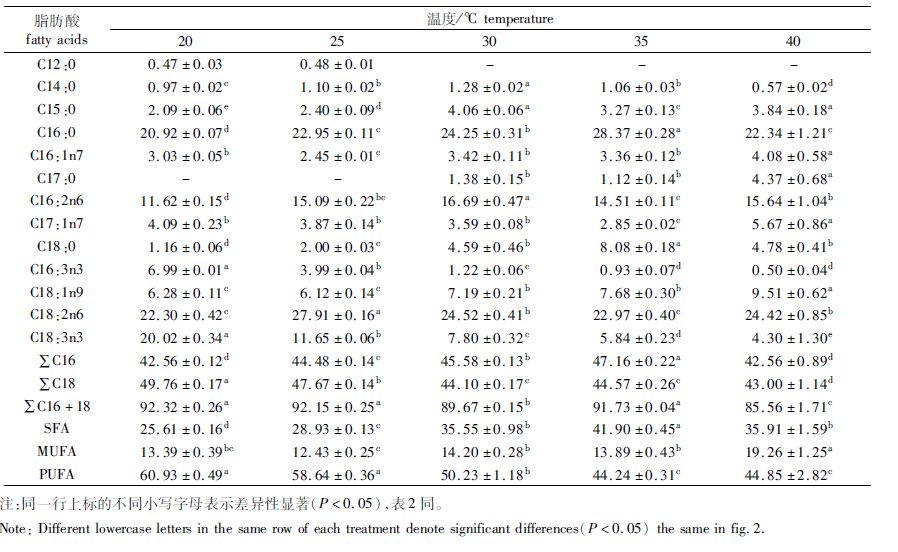
|
表 1 不同温度下绿球藻的脂肪酸组成(%总脂肪酸) Tab.1 Fatty acids profile(% total fatty acids) of Chlorococcum sp. at different temperature |
随着温度的升高,运动粘度各组之间变化不大;十六烷值不断增大,35 ℃和40 ℃时最高,分别为51.55和50.65;碘值则是先下降后升高,35 ℃时最低,为97.64 gI2/100 g(表 2)。

|
表 2 不同温度下绿球藻的生物柴油品质 Tab.2 Quality items of biodiesel from Chlorococcum sp. at different temperature |
温度是影响微藻生长的重要因素,高于或低于其适宜生长范围,均会显著降低其生长率[6, 16]。曾蓓蓓对绿球藻SHOU-F93和绿球藻SHOU-F124的研究表明,两株绿球藻的最适生长温度分别为19.3 ℃和24.3 ℃[17]。本试验中,该株绿球藻在20~40 ℃之间都能较好地生长,若以生物量为评价指标,经回归分析得该株绿球藻的最适生长温度为32.7 ℃,其最适生长温度和对高温的耐受性均较曾蓓蓓等[17]报道的两种绿球藻高,推测是由于藻株的来源不同而引起的。鉴于该株绿球藻属于典型的广温性耐高温藻株,因此可在室外光生物反应器中大规模培养。周连宁等[18]认为温度对微藻生长的影响主要通过影响酶的活性和营养物质的运输实现,温度较低时,细胞膜的运输和呼吸功能会受到影响,生长速率较慢;但随着温度的上升,酶活性不断增强,生长速率也不断加快;温度过高时,可能会破坏细胞和酶的活性,导致生长速率降低甚至出现负增长。而BERRY等[19]则认为高温抑制微藻生长主要与叶绿体有关,在植物的所有代谢过程中,叶绿体的光合作用被认为是对高温胁迫最敏感的,当植物的叶子或藻类受到高温胁迫时,它们的放氧、碳同化和光合磷酸化活性均显著下降。高温胁迫可导致捕光色素复合体同光系统Ⅱ(PSⅡ)的反应中心分离进而致使类囊体膜解垛叠[20],还可导致捕光色素复合体的结构发生变化[21],放氧复合体的活性丧失[22],以及从QA到QB的电子传递受抑制[23-24]。
早期研究表明,在极端高温或低温条件下,微藻合成脂肪的量减少[25]。OPUTE等[26]认为存在脂肪合成的最适温度,且因种而异,在极端温度下合成受限可能是相关酶发生不可逆损伤所致。丁彦聪等[27]研究了温度对小球藻细胞内叶绿素荧光参数的影响,结果表明温度过高会使活性反应中心的数量下降,进而捕获和用于电子传递的能量减少,造成油脂积累量下降。周连宁等[18]和张桂艳等[28]得出小球藻Chlorella sp. XQ-200419和Chlorella vulgaris的油脂含量随温度升高均先上升后下降,二者最适油脂积累温度分别为35 ℃和25 ℃。本试验中,随着温度的升高,绿球藻的总脂含量和总脂产量先上升后下降,均在35 ℃时达到最高,分别为23.67%和21.65 mg/L。回归分析表明,获得该绿球藻藻株最高总脂含量和最大油脂产量的培养温度分别为33.30 ℃和34.11 ℃。40 ℃下,总脂含量和总脂产量仍处于较高水平,说明40 ℃并不能使参与脂质合成的酶失活,只能使其活性较35 ℃稍有下降。
COHEN等[29]和曹春晖等[30]认为是不同温度下的不同生长状况导致了某些藻类脂肪酸组成的差异,且不饱和脂肪酸合成过程中的碳链延伸酶活性、去饱和酶的活性和去饱和酶基因的转录活性也与温度有关;VIGH等[31]认为,低温之所以能增加多不饱和脂肪酸含量是由于去饱和酶基因收到来自细胞膜上特异温度感应器的信号的原因。SKAMOTO等[32]研究发现,当培养温度由34 ℃降至22 ℃,Synechococcus PCC7002去饱和酶B基因表达量增加了10倍;郑亚君等[33]研究了温度对杜氏盐藻生长和脂肪酸组成的影响,结果表明:杜氏盐藻的脂肪酸以C16和C18为主,随着培养温度的升高,藻株内饱和脂肪酸和单不饱和脂肪酸所占比例增加,多不饱和脂肪酸所占比例减少。本试验中,该株绿球藻的脂肪酸以C16和C18为主,二者总量最高可达92.32%。随着温度的升高,高不饱和脂肪酸的含量逐渐降低,与此同时,亚麻酸(C18:3n3)含量也由20.02%降至4.30%,表明多不饱和脂肪酸的降低主要是由亚麻酸的降低引起的;饱和脂肪酸的含量先上升后下降,在35 ℃时达到最高(41.90%),而棕榈酸(C16∶0)的含量也是先上升后下降,在35 ℃时达到最高,表明棕榈酸的变化导致了饱和脂肪酸含量的变化。而这也符合前人的研究结果:温度降低时,为了保证细胞膜的流动性,细胞内不饱和脂肪酸含量会上升[34],相反地,温度升高时,为了保证细胞膜的完整性,饱和脂肪酸的含量会上升[35]。
表 3HARRINGTON等[36]研究表明,柴油的替代品应该具有C16~C19的链长,碳链较长可以保证有较高的沸点,有利于安全储运、运输和使用,但过长会导致熔点过高而引起流动性和低温性能变差。本试验中,绿球藻的脂肪酸以C16和C18为主,在适宜范围内。十六烷值(CN)表示柴油燃料的点火时间和燃烧性能,是衡量柴油品质的重要指标。CN一般在47~60为宜,CN过高会导致燃料与空气未经适宜混合就予以燃烧而导致燃烧不完全并产生黑烟,CN太小则燃料点火困难,不易启动并导致发动机爆震[11, 37]。生物柴油的CN主要是由于原料油中C16:0和C18:0两种饱和脂肪酸的含量决定的[38]。本试验中,随着温度的升高,CN从40.93升高至51.55,但只有30 ℃(48.57)、35 ℃(51.55)和40 ℃(50.65)组的CN在47~60范围内,符合生物柴油的标准。运动粘度是液体流动时内摩檫力的量度,其值随温度升高而降低,是衡量燃料流动性能及雾化性能的指标,轻质柴油适宜的运动粘度为1.9~6.0 mm2/s[39]。本试验中,各试验组运动粘度变化不大,在3.85 mm2/s左右,均符合生物柴油品质标准。碘值是对油脂分子碳链不饱和度的度量,指每100 g油脂吸收碘的克数,碘值高,十六烷值低,冷滤点低,碳链不饱和程度越高则碘值越高。本试验中,20 ℃组绿球藻脂肪酸的不饱和程度最高,其对应碘值最大,为145,但不符合欧盟和德国的生物柴油品质标准,而30 ℃(110.77 gI2/100 g)、35 ℃(97.64 gI2/100 g)和40 ℃(101.84 gI2/100 g)组都符合标准。
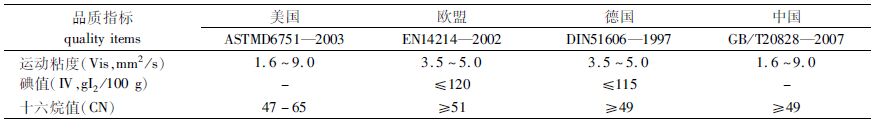
|
表 3 不同国家生物柴油标准的品质指标 Tab.3 Quality items of biodiesel standards of different countries |
综上所述,考虑到该高耐氨绿球藻藻株的生长性能、油脂含量、油脂产量和达到生物柴油品质标准,建议30~35 ℃为该藻株适宜的培养温度。
| [1] | RAWAT I, KUMAR R R, MUTANDA T, et al.Biodiesel from microalgae: a critical evaluation from laboratory to large scale production[J]. Applied Energy, 2013, 103: 444–467. DOI:10.1016/j.apenergy.2012.10.004 |
| [2] | ABOU-SHANAB R A I, JI M K, KIM H C, et al.Microalgal species growing on piggery wastewater as a valuable candidate for nutrient removal and biodiesel production[J]. Journal of Environmental Management, 2013, 115: 257–264. DOI:10.1016/j.jenvman.2012.11.022 |
| [3] | ZHU L D, WANG Z M, SHU Q, et al.Nutrient removal and biodiesel production by integration of freshwater algae cultivation with piggery wastewater treatment[J]. Water Research, 2013, 47(13): 4294–4302. DOI:10.1016/j.watres.2013.05.004 |
| [4] | 邱昌恩, 况琪军, 刘国祥, 等.不同氮浓度对绿球藻生长及生理特性的影响[J]. 中国环境科学, 2005, 25(4): 408–411. QIU C E, KUANG Q J, LIU G X, et al.Influence of different nitrogen concentrations on the growth and physiological characteristics of Chlorococcum sp[J]. China Environmental Science, 2005, 25(4): 408–411. |
| [5] | RAVEN J A, GEIDER R J.Temperature and algal growth[J]. The New Phytologist, 1988, 110(4): 441–461. DOI:10.1111/nph.1988.110.issue-4 |
| [6] | 蒋汉明, 翟静, 张媛英, 等.温度对海洋微藻生长及脂肪酸组成的影响[J]. 食品研究与开发, 2005, 26(6): 9–12. JIANG H M, ZHAI J, ZHANG Y Y, et al.Influences of temperature on the growth and fatty acid composition in marine microalgae[J]. Food Research and Development, 2005, 26(6): 9–12. |
| [7] | 华雪铭, 周洪琪, 丁卓平.温度和光照对微藻的生长、总脂肪含量及脂肪酸组成的影响[J]. 上海水产大学学报, 1999, 8(4): 309–315. HUANG X M, ZHOU H Q, DING Z P.Effect of temperature and illumination on the microalgae's growth, total lipid and fatty acid composition[J]. Journal of Shanghai Fisheries University, 1999, 8(4): 309–315. |
| [8] | 潘瑾, 俞建中, 马晓磊, 等.温度影响三角褐指藻生长和脂肪酸组成的初步探讨[J]. 渔业科学进展, 2010, 31(6): 90–94. PAN J, YU J Z, MA X L, et al.Effect of temperature on the growth and fatty acid composition of Phaeodactylum tricornutum[J]. Progress in Fishery Sciences, 2010, 31(6): 90–94. |
| [9] | FOLCH J M S, LEES M M, STANLEY G H S.A simple method for the isolation and purification of total lipid from animal tissue[J]. Journal of the Science of Food and Agriculture, 1957, 22(1): 24–36. |
| [10] | GRIFFITHS M J, VAN HILLE R P, HARRISON S T L.Selection of direct transesterification as the preferred method for assay of fatty acid content of microalgae[J]. Lipids, 2010, 45(11): 1053–1060. DOI:10.1007/s11745-010-3468-2 |
| [11] | HUANG X X, WEI L K, HUANG Z Z, et al.Effect of high ferric ion concentrations on total lipids and lipid characteristics of Tetraselmis subcordiformis, Nannochloropsis oculata and Pavlova viridis[J]. Journal of Applied Phycology, 2014, 26(1): 105–114. DOI:10.1007/s10811-013-0056-x |
| [12] | 段敏. 小球藻油制备生物柴油的试验和优化工艺研究[D]. 杭州: 浙江大学, 2011. DUAN M. Optimization of biodiesel preparation from Chlorella oil[D]. Hangzhou: Zhejiang University, 2011. |
| [13] | KALAYASIRI P, JEYASHOKE N, KRISNANGKURA K.Survey of seed oils for use as diesel fuels[J]. Journal of the American Oil Chemists' Society, 1996, 73(4): 471–474. DOI:10.1007/BF02523921 |
| [14] | RAMOS M J, FERNÁNDEZ C M, CASAS A, et al.Influence of fatty acid composition of raw materials on biodiesel properties[J]. Bioresource Technology, 2009, 100(1): 261–268. DOI:10.1016/j.biortech.2008.06.039 |
| [15] | KRISNANGKURA K.A simple method for estimation of cetane index of vegetable oil methyl esters[J]. Journal of the American Oil Chemists Society, 1986, 63(4): 552–553. DOI:10.1007/BF02645752 |
| [16] | UGWU C U, AOYAGI H, UCHIYAMA H.Influence of irradiance, dissolved oxygen concentration, and temperature on the growth of Chlorella sorokiniana[J]. Photosynthetica, 2007, 45(2): 309–311. DOI:10.1007/s11099-007-0052-y |
| [17] | 曾蓓蓓, 黄旭雄, 危立坤, 等.4株淡水微藻的适宜温度、光照强度及其细胞组成[J]. 上海海洋大学学报, 2014, 23(6): 856–862. ZENG B B, HUANG X X, WEI L K, et al.The suitable culture temperature, light intensity for four freshwater microalgae and analysis on cellular biochemical compositions[J]. Journal of Shanghai Ocean University, 2014, 23(6): 856–862. |
| [18] | 周连宁, 王波, 吴锋, 等.培养条件对小球藻生长及油脂积累的影响研究[J]. 生物学杂志, 2015, 32(3): 46–50. ZHOU L N, WANG B, WU F, et al.The impact of different culture conditions on the chlorella's growth and fat accumulation[J]. Journal of Biology, 2015, 32(3): 46–50. |
| [19] | BERRY J, BJÖRKAMAN O.Photosynthetic response and adaptation to temperature in higher plants[J]. Annual Review of Plant Physiology, 2003, 31: 491–543. |
| [20] | ARMOND P A, BJÖRKMAN O, STAEHELIN L A.Dissociation of supramolecular complexes in chloroplast membranes. A manifestation of heat damage to the photosynthetic apparatus[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1980, 601(3): 433–443. |
| [21] | SRIVASTAVA A, GUISSÉ B, GREPPIN H, et al.Regulation of antenna structure and electron transport in Photosystem II of Pisum sativum under elevated temperature probed by the fast polyphasic chlorophyll a fluorescence transient: OKJIP[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1997, 1320(1): 95–106. DOI:10.1016/S0005-2728(97)00017-0 |
| [22] | YAMANE Y, KASHINO Y, KOIKE H, et al.Effects of high temperatures on the photosynthetic systems in spinach: oxygen-evolving activities, fluorescence characteristics and the denaturation process[J]. Photosynthesis Research, 1998, 57(1): 51–59. DOI:10.1023/A:1006019102619 |
| [23] | CAO J, GOVINDJEE.Chlorophyll a fluorescence transient as an indicator of active and inactive photosystem Ⅱ in thylakoid membranes[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1990, 1015(2): 180–188. DOI:10.1016/0005-2728(90)90018-Y |
| [24] | 武宝玕, 韩志国, 藏汝波.热胁对海洋红藻及绿藻叶绿素荧光的影响[J]. 暨南大学学报(自然科学与医学版), 2002, 23(1): 108–112. WU B G, HAN Z G, ZANG R B.Effects of heat stress in marine red and green algae by chlorophyll fluorescence method[J]. Journal of Jinan University (Natural Science & Medicine Edition), 2002, 23(1): 108–112. |
| [25] | ARONSON S.Effect of incubation temperature on the macromolecular and lipid content of the phytoflagellate Ochromonas danica[J]. Journal of Phycology, 1973, 9(1): 111–113. DOI:10.1111/j.0022-3646.1973.00111.x |
| [26] | OPUTE F I.Studies on fat accumulation in Nitzschia palea Kütz[J]. Annals of Botany, 1974, 38(157): 889–902. |
| [27] | 丁彦聪, 高群, 刘家尧, 等.环境因子对小球藻生长的影响及高产油培养条件的优化[J]. 生态学报, 2011, 31(18): 5307–5315. DING Y C, GAO Q, LIU J Y, et al.Effect of environmental factors on growth of Chlorella sp. and optimization of culture conditions for high oil production[J]. Acta Ecologica Sinica, 2011, 31(18): 5307–5315. |
| [28] | 张桂艳, 温小斌, 梁芳, 等.重要理化因子对小球藻生长和油脂产量的影响[J]. 生态学报, 2011, 31(8): 2076–2085. ZHANG G Y, WEN X B, LANG F, et al.The effects of physical and chemical factors on the growth and lipid production of Chlorella[J]. Acta Ecologica Sinica, 2011, 31(8): 2076–2085. |
| [29] | COHEN Z, VONSHAK A, RICHMOND A.Effect of environmental conditions on fatty acid composition of the red alga Porphyridium cruentum: correlation to growth rate[J]. Journal of Phycology, 1988, 24(3): 328–332. |
| [30] | 曹春晖, 孙世春, 麦康森, 等.温度对四株海洋绿藻总脂含量和脂肪酸组成的影响[J]. 海湖盐与化工, 2006, 35(3): 16–18. CAO C H, SUN S Y, MAI K S, et al.Effect of temperature on the total lipid contents and fatty acid composition of 4 strains of marine green algae[J]. Sea-Lake Salt & Chemical Industry, 2006, 35(3): 16–18. |
| [31] | VIGH L, LOS D A, HORVÁTH I, et al.The primary signal in the biological perception of temperature: Pd-catalyzed hydrogenation of membrane lipids stimulated the expression of the desA gene in Synechocystis PCC6803[J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(19): 9090–9094. DOI:10.1073/pnas.90.19.9090 |
| [32] | SAKAMOTO T, HIGASHI S, WADA H, et al.Low-temperature-induced desaturation of fatty acids and expression of desaturase genes in the cyanobacterium synechococcus sp[J]. FEMS Microbiology Letters, 1997, 152(2): 313–320. DOI:10.1111/j.1574-6968.1997.tb10445.x |
| [33] | 郑亚君, 王翠红, 许萌萌, 等.温度对杜氏藻生长和脂肪酸组成的影响[J]. 山西大学学报(自然科学版), 2011, 34(S2): 123–126. ZHENG Y J, WANG C H, XU M M, et al.Effects of temperature on growth and fatty acid composition of Dunaliella salina[J]. Journal of Shanxi University (Natural Science Edition), 2011, 34(S2): 123–126. |
| [34] | LOS D A. MURATA N.Membrane fluidity and its roles in the perception of environmental signals[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2004, 1666(1/2): 142–157. |
| [35] | JIANG Y, CHEN F.Effects of temperature and temperature shift on docosahexaenoic acid production by the marine microalge Crypthecodinium cohnii[J]. Journal of the American Oil Chemists' Society, 2000, 77(6): 613–617. DOI:10.1007/s11746-000-0099-0 |
| [36] | HARRINGTON K J.Chemical and physical properties of vegetable oil esters and their effect on diesel fuel performance[J]. Biomass, 1986, 9(1): 1–17. DOI:10.1016/0144-4565(86)90008-9 |
| [37] | KNOTHE G, VAN GERPEN J, KRAHL J.The Biodiesel Handbook[M].Champaign, Illinois: CRC Press, 2005. |
| [38] | KNOTHE G, MATHEAUS A C, RYAN III T W.Cetane numbers of branched and straight-chain fatty esters determined in an ignition quality tester[J]. Fuel, 2003, 82(8): 971–975. DOI:10.1016/S0016-2361(02)00382-4 |
| [39] | 梅帅, 赵凤敏, 曹有福, 等.三种小球藻生物柴油品质指标评价[J]. 农业工程学报, 2013, 29(15): 229–235. MEI S, ZHAO F M, CAO Y F, et al.Evaluation of quality items for biodiesel made from three kinds of Chlorella vulgaris[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(15): 229–235. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. Aquatic Animal Genetic Breeding Center Collaborative Innovation Center in Shanghai, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


