海膜(Halymenia sinesis)隶属于红藻门(Rhodophyta)、杉藻目(Gigartinales)、海膜科(Halymeniaceae)、海膜属(Halymenia)。藻体呈深紫红色或红色,有不规则分枝,边缘锯齿状,片状到簇状,脆且光滑[1-2]。我国主要生长在具有热带特征的海岛,南海北区和南海南区,系暖温带性海藻,可供食用或药用等。海藻在长期的自然选择过程下对环境有一定的适应性,从而忍受环境因子的不断变化。近年来,国内外有很多海藻对各种逆境环境响应的研究,包括光照、温度、盐度、重金属、pH等[3-4]。随着全球变暖势,温度变化对海藻生长的影响受到越来越多的关注,例如郭赣林等研究过温度对孔石莼、浒苔、江蓠等潮间带海藻的生长和生理变化[5],鹿宁研究过高温胁迫对龙须菜的抗氧化系统的影响[6-7],王悠研究了海带对高温的生理生化响应等[8]。而对经济海藻蜈蚣藻属的研究则多集中于海藻多糖的提取、纯化和药用价值的研究,对海藻与环境之间的关系研究较少,对同属海膜科的海膜的研究更少。本文在之前研究的基础上,比较了不同恒温和不同变温幅度下,海膜的生长、生化组成以及抗氧化酶的变化,以了解海膜对不同生境的适应性,为海膜的大量栽培和改善其产量和品质提供参考。
1 材料与方法 1.1 实验材料和主要仪器实验所选海藻海膜来自海南省附近潮间带,长期培养于实验室内人工海洋系统中,培养条件:温度(25±1)℃,光照1 000 lx,光周期12L∶12D,pH 7.8~8.2,盐度28~31。实验前选取实验室内人工海洋系统中长势健康色泽良好的藻体,清理表面杂质,暂养于f/2加富海水中一周,2~3 d更换一次培养液。0.1 mol/L PBS缓冲液(pH 7.4); 0.1 mol/L磷酸缓冲液(pH 7.0);丙酮;南京建成公司酶试剂盒:植物过氧化物酶(POD)测定试剂盒(A084)、超氧化物歧化酶(SOD)测试盒(A001)、丙二醛(MDA)测定试剂盒(A003);人工海水的配置是用蒸馏水溶解海水晶,静置过滤后再加f/2-medium,调节pH到7.8~8.2,高压灭菌后自然冷却。
主要仪器:SPX-GB光照培养箱(上海跃进医疗器械有限公司)、HWS-26型电热恒温水浴锅(上海一恒科技有限公司)、T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司)、TGL-16M台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 实验设计选择色泽长势较优的海膜分取成5 g大小暂养一周备用,实验时将暂养海膜置于加有3 L人工海水的小玻璃缸中,分别于17、21、25、29、33 ℃下培养,每1个 温度处理有3 个重复玻璃缸,每个重复缸中有3片海膜,实验中光照强度1 000 lx,L∶D=12∶12,pH约7.8,盐度29,每天定时更换培养液。
不同变温条件是(25±0)、(25±2)、(25±3)、(25±4)、(25±5) ℃,其余培养条件与不同恒温处理时相同。
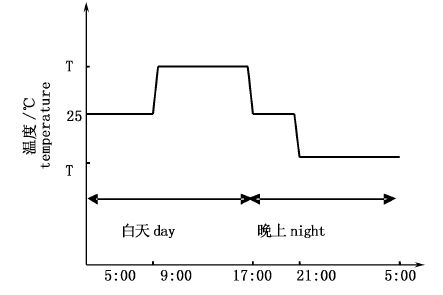
1.3 昼夜变温模式根据昼夜温度变化,将一天24 h分成4个阶段,5:00-9:00、9:00-17:00、17:00-21:00和21:00-5:00(图 1)。采用手动调节实现变温,+T、-T表示温度波动值,分别是2、3、4、5 ℃。
|
图 1 昼夜变温模式图
Fig. 1 The day and night temperature fluctuation mode
|
连续培养10 d,结束时称取各实验组海膜湿重,分别计算不同恒温下和不同变温幅度下海膜的日相对生长率(relative growth rate,RGR)。
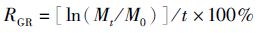 (1)
(1)
式中:RGR为日相对生长率; M0为初始鲜重(g);Mt为t天后的鲜重(g);t为实验周期(d)。
1.5 生化组成的测定叶绿素a(Chl.a)含量测定用丙酮提取法:称取一定鲜重(0.10~0.15 g)藻体加适量80%丙酮研磨成匀浆,转移至离心管中7 500 r/min离心10 min,上清液加丙酮定容至10 mL,测定666和730 nm处吸光值[9]。计算公式如下:
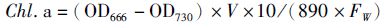 (2)
(2)
藻红蛋白(PE)含量测定:称取一定藻体鲜重(约0.1 g),用适量0.1 mol/L的磷酸缓冲液(pH 7.0)研磨,7 500 r/min离心15 min,上清液定容到10 mL,测455、564、592nm处吸光值[10]。计算公式如下:
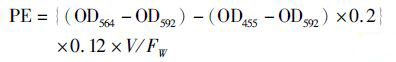 (3)
(3)
式中: OD为吸光值;V为定容后的溶液体积;FW为藻体湿重(mg/g)。
实验周期是15 d,从实验开始后第3天开始测第一次,以后每3天测一次,第15天结束。
1.6 生理指标的测定过氧化物酶(POD)、超氧化物歧化酶(SOD)、丙二醛(MDA)的测定均用南京建成公司酶试剂盒,实验过程严格按照说明要求操作。实验周期是11 d,从实验开始后第3天开始测第一次,以后每2天测一次,第11天结束。
1.7 数据分析利用Excel 2007和SPSS 17.0 软件进行数据处理和方差分析。
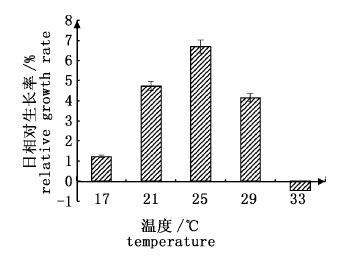
2 结果与分析 2.1 不同恒温下海膜的生长和生理生化变化 2.1.1 不同恒温下海膜的生长如图 2所示,除了在33 ℃恒温下,海膜在其余4种恒温条件下都有一定的生长,其中25 ℃时与其他恒温下有着显著性差异(P< 0.05),有最大的相对生长率,其次是21 ℃、29 ℃、17 ℃。且25 ℃时RGR分别是21 ℃的约1.41倍,29 ℃的约1.61倍,17 ℃ 的约5.51倍。但是在33 ℃的极端温度下,海膜生长到第6天藻体就开始出现从边缘变白、变软。
|
图 2 不同水温下海膜的日相对生长率
Fig. 2 The relative growth rate of H. sinesis at different water temperature
|
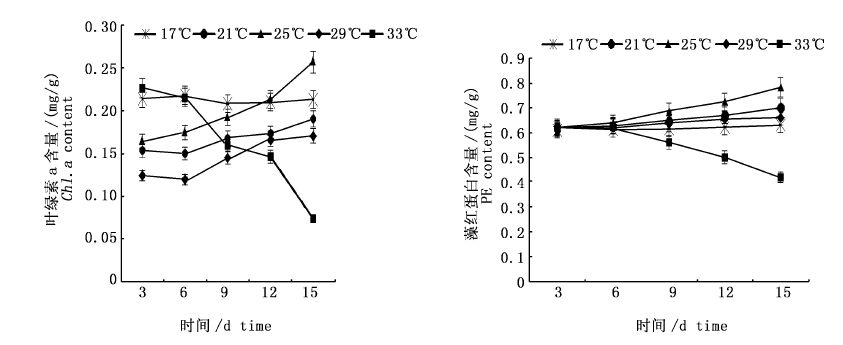
如图 3所示,低温(17 ℃)和高温(33 ℃)下,海膜的叶绿素a和藻红蛋白含量均呈现下降趋势,且高温(33 ℃)比低温下降更明显(P< 0.05),说明高温对叶绿素a和藻红蛋白含量影响更大。而21 ℃、25 ℃、29 ℃恒温下海膜的叶绿素a和藻红蛋白含量整体呈上升趋势。第15天时,25 ℃下海膜的叶绿素a含量提高了56.71%,藻红蛋白含量提高了30.72%;21 ℃下海膜的叶绿素a和藻红蛋白含量分别提高了24.18%和13.68%;29 ℃下是37.09%和11.47%。
|
图 3 不同温度下海膜的叶绿素a和藻红蛋白含量变化
Fig. 3 Variations of Chl.a and PE contents of H. sinesis at different temperature
|
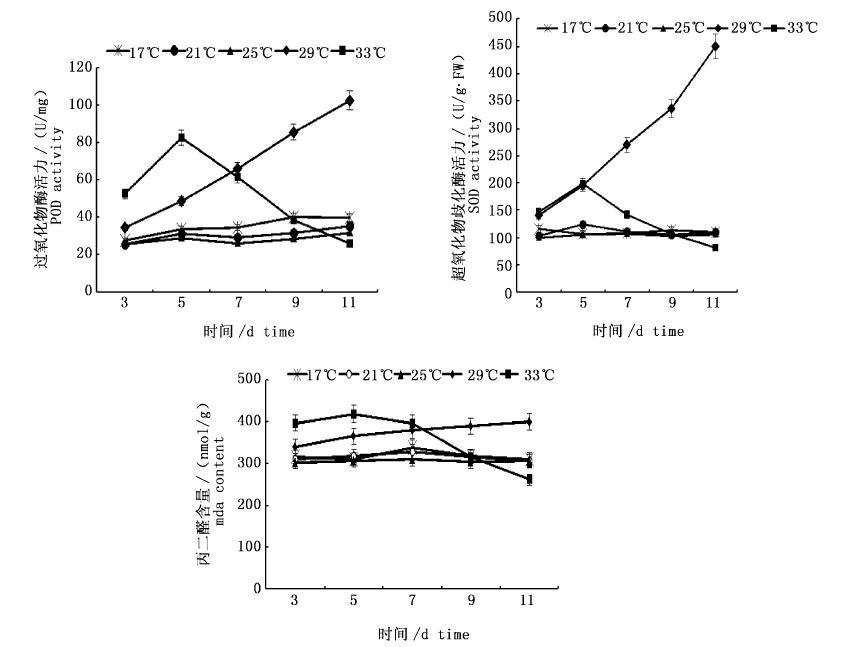
如图 4所示,在17 ℃、21 ℃、25 ℃下,海膜POD变化不是很明显,但是在29 ℃时,海膜的POD变化显著(P< 0.05),随培养时间延长上升很快,培养11 d上升约2.5倍,而在33 ℃高温胁迫的第3天和第5天海膜POD活性上升,但是从第5天开始急剧下降。
|
图 4 不同温度下海膜的POD、SOD和MDA含量变化
Fig. 4 Variations of POD,SOD and MDA content of H. sinesis at different temperature
|
海膜的SOD活性变化与POD相似,29 ℃海膜的SOD活性是25℃的3.25倍,33 ℃高温胁迫下海膜的SOD活性先升后降。
海膜的MDA含量,在17 ℃、21 ℃、25 ℃下均维持在较稳定的范围内波动,无明显差异(P﹥0.05);29 ℃时海膜的MDA呈上升趋势,第11天MDA含量是25 ℃的约0.31倍;33 ℃下,海膜的MDA含量在第3到9天均高于低温水平下含量,第5天开始下降。
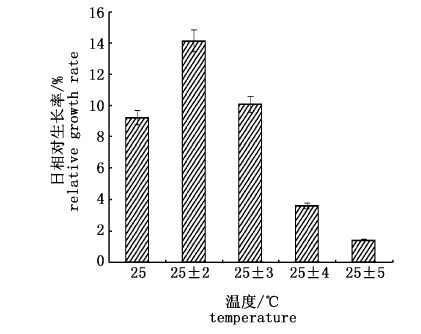
2.2 不同变温幅度下海膜的生长和生理生化变化 2.2.1 不同变温幅度下海膜的生长如图 5所示,与25 ℃恒温相比,±2 ℃变温下海膜的相对生长率显著升高(P< 0.05);而±3 ℃变温下的生长率变化不明显(P﹥0.05),略高于恒温,±4、±5 ℃变温下海膜的相对生长率显著低(P< 0.05)。海膜的生长率随着变温幅度的增加,生长率降低越明显。
|
图 5 不同变温下海膜的相对生长率
Fig. 5 The relative growth rate of H. sinesis at different temperature
|
如图 6所示,与25 ℃恒温相比,±4、±5 ℃变温幅度下海膜的叶绿素a和藻红蛋白含量无明显变化趋势(P﹥0.05);±2 ℃变温下海膜的叶绿素a和藻红蛋白含量呈上升趋势,且比25 ℃恒温上升显著(P< 0.05);±3 ℃变温下海膜的叶绿素a和藻红蛋白含量上升趋势也不明显(P﹥0.05)。
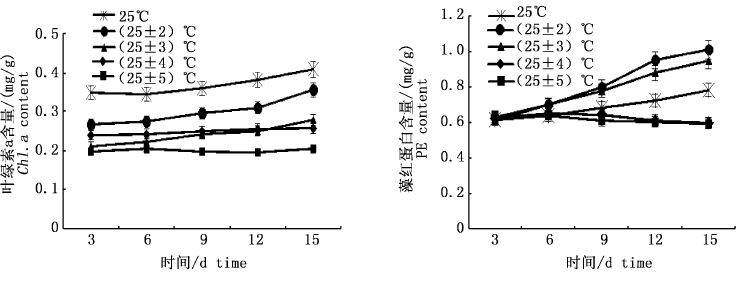
|
图 6 不同变温下海膜的叶绿素a和藻红蛋白含量变化
Fig. 6 Variations of Chla and PE content of H. sinesis with different temperature fluctuation
|
如图 7所示,与25 ℃恒温相比,±2 ℃和±3 ℃的变温幅度下,海膜的POD活性略高于恒温组,变化不是很明显(P﹥0.05);在±4、±5 ℃变温幅度下海膜的POD活性显著上升(P< 0.05),分别是恒温组的约3倍和3.3倍。
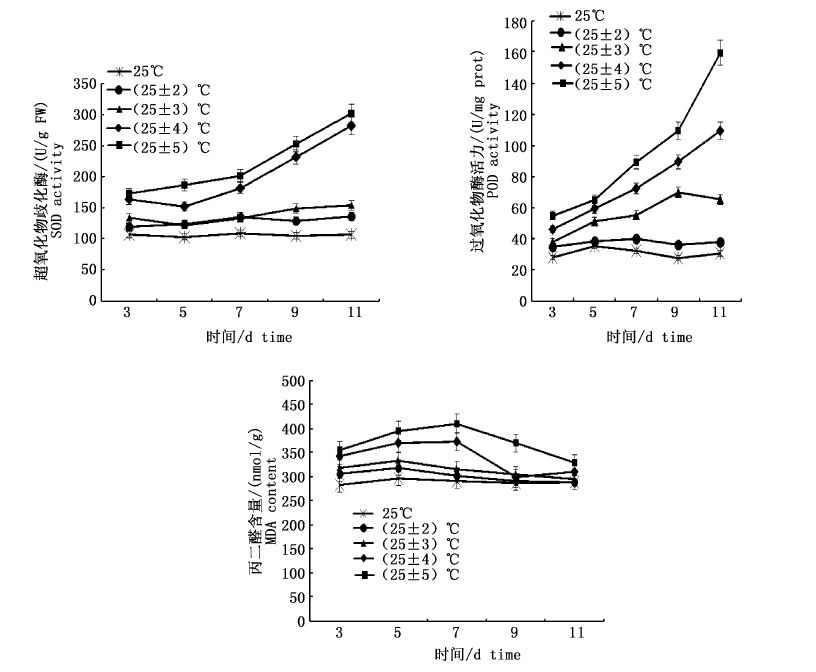
|
图 7 不同变温下海膜的POD、SOD和MDA含量变化
Fig. 7 Variations of POD,SOD and MDA content of H. sinesis with different temperature fluctuation
|
不同变温幅度下海膜的SOD变化与POD活性变化相似,±2 ℃和±3 ℃的变温幅度下变化不明显(P﹥0.05);±4、±5 ℃变温幅度下海膜的SOD活性分别是恒温组的约1.42倍和1.60倍。
不同变温幅度下海膜的MDA含量,在±2 ℃和±3 ℃的变温幅度下变化不明显(P< 0.05),在很小的范围内波动;±4、±5 ℃变温幅度下海膜的MDA含量在第5到9天均高于低温水平下,从第11天开始下降。
3 讨论在自然界中,每种海藻都有特定的生长海区,有长期适应下来的最高温度和最低温度界限,并有其生长的最适温度,这都能在海藻生理特性上得到反映[11-12]。本实验根据全球温度不断升高和海洋昼夜温差的波动现象,设置(17、21、25、29、33 ℃)5个不同恒温及(25±0)、(25±2)、(25±3)、(25±4)和(25±5) ℃ 5个不同变温进行研究。结果表明海膜在17~29 ℃都能进行一定的生长,在25 ℃时有最大的相对生长率,同时观察到29 ℃培养海膜后期藻体开始变软;33 ℃时藻体变软颜色变淡,局部变白溃烂。而与25 ℃恒温相比,海膜在(±2、±3 ℃)的变温幅度下相对生长率显著增加(P< 0.05),而(±4、±5 ℃)的变温幅度下相对生长率变化不明显(P﹥0.05)。综上所述说明海膜对温度有较强的适应性,更适应适宜的小范围温度变化。
叶绿素a和藻胆蛋白是海膜的主要光合色素,藻胆蛋白是藻红蛋白、藻蓝蛋白和别藻蓝蛋白的复合体,能高效协助PSⅡ捕光[13],其含量的高低与藻体本身的光合作用和生长旺盛与否密切相关。据报道高温胁迫下江蓠的藻红蛋白和叶绿素含量发生变化,藻体颜色也改变[14]。龙须菜在低温和高温胁迫下叶绿素和藻红蛋白含量有所下降[15]。这与本实验中研究结果相似,海膜在高于29 ℃的高温和较大的温度波动下,随着培养时间的延长,两者的含量都有所下降,藻体变软变浅说明过高的温度已经对海膜造成不可逆转的伤害,细胞膜系统破坏,从而导致叶绿体膜结构和功能改变,色素减少,光合作用能力下降。
变温对水生和陆生生物的生长有一定的促进作用,能改善其品质和产量[16]。可能是适宜的变温对生物体来说是一种刺激,从而调整机体产生一些色素、糖或者蛋白或者激活某些酶的活性,来抵御或预防可能会发生的胁迫,所以持续有规律的波动对生物体有一定的促进作用。许多农产品种植过程中都会用这种方法增加产量改善品质[17]。本实验的研究结果:与相应的恒温25 ℃相比,±2、±3、±4、±5 ℃的变温幅度都能促进海膜生长,而且±2﹥±3﹥±4﹥±5 ℃,随着温幅的增大,生长率逐渐减小。总之,适宜的变温,才能促进海膜的生长。因此,在人工养殖过程中,结合适宜的变温和时间的准确性,才能节省时间和成本。
正常情况下,藻类细胞内活性氧的产生与清除处于动态平衡[7]。高温胁迫下,藻体活性氧自由基会积累引起膜脂过氧化会产生丙二醛(MDA),MDA间接反映膜受损程度[6, 18]。超氧化物歧化酶(SOD)可以将氧自由基转化为H2O2、过氧化物酶(POD)可以将H2O2 分解为H2O和O2[19]。柯德森发现龙须菜的POD在30 ℃和35 ℃温度下,活性明显上升,培养12 d上升近5倍[20];陈伟洲等研究表明皱紫菜的SOD在低温(14、17和20 ℃)时差异不明显,温度高于20 ℃时酶活性随着温度升高上升[21]。海膜的MDA、POD和SOD在低温时变化不明显,随着温度的升高和试验时间延长而成倍增加,高温胁迫(33 ℃)下,实验初期上升,之后随着培养时间的延长又急剧下降,可能是细胞膜破坏后合成这些酶所必需的蛋白和能量被破坏,或是温度过高酶失活导致氧自由基进一步积累反过来对海膜直接造成胁迫,海膜藻体溃烂。而在变温时海膜的MDA是先上升且随着变温幅度的增加上升越快,后期下降,而POD和SOD是随着变温幅度增加而上升,可能是后期海膜的抗氧化酶发生了作用,而且海膜的藻胆蛋白也可以清除氧自由基,消除了部分氧自由基使MDA含量下降,具体的机制还需要进一步的研究。
| [1] | 丁兰平, 黄冰心, 王宏伟.中国海洋红藻门新分类系统[J]. 广西科学, 2015, 22(2): 164–188. DING L P, HUANG B X, WANG H W.New classification system of marine red algae of China[J]. Guangxi Sciences, 2015, 22(2): 164–188. |
| [2] | 夏邦美.中国海藻志, 第二卷, 红藻门[M].北京: 科学出版社, 2004: 150. XIA B M.Flora algarum marinarum sinicarum, Tomus Ⅱ, rhodophyta[M].Beijing: Science Press, 2004: 150. |
| [3] | 丁兰平, 黄冰心, 谢艳齐.中国大型海藻的研究现状及其存在的问题[J]. 生物多样性, 2011, 19(6): 798–804. DING L P, HUANG B X, XIE Y Q.Advances and problems with the study of marine macroalgae of China seas[J]. Biodiversity Science, 2011, 19(6): 798–804. |
| [4] | HEIDARI M, JAMSHIDI P.Effects of salinity and potassium application on antioxidant enzyme activities and physiological parameters in Pearl Millet[J]. Agricultural Sciences in China, 2011, 10(2): 228–237. DOI:10.1016/S1671-2927(09)60309-6 |
| [5] | 郭赣林, 董双林, 董云伟.温度及其波动对孔石莼生长及光合作用的影响[J]. 中国海洋大学学报, 2006, 36(6): 941–945. GUO G L, DONG S L, DONG Y W.Effects of constant and diel fluctuating temperatures on the growth and photosynthesis of the Macroalgae Ulva pertusa Kjellm[J]. Periodical of Ocean University of China, 2006, 36(6): 941–945. |
| [6] | 鹿宁, 臧晓南, 张学成, 等.高温胁迫下不同龙须菜品系抗氧化能力的比较[J]. 武汉大学学报(理学版), 2010, 56(5): 570–577. LU N, ZANG X N, ZHANG X C, et al.Comparison of antioxidant activities of different strains of Gracilaria lemaneiformis under high-temperature stress[J]. Journal of Wuhan University (Natural Science Edition), 2010, 56(5): 570–577. |
| [7] | 鹿宁, 臧晓南, 张学成, 等.逆境胁迫对藻类抗氧化酶系统的影响[J]. 武汉大学学报(理学版), 2012, 58(2): 119–124. LU N, ZANG X N, ZHANG X C, et al.Effects of stress on antioxidant enzyme system in algae[J]. Journal of Wuhan University (Natural Science Edition), 2012, 58(2): 119–124. |
| [8] | 王悠. 海带对高温胁迫的生理生化响应和耐高温机理的初步研究[D]. 青岛: 中国海洋大学, 2003. WANG Y. The Physiological and biochemical responses to heat stress and the preliminary study on heat-resistant mechanisms in Laminaria japonica[D]. Qingdao: Ocean University of China, 2003. |
| [9] | 张志良, 翟伟菁, 李小芳.植物生理学实验指导[M].北京: 高等教育出版社, 2010: 58-61. ZHANG Z L, ZHAI W J, LI X F.Plant physiology experiment instruction[M].Beijing: Higher Education Press, 2010: 58-61. |
| [10] | BEER S, ESHEL A.Determining phycoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae[J]. Australian Journal of Marine and Freshwater Research, 1985, 36(6): 785–792. DOI:10.1071/MF9850785 |
| [11] | 曾呈奎, 夏邦美.中国海藻分类研究现状及发展趋势[J]. 海洋科学, 1992: 10–11. ZENG C K, XIA B M.Classification advances and development trend with the study of marine macroalgae of China seas[J]. Marine Sciences, 1992: 10–11. |
| [12] | RAVEN J A, GEIDER R J.Temperature and algal growth[J]. New Phytologist, 1988, 110(4): 441–461. DOI:10.1111/nph.1988.110.issue-4 |
| [13] | 张学成, 张锦东, 隋正红, 等.江蓠属藻胆蛋白的研究Ⅰ诱变、突变体筛选及藻胆蛋白的光谱物性[J]. 青岛海洋大学学报, 1996, 26(3): 318–326. HANG X C, ZHANG J D, SUI Z H, et al.Studies on phycobiliproteins from Gracilaria Ⅰ. mutagenesis, mutation selection and characterization of absorption spectra and flucorescent emission spectra[J]. Journal of Ocean University of Qingdao, 1996, 26(3): 318–326. |
| [14] | 张学成, 费修绠, 王广策, 等.江蓠属海藻龙须菜的基础研究与大规模栽培[J]. 中国海洋大学学报, 2009, 39(5): 947–954. ZHANG X C, FEI X G, WANG G C, et al.Genetic studies and large scale cultivation of Gracilaria lemaneiformis[J]. Periodical of Ocean University of China, 2009, 39(5): 947–954. |
| [15] | SHEN D L, WU M.Chromosomal and mutagenic study of the marine macroalga, Gracilaria tenuistipitata[J]. Journal of Applied Phycology, 1995, 7(1): 25–31. DOI:10.1007/BF00003546 |
| [16] | 郭赣林, 阎斌伦, 高焕, 等.变温对孔石莼生长和生化组成的影响[J]. 水产科学, 2012, 31(6): 350–353. GUO G L, YAN B L, GAO H, et al.Effects of fluctuating temperature on growth and chemical constituents of sea weed Ulva pertusa[J]. Fisheries Science, 2012, 31(6): 350–353. |
| [17] | 郭赣林, 董双林, 董云伟.温度及其波动对潮间带海藻生长及光合作用的影响[J]. 海洋开发与管理, 2007, 24(5): 115–120. GUO G L, DONG S L, DONG Y W.The impact of temperature fluctuation on the growth and photosynthesis of inter-tidal algal[J]. Ocean Development and Management, 2007, 24(5): 115–120. |
| [18] | 娄燕, 吴靖娜, 熊何健, 等.我国海藻中抗氧化活性物质的研究进展[J]. 福建水产, 2015, 37(2): 166–171. LOU Y, WU J N, XIONG H J, et al.Advances in studies of antioxidant active substances from seaweed of China[J]. Journal of Fujian Fisheries, 2015, 37(2): 166–171. |
| [19] | 张元, 谢潮添, 陈昌生, 等.高温胁迫下坛紫菜叶状体的生理响应[J]. 水产学报, 2011, 35(3): 379–386. ZHANG Y, XIE C T, CHEN C S, et al.Physiological responses of gametophytic blades of Porphyra haitanensis to rising temperature stresses[J]. Journal of Fisheries of China, 2011, 35(3): 379–386. |
| [20] | 柯德森, 史椰灯, 王正询.环境因素对龙须菜过氧化物酶活性的影响[J]. 广州大学学报(自然科学版), 2007, 6(4): 26–29. KE D S, SHI Y D, WANG Z X.Effects of environmental factors on the activity of peroxidase in Gracilaria lemaneiformis[J]. Journal of Guangzhou University (Natural Science Edition), 2007, 6(4): 26–29. |
| [21] | 陈伟洲, 吴文婷, 许俊宾, 等.不同生态因子对皱紫菜生长及生理组分的影响[J]. 南方水产科学, 2013, 9(2): 14–19. CHEN W Z, WU W T, XU J B, et al.Effects of different ecological factors on growth and physical components of Porphyra crispate[J]. South China Fisheries Science, 2013, 9(2): 14–19. |
 2016,
Vol. 25
2016,
Vol. 25


