菊黄东方鲀(Takifugu flavidus)隶属于硬骨鱼纲鲀形目(Tetraodontiformes)鲀科(Tetraodontidae)东方鲀属(Takifugu),俗称“满天星”,主要分布于我国东海、黄海及渤海,属于温带近海底层鱼类[1],不作长距离的洄游,菊黄东方鲀具有很高的药用、食用价值[2],在国内东方鲀属鱼类中价格最高[2]。菊黄东方鲀的人工繁殖技术研究从2001年开始[3],到2004年养殖逐渐兴起,其养殖面积日益扩大,产业主要分布于我国的沿海地区。
目前,有关菊黄东方鲀幼鱼阶段的基础研究主要集中于生长特性[4]、发育及行为生态[5-6]、消化酶活性[7]、氨氮和常见水产药物毒性试验[8-9]以及外界环境因子对其的影响[10-12],探明了幼鱼生长与消化酶特性[4, 7]、氨氮安全浓度[8]和适宜环境范围(如:盐度、温度等)[10-12]。有关菊黄东方鲀幼鱼后期驯化转食阶段生长与营养特点的相关研究较少;而菊黄东方鲀这阶段幼鱼死亡率较高。脂类是生物体的储能物质及能量提供者,又是生物体的重要组成部分,能协助脂溶性维生素的吸收和参与机体各方面的代谢活动等[13-14]。因此,为了探讨造成高死亡率的原因及在转食配合饲料过程中幼鱼是否有足够的能量支撑,本文采用生化分析手段,检测分析了转食前、中、后的菊黄东方鲀幼鱼生长和全鱼脂肪酸组成及含量,旨在掌握菊黄东方鲀幼鱼在驯化转食配合饲料过程中脂肪酸组成及含量的变化规律,从而评价菊黄东方鲀幼鱼在驯化转食过程中的脂类营养状况,为开发和研制适合菊黄东方鲀幼鱼驯化转食的配合饲料提供基础资料,同时为驯化转食阶段幼鱼营养性疾病的诊断提供依据,并为其养殖管理提供指导。
1 材料与方法 1.1 试验鱼与幼鱼驯化转食方法实验用菊黄东方鲀鱼苗,于2014年5月21日取自上海市水产研究所座落于杭州湾北部沿岸的奉贤基地。菊黄东方鲀人工繁殖和苗种培育期间管理等方法参照施永海等[15],苗种培育到20日龄,此时鱼苗全长0.9~1.0 cm,放养到海水土池进行幼鱼培育,放养密度为15尾/m2,鱼苗进入池塘后,主要摄食池塘中的天然饵料——海水桡足类及糠虾幼体等(干物质基础下粗蛋白质含量为67.16%±0.65% ,粗脂肪含量为7.13%± 0.37% ,粗灰分含量为15.81%±0.13%,n=3;其脂肪酸组成见表 1),21 d 后开始转食驯化。将商品粉状饲料(常熟泉兴营养添加剂有限公司生产的幼鳖商业粉状配合饲料,干物质基础下粗蛋白质含量为 48.82% ±0.28%,粗脂肪含量为5.74% ± 0.27%,粗灰分含量为13.93%±0.05%,n=3,其脂肪酸组成见表 1)做成小面团,置于池边水深10 cm处,多处投喂。一般驯食10 d后,95%以上的鱼苗能摄食配合饲料。试验期间,每2周换水1次,每次30%。
|
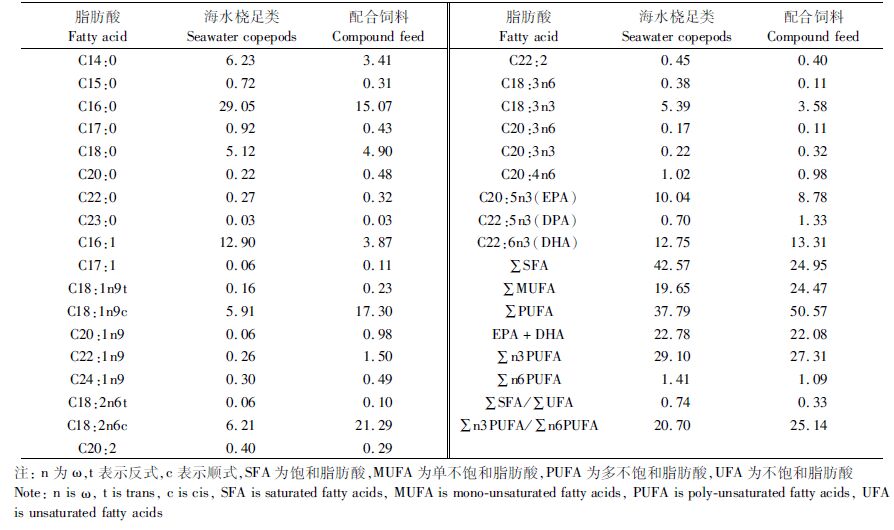
表 1 海水桡足类和配合饲料的脂肪酸组成及含量 Tab.1 Fatty acid composition and content of seawater copepods and compound feed |
本试验采样分别获取驯化转食配合饲料前幼鱼(41日龄,主要摄食海水桡足类)、驯化中幼鱼(45日龄,约有50%鱼主要摄食配合饲料,剩余的鱼还主要摄食海水桡足类)和驯化后幼鱼(57日龄,98%以上的鱼摄食配合饲料)3 组样品,取样前饥饿24 h,每组样品分3次取样,每次取样30尾幼鱼作为一个样本,即一个平行;另外,驯化后幼鱼取样时,剔除特别消瘦的鱼(这些鱼是没法驯化的“僵鱼”),选择摄食配合饲料、体格健壮的鱼。取样后测量体长和体质量,然后将全鱼立即置于-20 ℃的冰箱冷冻,冷冻后再置于实验室-80 ℃的冰箱中保存。总脂和脂肪酸测量时,将样品真空冷冻干燥至恒重,碾磨、混匀后待测。
1.3 水分、总脂和脂肪酸测定方法采用冷冻干燥法测定样品中的水分,按氯仿甲醇法提取总脂,脂肪的皂化和衍生见GB/T22223—2008食品中总脂肪、饱和脂肪(酸)、不饱和脂肪(酸)的测定,以脂肪酸甲酯做标准定性,以色谱峰峰面积归一法计算出各脂肪酸相对含量,仪器为Agilent 6890 型气相色谱仪。
1.4 数据处理和统计所有数据用Mean±SD表示,采用Excel 和SPSS 17.0处理数据及图表。用Oneway ANOVA对各发育阶段组数据差异进行方差分析,如数据是百分数,先采用反正弦函数转换后再进行方差分析;用Duncan氏法作多重比较,以P<0.05为差异显著。
相关计算公式如下:
 (1)
(1)
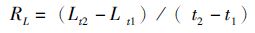 (2)
(2)
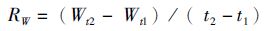 (3)
(3)
式中: CF为肥满度;L为体长(mm);W为体质量(g);RL为体长日均增长量(mm/d) ; RW为体质量日均增长量(g/d);t1、t2为不同的日龄(d)。
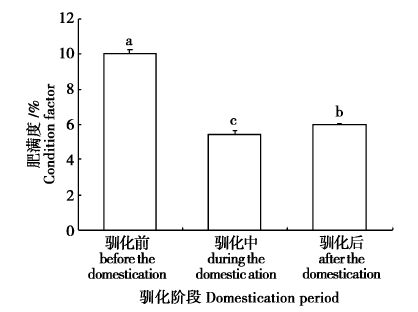
2 结果与分析 2.1 驯化转食过程中幼鱼的生长和肥满度菊黄东方鲀幼鱼在驯化转食配合饲料过程中,体长随驯化有显著增加(P<0.05),其体长日均增长保持在1.16~1.51 mm/d(表 2);驯化中的体增重相对较慢,但驯化转食配合饲料后,幼鱼的体重增加显著(P<0.05),其体重日均增长也由驯化中的0.04 g/d增加到0.26 g/d(表 2)。幼鱼的肥满度在驯化前(10.02)高于(P<0.05)驯化中的(5.43)和驯化后的(6.00),在驯化中幼鱼的肥满度最低(5.43),驯化后幼鱼的肥满度有上升恢复(6.00,P<0.05,图 1)。

|
表 2 菊黄东方鲀幼鱼驯化转食过程中的生长 Tab.2 The growth of tawny puffer (Takifugu flavidus) juvenile during the bait conversion period |
|
图 1 菊黄东方鲀幼鱼驯化转食过程中的肥满度变化
Fig. 1 Changes of condition factor of tawny puffer (Takifugu flavidus) juvenile during the bait conversion period (n=3)
具不同小写字母的值表示差异显著(P<0.05) Mean values followed by different letters were significantly different (P<0.05) |
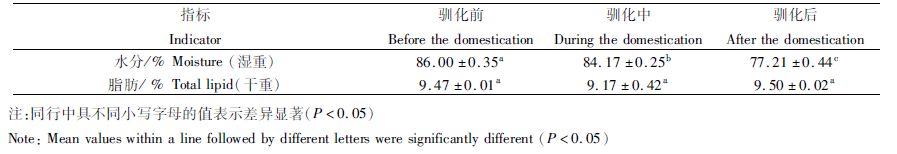
菊黄东方鲀幼鱼全鱼的水分含量随着驯食而显著降低(P<0.05);幼鱼的总脂含量在驯化过程中略微降低(P >0.05),随着驯化完全摄食配合饲料后,其总脂含量恢复到原来水平,但驯化期间的总脂含量没有显著差异(P>0.05),见表 3。
|
表 3 菊黄东方鲀幼鱼驯化转食过程中水分和总脂含量 Tab.3 The moisture and total lipid content of tawny puffer (Takifugu flavidus) juvenile during the bait conversion period |
在菊黄东方鲀驯化转食前、中、后各阶段的全鱼干样中,共检测到碳链长度为C14~C22之间的27种脂肪酸,分别为8种饱和脂肪酸(SFA)、7种单不饱和脂肪酸(MUFA)和12种多不饱和脂肪酸(PUFA),其百分比含量见表 4。
2.3.1 单个脂肪酸百分含量的变化菊黄东方鲀幼鱼驯化转食过程中各阶段的C16:0占总脂肪酸的百分含量均最高(21.26%~23.81%),且驯化前、中、后各阶段之间没有显著差异(P>0.05,表 4)。幼鱼在驯化转食配合饲料过程中,C18:0的百分含量下降(P<0.05),驯化后幼鱼的C18:0百分含量(10.33%)低于(P<0.05)驯化前(15.96%)和驯化中(14.46%),驯化前和驯化中的C18:0百分含量没有显著差异(P>0.05,表 4)。随着驯化转食进程,幼鱼C16:1百分含量上升(P<0.05),驯化前的C16:1百分含量(6.39%)低于(P<0.05)驯化后的(9.25%,表 4)。C18:1n9c在幼鱼驯化转食各阶段的含量较丰富,在驯化前的C18:1n9c百分含量排第三,驯化中和驯化后的C18:1n9c百分含量均排第二,幼鱼C18:1n9c百分含量随着驯化转食进程上升(P<0.05),驯化前和驯化中的含量(分别为14.63%和16.76%)低于(P<0.05)驯化后的(23.42%,表 4)。
菊黄东方鲀驯化转食配合饲料前后,C22:6n3(DHA)的百分含量稳定且较丰富(11.95%~13.05%),但随驯化略微降低(P>0.05) (表 4);C20:5n3(EPA)百分含量在驯化中略微下降(P>0.05),但驯化后又略有上升(P>0.05),其含量在驯化前、中、后各阶段之间无显著变化(P>0.05,表 4);C22:5n3(DPA)百分含量随驯化降低(P<0.05),驯化前的C22:5n3(DPA)(6.28%)高于(P<0.05)驯化中(5.18%)和驯化后(4.73%,表 4)。DHA+EPA的百分含量在幼鱼驯化中出现略微下降(P>0.05),但驯化后又略有上升(P>0.05),其含量在驯化前、中、后各阶段之间无显著变化(P>0.05) 。
2.3.2 SFA、MUFA和PUFA百分含量的变化菊黄东方鲀幼鱼驯化转食配合饲料前后,脂肪酸组成中SFA的比例在驯化前后相对稳定(38.13%~42.52%),驯化前、中、后的各阶段之间SFA的比例没有显著差异(P>0.05,表 4);MUFA的比例随驯化进程呈现上升趋势(P<0.05),数值从23.74%上升到34.64% (表 4);但PUFA的比例随驯化呈现下降趋势(P<0.05),数值从34.12%下降到27.23% (表 4),特别是其中的∑n3PUFA比例随驯化也呈现下降趋势(P<0.05),数值从29.00%下降到22.90%;另外,驯化中幼鱼的∑n6PUFA比例(4.59%)高于(P<0.05)驯化的(3.89%,表 4)。
2.3.3 ∑SFA/∑UFA和∑n3PUFA/∑n6PUFA比率的变化菊黄东方鲀幼鱼驯化过程中的饱和脂肪酸与不饱和脂肪酸的比率(∑SFA/∑UFA)随驯化呈现“n”型的微弱变化(P>0.05),最高值(0.98)出现在驯化中,但驯化前、中、后的∑SFA/∑UFA没有显著差异(P>0.05)。驯化前、中、后的∑n3PUFA/∑n6PUFA比率(5.70%~6.84%)没有显著差异(P>0.05),驯化中∑n3PUFA/∑n6PUFA比率(5.70%)有稍微下降(P>0.05,表 4)。

|
表 4 菊黄东方鲀驯化前、中、后幼鱼的脂肪酸组成及含量(n=3,%) Tab.4 Fatty acid composition and content of tawny puffer (Takifugu flavidus) juvenile before,during,and after the domestication (n=3,%) |
鱼类饥饿后再投饵,会出现一定生长补偿[16-17]。鱼类驯化转食配合饲料也相当于饥饿再投喂的过程,驯食过程中幼鱼可能需要较长的时间来建立巡游摄食配合饲料,这也就意味着幼鱼有一段时间的饥饿,等到幼鱼习惯摄食配合饲料,鱼体生长会出现补偿;在本研究中,菊黄东方鲀幼鱼在驯化转食过程中体长和体质量都有明显的增加,特别是幼鱼在完全摄食配合饲料后的体质量急剧增加,说明驯化转食会减缓幼鱼的体质量生长速度,但是,一旦幼鱼摄食配合饲料后,幼鱼体重生长速度明显增加,出现了饥饿的体质量生长补偿。这与很多鱼类饥饿补偿生长机制的研究结果一致[16-17]。
肥满度直接反映出鱼类胖瘦程度和生长情况,本研究中,菊黄东方鲀驯化前幼鱼的肥满度非常高(10.02),在驯化中最低(5.43),驯化后肥满度有显著性上升恢复(6.00),研究结果也说明了驯化转食前鱼体比较胖,有足够的能量储存;虽然,驯食过程中幼鱼肥满度急剧下降,鱼体消瘦,但摄食配合饲料后,鱼体也有明显的恢复。
随着驯化摄食配合饲料,菊黄东方鲀幼鱼全鱼鲜样的水分含量明显下降、干物质含量明显升高,而幼鱼全鱼干样的总脂含量虽在驯化过程中有略微降低,但总体基本不变。这可能是幼鱼摄食配合饲料后,鱼体肌肉的粗蛋白含量明显增加,鱼体肌肉更加结实。这也说明,幼鱼摄食配合饲料后,随着进一步个体发育,鱼的活动能力与游泳能力都大大增强。
3.2 菊黄东方鲀幼鱼体内脂肪酸组成与饵料的关系鱼类摄取的饵料种类密切关系着其体内的脂肪酸组成[18]。在本研究中,菊黄东方鲀幼鱼驯化转食前主要摄食池塘中的海水桡足类,驯化转食后主要摄食商用配合饲料,在驯化过程中,两者兼食;对两种饵料以及摄食该饵料后的幼鱼全鱼进行干物质脂肪酸组成分析显示(表 1和表 4):桡足类的干物质C18:1n9c和C18:2n6c百分含量(分别为5.91%和6.21%)低于配合饲料(分别为17.30%和21.29%),相应地,摄食桡足类的幼鱼C18:1n9c和C18:2n6c百分含量(分别为14.63%和1.35%)显著低于摄食配合饲料后的(分别为23.42%和2.47%)。这可以看出饵料干物质中C18:1n9c和C18:2n6c含量多的,幼鱼摄食该饵料后,其鱼体内的C18:1n9c和C18:2n6c含量也相对较多,呈现出正相关性;桡足类的干物质C16:0和C16:1百分含量(分别为29.05%和12.90%)高于配合饲料(分别为15.07%和3.87%),在驯化过程中,菊黄东方鲀幼鱼体内的C16:0百分含量在21.26%~23.81%,且没有显著差异,而摄食桡足类的幼鱼C16:1百分含量(6.39%)显著低于摄食配合饲料后的(9.25%)。这也可以看出,饵料中的C16:0和C16:1百分含量与摄食该饵料的菊黄东方鲀幼鱼体内的百分含量没有相关性,甚至出现了负相关。因此,菊黄东方鲀幼鱼体内脂肪酸组成与饵料成分有一定相关,但不是绝对的,鱼体内脂肪酸组成与饵料有关外,还与其生存环境和生长期等都密切相关[19]。
值得注意的是,从百分含量的数值上来看,配合饲料的C18:2n6c含量特别高(21.29%),但菊黄东方鲀幼鱼摄食后,体内的C18:2n6c含量还非常低(2.47%),菊黄东方鲀幼鱼不需要过多的C18:2n6c,或者说幼鱼摄食配合饲料后,大量的C18:2n6c没有被吸收,这也造成了饲料的浪费。相反,配合饲料的C16:1含量又特别低(3.87%),但菊黄东方鲀幼鱼摄食后,体内的C16:1含量出现较高值(9.25%),可以看出,C16:1需要从其他脂肪酸转化过来,但脂肪酸的转化需要消耗能量物质,这容易造成配合饲料的“水桶的短板效应”。因此,建议菊黄东方鲀幼鱼配合饲料中减少C18:2n6c比例、增加C16:1的比例。
3.3 菊黄东方鲀幼鱼驯化转食过程中脂肪酸变化特点海水鱼类在胚胎和仔鱼开口前的早期发育阶段,饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)作为重要能源往往首先被利用,而n3PUFA会被适当地保存下来,脂肪酸利用先后顺序为SFA、MUFA、n6PUFA、n3PUFA,这在许多海水鱼类中得到了证实,如:塞内加尔鳎(Solea senegalensis) [13]、金头鲷(Maccullochella macquarensis) [14]、条石鲷(Oplegnathus fasciatus)[20]、大黄鱼(Pseudosciaena crocea)[21]、日本鬼鲉(Inimicus japonicus) [22]等;但随着鱼苗发育,鱼苗对n3PUFA的利用迅速上升,如: 条石鲷[20]和日本鬼鲉[22]。本研究中,菊黄东方鲀幼鱼驯化转食过程中,虽然已经进入了幼鱼发育的后期,但也延续了鱼苗发育中期对n3PUFA高需求量的特点:∑n3PUFA百分含量呈现显著的下降趋势,数值从驯化前的29.00%下降到驯化后的22.90%;∑n3PUFA实际含量也呈现微弱的下降趋势,含量从驯化前的26.38 mg/g下降到驯化后的20.92 mg/g。而且,幼鱼驯化前摄取的天然饵料干物质n3PUFA的百分含量与驯化后摄取的配合饲料的有些相似,n3PUFA的百分含量分别是29.10%和27.31%,其中DHA+EPA分别为22.78%和22.08%。这可能是因为菊黄东方鲀幼鱼在驯化转食阶段,鱼苗虽发育到幼鱼期,外形上已与成鱼相接近,但内部还有很多器官没有发育完全,还需要大量的DHA、EPA等重要营养物质,来应对内部器官发育的需求(如,脑神经等的发育)。然而,n3PUFA中DHA和EPA主要是通过食物链的富集作用在体内积聚起来的[20]。因此,菊黄东方鲀作为海水鱼类,在发育到幼鱼后期阶段,从外界摄取n3PUFA(特别是DHA和EPA)对幼鱼的完全发育还是非常重要的。建议在菊黄东方鲀幼鱼配合饲料中加大DHA和EPA的添加量。
3.4 菊黄东方鲀幼鱼后期培育成活率低的成因探讨菊黄东方鲀幼鱼在驯化转食过程中,幼鱼可能需要较长的时间来建立巡游摄食配合饲料,这也就意味着幼鱼有一段时间的饥饿;但往往在幼鱼培育到后期时,池塘里天然的饵料非常少,可能有些鱼苗已经有长时间没有摄取到足够的饵料,鱼体本身就比较瘦弱,如果这时强制驯化转食配合饲料,幼鱼没有足够能源储存来支撑驯化转食阶段正常的生命活动,最终导致死亡。因此,菊黄东方鲀幼鱼驯化转食前,加强投喂活体饵料,提高鱼体的肥满度,以保证有足够能源储存和健康体质来应对驯化饥饿。
菊黄东方鲀幼鱼阶段,特别是幼鱼后期(夏花鱼种),幼鱼还需要进一步发育才能发育完全,n3PUFA中EPA和DHA已被称为人和动物生长发育的必需脂肪酸[23],主要通过食物链的富集作用在体内积聚起来[20]。在本研究中,菊黄东方鲀幼鱼培育后期,特别是驯化转食后,鱼体内n3PUFA明显减少,但过低的DHA会导致海水鱼类应激能力的下降和较高的死亡率[24],这也可能是菊黄东方鲀幼鱼后期成活率低下的原因之一。因此,在菊黄东方鲀驯化转食的配合饲料中应加大DHA和EPA的添加量。
4 结论研究表明菊黄东方鲀幼鱼在驯化完全转食配合饲料后,呈现出体质量的生长补偿现象。菊黄东方鲀幼鱼后期对n3PUFA(特别是DHA和EPA)有较高的需求量,但不需要过多的C18:2n6c,部分的C16:1需要从其他营养物质转化过来。为提高菊黄东方鲀幼鱼驯化转食配合饲料过程中成活率,建议:(1)幼鱼驯化转食前,加强投喂活体饵料,特别是富含n3PUFA的海水桡足类,提高鱼体的肥满度和能源储存;(2)幼鱼驯化转食的配合饲料中进一步加大DHA和EPA的添加量,同时减少C18:2n6c比例、增加C16:1的比例。
| [1] | 杨竹舫, 张汉秋, 匡云华.渤海湾菊黄东方鲀Fugu flavidus生物学的初步研究[J]. 海洋通报, 1991, 10(6): 44–47. YANG Z F, ZHANG H Q, KUANG Y H.Studies on biology of Fugu flavidus in Bohai bay[J]. Marine Science Bulletin, 1991, 10(6): 44–47. |
| [2] | SHI Y H, ZHANG G Y, ZHU Y Z, et al.Effects of temperature on fertilized eggs and larvae of tawny puffer Takifugu flavidus[J]. Aquaculture Research, 2010, 41(12): 1741–1747. DOI:10.1111/are.2010.41.issue-12 |
| [3] | 虞建辉, 周志云.菊黄东方鲀低盐度人工育苗技术[J]. 科学养鱼, 2002: 12–13. YU J H, ZHOU Z Y.Artificial breeding technique of Fugu flavidus under low salinity[J]. Scientific Fish Farming, 2002: 12–13. |
| [4] | 谢永德, 施永海, 张海明, 等.菊黄东方鲀1龄幼鱼生长特性[J]. 广东海洋大学学报, 2013, 33(6): 9–13. XIE Y D, SHI Y H, ZHANG H M, et al.Study on growth characteristics of one-year-old Takifugu flavidus under artificial culturing condition[J]. Journal of Guangdong Ocean University, 2013, 33(6): 9–13. |
| [5] | 郑惠东, 钟建兴, 蔡良侯, 等.菊黄东方鲀胚胎及仔稚幼鱼的发育[J]. 台湾海峡, 2007, 26(1): 108–114. ZHENG H D, ZHONG J X, CAI L H, et al.Embryonic, larval and juvenile development of Fugu flavidus[J]. Journal of Oceanography in Taiwan Strait, 2007, 26(1): 108–114. |
| [6] | 施永海, 张根玉, 刘建忠, 等.菊黄东方鲀仔稚鱼的生长、发育及行为生态[J]. 水产学报, 2010, 34(10): 1509–1517. SHI Y H, ZHANG G Y, LIU J Z, et al.Growth, development and behavior ecology of tawny puffer (Takifugu flavidus) larvae and juveniles[J]. Journal of Fisheries of China, 2010, 34(10): 1509–1517. |
| [7] | 刘永士, 施永海, 张根玉, 等.菊黄东方鲀当年鱼种养殖阶段消化酶活性研究[J]. 水生态学杂志, 2015, 36(4): 92–97. LIU Y S, SHI Y H, ZHANG G Y, et al.Digestive enzyme activity of juvenile tawny puffer (Takifugu flavidus) cultured in ponds[J]. Journal of Hydroecology, 2015, 36(4): 92–97. |
| [8] | 徐嘉波, 张根玉, 施永海, 等.氨氮对菊黄东方鲀幼鱼的毒性试验[J]. 中国农学通报, 2012, 28(29): 161–164. XU J B, ZHANG G Y, SHI Y H, et al.The toxic effect of Ammonia Nitrogen on juveniles of tawny puffer[J]. Chinese Agricultural Science Bulletin, 2012, 28(29): 161–164. |
| [9] | 张年国, 潘桂平, 周文玉, 等.4种常见水产药物对菊黄东方鲀的急性毒性试验[J]. 水产科技情报, 2015, 42(6): 339–342. ZHANG N G, PAN G P, ZHOU W Y, et al.The acute toxic effect of 4 kinds of aquatic drugs on Takifugu flavidus[J]. Fisheries Science & Technology Information, 2015, 42(6): 339–342. |
| [10] | SHI Y H, ZHANG G Y, LIU J Z, et al.Effects of temperature and salinity on oxygen consumption of tawny puffer Takifugu flavidus juvenile[J]. Aquaculture Research, 2011, 42(2): 301–307. DOI:10.1111/are.2010.42.issue-2 |
| [11] | 施永海, 张根玉, 刘建忠, 等.温度对暗纹东方鲀和菊黄东方鲀幼鱼瞬时耗氧速率的影响[J]. 上海海洋大学学报, 2011, 20(1): 50–55. SHI Y H, ZHANG G Y, LIU J Z, et al.Effects of temperature on the instantaneous oxygen consumption rate of obscure puffer (Takifugu obscurus) and tawny puffer (Takifugu flavidus) juveniles[J]. Journal of Shanghai Ocean University, 2011, 20(1): 50–55. |
| [12] | 施永海, 张根玉, 刘建忠, 等.低盐对菊黄东方鲀幼鱼生长、存活、耗氧、鳃Na+/K+-ATP酶以及肝抗氧化酶的影响[J]. 动物学杂志, 2015, 50(3): 415–425. SHI Y H, ZHANG G Y, LIU J Z, et al.Effects of low salinity on the growth, survival, oxygen consumption, gill Na+/K+-ATPase, and liver antioxidase of young fish tawny puffer Takifugu flavidus[J]. Chinese Journal of Zoology, 2015, 50(3): 415–425. |
| [13] | MOURENTE G, VáZQUEZ R.Changes in the content of total lipid, lipid classes and their fatty acids of developing eggs and unfed larvae of the Senegal sole, Solea senegalensis Kaup[J]. Fish Physiology and Biochemistry, 1996, 15(3): 221–235. DOI:10.1007/BF01875573 |
| [14] | GUNASEKERA R M, DE SILVA S S, INGRAM B A.Chemical changes in fed and starved larval trout cod, Maccullochella macquarensis during early development[J]. Fish Physiology and Biochemistry, 2001, 25(4): 255–268. DOI:10.1023/A:1023247718139 |
| [15] | 施永海, 张根玉, 朱雅珠, 等.菊黄东方鲀河口区海水全人工繁育技术研究[J]. 水产科技情报, 2007, 34(3): 99–102. SHI Y H, ZHANG G Y, ZHU Y Z, et al.Study on the complete marine artifical breeding techniques of tawny puffer Takifugu flavidus in estuarine region[J]. Fisheries Science & Technology Information, 2007, 34(3): 99–102. |
| [16] | 区又君, 刘泽伟.千年笛鲷幼鱼的饥饿和补偿生长[J]. 水产学报, 2007, 31(3): 323–328. OU Y J, LIU Z W.Starvation and compensatory growth in the young Lutjanus sebae[J]. Journal of Fisheries of China, 2007, 31(3): 323–328. |
| [17] | 刘龙龙, 罗鸣, 陈傅晓, 等.卵形鲳鲹幼鱼的饥饿和补偿生长研究[J]. 上海海洋大学学报, 2014, 23(1): 31–36. LIU L L, LUO M, CHEN F X, et al.Study on the compensatory growth following starvation of juvenile golden pompano Trachinotus ovatus[J]. Journal of Shanghai Ocean University, 2014, 23(1): 31–36. |
| [18] | 庄平, 宋超, 章龙珍, 等.转食不同饵料对野生中华鲟幼鱼肌肉营养成分的影响[J]. 水生生物学报, 2009, 33(5): 998–1004. ZHUANG P, SONG C, ZHANG L Z, et al.Effects of changing to different diets on nutritive components in the muscle of wild juvenile Acipenser sinensis[J]. Acta Hydrobiologica Sinica, 2009, 33(5): 998–1004. |
| [19] | 尹洪滨, 孙中武, 孙大江, 等.6种养殖鲟鳇鱼肌肉营养成分的比较分析[J]. 大连水产学院学报, 2004, 19(2): 92–96. YIN H B, SUN Z W, SUN D J, et al.Comparison of nutritive compositions in muscles among six farmed sturgeon species[J]. Journal of Dalian Fisheries University, 2004, 19(2): 92–96. |
| [20] | 徐善良, 王亚军, 王丹丽, 等.条石鲷(Oplegnathus fasciatus)发育早期的脂肪酸组成变化研究[J]. 海洋与湖沼, 2013, 44(2): 438–444. XU S L, WANG Y J, WANG D L, et al.The study of fatty acid components in early developmental stage of Oplegnathus fasciatus[J]. Oceanologia et Limnologia Sinica, 2013, 44(2): 438–444. |
| [21] | 王丹丽, 徐善良, 严小军, 等.大黄鱼仔、稚、幼鱼发育阶段的脂肪酸组成及其变化[J]. 水产学报, 2006, 30(2): 241–245. WANG D L, XU S L, YAN X J, et al.Fatty acid composition and their changes in larvae and juveniles of Pseudosciaena crocea[J]. Journal of Fisheries of China, 2006, 30(2): 241–245. |
| [22] | 黄旭雄, 冯隆峰, 温文, 等.日本鬼鲉胚胎及卵黄囊仔鱼发育过程中脂肪及脂肪酸特性变化[J]. 水产学报, 2013, 37(4): 526–535. DOI:10.3724/SP.J.1231.2013.38335 HUANG X X, FENG L F, WEN W, et al.The changes in lipid and fatty acid profiles of devil stinger Inimicus japonicas during the development of embryo and yolk-sac larvae[J]. Journal of Fisheries of China, 2013, 37(4): 526–535. DOI:10.3724/SP.J.1231.2013.38335 |
| [23] | 庄平, 宋超, 章龙珍.舌虾虎鱼肌肉营养成分与品质评价[J]. 水产学报, 2010, 34(4): 559–564. DOI:10.3724/SP.J.1231.2010.06740 ZHUANG P, SONG C, ZHANG L Z.Evaluation of nutritive quality and nutrient components in the muscle of Glossogobius giuris[J]. Journal of Fisheries of China, 2010, 34(4): 559–564. DOI:10.3724/SP.J.1231.2010.06740 |
| [24] | 刘镜恪, 陈晓琳.海水仔稚鱼的必需脂肪酸——n-3系列高度不饱和脂肪酸研究概况[J]. 青岛海洋大学学报(自然科学版), 2002, 32(6): 897–902. LIU J K, CHEN X L.A survey of research on n-3 HUFA nutrition for marine fish larvae[J]. Journal of Ocean University of Qingdao(Nature Edition), 2002, 32(6): 897–902. |
 2017,
Vol. 26
2017,
Vol. 26

