2. 浦东新区农业服务中心泥城站, 上海 201306
大黄鱼(Pseudosciaena crocea)属硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、石首鱼科(Sciaenide)、黄鱼属(Pseudosciaena),又名黄鱼、大王鱼、大黄花鱼、黄金龙、桂花黄鱼、石首鱼、黄瓜鱼,是我国最重要的海水养殖种类,为传统“四大海产”(大黄鱼、小黄鱼、带鱼、乌贼)之一。大黄鱼肉质鲜美细嫩,富含高蛋白,胆固醇含量很低,同时还富含EPA、DHA等高度不饱和脂肪酸,是我国沿海传统的滋补海产品。20世纪70年代以来,由于我国海水鱼类捕捞量的大量增加,野生大黄鱼资源受到严重破坏,导致大黄鱼资源濒临枯竭,但也使得人工养殖大黄鱼产业迅速发展。目前我国大黄鱼的人工养殖主要以网箱养殖为主,到20世纪末,网箱养殖大黄鱼已经成为我国网箱养殖产量最高的品种之一[1]。但是近年来,由于大黄鱼网箱养殖密度过高,水体流通不畅,导致水体环境日益恶劣,病害严重,特别是由海水小瓜虫引起的“白点病”,极大地损害了生产效益。由于海水小瓜虫在低盐环境中不易存活而且大黄鱼对低盐有较强的耐受力[2],因此大黄鱼的淡化养殖可能会成为大黄鱼养殖的一种重要模式。
盐度作为一种重要水域生态因子,对鱼类具有一系列的生态生理学作用,尤其是对鱼类的生长代谢、繁殖等各种生理活动影响很大[3],在进行海水鱼类的人工繁殖和种苗培育时,盐度的影响尤为重要[4-6]。盐度的高低能够影响鱼类的许多生长性状[7],合理控制养殖水体的盐度将能有效地提高鱼类的生长性能并进而提高养殖业的经济效益。关于大黄鱼淡化养殖的研究国内外已有文献进行过报道[8-12],大黄鱼已经成功在循环水养殖条件下盐度为10的海水中进行养殖,但是尚无关于低盐度下大黄鱼性腺发育的研究。本试验在盐度为5的循环水条件下养殖大黄鱼,对大黄鱼的生长及性腺发育进行研究,并与正常海水中网箱养殖条件下同龄大黄鱼进行比较,以此来研究低盐度对大黄鱼生长及性腺发育的影响,分析大黄鱼淡化养殖与淡化养殖条件下人工繁殖的可能性。
1 材料与方法 1.1 实验材料与设计淡化养殖实验采用的大黄鱼为8月龄春苗,于2013年12月28日自宁德市横屿岛水产有限公司运输到上海海洋大学滨海养殖基地,将约600尾大黄鱼平均置于3个约1 500 L养殖桶的半封闭循环水系统中(图 1),平均密度约为200尾每桶,将红海盐溶于曝气24 h以上的自来水中,并用精密海水比重计测定比重,将淡化养殖海水的盐度初步调节为10,并在一个月内逐渐淡化水体,在第30天使水体盐度变为5,水体盐度以美国YSI ProPlus型便携式多参数水质测定仪准确校正。循环水养殖条件:温度为18~20 ℃、盐度为5±0.5、pH为8.0±0.2、溶解氧为(7.5±0.5) mg/L、硫化物为0.05~0.1 mg/L、氨氮为0.1~0.2 mg/L、亚硝酸盐氮为0.25~0.3 mg/L、光照强度为700~1000 lux、光照周期为12L:12D。上述相关水质指标由北京桑普生物化学技术有限公司生产的水质测试盒测定。
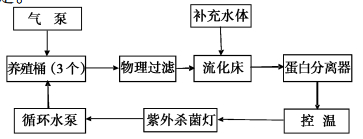
|
图 1 循环水系统工艺图
Fig. 1 The process sketch of circulating water system
|
本实验使用的正常海水盐度(盐度为35)养殖的大黄鱼取自宁德市横屿岛水产有限公司,在自然海域网箱中进行养殖。淡化养殖的大黄鱼与正常海水养殖的大黄鱼,饲喂相同的全价人工配合饲料,饲料购买于广东海大集团股份有限公司。每天投喂两次,投喂时间分别为上午8:00和下午16:00,投喂量根据大黄鱼摄食情况调整,投喂结束以投喂的饲料在下沉过程中未被大黄鱼吞食为准。循环水系统在投喂后30 min进行吸污,吸出残留饵料及粪便,然后进行补水,加入系统中的水是用曝气过的自来水配置的盐度为5的人工配置海水。整个养殖过程不换水,24 h不间断充气,定期更换过滤箱中的滤棉并及时清除蛋白分离器中的废液。在养殖过程中,随时检查养殖系统水体的水质指标,保持系统内水质稳定。
1.2 样品采集与实验方法于2013年12月28日采集网箱养殖雌性大黄鱼,测量其体长、体质量、性腺重作为对照组,于2014年4月30日、2014年11月15日、2015年5月15日分别采集淡化养殖和网箱养殖雌性大黄鱼,测量其体长、体质量、性腺重。并采集2015年5月15日两种大黄鱼性腺,用4%多聚甲醛固定12 h,梯度乙醇脱水,石蜡包埋,切片厚8 μm,苏木精-伊红染色。每组大黄鱼采集8尾,计算不同养殖条件下大黄鱼的肥满度和性腺指数。
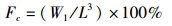 (1)
(1)
式中:Fc为肥满度;W1为大黄鱼体质量(g);L为大黄鱼体长(cm)。
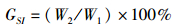 (2)
(2)
式中:GSI为性腺指数;W1、W2分别为大黄鱼的体重和大黄鱼性腺重(g)。参照林丹军等描述的大黄鱼性腺发育分期[13],将雌性大黄鱼性腺细胞划分为5期,统计繁殖季节不同养殖模式中大黄鱼性腺发育时期以及性腺中不同时期性腺细胞所占比例。
1.3 数据处理所有试验数据通过Tukey检验采用单因素方差分析,表示为平均值±标准误差(SE),以P < 0.05为差异显著,P < 0.01为差异极显著,并用统计软件GraphPad Prism 6.0 Demo作图。
2 结果 2.1 两种养殖模式中大黄鱼体重与肥满度的比较本研究比较了两种养殖模式中大黄鱼体质量、肥满度随着年龄增长的变化以及在不同养殖条件下相同年龄大黄鱼体质量、肥满度的差异。如图 2所示,大黄鱼的体质量在不同养殖条件下随着养殖时间的增长不断增加,在正常海水盐度网箱养殖中大黄鱼体质量的增长速度明显高于淡化养殖条件下循环水系统中大黄鱼,并且在2014年4月30日、2014年11月15日、2015年5月15日组的大黄鱼样品中正常海水养殖的大黄鱼体质量显著高于淡化养殖条件下大黄鱼的体质量(P < 0.01)。在两种养殖模式中大黄鱼肥满度随着时间的变化上下波动,并且在繁殖季节大黄鱼的肥满度高于非繁殖季节大黄鱼的肥满度。
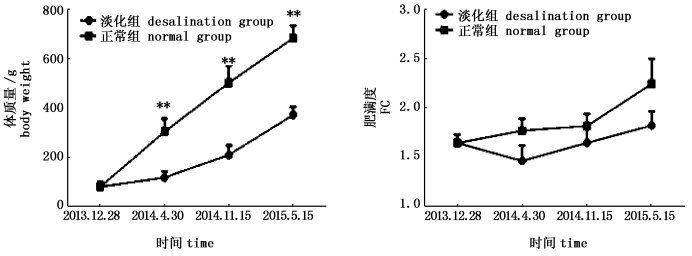
|
图 2 两种养殖模式中大黄鱼体质量与肥满度的比较
Fig. 2 Comparison of large yellow croaker quality and fatness under two kinds of breeding patterns
**表示在相同采样时间点上不同养殖模式下两组大黄鱼体质量差异极显著(P < 0.01) **means the highly significant differences in weight between the two groups of large yellow croaker in different breeding patterns at the same sampling (P < 0.01) |
在两种养殖模式中大黄鱼的性腺指数都随着年龄的增长而增加。在2014年4月30日组正常海水网箱养殖条件下大黄鱼的性腺指数显著高于循环水系统中淡化养殖条件下大黄鱼的性腺指数(P < 0.05),在2014年11月15日、2015年5月15日,正常海水网箱养殖条件下大黄鱼的性腺指数高于循环水系统中淡化养殖条件下大黄鱼的性腺指数,但无显著差异(P>0.05)。
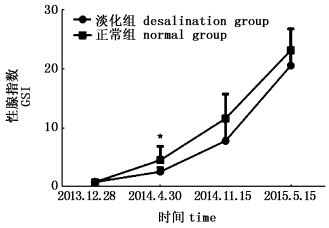
|
图 3 两种养殖模式中大黄鱼性腺指数的比较
Fig. 3 Camparion of GSI for ovaries of Pseudosciaena croceacultured under two kinds of breeding patterns
*表示为在相同采样时间点时两种养殖模式下大黄鱼的性腺指数差异显著(P < 0.05) *means the significant differences (P < 0.05) in GSI between the cultured croakers under two different breeding patterns during the same perio |
本试验大黄鱼在2015年5月达到2龄,并处于繁殖季节,主要对两种不同养殖模式中大黄鱼性腺进行固定、包埋、切片、HE染色,两种养殖模式中大黄鱼性腺进行HE染色,并对淡化养殖条件下循环水系统中的大黄鱼与正常海水网箱养殖条件下大黄鱼性腺中的各时期性腺细胞进行统计。结果如图 4、5及表 1所示:淡化养殖条件下循环水系统中的大黄鱼与正常海水网箱养殖条件下的大黄鱼性腺均发育到Ⅴ期。在循环水系统中淡化养殖条件下大黄鱼可以发育成熟,但是V期性腺细胞所占比例仅为17.4%,而正常海水网箱养殖的大黄鱼性腺发育成熟时,V期性腺细胞所占比例为37.2%,显著高于淡水组的V期性腺细胞所占比例(P < 0.01)。两组大黄鱼性腺中Ⅲ、Ⅳ期性腺细胞所占比例无显著差异(P >0.05)。淡化组中Ⅱ期性腺细胞为27.7%显著高于正常组中的20%(P < 0.05)。在繁殖季节淡化组大黄鱼性腺中还存在大量的Ⅰ期性腺细胞,而在正常海水组中的大黄鱼在繁殖季节性腺中无Ⅰ期性腺细胞。
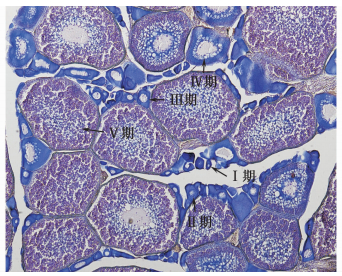
|
图 4 淡化养殖条件下循环水系统中大黄鱼性腺HE染色结果(×40)
Fig. 4 The result of HE dyeing of ovary for desalination cultured Pseudosciaena crocea(×40)
|
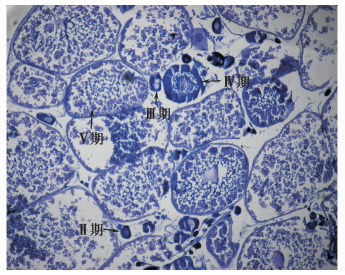
|
图 5 正常海水网箱养殖中大黄鱼性腺HE染色结果(×40)
Fig. 5 The result of HE dyeing of ovary for normal marine cage cultured Pseudosciaena crocea(×40)
|
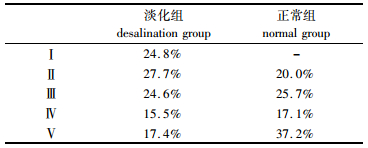
|
表 1 两种养殖模式中2龄大黄鱼在繁殖季节卵巢中各时期性腺细胞所占比例 Tab.1 The proportion of various ovarian cells for two ages Pseudosciaena croceain breeding season under two kinds of breeding pattern |
盐度作为一种生态因子,对鱼类具有一系列的生态生理学作用[6]。研究淡化养殖对大黄鱼生长、肥满度的影响,可以为大黄鱼的内陆养殖提供理论基础和实践支撑,缓解自然海域中野生大黄鱼资源枯竭的危机,并对自然海域中网箱养殖大黄鱼产生的水质污染有很好的缓解作用,还可以为内陆人民提供鲜活的大黄鱼,减少大黄鱼的运输成本。研究淡化养殖对大黄鱼性腺发育及性腺细胞分化的影响,可以为大黄鱼淡化养殖条件下的人工繁殖提供很好的理论基础,实现内陆淡化养殖大黄鱼苗种的自给自足,对大黄鱼淡化养殖的发展和规模的扩大起到促进作用。
3.1 盐度对大黄鱼生长、肥满度的影响盐度是影响水生生物生理的主要环境因素。改变环境盐度可以直接影响鱼类的新陈代谢[14-15]。但是关于盐度对鱼类生长的影响,有结果表明,盐度的小幅度变化并不影响一些广盐性鱼类的生长,如牙鲆、川鲽,鲈鱼等;而其他非广盐性鱼类在低或高盐度条件下的生长都受到了影响[16-19];盐度的剧变会影响鱼类生长,甚至会导致鱼类死亡。大黄鱼为集群洄游性鱼类,其适盐范围比较广,李兵等的研究表明,30日龄的大黄鱼幼鱼对盐度的适应范围是5.5~41.0[3],曾荣林等研究表明2月龄大黄鱼被直接从海水中转移到盐度3以上的海水中72 h内成活率都在80%以上[4]。李兵等的研究表明,经过低盐耐受性驯化后的大黄鱼幼鱼在盐度为10的海水中养殖80 d后其体长和体质量均有增长[3]。现有关于大黄鱼淡化养殖的研究主要集中在大黄鱼稚鱼、幼鱼时期的淡化养殖研究,但是尚无关于大黄鱼成鱼淡化的研究。
本实验主要研究了大黄鱼成鱼经过低盐耐受性驯化后其生长、肥满度的变化。结果表明,大黄鱼成鱼经低盐度耐受驯化后,可以在盐度为5的循环水养殖系统中正常生长。但在淡化养殖条件下大黄鱼的生长速度和肥满度低于正常海水网箱养殖中大黄鱼的生长速度和肥满度。造成这些结果的原因可能是:在淡化初期大黄鱼不适应淡化养殖的环境,淡化养殖影响了大黄鱼的摄食;大黄鱼在淡化过程中需要消耗能量来维持体内渗透压的平衡。但是在大黄鱼淡化养殖6个月后,淡化养殖条件下大黄鱼的生长速率和正常海水网箱养殖的大黄鱼生长速率几乎相同。因此,大黄鱼成鱼在低盐耐受性驯化后对降低程度很大的低盐也有很强的耐受力。
3.2 盐度对大黄鱼性腺发育的影响盐度作为最重要的水生生物环境因子之一,可以影响鱼类性腺的发育,降低鱼类的性腺指数,升高或降低盐度会影响鱼类产卵的数量和受精率。有研究曾报道将繁殖时期黑头呆鱼置于不同盐度的高盐水体中,随着盐度的升高会降低黑头呆鱼的产卵总数量、卵的受精率和产卵天数,并且盐度越高影响越大[6]。某些淡水鱼类,略微升高水体的盐度还会促进其胚胎的发育和提高受精率,如乌鳢、鲤等;但是过高的盐度会抑制其胚胎的发育和受精率[7]。在鱼类的繁殖季节,将海水鱼类例如底鳉,放入低盐环境中时会影响其性腺指数的增加,并降低其产卵总量,抑制鱼体内相关繁殖激素的分泌[20]。这与我们的研究结果相一致,这表明在大黄鱼中,较低的盐度对于大黄鱼的性腺有比较大的抑制作用。此外,鱼类产卵数量和卵的受精率与性腺中性腺细胞发育的程度密切相关,本实验中大黄鱼长期生活在盐度为5的海水中性腺可以发育成熟,但是其性腺发育成熟时,性腺中成熟卵细胞数量明显低于正常海水中的成熟卵细胞的数量。造成这些结果的原因可能是:淡化养殖条件下水中某些促进大黄鱼性腺发育离子含量的不足;在淡化养殖条件下光周期与自然环境中光周期不同。
| [1] | 张彩兰, 刘家富, 李雅璀, 等.福建省大黄鱼养殖现状分析与对策[J]. 上海水产大学学报, 2002, 11(1): 77–83. ZHANG C L, LIU J F, LI Y C, et al.Analysing the present condition and countermeasure of cultured large yellow croaker Pseudosciaena crocea in Fujian Province[J]. Journal of Shanghai Fisheries University, 2002, 11(1): 77–83. |
| [2] | CHEUNG P J, NIGRELLI R F, RUGGIERI G D.Studies on cryptocaryoniasis in marine fish:effect of temperature and salinity on the reproductive cycle of Cryptocaryon irritans Brown, 1951[J]. Journal of Fish Diseases, 1979, 2(2): 93–97. DOI:10.1111/jfd.1979.2.issue-2 |
| [3] | HOOVER Z, WEISGERBER J N, POLLOCK M S, et al.Sub-lethal increases in salinity affect reproduction in fathead minnows[J]. Science of the Total Environment, 2013, 463-464: 334–339. DOI:10.1016/j.scitotenv.2013.06.046 |
| [4] | 张龙岗.盐度对淡水鱼类繁殖生长及代谢相关指标的影响[J]. 安徽农业科学, 2011, 39(2): 1053–1055. ZHANG L G.Effects of salinity on reproduction, growth and metabolism related indicators in freshwater fishes[J]. Journal of Anhui Agricultural Sciences, 2011, 39(2): 1053–1055. |
| [5] | RICKWOOD C J, DUBÉ M G, HEWITT L M, et al.Use of paired fathead minnow (Pimephales promelas) reproductive test. Part 1:assessing biological effects of final bleached Kraft pulp mill effluent using a mobile bioassay trailer system[J]. Environmental Toxicology and Chemistry, 2006, 25(7): 1836–1846. DOI:10.1897/05-417R.1 |
| [6] | HUTCHINSON T H, YOKOTA H, HAGINO S, et al.Development of fish tests for endocrine disruptors[J]. Pure and Applied Chemistry, 2003, 75(11/12): 2343–2353. |
| [7] | 李学军, 李思发, 么宗利, 等.不同盐度下尼罗罗非鱼、萨罗罗非鱼和以色列红罗非鱼幼鱼生长、成活率及肥满系数的差异[J]. 中国水产科学, 2005, 12(3): 245–251. LI X J, LI S F, YAO Z L, et al.Variation of growth, survival rate and condition factor of juvenile Oreochromis niloticus, Sarotherodon melanotheron and Israeli red tilapia at different salinities[J]. Journal of Fishery Sciences of China, 2005, 12(3): 245–251. |
| [8] | 李兵, 王帅, 张伟, 等.室内低盐度饲养大黄鱼的初步研究[J]. 上海海洋大学学报, 2012, 21(4): 524–529. LI B, WANG S, ZHANG W, et al.Studies on the indoor circulating culture of Pseudosciaena crocea at low salinity[J]. Journal of Shanghai Ocean University, 2012, 21(4): 524–529. |
| [9] | 曾荣林, 谢仰杰, 王志勇, 等.大黄鱼幼鱼对低盐度的耐受性研究[J]. 集美大学学报(自然科学版), 2013, 18(3): 167–171. ZENG R L, XIE Y J, WANG Z Y, et al.Tolerance of young fish of large yellow croaker (Larimichthys crocea) to low salinity[J]. Journal of Jimei University (Natural Science), 2013, 18(3): 167–171. |
| [10] | 李兵, 钟英斌, 吕为群.大黄鱼早期发育阶段对盐度的适应性[J]. 上海海洋大学学报, 2012, 21(2): 204–211. LI B, ZHONG Y B, LV W Q.Salinity tolerance of Pseudosciaena crocea during early development[J]. Journal of Shanghai Ocean University, 2012, 21(2): 204–211. |
| [11] | 王晓清, 王志勇, 何湘蓉.大黄鱼(Larimichthys crocea)耐环境因子试验及其遗传力的估计[J]. 海洋与湖沼, 2009, 40(6): 781–785. WANG X Q, WANG Z Y, HE X R.Heritability and tolerance of Larimichthys crocea to environmental factors[J]. Oceanologia et Limnologia Sinica, 2009, 40(6): 781–785. |
| [12] | 陈惠群, 焦海峰, 冯坚.盐度突变对大黄鱼受精卵孵化及稚鱼成活的影响[J]. 水产科学, 2005, 24(1): 20–21. CHEN H Q, JIAO H F, FENG J.Effect of salinity on the hatching rate and larval survival in large yellow croakerc Pseudosciaena crocea[J]. Fisheries Science, 2005, 24(1): 20–21. |
| [13] | 林丹军, 张健, 骆嘉, 等.人工养殖的大黄鱼性腺发育及性周期研究[J]. 福建师范大学学报(自然科学版), 1992, 8(3): 81–87. LIN D J, ZHANG J, LUO J, et al.Studies on the gonadal development and the annual reproductive cycle of the cultured large yellow croaker, Pseudosciaena crocea (Richardson)[J]. Journal of Fujian Normal University (Natural Science), 1992, 8(3): 81–87. |
| [14] | ANNI I S A, BIANCHINI A, BARCAROLLI I F, et al.Salinity influence on growth, osmoregulation and energy turnover in juvenile pompano Trachinotus marginatus Cuvier 1832[J]. Aquaculture, 2016, 455: 63–72. DOI:10.1016/j.aquaculture.2016.01.010 |
| [15] | BOEUF G, PAYAN P.How should salinity influence fish growth?[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2001, 130(4): 411–423. |
| [16] | BARMAN U K, JANA S N, GARG S K, et al.Effect of inland water salinity on growth, feed conversion efficiency and intestinal enzyme activity in growing grey mullet, Mugil cephalus (Linn.):field and laboratory studies[J]. Aquaculture International, 2005, 13(3): 241–256. DOI:10.1007/s10499-004-2479-5 |
| [17] | LISBO V, BARCAROLLI I F, SAMPAIO L A, et al.Acclimation of juvenile Mugil liza Valenciennes, 1836 (Mugiliformes:Mugilidae) to different environmental salinities[J]. Neotropical Ichthyology, 2015, 13(3): 591–598. DOI:10.1590/1982-0224-20140123 |
| [18] | MA Z H, GUO H Y, ZHENG P L, et al.Effect of salinity on the rearing performance of juvenile golden pompano Trachinotus ovatus (Linnaeus 1758)[J]. Aquaculture Research, 2015, 47(6): 1761–1769. |
| [19] | URBINA M A, GLOVER C N.Effect of salinity on osmoregulation, metabolism and nitrogen excretion in the amphidromous fish, inanga (Galaxias maculatus)[J]. Journal of Experimental Marine Biology and Ecology, 2015, 473: 7–15. DOI:10.1016/j.jembe.2015.07.014 |
| [20] | GLINKA C O, FRASCA JR S, PROVATAS A, et al.The effects of model androgen 5α-dihydrotestosterone on mummichog (Fundulus heteroclitus) reproduction under different salinities[J]. Aquatic Toxicology, 2015, 165: 266–276. DOI:10.1016/j.aquatox.2015.05.019 |
2. Pudong New Area Agricultural Service Center Nicheng Station, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


