2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 水产动物遗传育种中心上海市协同创新中心, 上海 201306
中华绒螯蟹(Eriocheir sinensis)俗称河蟹,隶属于甲壳纲(Crustacea)、十足目(Decapoda)、方蟹科(Grapsidae)、绒螯蟹属(Eriocheir),是我国特产,因其具有独特的风味、营养和较高的经济价值而受到广大水产养殖者的青睐[1]。目前,河蟹苗种培育技术已很成熟,池塘生态养殖被普遍采用[2]。另外,网箱养殖也以其机动灵活、高产等特点受到了广大渔民的喜爱,并取得良好的经济效益[3-4]。
目前,国内关于中华绒螯蟹的研究主要有稻蟹共作模式对水质指标、浮游动植物群落、水稻产量等的影响[5-8],中华绒螯蟹蜕皮激素受体基因的克隆与表达分析[9-10],中华绒螯蟹饲料中主要氨基酸和脂肪酸的最适添加量[11-12],中华绒螯蟹配套系育种群体和野生群体遗传多样性比较分析[13]等;国外对日本绒螯蟹[14](E. japonica)和蜘蛛蟹科[15-17](Majidae)也有较多的研究,但有关长江水系中华绒螯蟹人工育种群体与野生群体后代生长特性比较的研究国外均未见报道。本实验探究了长江水系中华绒螯蟹人工育种群体与野生群体在1龄蟹种阶段的蜕壳、生长及形态学变化,并作对比分析。希望为中华绒螯蟹亲本选育提供基础资料,进一步完善中华绒螯蟹生长发育方面的研究。
1 材料与方法 1.1 实验地点本实验于2014年5~10月在上海市崇明县新河镇新建村上海福岛水产专业养殖合作社基地(31°36′N~31°33′N、121°33′E~121°30′E)进行。该区环江靠海,雨水充沛,年平均降雨量1 025 mm左右,全年的日照数为2 094.19 h,年平均气温15.24 ℃,空气相对湿度常年保持在80%,属亚热带湿润季风气候,平均海拔3.73 m。
1.2 实验材料育种群体亲蟹是中华绒螯蟹配套选育系群体第5代(F5)的亲本群体,由上海市中华绒螯蟹产业技术体系苗种基地提供,野生群体亲蟹2013年12月采集于长江口九段沙水域,在上海市中华绒螯蟹产业技术体系苗种基地培育。实验设置3个处理:母本重(150.39±5.82) g,父本重(300.23±9.61) g的育种群体后代设为A;父本重均为(300.56±10.27) g,母本重分别为(150.47±6.28) g和(250.33±8.68) g野生群体后代设为B、C。每个处理4个平行。试验池塘长56 m,宽34 m,面积1 904 m2。实验网箱为拉链式全封闭尼龙网箱,前期网箱网目大小为1.25 mm;后期网目为4.25 mm,网箱长×宽×高为2.00 m× 1.00 m× 1.50 m。
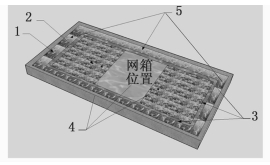
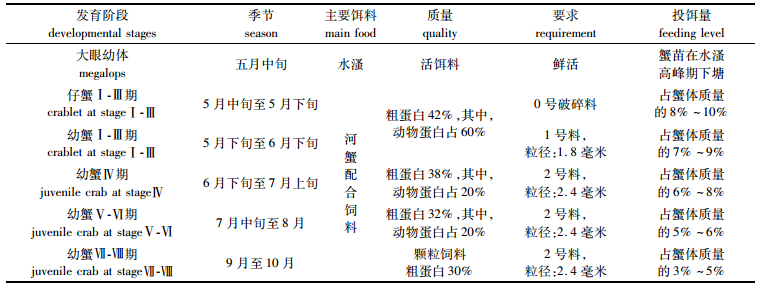
1.3 实验设计实验网箱12个,采用拉丁方设计放置(图 1)于池塘正中央环沟内区域,每排网箱间距为2 m。2014年5月15日,将大眼幼体放养于池塘内,密度约为21万只/667 m2,同时将大眼幼体按每箱500只放养于实验网箱中,大眼幼体均质量为(6.00±0.48) mg。每个网箱投放等量沉水植物伊乐藻(Elodea nuttallii)和浮水植物水花生(Altemanthena philoxeroides),并确保在养殖过程中水草覆盖面积60%左右。在各网箱中央放置一饵料盘,长×宽为0.30 m× 0.50 m,用绳系于网箱顶,可拉出水面投放饵料和观察大眼幼体的摄食。饲料每天17:00按王武等[18](表 1)方案投喂,并根据实际摄食适量增减。网箱每4 d清理一次,以保证网箱的透水性。
|
图 1 实验网箱分布图
Fig. 1 Test cages distribution
1.伊乐藻;2.水花生;3.环沟;4.环沟内区域;5.塘埂与环沟之间区域 1. Elodea nuttallii; 2. Altemanthena philoxeroides; 3. Circular groove; 4. The area in circular groove; 5. The area between the pond dam and circular groove |
|
表 1 蟹种在不同发育阶段的投饵状况和要求 Tab.1 The feeding conditions at different developmental stages and requirements of Eriocheir sinensis |
在河蟹大批(80%~85%)蜕壳完成后蟹壳刚固化时进行采样。
1.4.2 采样方式和数量网捕,随机采样,不分大小,每个网箱≥30只。采样共11次,分别对应河蟹的11次蜕壳。
1.4.3 测量指标体质量称量用分析天平(精确度0.1 mg),单个称量,称量前用吸水纸吸去蟹壳外部水分。壳长、壳宽、体高测量用电子数显卡尺,精确度0.01 mm,以头中部凹陷处到尾部垂线距离为壳长,以壳的最宽处作为壳宽。另外对成活率进行了3次统计,时间分别在第3次蜕壳、第9次蜕壳和实验结束(第11次蜕壳)。
1.4.4 水质监测水质监测每10 d进行一次。实验期间水温为19.8~31.4 ℃,pH为7.3~8.4,溶解氧为5.0~15.0 mg/L,氨氮(NH4+-N)含量小于0.1 mg/L,亚硝酸盐氮小于0.1 mg/L。溶解氧和水温采用美国YSI550A溶氧仪测定,pH采用PHSJ-3F型实验室pH酸度计测定,氨氮采用纳氏试剂光度法测定,亚硝酸盐(NO2--N)采用盐酸萘乙二胺比色法测定。
1.5 计算方法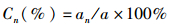 (1)
(1)
式中:Cn为成活率;an为第n次蜕壳后河蟹数量;a为初始投放河蟹数量。
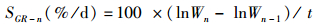 (2)
(2)
式中:SGR-n为第n次蜕壳后的特定生长率;Wn为第n次蜕壳后河蟹体质量;Wn-1为第n-1蜕壳后河蟹体质量;t为养殖天数或蜕壳所需天数。
1.6 数据统计及分析试验数据采用Excel和SPSS 22.0进行作图、统计和方差分析。
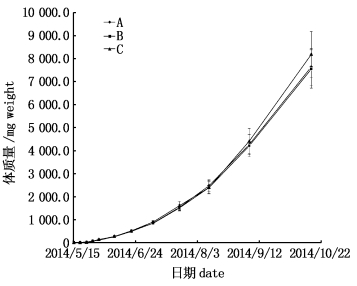
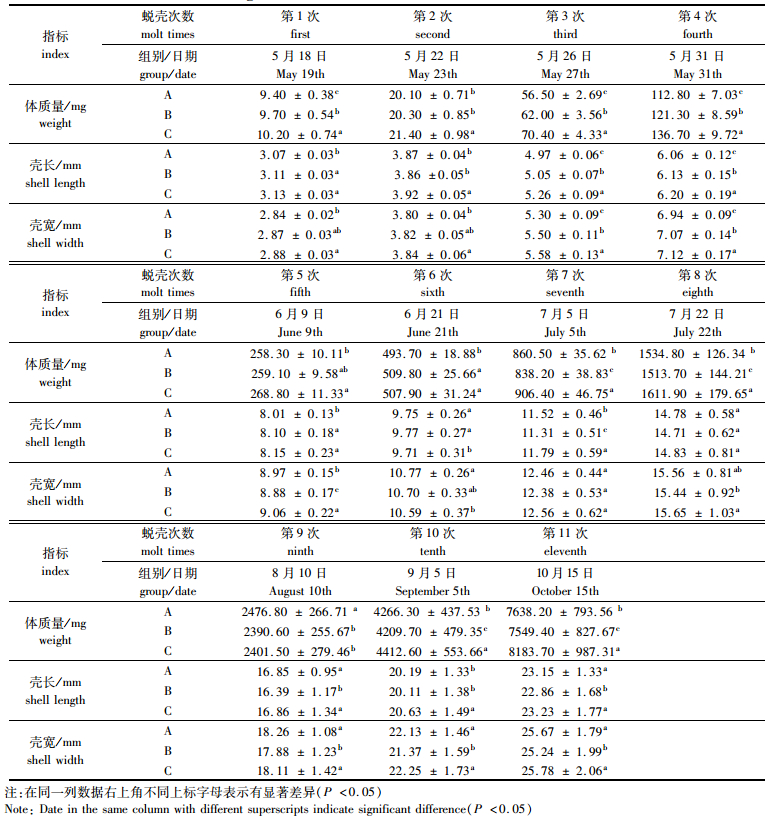
2 结果 2.1 体质量的增长体质量增长见图 2和表 2。11次蜕壳后处理A、B、C体质量均表现出显著性差异(P < 0.05):第1、3、4次蜕壳后,处理C体质量显著高于B和A (P < 0.05),处理B体质量显著高于A (P < 0.05);第2次蜕壳后,处理C体质量显著高于B和A (P < 0.05),处理A和B差异不显著(P >0.05);第5次蜕壳后,处理C体质量显著高于A (P < 0.05),处理A与B、B与C差异不显著(P >0.05);第6次蜕壳后,处理B和C体质量显著高于A (P < 0.05),处理B和C差异不显著(P >0.05);第9次蜕壳后,处理A体质量显著高于B和C (P < 0.05),处理B和C差异不显著(P >0.05);第7、8、10、11次蜕壳后,处理C体质量显著高于B和A (P < 0.05),处理A体质量显著高于B (P < 0.05),见表 3。
|
图 2 中华绒螯蟹11次蜕壳的体质量增长变化
Fig. 2 The eleven times molting changes in weight gain of Eriocheir sinensis
|
|
表 2 3种规格蟹种11次蜕壳生长性状的对比 Tab.2 The contrast of growth traits in three sizes at eleven times molt of Eriocheir sinensis |
第11次蜕壳后,河蟹成长为一龄蟹种,从第11次蜕壳后体质量数据可以看出,处理C体质量显著高于B、A (P < 0.05),A体质量显著高于B (P < 0.05)。
经过158 d的养殖,处理A、B和C河蟹平均体质量从(6.00±0.48) mg分别增至(7 638.20±793.56) mg、(7 549.40±827.67) mg和(8 183.70±987.31) mg,分别增长了1 273.00、1 258.17和1 363.95倍,特定生长率分别为(4.53%±0.08%)/d、(4.52%±0.09%)/d和(4.57%±0.11%)/d,处理A、B、C特定生长率差异不显著(P>0.05)。
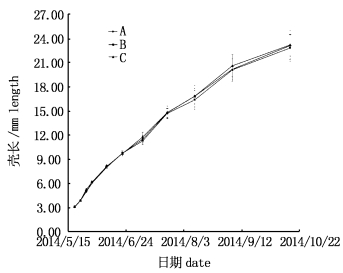
2.2 壳长的增长壳长的增长见图 3和表 2。除第8次蜕壳外,其余10次蜕壳后处理A、B、C壳长均表现出显著性差异(P < 0.05):第1、5次蜕壳后,处理B和C壳长显著长于A (P < 0.05),处理B与C差异不显著(P>0.05);第2、10次蜕壳后,处理C壳长显著长于A和B (P < 0.05),处理A与B差异不显著(P>0.05);第3、4次蜕壳后,处理C壳长显著长于B和A (P < 0.05),处理B壳长显著长于A (P < 0.05);第6次蜕壳后,处理A和B壳长显著长于C (P < 0.05),处理A与B差异不显著(P>0.05);第7次蜕壳后,处理C壳长显著长于B和A (P < 0.05),处理A壳长显著长于B (P < 0.05);第9、11次蜕壳后,处理C和A壳长显著长于B (P < 0.05),处理C与A差异不显著(P >0.05)。
|
图 3 中华绒螯蟹11次蜕壳的壳长增长变化
Fig. 3 The eleven times molting changes in carapace length increase of Eriocheir sinensis
|
从第11次蜕壳后壳长数据可以看出,处理C和A壳长显著长于B (P < 0.05),处理C与A差异不显著(P>0.05)。
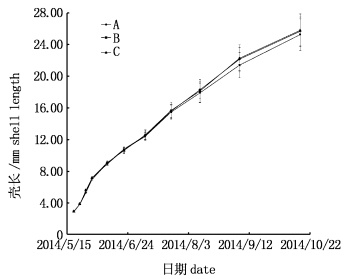
2.3 壳宽的增长壳宽增长见图 4和表 2。除第7次蜕壳外,其余10次蜕壳后处理A、B、C壳宽均表现出显著性差异(P < 0.05):第1、2次蜕壳后,处理C壳宽显著宽于A (P < 0.05),处理A与B、B与C差异不显著(P>0.05);第3、4次蜕壳后,处理C壳宽显著宽于B和A (P < 0.05),处理B壳宽显著宽于A (P < 0.05);第5次蜕壳后,处理C壳宽显著宽于B和A (P < 0.05),处理A壳宽显著宽于B (P < 0.05);第6次蜕壳后,处理A壳宽显著宽于C (P < 0.05),处理A与B、B与C差异不显著(P>0.05);第8次蜕壳后,处理C壳宽显著宽于B (P < 0.05),A与C、A与B差异不显著(P>0.05);第9、10、11次蜕壳后,处理C和A壳宽显著长于B (P < 0.05),C与A差异不显著(P>0.05)。
|
图 4 中华绒螯蟹11次蜕壳的壳宽增长变化
Fig. 4 The eleven times molting changes in carapace width increase of Eriocheir sinensis
|
从第11次蜕壳后壳宽数据可以看出,处理C和A壳宽显著长于B (P < 0.05),C与A差异不显著(P>0.05)。
2.4 壳长、壳宽与蜕壳间期时长的关系长江水系中华绒螯蟹育种群体和野生群体蜕壳间期的平均时长均以壳宽或壳长的指数增长(图 5,其中R2为相关系数)。
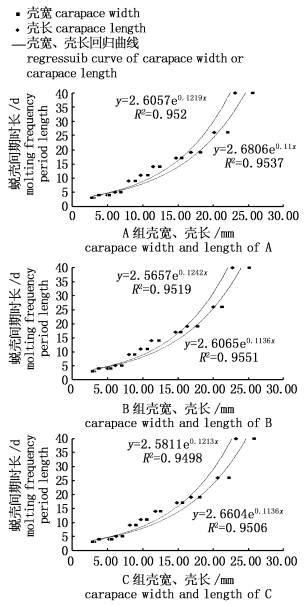
|
图 5 中华绒螯蟹蜕壳育种群体(A)和野生群体(B、C)间期时长与壳宽、壳长的回归分析
Fig. 5 The regression analysis of molt interphase and carapace width and length of breeding population (A) and wild population (B, C) Eriocheir sinensis
|
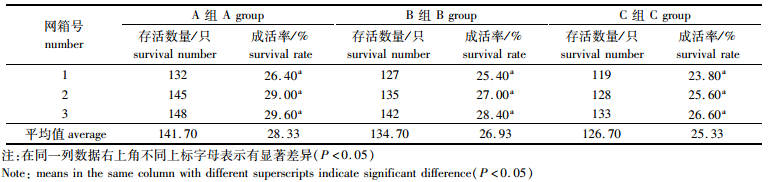
第11次蜕壳后,河蟹成长为一龄蟹种,且处理A、B、C成活率差异不显著(P>0.05)。从第11次蜕壳后平均成活率数据可以看出,处理A平均成活率最高,分别较B、C高1.40%、3.00%,B平均成活率较C高1.50%(表 3)。
|
表 3 4种规格蟹种成活率的对比 Tab.3 The contrast of survival rate in four sizes of Eriocheir sinensis |
影响中华绒螯蟹幼蟹生长发育的因素主要有种群来源、水质、水温、饵料、遗传和放养密度[18]。据报道,在鱼类早期的生长中母本效应普遍存在[19]。BANG等[20]采用因子设计法对大西洋鲱鱼仔鱼性状表型变异的研究表明,母本效应明显存在于仔鱼重量及卵黄囊体积上。许益铵[21]对大黄鱼的研究发现,通过比较大黄鱼的绝对增长率和体质量参数得出母本体质量较大的家系组多数较母本体质量较小的家系组大,表明多数家系表现出母本效应。因此在对育种家系的选育上,雌性亲本选择性状较好的家系对后代更有利。本实验在水温、水质、饵料和放养密度相同的条件下,一龄蟹种阶段,C在体质量、壳长、壳宽方面显著好于B,在体质量方面显著好于A;C腹肢更长更大。即大规格野生母本后代在一龄蟹种阶段生长性状优于小规格野生与育种母本后代,存在母本效应。另外黄姝等[22]在实验室条件下做了中华绒螯蟹成蟹阶段的蜕壳与生长观察后认为,在生产上选取规格较大的一龄蟹种能有效提高成蟹的育成规格。因此推断,用大规格的河蟹做母本繁育的后代成蟹育成规格优于小规格母本后代。
另外,研究表明,长江水系中华绒螯蟹育种群体和野生群体蜕壳间期的平均时长均以壳宽或壳长的指数增长。此结果与张庆阳[23]等对辽河水系中华绒螯蟹的研究结果相同,且与国外对远洋梭子蟹(Portunus pelagicus)的研究结果蜕壳间期时长以体长的三次方或者对数增长[24]不同。
3.2 野生群体与育种群体比较吴廉等[13]通过微卫星分子标记方法研究中华绒螯蟹配套系育种群体与野生群体后认为,人工选择作用促进了配套系育种群体与野生群体的遗传分化并导致了育种群体的遗传多样性下降,而配套系育种技术可在一定程度上增加配套子代的遗传多样性。何杰等[25]则认为,长江水系野生大眼幼体在成蟹阶段的养殖性能优于人工繁育大眼幼体。而我们研究却发现,A在体质量、壳长、壳宽方面均显著优于B,证明了育种工作的显著性和重要性。另外,就成活率而言,育种群体后代要比野生群体后代略高,我们认为是育种群体经过驯化更能适应池塘水体环境的缘故。由于本实验是在室外池塘网箱中进行的,实验可能存在一定的偶然因素,且主要针对的是中华绒螯蟹野生与育种群体后代一龄蟹种阶段的生长发育情况对比,今后会进行成蟹阶段的生长发育对比实验,进一步比较长江水系中华绒螯蟹野生群体与育种群体的生长发育差异。
| [1] | 戴恒鑫, 马旭洲, 李应森, 等.湖南大通湖河蟹池塘生态养殖模式对水质净化的试验研究[J]. 安全与环境学报, 2012, 12(5): 89–94. DAI H X, MA X Z, LI Y S, et al.Purification effect of the ecological culture pattern of Eriocheir sinensis on the water quality in Datong Lake, Hunan[J]. Journal of Safety and Environment, 2012, 12(5): 89–94. |
| [2] | 何杰.中华绒螯蟹池塘生态养殖群体生长特征研究[J]. 水利渔业, 2005, 25(6): 10–11, 28. HE J.Population growth characteristics of the mitten crab in ecological aquaculture ponds[J]. Reservoir Fisheries, 2005, 25(6): 10–11, 28. |
| [3] | 雷钧镒, 李猛, 马旭洲, 等.大薸与青萍对网箱养殖长吻鮠氮磷排放的影响[J]. 安全与环境学报, 2013, 14(3): 205–209. LEI J Y, LI M, MA X Z, et al.Consequential effects of Pistiastratiotes L and Lemna minor on cage aquaculture of Leiocassis longirostris's emissions of nitrogen and phosphorus[J]. Journal of Safety and Environment, 2013, 14(3): 205–209. |
| [4] | 刘国兴, 仲新玲, 芦光宇, 等.软、硬底质网箱对克氏原螯虾养殖效果分析[J]. 江西农业学报, 2014, 26(9): 94–97. LIU G X, ZHONG X L, LU G Y, et al.Effect of soft-bottom and hard-bottom net cages on raising of Procambarus clarkii[J]. Acta Agriculturae Jiangxi, 2014, 26(9): 94–97. |
| [5] | 李岩, 王武, 马旭洲, 等.稻蟹共作对稻田水体底栖动物多样性的影响[J]. 中国生态农业学报, 2013, 21(7): 838–843. DOI:10.3724/SP.J.1011.2013.00838 LI Y, WANG W, MA X Z, et al.Effect of rice-crab culture system on zoobenthos diversity in paddy field[J]. Chinese Journal of Eco-Agriculture, 2013, 21(7): 838–843. DOI:10.3724/SP.J.1011.2013.00838 |
| [6] | 孙文通, 张庆阳, 马旭洲, 等.不同河蟹放养密度对养蟹稻田水环境及水稻产量影响的研究[J]. 上海海洋大学学报, 2014, 23(3): 366–373. SUN W T, ZHANG Q Y, MA X Z, et al.A study on effects of different crab stocking density on water environment and rice yield[J]. Journal of Shanghai Ocean University, 2014, 23(3): 366–373. |
| [7] | 徐敏, 马旭洲, 王武.稻蟹共生系统水稻栽培模式对水稻和河蟹的影响[J]. 中国农业科学, 2014, 47(9): 1828–1835. XU M, MA X Z, WANG W.Effects of different cultivation patterns on rice yield and crab in rice-crab culture system[J]. Scientia Agricultura Sinica, 2014, 47(9): 1828–1835. |
| [8] | 张庆阳, 吕东锋, 马旭洲, 等.稻蟹共作系统对浮游甲壳动物群落的影响[J]. 上海海洋大学学报, 2014, 23(6): 834–841. ZHANG Q Y, LV D F, MA X Z, et al.The impact of rice-crab culture system on crustacean zooplankton community[J]. Journal of Shanghai Ocean University, 2014, 23(6): 834–841. |
| [9] | 王瑶, 杨志刚, 郭子好, 等.中华绒螯蟹RXR基因全长cDNA克隆及表达分析[J]. 水产学报, 2013, 37(12): 1761–1769. DOI:10.3724/SP.J.1231.2013.38754 WANG Y, YANG Z G, GUO Z H, et al.The full length cDNA cloning and expression analysis of RXR from the Chinese mitten crab (Eriocheir sinensis)[J]. Journal of Fisheries of China, 2013, 37(12): 1761–1769. DOI:10.3724/SP.J.1231.2013.38754 |
| [10] | 宫磊, 张亦陈, 孙妍, 等.中华绒螯蟹蜕皮激素受体基因(Ers-EcR)的克隆和组织表达分析[J]. 水产学报, 2014, 38(6): 786–793. GONG L, ZHANG Y C, SUN Y, et al.Cloning and expression analysis of ecdysteriod receptor gene (Ers-EcR) in Eriocheir sinensis[J]. Journal of Fisheries of China, 2014, 38(6): 786–793. |
| [11] | 赵亚婷, 吴旭干, 常国亮, 等.饲料中DHA含量对中华绒螯蟹幼蟹生长、脂类组成和低氧胁迫的影响[J]. 水生生物学报, 2013, 37(6): 1133–1144. ZHAO Y T, WU X G, CHANG G L, et al.Effects of dietary DHA levels on growth, lipid composition and hypoxia stress of juvenile Chinese mitten crab Eriocheir sinensis[J]. Acta Hydrobiologica Sinica, 2013, 37(6): 1133–1144. |
| [12] | 杨霞, 叶金云, 周志金, 等.中华绒螯蟹幼蟹对亮氨酸和异亮氨酸的需要量[J]. 水生生物学报, 2014, 38(6): 1062–1070. YANG X, YE J Y, ZHOU Z J, et al.Study on the optimal levels of dietary leucine and isoleucine for juvenile Chinese mitten crabs, Eriocheir sinensis[J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1062–1070. |
| [13] | 吴廉, 慈元吉, 黄姝, 等.中华绒螯蟹配套系育种群体与野生群体的遗传比较与选择压力分析[J]. 中国水产科学, 2015, 22(2): 204–213. WU L, CI Y J, HUANG S, et al.Genetic comparison and selection pressure analysis in complete set lines breeding and wild populations of Chinese mitten crab (Eriocheir sinensis)[J]. Journal of Fishery Sciences of China, 2015, 22(2): 204–213. |
| [14] | KOBAYASHI S.Molting growth patterns of the Japanese mitten crab Eriocheir japonica (De Haan) under laboratory-reared conditions[J]. Journal of Crustacean Biology, 2012, 32(5): 753–761. DOI:10.1163/193724012X649796 |
| [15] | GUERAO G, ROTLLANT G.Survival and growth of post-settlement juveniles of the spider crab Maja brachydactyla (Brachyura:Majoidea) reared under individual culture system[J]. Aquaculture, 2009, 289(1/2): 181–184. |
| [16] | GUERAO G, ROTLLANT G.Development and growth of the early juveniles of the spider crab Maja squinado (Brachyura:Majoidea) in an individual culture system[J]. Aquaculture, 2010, 307(1/2): 105–110. |
| [17] | DURáN J, PALMER M, PASTOR E.Growing reared spider crabs (Maja squinado) to sexual maturity:the first empirical data and a predictive growth model[J]. Aquaculture, 2013, 408-409: 78–87. DOI:10.1016/j.aquaculture.2013.05.031 |
| [18] | 王武, 王成辉, 马旭洲. 河蟹生态养殖[M]. (2版). 北京: 中国农业出版社, 2013: 20-239. WANG W, WANG C H, MA X Z. The ecological culture of Eriocheir sinensis[M]. (2版). Beijing: China Agriculture Press, 2013: 20-239. |
| [19] | VANDEPUTTE M, KOCOUR M, MAUGER S, et al.Heritability estimates for growth-related traits using microsatellite parentage assignment in juvenile common carp (Cyprinus carpio L.)[J]. Aquaculture, 2014, 335(1/4): 223–236. |
| [20] | BANG A, GRØNKJÆR P, CLEMMESEN C, et al.Parental effects on early life history traits of Atlantic herring (Clupea harengus L.) larvae[J]. Journal of Experimental Marine Biology and Ecology, 2006, 334(1): 51–63. DOI:10.1016/j.jembe.2006.01.003 |
| [21] | 许益铵.舟山附近海域大黄鱼遗传多样性及家系的生长性状研究[D].舟山:浙江海洋学院, 2014:34-35. XU Y A. Genetic diversity of the large yellow croaker from surrounding Zhou Shan waters and the research of growth traits of family[D]. Zhoushan:Zhejiang Ocean University, 2014:34-35. http://cdmd.cnki.com.cn/Article/CDMD-10340-1014219570.htm |
| [22] | 黄姝, 王中清, 茅海成, 等.中华绒螯蟹在实验室条件下的成蟹阶段蜕壳与生长观察[J]. 上海海洋大学学报, 2014, 23(3): 359–365. HUANG S, WANG Z Q, MAO H C, et al.Observation on molting and growth of adult Chinese mitten crab reared in the laboratory condition[J]. Journal of Shanghai Ocean University, 2014, 23(3): 359–365. |
| [23] | 张庆阳, 马旭洲, 王昂, 等.稻田网箱养殖辽河水系中华绒螯蟹幼蟹的个体生长[J]. 动物学杂志, 2015, 50(1): 112–121. ZHANG Q Y, MA X Z, WANG A, et al.The research of individual growth of Eriocheir sinensis for liaohe population juvenile crab in paddy field net cage[J]. Chinese Journal of Zoology, 2015, 50(1): 112–121. |
| [24] | MAUCHLINE J.The Hiatt growth diagram for Crustacea[J]. Marine Biology, 1976, 35(1): 79–84. DOI:10.1007/BF00386676 |
| [25] | 何杰, 吴旭干, 姜晓东, 等.野生和人工繁育大眼幼体在成蟹阶段的养殖性能比较[J]. 上海海洋大学学报, 2015, 24(1): 60–67. HE J, WU X G, JIANG X D, et al.Comparison of the culture performance of wild-caught and artifical breeding Chinese mitten crab megalopae reared in the grow-out ponds during the adult Eriocheir sinensis culture stage[J]. Journal of Shanghai Ocean University, 2015, 24(1): 60–67. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. Shanghai Collaborative Innovation Center for Aquatic Animal Genetics and Breeding, Shanghai 201306, China
 2016,
Vol. 25
2016,
Vol. 25


